新型复合诱变法筛选高产1,3-丙二醇菌株
于云娟, 李兆坤, 刘 妍, 续丹丹, 王凤寰
北京工商大学,北京 100048
新型复合诱变法筛选高产1,3-丙二醇菌株
于云娟,李兆坤,刘妍,续丹丹,王凤寰*
北京工商大学,北京 100048
摘要:为提高肺炎克雷伯氏菌生产1,3-丙二醇的能力,使用一种新型的以氮气为工作气体的等离子体复合紫外的诱变系统(MPMS-UV)对菌种进行诱变。用含有90 g/L ~100 g/L 1,3-丙二醇的选择培养基进行筛选驯化,最终获得一株高产PDO且甘油利用率高的优良菌株k2。2 L批式流加发酵结果表明,该菌株PDO产量为69.71 g/L,摩尔产率为0.57 mol/mol,比原始菌株分别提高了44.7%和21%。
关键词:1,3-丙二醇; 紫外复合等离子体诱变系统; 发酵
1,3-丙二醇(PDO)是聚对苯二甲酸丙二醇酯(PTT)的合成前体。PTT是一种新型的聚酯纤维材料。作为时装材料,PTT具有良好的伸展性、柔韧性、抗皱性及易加工性,因此在服装材料领域有巨大的市场前景。目前全球65%的PDO是采用化学法合成[1],但化学合成法存在一些问题:对设备有高压和高温的要求、反应过程中需使用昂贵的催化剂、释放有毒的中间体、依赖不可再生材料、低产量和复杂性等[2]。1881年Fzeund提出了甘油发酵PDO,之后由于生物法发酵PDO成本低、污染少、条件温和等优点,得到了大家广泛的认可[3]。Du Pont利用基因工程手段获得工程菌E.coli,以葡萄糖为初始底物发酵生产PDO[4],并取得了很大的进展,处于世界领先水平;我国虽然起步较晚,但发展非常快。盛虹集团与清华大学合作开发,采用生物柴油副产物甘油作为主要原料,5万吨/年项目于2013年 5月开工建设[5]。
采用微生物法生产PDO关键在于菌株。肺炎克雷伯氏菌(Klebsiellapneumonia)产PDO能力强,周期短,效率高,是现在研究的热点。但是该菌株存在底物和产物抑制的问题[6],这是利用微生物法发酵PDO难题的关键之一。目前获得优良菌株的方法包括用基因工程手段来定向改造菌株代谢途径[7];利用物理、化学手段对菌株进行诱变。常用的物理方法有紫外诱变、等离子体诱变等;常用的等离子体诱变包括介质阻挡放电等离子体[8]、常温常压等离子体ARTP等,本实验所采用的是一种新型的物理方法——紫外复合等离子体诱变方法(MPMS-UV)。MPMS所使用的工作气体是氮气,取代了ARTP所使用的高成本的氦气,同时结合紫外照射,这样可以有效增加突变率;同时也具有操作简单、成本低、无毒无害等特点,是一种适合现代工业需求的育种方法。实验使用紫外复合等离子体来诱变菌株,经过多次筛选、驯化和发酵最终挑选出优良菌株,为将来发酵PDO提供良好菌株和为发展等离子体诱变系统提供理论依据。
1材料与方法
1.1材料
菌株:肺炎克雷伯氏菌Klebsiellapneumoniakp-13(由北京生物加工过程重点实验室提供)
主要试验仪器:恒温摇床(太仓市实验设备厂),恒温培养箱(上海一恒科学实验有限公司),多功能等离子体诱变系统(北京艾德豪克国际技术有限公司),高效液相色谱(岛津有限公司),2L全自动发酵罐(镇江东方生物工程设备技术公司)。
种子培养基(g/L):蛋白胨10,NaCl 5,酵母粉 5,pH 7.0。
选择培养基(g/L):蛋白胨10,NaCl 5,酵母粉 5,PDO 90/100,琼脂 15(固体),pH 7.0。
发酵培养基(g/L):K2HPO4·3H2O 3.4,KH2PO41.3,(NH4)2SO44,MgSO40.24,CaCl20.1,葡萄糖 2.5,酵母粉 3,甘油 20,富马酸 0.025,微量元素 1mL,pH 7.0。
1.2方法
1.2.1培养条件
摇瓶培养条件:250 mL摇瓶装液量100 mL,接种量1%,温度37 ℃,转速200 r/min,培养时间10 h。
发酵罐培养条件:初始发酵培养液体积1.6 L,接种量10%,发酵温度37 ℃,转速300 r/min,初始甘油浓度25 g/L,补料液配方:70%甘油、10%葡萄糖、20%水,用4 mol/L KOH调节pH为7.0,发酵时间30 h。
1.2.2诱变处理
等离子体诱变参数:99.99%及以上氮气,气体流量12.05 slpm,诱变距离20 mm,温度25 ℃,垂直照射;紫外诱变:距离30cm,波长254 nm,功率300 W,斜45°照射。
将原始菌株活化传代2次后接种于100 mL的摇瓶中进行培养,待菌体生长到对数期时进行稀释,稀释到大约108个/mL,菌悬液制备完毕。取制备好的菌悬液15 μL,放入诱变系统中,打开紫外灯并注入氮气同时进行诱变。诱变的时间选取致死率为95%左右的时间点。复合诱变后,将菌液从处理室取出,稀释适当倍数涂布于1,3-丙二醇浓度为90 g/L的选择培养基平板上在37 ℃恒温培养箱中培养48 h。
1.2.3菌种筛选与驯化
挑取在选择培养基中体积较大长势较好的菌落,划线到PDO浓度为100 g/L的选择培养基上进行二次筛选,将体积长势较好的菌落转接到与选择培养基相同浓度PDO的摇瓶中多次培养驯化。考察各摇瓶菌株的生物量、产物浓度,最后挑选最优菌株进行发酵罐实验[7, 9]。
1.2.4发酵实验及发酵参数测定
筛选后的优良菌株进行2 L补料批式发酵实验,每2 h取样1次,在600 nm下测定吸光值,测定甘油浓度,根据所得甘油浓度调节补料流加速度,使罐内甘油浓度保持在15 g/L ~20 g/L。发酵完毕后用高效液相色谱测定发酵液中底物、代谢产物等有效成分的含量。实时测量发酵罐内甘油含量采用高碘酸钠氧化法;产物浓度使用岛津高效液相色谱分析,检测器为RID示差检测器,色谱柱为Bio-Rad 公司Amines HPX-87H 有机酸离子交换柱,柱温65 ℃,流动相为 5 mmol/L H2SO4,流速为0.6 ml/min。样品分析前经0.45 μm 微滤膜过滤。
2结果与讨论
2.1诱变致死率
对菌株进行不同时间的复合诱变,计算致死率,结果如表1所示。随着诱变时间增加,致死率也增加,当诱变时间为40 s时致死率为100%,诱变20 s时致死率为93%,因此选择诱变时间20 s。
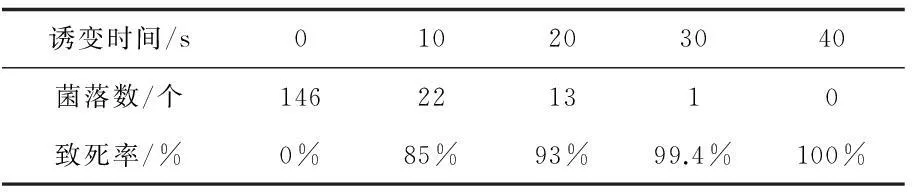
表1 复合诱变致死率
2.2摇瓶发酵
第一次使用PDO浓度为90 g/L的平板初步筛选出25个菌落体积较大的菌株,将这25个菌落涂布于PDO浓度为100 g/L的平板上复筛。有8个菌落体积较大,长势良好,将这8株菌命名为k1-k8。经传代驯化摇瓶培养后,突变菌株的生物量与PDO含量均比原始菌株高,其中 k2、k4、k7的生物量和PDO的含量明显高于其他突变菌(图1),OD值分别为6.85、6.89、6.98;PDO分别为11.212 g/L、10.812 g/L、12.013 g/L;k7的生物量和PDO的含量是最高的。
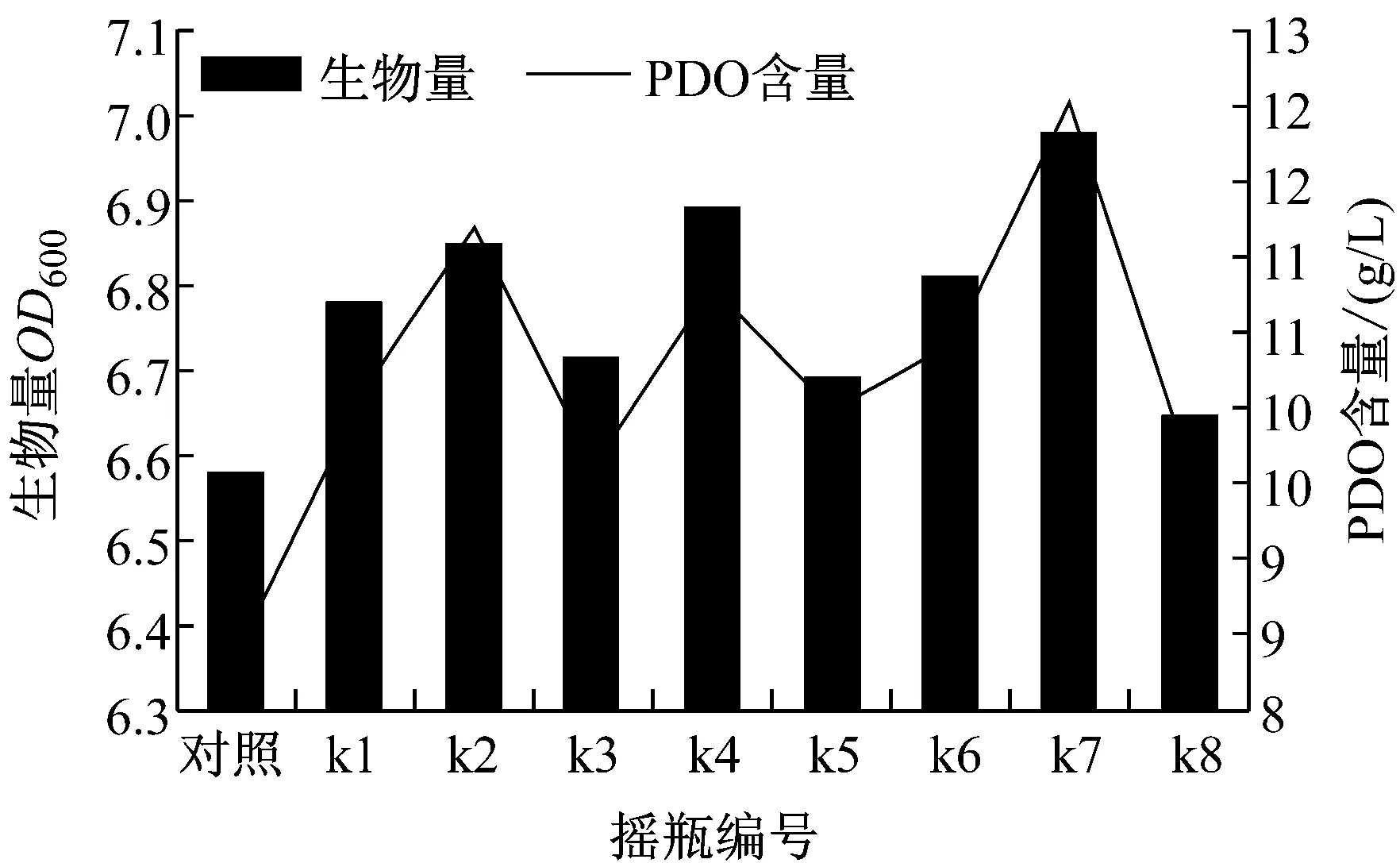
图1 诱变后各摇瓶生物量及PDO含量
K.pneumonia甘油代谢途径包括还原途径和氧化途径,PDO代谢属于还原途径;氧化途径会产生一些主要的副产物,如乙酸、乳酸、乙醇等(图2),这些副产物的合成过程会对主产物PDO的合成造成一定影响。由于副产物乙酸不消耗NADH,并且提供ATP,因此乙酸的合成有利于合成PDO;而副产物乳酸、乙醇等消耗NADH,与PDO形成竞争关系,因此乳酸与乙醇等的合成不利于PDO的合成。对于k2和k4,由图3看出,k2的 pH值下降较k4多,表明产酸较k4多,由此可以推断PDO产量可能会较多。另从图4看到,k2甘油的消耗量也较k4多,表明k2菌株的性能可能优于k4。
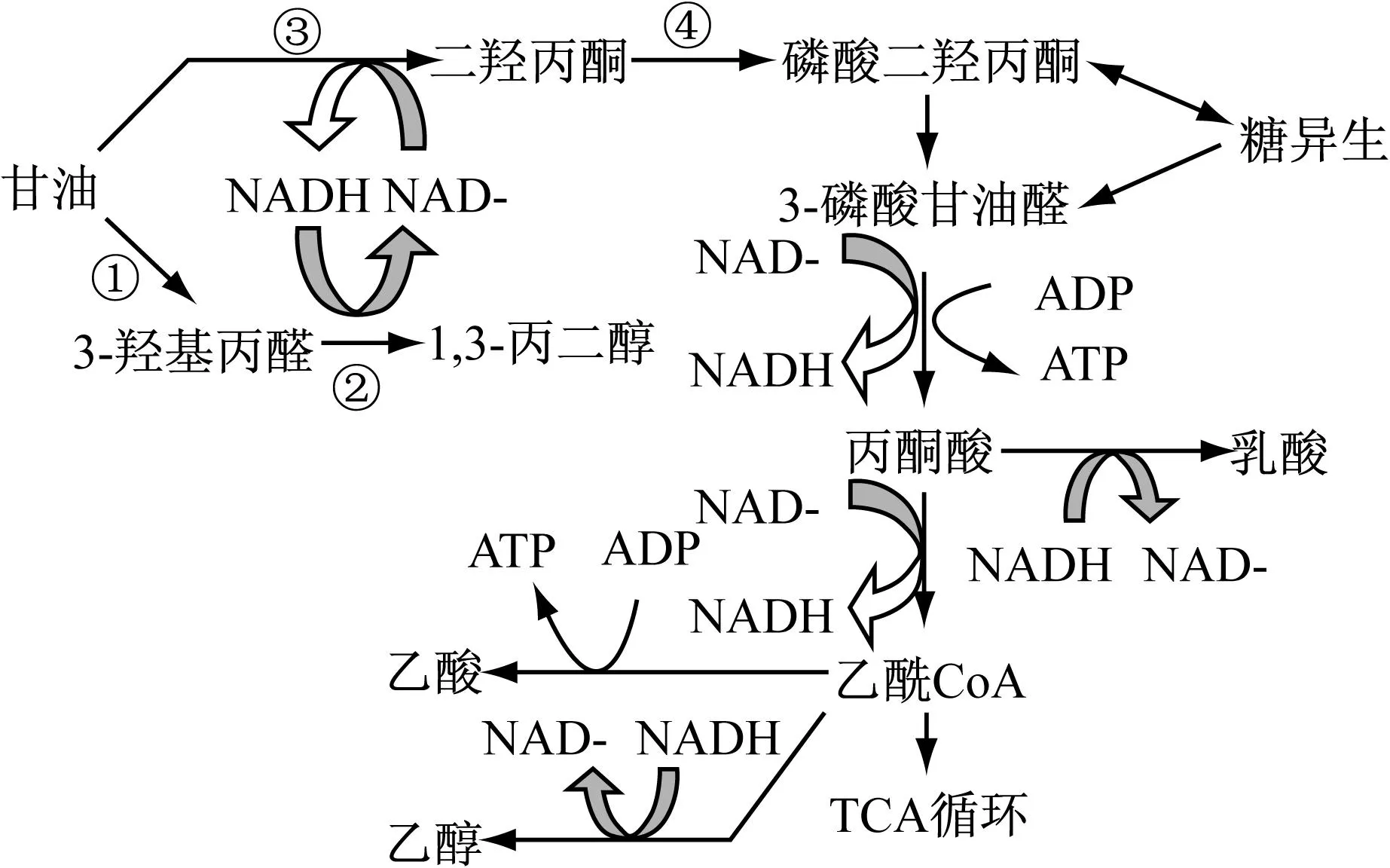
①甘油脱水酶(GDHt);②1,3-丙二醇氧化还原酶(PDOR);③甘油脱氢酶(GDH);④二羟基丙酮激酶(DHAK)
图2Klebsiellapneumonia甘油代谢途径
2.32 L发酵实验
将摇瓶实验中PDO产量最高的两株菌k2、k7以及原始菌株进行2L发酵罐实验,结果如图5所示。诱变后的两株菌的生物量(OD600)比原始的菌株都要高,其中k7的OD值最高可达18.1,而原始菌株最高OD值是15.2,增加了19%。k2的OD值最高是16.2,相对原始菌株增加了6.5%。产物PDO如图6所示,k7的产量是67.87 g/L,原始菌株PDO的最终产量是48.19 g/L,k7相对原始菌株增加了40.8%;k2的产量是69.71 g/L,增加了44.7%。
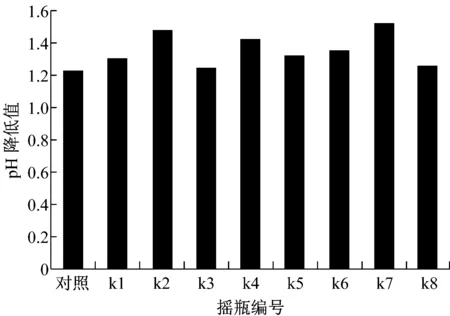
图3 pH变化值

图4 甘油消耗量
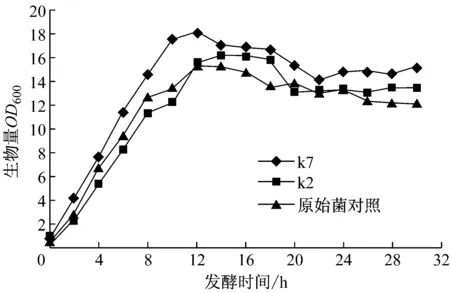
图5 k2、k7与原始菌株生物量的比较
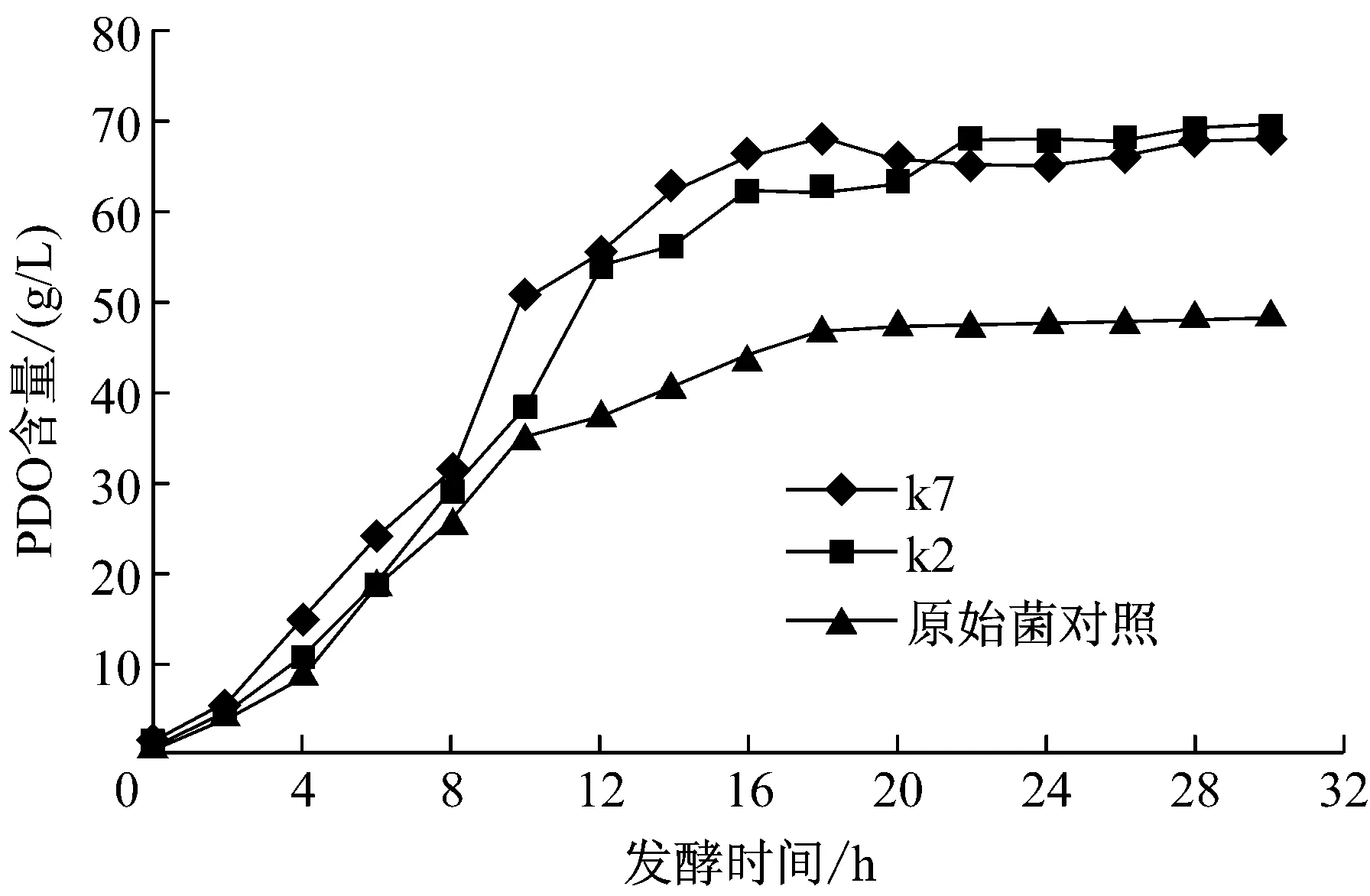
图6 k2、k7与原始菌株PDO含量的比较
原始菌株与诱变菌株的最终发酵参数如表2所示,可以看出,k2的生物量不如k7的高,但是PDO的产量却高于k7,k2的生物量比k7低了10.5%,但PDO的产量却高了2.7%,这说明k2产PDO的能力强于k7。
如表2所示,原始菌株乙酸的最终产量是4.53g/L,相对PDO的含量是9.4%。诱变后k2、k7乙酸的产量分别是8.66 g/L、7.51 g/L,相对PDO的含量是12.42%、11%,由此看到诱变后菌株乙酸的产率增加,且k2高于k7。由图7可以看到,菌株在发酵的过程中,副产物乙酸的合成主要是菌株对数生长期合成积累。在发酵初期以对数形式增长,到发酵中期12 h左右会达到峰值,继续发酵产量会有所下降,增长趋势与PDO一致。

表2 批式发酵结果
原始菌株乳酸的最终产量是22.14 g/L,相对PDO的含量是45.9%,诱变后k2、k7乳酸的产量分别21.53 g/L、27.3 g/L,相对PDO的含量是30.9%、40.2%,k2低于k7。图8显示,副产物乳酸是在发酵后期增加积累,在发酵的前12 h增长比较缓慢,到12 h以后开始大量合成,到24 h后进入缓慢期。乳酸的合成不利于PDO的合成。有相关研究表明,敲除编码乳酸脱氢酶的基因片段ldhA不会影响菌体生长代谢,菌浓度未有变化[10]。

图7 副产物乙酸发酵结果
k2、k7菌株副产物2,3-丁二醇(2,3-BD)的产量明显高于原始菌株(图9),且起始合成时间也提前了,原始菌株在发酵16h开始合成,而k2、k7在发酵10h开始合成且k7高于k2。生成2,3-BD虽需还原当量,但其生成量对PDO的产量影响不大,并且2,3-BD是一种重要的化工原料和液体燃料,在化工、食品、燃料及航空航天等领域有很广泛的应用[11]。因此2,3-BD产量的增加对工厂的实际效益是有益的。有研究表明敲除乳酸支路还会有利于2,3-BD的生成量[12]。
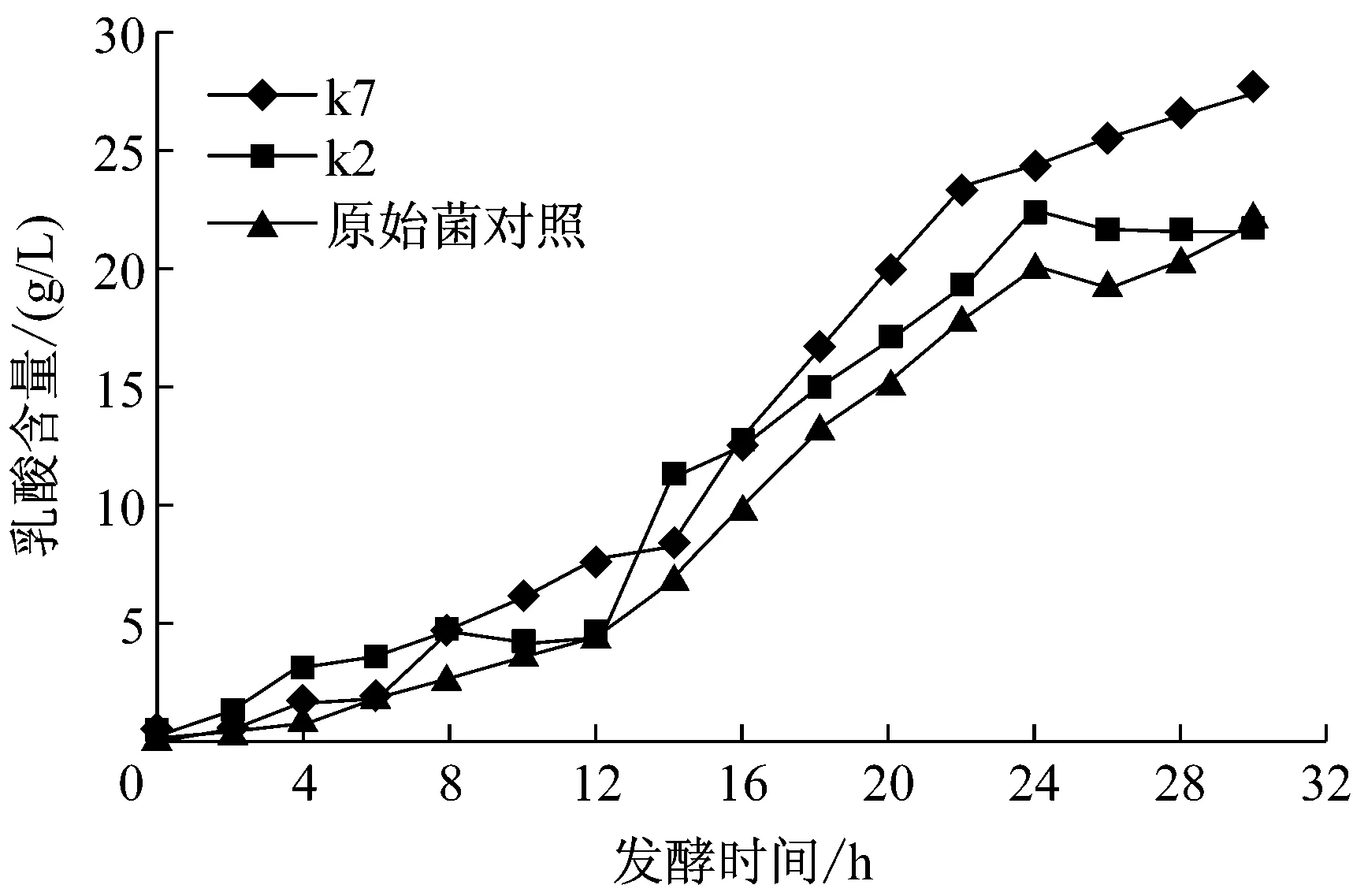
图8 乳酸发酵产量
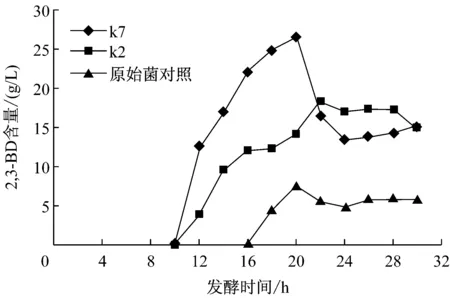
图9 2,3-丁二醇的发酵产量
K.pneumonia在诱变后可能会出现退化现象,不能稳定遗传诱变后的优良性能。解决这一问题可以从下面两个方面解决。一是用含高浓度PDO的培养基进行多次培养。PDO虽对菌株有抑制作用,但该菌种产PDO的能力与其对PDO的耐受力成正相关。用高浓度PDO的选择培养基来进行多次培养驯化,可以使菌株对这种特殊环境的适应性更强;另外驯化的过程又起到进一步筛选的作用。二是选择良好的保菌方式非常重要。本实验采用低温冷冻法保藏菌种,将菌株放入一定比例的甘油管中,放入-80 ℃的超低温冰箱中进行保藏。
副产物乙酸、乳酸的产量与PDO的产量之间的关联十分明显,乙酸与PDO成正相关,乳酸与PDO成负相关。本实验没有详细考察副产物乙醇与PDO的关系,有文献记载乙醇与PDO也是成负相关的。这些副产物对PDO的生成有很大的影响,是评定一株菌种是否优良的重要参数[13-16]。后续实验计划考察乙醇、琥珀酸等副产物以及产PDO的关键酶活与1,3-丙二醇产量的关系,从代谢途径、代谢流节点代谢通量和副产物产量综合分析菌种的各项性能,以求挑选出更优更适合生产的菌种。
3结论
采用紫外复合等离子体诱变技术对K.pneumonia进行诱变,用PDO浓度为90 g/L~100 g/L的选择培养基对诱变后的菌株进行培养筛选。通过发酵产物,如乙酸、乳酸、2,3-BD等产量与PDO产量之间的关系,以及菌株生物量和甘油消耗量的研究确定优良菌株。最终获得一株优良菌株k2。2 L批式流加发酵结果表明:该菌株PDO产量为69.71 g/L,摩尔产率为0.57 mol/mol,生产强度为0.8 g/L·h,较原始菌株分别提高了44.7% 、21%和11.3%;副产物乙酸含量为8.66 g/L,较原始菌株提高了91.16%;乳酸产量为21.53 g/L,较原始菌株降低2.76%;2,3-BD含量为14.83 g/L,较原始菌株提高了151.3%。
参考文献
[1]沈瑶瑶,于建荣,毛开云. 生物基1,3-丙二醇技术开发及产业发展趋势[J].生物产业技术, 2014,(4):38-43.
[2]Kaur G, Srivastava AK, Chand S. Advances in biotechnological production of 1,3-propanediol [J]. Biochemical Engineering Journal, 2012, 64:6-8.
[3]Maervoet VET, Mey MD, Beauprez J,etal. Enhancing the microbial conversion of glycerol to 1,3-propanediol using metabolic engineering[J]. Organic Process Research & Development,2011,15(1):189-202.
[4]吴从意, 陈静. 1,3-丙二醇制备研究进展[J].分子催化, 2012, 26(3):276-283.
[5]张丽. 我国1,3-丙二醇-聚对苯二甲酸丙二醇酯产业链发展形势[J].化学工业, 2014,32(6):7-8.
[6]张宏蕊,金平,刘树臣. 发酵产1,3-丙二醇的关键酶研究进展[J].化学与生物工程, 2011,28(3):1-4.
[7]Celińska E.Klebsiellaspp. as a 1, 3-propanediol producer-the metabolic engineering approach[J]. informa healthcare, 2011,19.
[8]Dong XY, Xiu ZL, Li S,etal. Dielectric Barrier Discharge Plasma as a Novel Approach for Improving 1,3-Propanediol Production inKlebsiellapneumonia[J]. Biotechnol Lett, 2010, 32(9): 1245-1250.
[9]侯英敏. 等离子体诱变生产1,3-丙二醇菌种的研究[D]. 硕士学位论文.大连理工大学,2006:26.
[10]周佳佳,高黎荣,刘龙飞等.D-乳酸合成阻断对肺炎克雷伯氏菌的1,3-丙二醇发酵的影响[J].工业微生物, 2014, 44(4):24-27.
[11]戴建英,孙亚琴,孙丽慧等.生物基化学品2,3-丁二醇的研究进展[J].过程工程学报, 2010,10(1):200-207.
[12]Yang,G., Tian J S, li J. Fermentation of 1,3-propanediol by a lactate deficient mutant ofKlebsiellaoxytocaunder microaerobic conditions[J]. Appl Microbiol Biotechnol,2007,73(5):1017-1024.
[13]徐卫涛,钟志辉,付水林等. pH值对克雷伯氏肺炎杆菌发酵甘油产1,3-丙二醇的影响与控制[J].化学与生物工程,2011,28(8):81-83.
[14]唐广明,徐佳杰,徐卫涛等. 高产1,3-丙二醇菌株的诱变与筛选[J].化学与生物工程, 2010,27(3):46-50.
[15]Skraly FA, Lytle BL, Cameron DC. Construction and characterization of a 1,3-propanediol operon[J]. Appl. Environ. Microbiol, 1998, 64(1): 98-105.
[16]Wang LY, Huang ZL, Li G,etal. Novel Mutation Breeding Method forStreptomycesavermitilisUsing an Atmospheric Pressure Glow Discharge Plasma [J]. J Appl Microbiol, 2010, 108(3): 851-858.
New combined mutagenesis for screening of high-yielding 1,3-propanediol strains
YU Yun-juan, LI Zhao-kun, LIU Yan, XU Dan-dan, WANG Feng-huan
Beijing Technology and Business University, Beijing 100048
AbstractIn order to improve the 1,3-propanediol production of Klebsiella pneumoniae, the multi-function plasma mutation and ultraviolet system(MPMS-UV)were performed for strain mutagenesis using nitrogen as working gas. The strains were screened using the selection culture medium with 90~100 g /L of 1,3-propanediol. Ultimately, a mutant strain k2 with high 1,3-propanediol yield and glycerol utilization was obtained. In 2 L fed-batch fermentation, the strain K. pneumoniae k2 could produce 1,3-propanediol as high as 69.71 g/L with high conversion rate of 0.57, which were 44.7% and 21% higher than those of the parent strain, respectively.
Key words1,3-propanediol; MPMS-UV combined mutagenesis; fermentation
基金项目:北京市青年英才计划(YETP1450)。
作者简介:于云娟(1990~),女,硕士。 E-mail:yyjuan1050@foxmail.com。 *通讯作者:王凤寰(1978~),男,博士,副教授。E-mail:wangfenghuan@th.btbu.edu.cn。

