阿魏菇醇提物抗肿瘤功效及三萜类成分的提取
王为兰 陈开旭 刘军 段魏魏 徐亚楠 张富春
(新疆生物资源基因工程重点实验室 新疆大学生命科学与技术学院,乌鲁木齐 830046)
阿魏菇醇提物抗肿瘤功效及三萜类成分的提取
王为兰 陈开旭 刘军 段魏魏 徐亚楠 张富春
(新疆生物资源基因工程重点实验室 新疆大学生命科学与技术学院,乌鲁木齐 830046)
为探究阿魏菇醇溶性物质(PFECs)抗肿瘤功效,优化阿魏菇醇提物三萜类化合物(PFTPs)提取条件,获取最大提取率。采用MTT法检测PFECs对5种肿瘤细胞生长抑制活性;对两种正常细胞无明显抑制作用;采用超声辅助、微波辅助热水浸提法、单因素试验与响应曲面法相结合,对阿魏菇三萜类化合物提取工艺优化。结果显示,PFECs具有显著的抗肿瘤活性;PFTPs提取的最佳工艺参数为:料液比1∶19(g/mL)、提取温度75℃、提取时间22 min(超声40 min后),提取率为4.42%。
阿魏菇;醇提物;活性成分;抗肿瘤;三萜化合物;提取优化;响应曲面
阿魏菇(Pleurotus ferulae Lanzi)又称为阿魏侧耳,属于担子菌侧耳科侧耳属,寄生在荒漠地区的一种药用植物阿魏中,故而得名。阿魏菇富含人体必需的多种氨基酸、蛋白质、多糖等,是一种珍贵的食药两用菌,主要分布在我国新疆的伊犁、塔城、阿勒泰和木垒地区。
三萜类化合物广泛存在于菌类、蕨类等植物之中,具有抗肿瘤[1-6]、抗炎杀菌[7-12]、抗氧化[13-15]、降血糖[16-20]等活性。前期系统预实验结果表明,阿魏菇中含有萜类化合物、多糖类、多糖-蛋白复合物、蛋白质类、脂肪与激素类、酚类化合物等成分。研究报道阿魏菇具有调节人体生理平衡、抗氧化[21]、抗衰老、抗疲劳、抗肿瘤[22]、降血脂[23]、调节血糖水平[24]、增强机体免疫[25]等功效;目前对阿魏菇药理活性研究尚浅,生物活性成分有待深入探究;因此以阿魏菇为研究对象,检测阿魏菇醇溶性物质药理功效,从阿魏菇中提取活性成分三萜类化合物,并通过单因素及响应曲面法进行提取优化,为阿魏菇三萜类化合物的药理功效研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料 阿魏菇子实体采购于新疆青河县,色白均匀,每个子实体重量约为200-500 g之间。
1.1.2 试剂 RPMI1640培养基,磷酸盐缓冲液(PBS),二甲基亚砜(DMSO),胰蛋白酶(Trypsin,0.25%),四甲基偶氮唑蓝(MTT)购自于美国Sigma公司;胎牛血清(FBS,Gibco)购自于美国Gibco公司;乙酸乙酯、高氯酸、甲醇、香草醛、冰乙酸、多聚甲醛、无水乙醇购自天津市富宇精细化工有限公司;熊果酸标准品购于上海源叶生物科技有限公司;齐墩果酸标准品购于上海源叶生物科技有限公司;碱式醋酸铅购于洛阳市化学试剂厂等;以上试剂均为分析纯。
1.1.3 主要仪器和设备 Bio-Rad酶联免疫检测仪(美国Bio-Rad公司)HH-2数显恒温水浴锅(金坛市医疗仪器厂),SHB-IIIS循环水式多用真空泵(郑州长城科工贸有限公司),LABOROTA 4000旋转蒸发器(德国Heidolph公司),SB5200DT超声波清洗仪(宁波新芝生物科技股份有限公司),Free Zone 2.5冷冻干燥机(美国LABCONCO公司),Avanti J-E高速冷冻离心机(美国BECKMAN公司)等。
1.2 方法
1.2.1 阿魏菇真空冷冻干燥工艺 阿魏菇子实体清洗(蒸馏水冲洗,纱布擦拭)→切片(适量厚度)→装入培养皿(200 g/盘)→保鲜膜封闭→-80℃冰箱冷冻过夜→真空干燥(冷阱温度为-50℃,真空压力为0.08 MPa)→完全冻干→粉碎,过40目筛→封入包装袋,-20℃冻存。
1.2.2 阿魏菇醇提取物(PFECs)的提取工艺流程 阿魏菇子实体冻干粉200 g→加适量浓度乙醇→超声辅助20 min→60℃水浴浸提2 h→3 500 r/min离心10 min→反复浸提、至滤液澄清→合并上清液 浓缩至浸膏→真空冷冻干燥→阿魏菇醇提物(PFECs)。
1.2.3 阿魏菇醇提取物(PFECs)的抗肿瘤活性检测 取对数生长期的人食管癌Eca109细胞,人宫颈癌HeLa细胞,鼠黑色素瘤B16F10细胞,人胚肾细胞293FT,人乳腺癌细胞MCF-7,0.25% 胰蛋白酶消化收集后,用新鲜的RPMI1640培养基或DMEM培养基分别稀释成2×104/mL的细胞悬液,100 μL/孔接种于96孔板培养24 h。分别以0.2、0.4、0.8、1.6和3.2 mg/mL的PFECs处理细胞,设置空白组、阴性对照组,各组设6个复孔,继续培养48 h,加入20 μL MTT(5 mg/mL)溶液孵育4 h,弃去各孔残液,200 μL DMSO溶解,室温振荡30 min,酶联免疫吸附仪490 nm测定各孔吸光度值。
细胞存活率(%)=(试验孔OD值/对照孔OD值)×100%
细胞抑制率(%)=(1-试验孔OD值/对照孔OD值)×100%
同理,体外培养人胃癌细胞BGC823,人胃细胞GES-1,以0.4、0.8、1.6和3.2 mg/mL的PFECs处理,设置空白组,阴性对照组,分别作用24、48和72 h,加MTT溶液,酶标仪波长490 nm检测。
1.2.4 阿魏菇醇提物中活性成分三萜类化合物的提取工艺(1)超声辅助提取工艺流程:新鲜阿魏菇子实体→ 匀浆→按照一定料液比加提取溶剂→超声辅助破碎→热水浸提→离心→收集合并上清液→减压旋转蒸发→定容→取样检测提取率。(2)微波辅助提取工艺流程:同上述方法1.2.4.1,辅助方法为微波破碎法。
1.2.5 阿魏菇醇提物中活性成分三萜类化合物(PFTPs)的定性检测 各取0.1%、0.5%和1% 浓度的阿魏菇乙醇提取液1 mL,设置空白组、阴性对照组,水浴蒸干,分别加入1mL氯仿溶解残渣,收集氯仿液于EP管中,再加入1 mL浓硫酸,样液分为两层:氯仿层和硫酸层;若观察到氯仿层呈红色或青红色,硫酸层呈荧光绿色,表明乙醇提取液可能含有三萜类化合物。
1.2.6 阿魏菇醇提物中三萜类化合物(PFTPs)的含量测定 以齐墩果酸为标准品,选用香草醛-冰醋酸,高氯酸显色法测定[26]。
齐墩果酸标准曲线的制作:准确称取齐墩果酸标准品4 mg,用甲醇定容至10 mL配制成0.4 mg/mL标准溶液。分别取0.2、0.4、0.8、1.0、1.2和1.4 mL标准液,水浴加热,除去溶剂后,加入0.5 mL新配制的5%香草醛-冰乙酸及1.4 mL高氯酸,60℃恒温水加热15 min,取出流水冷却至室温,再加入乙酸乙酯定容至10 mL,摇匀,于550 nm处测定吸光度,绘制标准曲线。以吸光度(y)为纵坐标,以齐墩果酸标准溶液的浓度(x)为横坐标绘制标准曲线,计算回归方程。
1.2.7 阿魏菇醇提物中三萜类化合物(PFTPs)提取的单因素试验
1.2.7.1 提取次数的确定 准确称取10 g阿魏菇干粉,料液比1∶30(g/mL),乙醇浓度70%,提取温度为60℃,提取时间120 min,选择提取次数分别为1次、2次、3次进行提取,测定吸光度值,计算三萜提取率。
1.2.7.2 提取时间的确定 选择提取时间分别为30、60、90、120、150和180 min进行提取。
1.2.7.3 乙醇浓度的确定 选择乙醇浓度分别为40%、50%、60%、70%、80%、90%和95%进行提取。
1.2.7.4 温度的确定 选择提取温度为50℃、60℃、70℃、80℃和90℃进行提取。
1.2.7.5 微波时间的确定 选择微波辅助提取时间分别为5、10、15、20、25和30 min,微波辅助后热水浸提时间选择为30、60和90 min进行提取。
1.2.7.6 超声时间的确定 选择超声辅助提取时间分别为30、40、50和60 min,超声辅助后热水浸提时间选择为10、20、30、40和50 min进行提取。
1.2.7.7 料液比的确定 选择料液比为1∶20(提取1次),1∶20(提取2次),1∶20(提取3次),1∶30(提取1次),1∶30(提取2次),1∶30(提取3次)进行提取。
1.2.8 阿魏菇醇提物中三萜类化合物(PFTPs)提取条件的响应面优化试验 综合考虑单因素试验结果,影响三萜类化合物提取的主要因素是提取温度、超声后的提取时间,料液比。根据Central-Composite设计原理,运用Design-Expert.8.0.6软件设计三因素三水平的旋转中心组合试验。以三萜类化合物提取率为响应值,确定提取三萜类化合物的最佳工艺参数。表1 为微波辅助法提取三萜时的因素水平表。
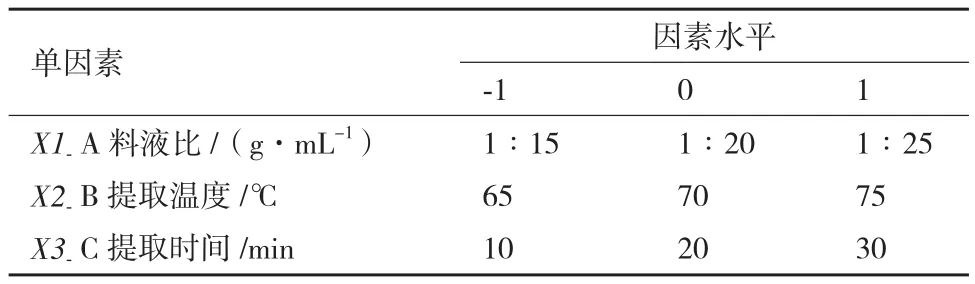
表1 响应面试验设计因素及水平
1.2.9 阿魏菇醇提物中三萜类化合物(PFTPs)的提取率 提取率(%)=(C×V×n/W)×100%/10,其中,C:三萜类化合物浓度(μg/mL);V:提取液的体积(mL);n:稀释倍数;W:样品的质量(μg)。
2 结果
2.1 阿魏菇醇提取物(PFECs)的抗肿瘤作用
PFECs均能够显著抑制4种肿瘤细胞增殖生长,且对人胚肾细胞293FT细胞生长活性无显著性抑制作用(图1-A)。与阴性对照组比较,PFECs对B16F10细胞增殖活性具有显著性抑制作用。PFECs浓度为0.2、0.4、0.8、1.6和3.2 mg/mL时,B16F10细胞增殖活性分别降低至79.26%、70.83%、60.24%、39.27%、36.96%(P<0.05)。同理可证,当浓度为0.4 mg/mL和0.8 mg/mL 时,PFECs对Eca109细胞增殖呈显著性抑制作用,浓度越高,抑制作用愈显著。PFECs可显著抑 制HeLa细胞增殖;浓度越大,抑制效果越显著;但从结果中发现0.8 mg/mL PFECs作用细胞后,抑制效果不显著,这可能是由于细胞密度不均匀所致。PFECs对MCF-7细胞增殖抑制作用随着浓度增加而逐渐显著;细胞增殖相对活性明显降低,分别为 69.99%、64.46%、63.49%、45.25%和36.56%。当PFECs浓度由0.2 mg/mL增大至1.6 mg/mL时,293FT细胞增殖相对活性均未受到抑制作用;但3.2 mg/mL PFECs作用48 h后,293FT细胞相对增殖活性受到显著抑制(P<0.05);这是由于PFECs浓度过高,作用时间过长导致。结合以上结果,肿瘤细胞对PFECs敏感程度大小依次为B16F10细胞> MCF-7>Eca109细胞>HeLa细胞。
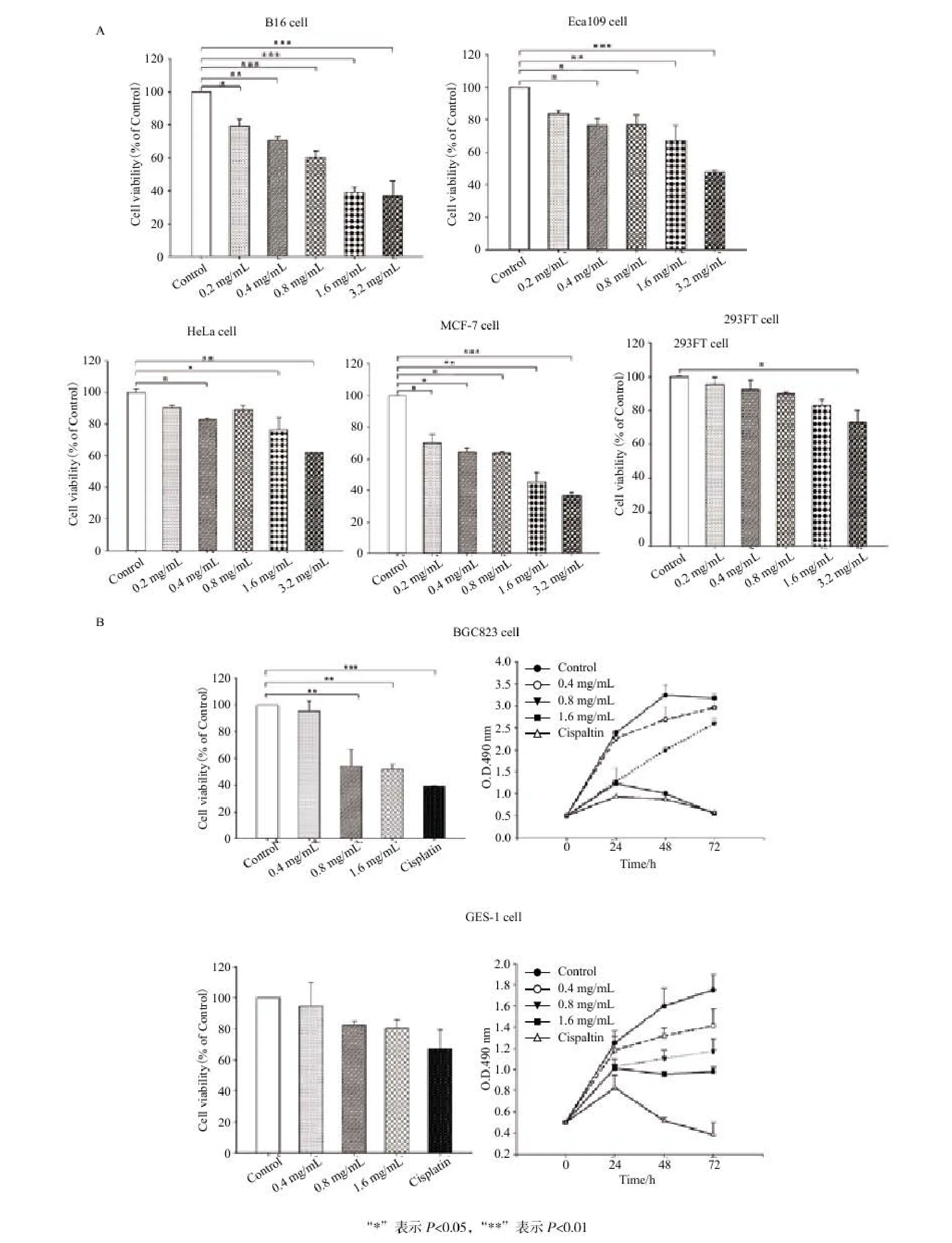
图1 阿魏菇醇提取物(PFECs)抗肿瘤活性
通过PFECs对胃癌BGC-823细胞及正常胃GES-1细胞活性、增殖的抑制作用确定PFECs最适作用浓度及最佳作用时间,结果如图1-B。PFECs呈时间-剂量依赖性抑制BGC-823细胞活性,且在24 h时,0.8 mg/mL、1.6 mg/mL PFECs对BGC-823细胞抑制显著;对正常胃GES-1细胞无显著性抑制作用。
综合结果分析得知,适宜浓度的PFECs具有显著抗肿瘤作用,能够抑制肿瘤细胞增殖,并对正常细胞毒副作用较小,确定PFECs最佳作用时间为24 h,最适作用浓度范围为(0.4、0.8和1.6 mg/mL)。
2.2 阿魏菇醇提物中三萜类化合物定性分析结果
氯仿-浓硫酸实验结果(图2)显示,氯仿层呈红色或砖红色,硫酸层呈荧光绿色,证明阿魏菇醇提物中含有一定量的三萜类化合物。

图2 阿魏菇醇提取液中三萜类化合物的定性分析
2.3 阿魏菇三萜类化合物提取单因素分析
2.3.1 提取次数对阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸):y=0.023x+0.023,相关系数:R=0.9988。不同提取次数对齐墩果酸类三萜得率会有影响,且在第一次提取时得率最大,至第3次提取时,提取率变化缓慢,表明已提取完全(图3)。因此提取次数确定为2次。
2.3.2 提取时间阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸)y=0.009 2x+0.009 6相关系数:R=0.998 0。从图4可以看出,从 30-90 min之间PFTPs得率呈增加趋势,在90-180 min时,PFTPs得率变化比较缓慢,随着时间的延长三萜得率开始降低。因此,从节能经济的基础上考虑,选用90 min为最佳提取时间。
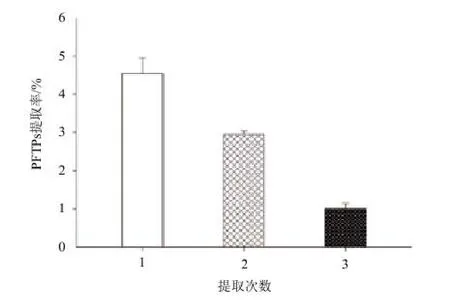
图3 提取次数对阿魏菇三萜类化合物(PFTPs)的影响
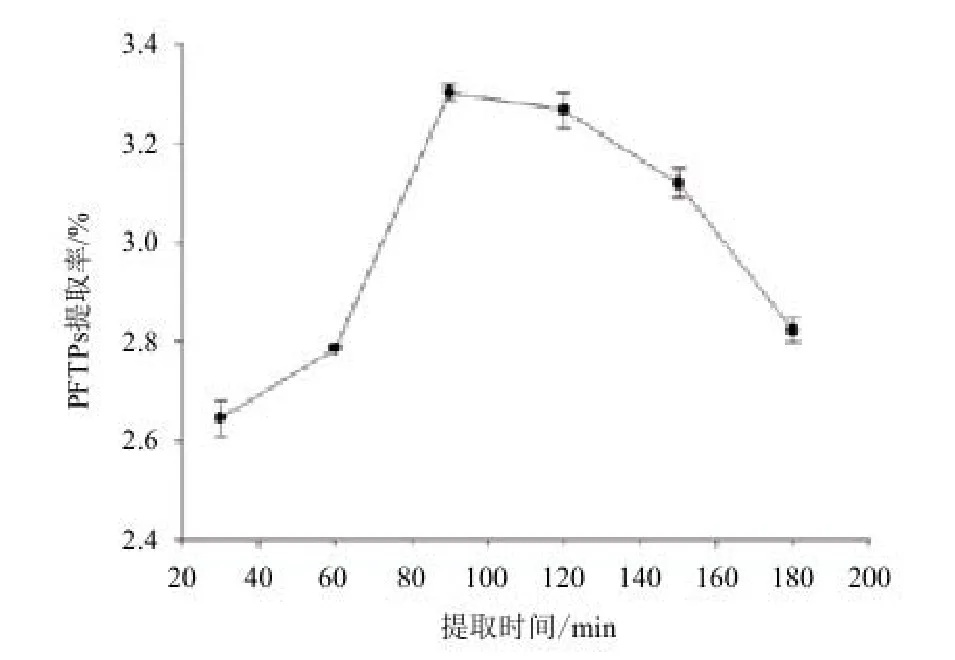
图4 提取时间对阿魏菇三萜类化合物(PFTPs)的影响
2.3.3 乙醇浓度对阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸):y=0.015 5x-0.003 1相关系数:R=0.995 9。图5显示,随着乙醇浓度的增大,三萜得率也在逐渐增大,直到乙醇浓度为95%时,三萜得率最大,说明乙醇浓度对阿魏菇三萜得率的影响较大。
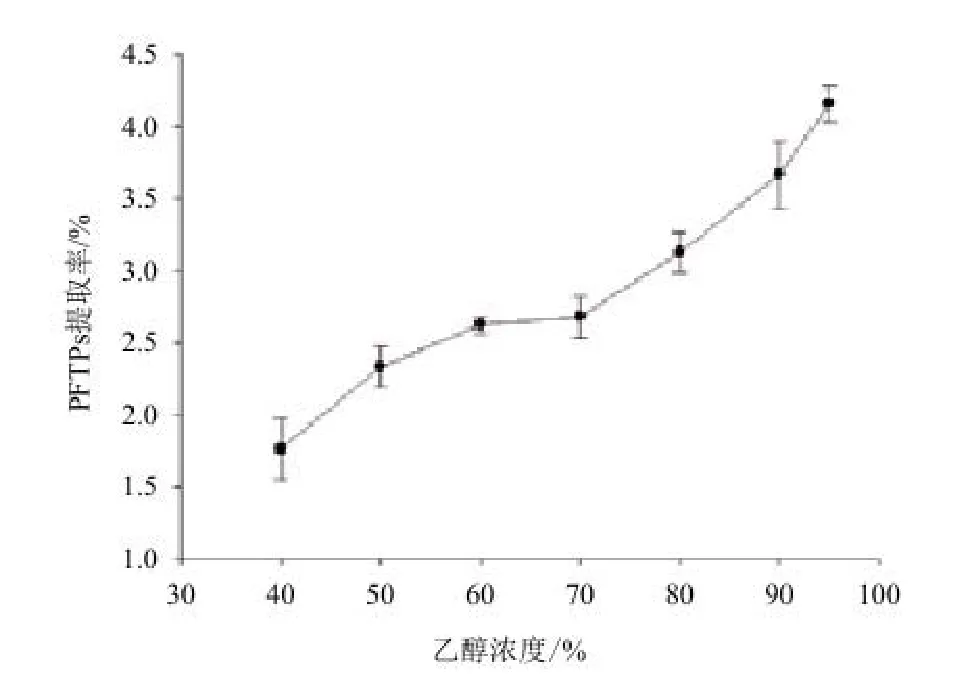
图5 乙醇浓度对阿魏菇三萜类化合物(PFTPs)的影响
2.3.4 提取温度对阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸):y=0.0149x+0.0256,相关系数:R=0.9954。图6显示,温度对PFTPs提取影响是显著的;50℃-70℃时,随着温度升高得率增加;随温度升高(70℃-90℃),PFTPs得率反而下降。这可能是因为温度较低时,三萜化合物不能充分浸出,得率较低;但温度过高,又会使部分三萜化合物裂解,造成得率有所下降。因此选取70℃为PFTPs提取温度。
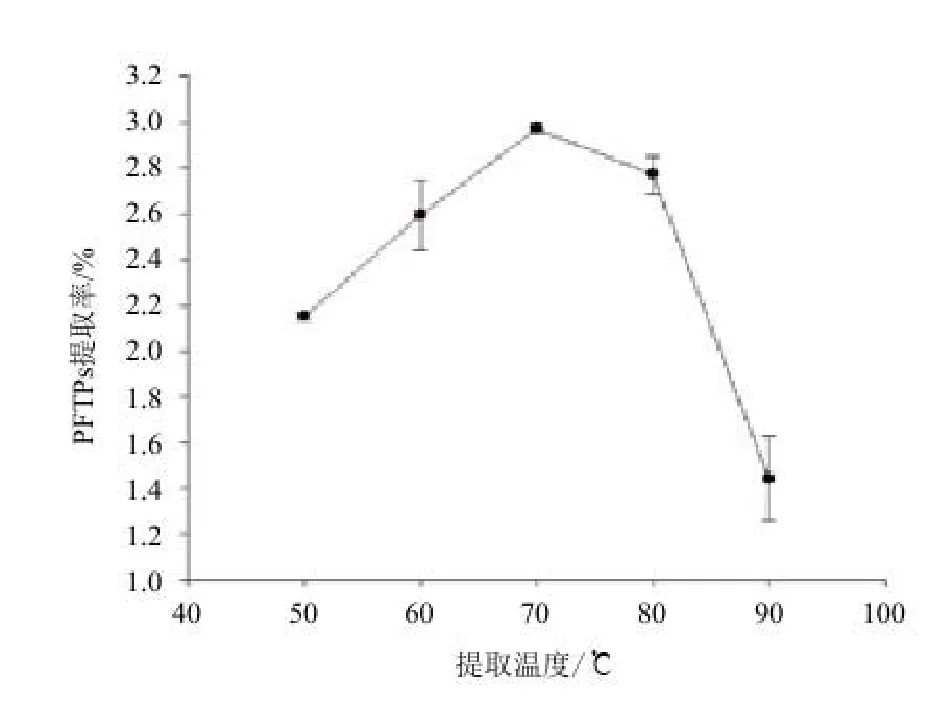
图6 提取温度对阿魏菇三萜类化合物(PFTPs)的影响
2.3.5 微波辅助时间对阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸)y=0.011 5x+0.016 3,相关系数:R=0.995 8。图7显示,微波辅助15 min对阿魏菇三萜类化合物的提取影响较大。
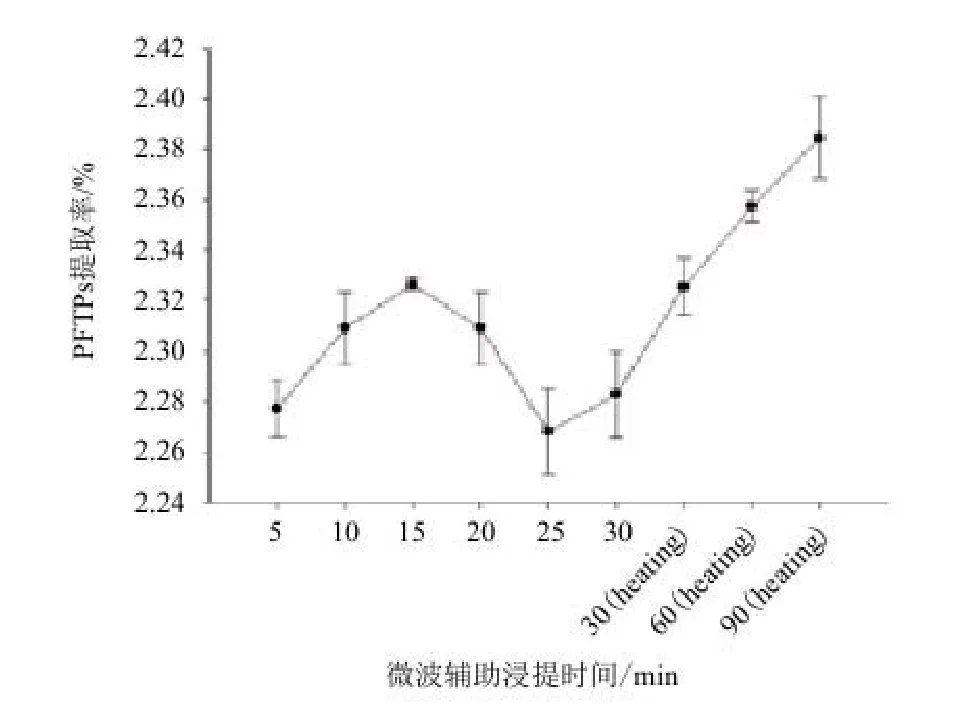
图7 微波辅助时间对阿魏菇三萜类化合物(PFTPs)的影响
2.3.6 超声时间对阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸):y=0.011 3x-0.007 3,相关系数:R=0.993 8。图8显示,超声40 min时,PFTPs得率最高,随着超声和加热时间的增多,使部分三萜裂解,三萜得率反而降低。因此确定超声时间40 min为最佳。
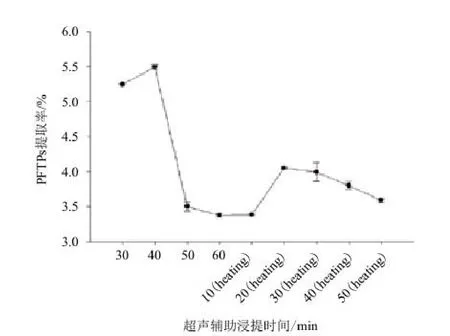
图8 超声辅助时间对阿魏菇三萜类化合物(PFTPs)的影响
2.3.7 料液比对阿魏菇三萜类化合物提取率的影响 标准曲线的线性回归方程(齐墩果酸)y=0.012 8x+0.054 3,相关系数:R=0.994 0。图9显示,在料液比为1∶20(g/mL),提取1次条件下,PFTPs得率最高,确定料液比为1∶20(g/mL)。
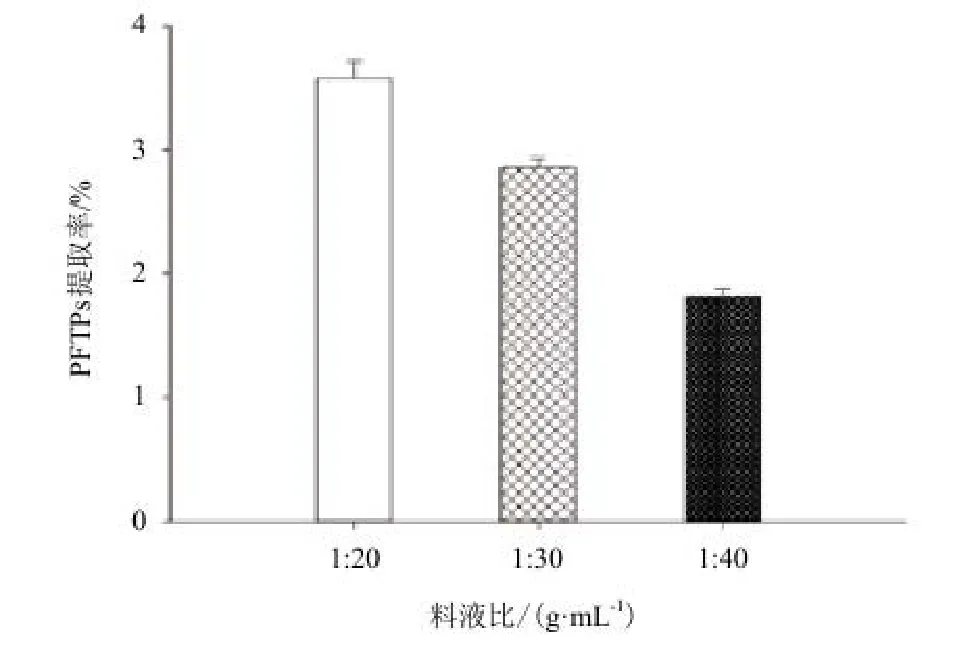
图9 料液比例对阿魏菇三萜类化合物(PFTPs)的影响
2.4 响应面分析法优化提取工艺结果
经多项式回归分析得到一个关于响应值(PFTPs提取率)与自变量关系的二价经验模型:共17个试验点,确定阿魏菇三萜类化合物(PFTPs)最佳提取优化工艺因素水平;试验因素、设计水平取值如表1所示;响应面试验设计与结果如表2所示。
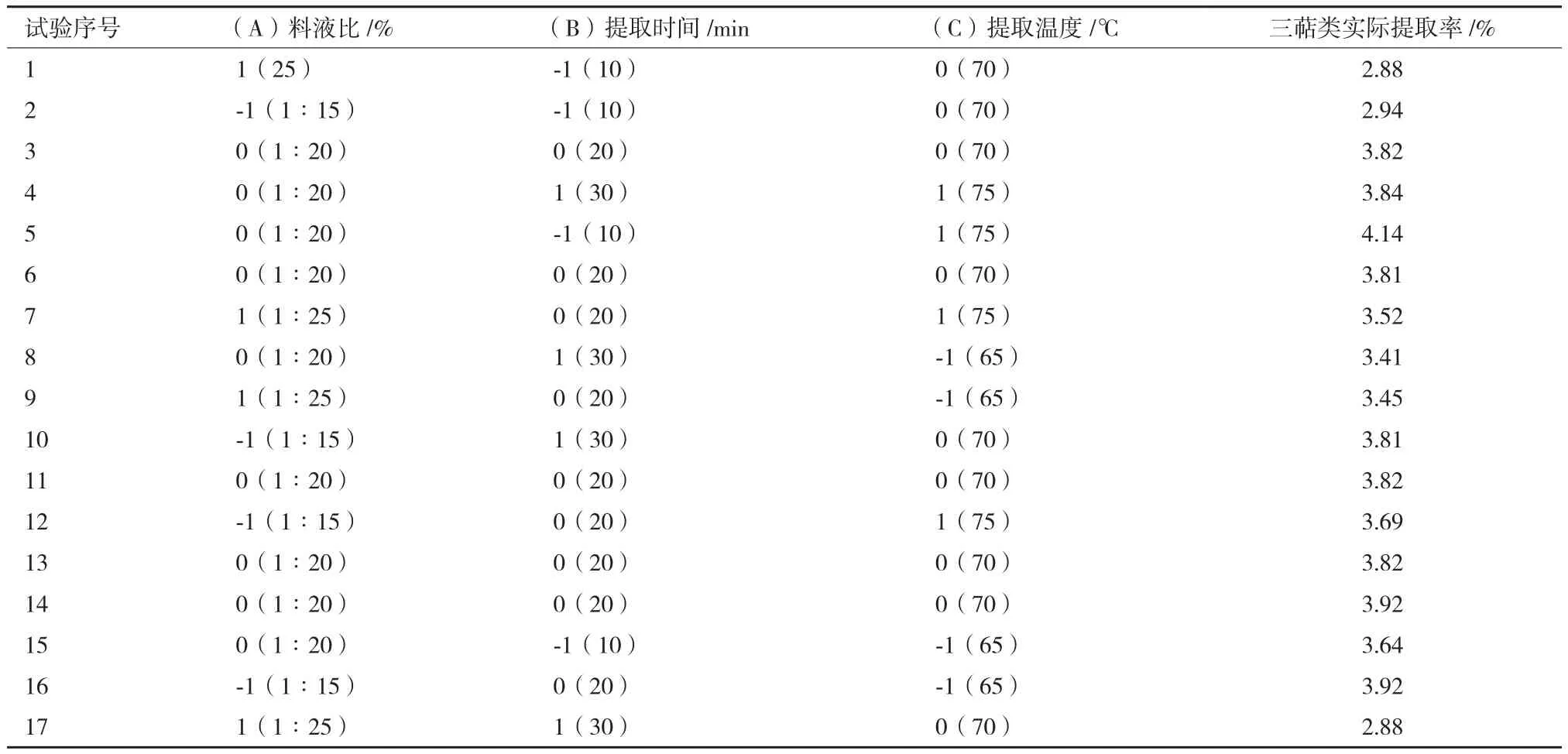
表2 响应面法设计与试验结果
2.4.1 建立模型方程与显著性检验 对表2中的数据进行多元回归拟合,进行显著性检验。对X1:料液比(A)、X2:提取时间(B)、X3:提取温度(C)与PFTPs提取率,由于方程变量间拟合度较差,需采用手动优化的方法对回归模型进行优化。优化结果见表4,经优化后的方程为:
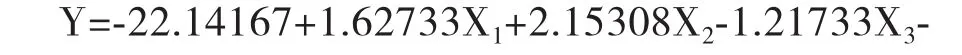
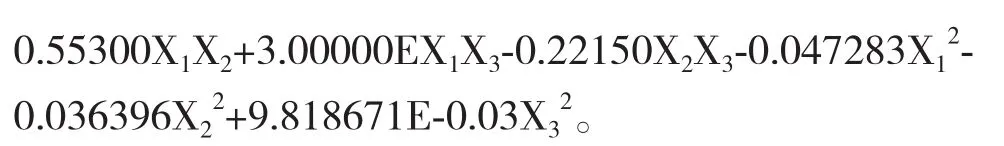
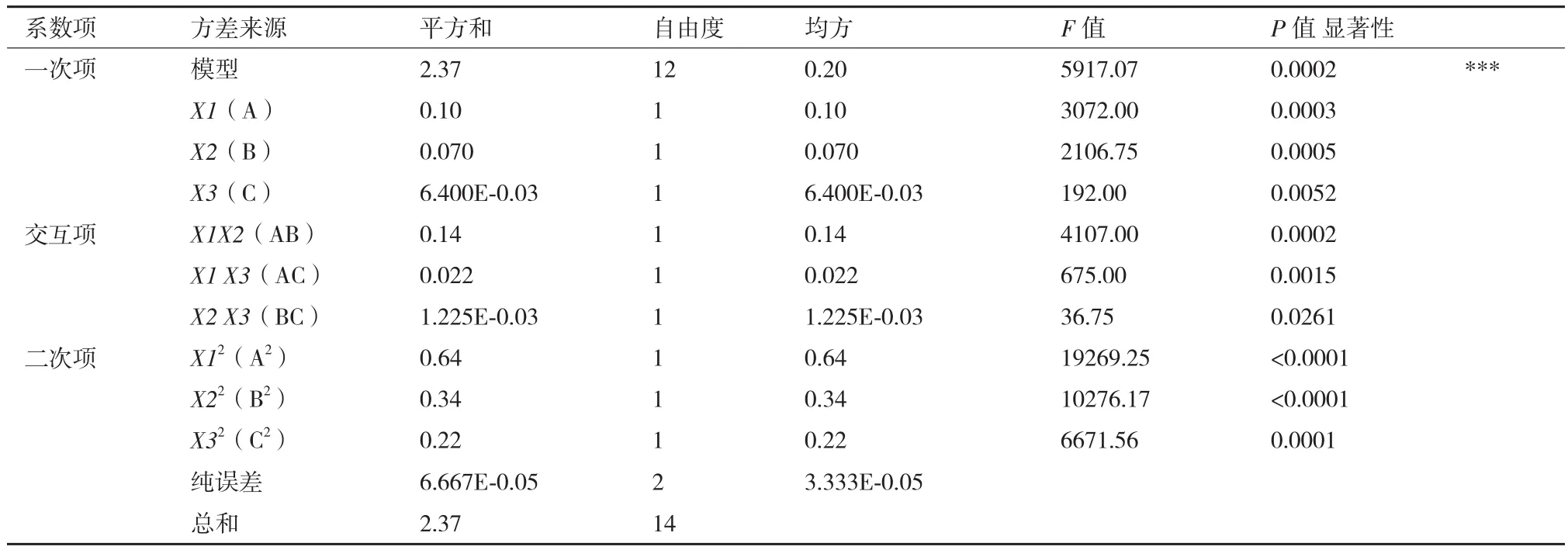
表3 响应曲面回归方程参数及显著性检验
表3中回归方差分析显著性检验结果表明,模型F值为591 7.07,P为0.000 1,表明模型显著。变量一次项X1(料液比)、X2(提取时间)、X3(提取温度),二次项(X12、X2
2),表明料液比、提取温度、提取时间(超声40 min后)以及三者相互作用对三萜提取率都具有显著影响。模型可信度分析统计结果(表4)表明,模型的复相关校正系数R2为0.999 8,C.V%=0.16,拟合程度比较好,误差小,由此得知回归模型拟合程度很好,响应曲面法适合应用于PFTPs提取率的分析及预测。

表4 模型可信度分析的统计检验结果
2.4.2 响应曲面图分析 以阿魏菇三萜类化合物(PFTPs)提取率为响应量,由两两自变量为坐标的3D图和等高线图直观反映料液比、提取时间和提取温度对PFTPs提取率的影响。
图10-a和图10-b为料液比与提取时间交互作用对PFTPs提取率影响的响应曲面和等高线图;PFTPs提取率随着料液比的增加而减小,随着提取时间的延长先增大后减小;图10-c和图10-d为料液比与提取温度交互作用对PFTPs提取率影响的响应曲面和等高线图;PFTPs提取率随着料液比的增大而减少,随着提取温度升高而减少。可能是因为温度过高后使浸出的PFTPs又再次溶解。图10-e和图10-f为提取时间与提取温度交互作用对PFTPs提取率影响的响应曲面和等高线图;PFTPs提取率随着提取时间的延长先增大后减小,随着提取温度升高而增大。结合响应曲面图及显著性检验结果可知三因素对三萜提取率影响显著大小依次为料液比>提取温度>提取时间。
2.4.4 数据点分布图分析 预测值与实际值数据点分布图(图11)显示,数据点几乎全部分布在一条直线上;综上分析三萜回归方程拟合度显著,响应面模型建立成功,具备很高的可行性与准确性。
2.4.5 阿魏菇三萜最佳优化提取条件的验证 通过对回归方程的求解,三萜提取优化工艺条件为:料液比为1∶18.79(%),提取温度为75℃,超声时间为21.67 min;在此条件下三萜提取率达到4.16%。经实际条件修正,实验验证发现,以料液比:1∶19(g/mL),提取温度:75℃,超声40 min后提取时间:22 min,PFTPs最大提取率4.42%。
3 讨论
本研究将提取的阿魏菇醇提物(PFECs)进行肿瘤细胞增殖抑制检测,抗肿瘤效果较显著,这与相关的研究报道结果相一致[27],2004年,研究者发现阿魏菇粗提物能够显著抑制人肝癌细胞(QCY-7703,Q3),人胃癌细胞(MGC-823)等多种细胞株的增殖,并发现影响细胞表面蛋白受体分子fas基因的mRNA水平表达。本研究的前期实验结果也同样证实阿魏菇醇提物可以影响细胞周期及细胞凋亡蛋白水平的表达[22,28]。经研究者发现,阿魏菇的抗肿瘤机制有可能通过提高机体免疫功能抑制肿瘤生长等途径实现[29]。杨琳等[24]发现阿魏菇主要通过增大免疫器官指数、激活巨噬细胞和T、B淋巴细胞、增强红细胞免疫功能、诱生细胞因子等途径,在提高机体免疫功能方面发挥重要作用。本研究也发现富含多糖的阿魏菇粗提物可显著调节小鼠机体免疫,刺激TNF-α,CD40等因子水平[25],但阿魏菇抗肿瘤的分子作用机制仍需要深入探讨。目前阿魏菇醇溶性部位有效成分的提取及功能作用研究报道较少,根据阿魏菇乙醇、酸性乙醇溶液预试验初步鉴定,阿魏菇醇溶性部位中存在三萜类等物质;因此推测阿魏菇醇提物的抗肿瘤作用可能是由于萜类、生物碱等物质在醇提物中发挥了关键作用。
预实验结果表明传统提取方法提取阿魏菇三萜类化合物(PFTPs)存在提取率低,活性差等特点。随着新技术的发展,多种新型浸提方法如超声辅助提取法[30,31]、微波辅助提取法[32]、超临界流体萃取法[33]等被采用。超声辅助浸提法是其中一种高效、成本低廉,简单有效的技术方法,文献报道它在提取工艺过程中可显著增加提取成分得率,缩短提取时间,提高产量[34],对提取物中不稳定物质损伤小,避免活性组分的降解[35,36]。因此本研究在维持醇溶组份活性稳定的基础上,对阿魏菇醇溶性部位三萜类化合物(PFTPs)进行超声辅助、微波辅助提取优化,发现超声辅助效果较好,提取率较高;提取是研究中草药等物质活性组分的关键步骤。由于醇溶性部位的提取存在着提取率低,含量少的问题,结合响应曲面法提取优化工艺,对PFTPs进行了优化提取,获取最大提取率,保证了后续试验的顺利进行。阿魏菇醇提物的功效检测及三萜类化合物(PFTPs)的提取优化不仅筛选出阿魏菇显著的生物活性物质作用部位,也为深入研究其抗肿瘤作用分子机制奠定理论基础;但仍需要对阿魏菇三萜类化合物的分离纯化及功效验证进一步深入研究。
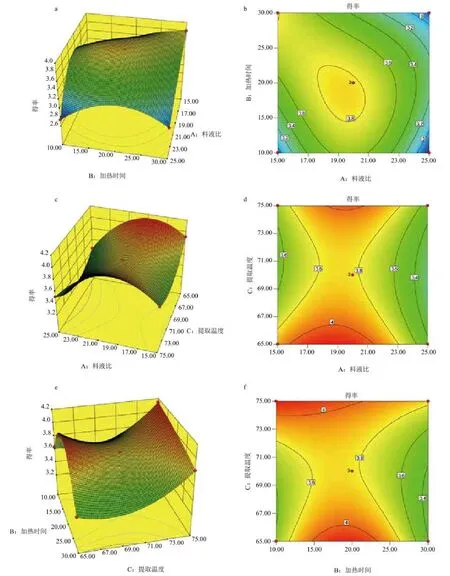
图10 响应值与三个因素之间的响应面图(3D图)和曲线图(2D)
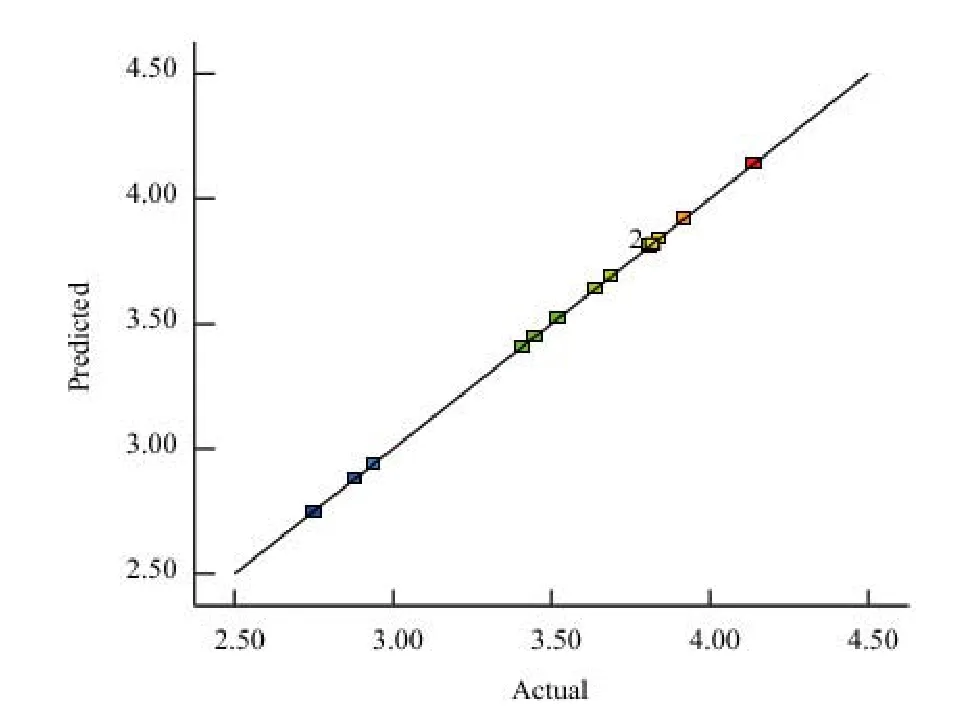
图11 响应面数据点图(预测响应值与实际检测值的比较)
4 结论
初步证实阿魏菇醇提取物的抗氧化、抗肿瘤功效;通过氯仿-浓硫酸试验初步鉴定阿魏菇中含有三萜类化合物;并采用超声辅助提取法提取优化三萜类化合物的最佳提取工艺条件为:提取温度75℃、提取时间为22 min(超声40 min后)、料液比为1∶19(g/mL),在此条件验证结果为:三萜类化合物提取率为4.42%。
[1]Wu C, Zhang RL, Li HY, et al. Triterpenoid saponins from the root bark of Schima superba and their cytotoxic activity on B16 melanoma cell line[J]. Carbohydrate Research, 2015, 413:107-114.
[2]Li HF, Wang XA, Xiang SS, et al. Oleanolic acid induces mitochondrial-dependent apoptosis and G0/G1 phase arrest in gallbladder cancer cells[J]. Drug Design, Development and Therapy, 2015, 9:3017-3030.
[3]Li H, Wang XY, Wang XY, et al. Two new triterpenoid saponins from the aerial parts of Anemone taipaiensis[J]. Journal of Asian Natural Products Research, 2015, 17(5):576-585.
[4]Zhang HY, Wang YW, Zhu PQ, et al. Design, synthesis and antitumor activity of triterpenoid pyrazine derivatives from 23-hydroxybetulinic acid[J]. European Journal of Medicinal Chemistry, 2015, 97:235-244.
[5]Li Y, Yang J, et al. Ilexgenin A inhibits endoplasmic reticulum stress and ameliorates endothelial dysfunction via suppression of TXNIP/NLRP3 inflammasome activation in an AMPK dependent manner[J]. Pharmacological Research, 2015, 99:101-115.
[6]Zong JF, Wang RL, Bao GH, et al. Novel triterpenoid saponins from residual seed cake of Camellia oleifera Abel show anti-proliferative activity against tumor cells[J]. Fitoterapia, 2015, 104:7-13.
[7]Liu CD, Dunkin D, Lai J, et al. Anti-inflammatory effects of ganoderma lucidum triterpenoid in human Crohn's disease associated with downregulation of NF-κB signaling[J]. Inflammatory Bowel Diseases. 2015, 21(8):1918-1925.
[8]Guo ZK, Yang T, Cai CH, et al. A new apotirucallanetype triterpenoid from Atalantia buxifolia[J]. Journal of Asian Natural Products Research, 2015, 28:1-6.
[9]Wang YY, Zhang CY, Ma YQ, et al. Therapeutic effects of C-28 methyl ester of 2-cyano-3, 12-dioxoolean-1, 9-dien-28-oic acid(CDDO-Me;bardoxolone methyl)on radiation-induced lung inflammation and fibrosis in mice[J]. Drug Design, Development and Therapy, 2015, 9:3163-3178.
[10]Probst BL, Trevino I, et al. RTA 408, a novel synthetic triterpenoid with broad anticancer and anti-inflammatory activity[J]. PLoS One, 2015, 21:10(4):e0122942.
[11]Wang T, Wei ZF, Dou YN, et al. Intestinal interleukin-10 mobilization as a contributor to the anti-arthritis effect of orally administered madecassoside:a unique action mode of saponin compounds with poor bioavail ability[J]. Biochemical Pharmacology, 2015, 94(1):30-38.
[12]Yang WS, Ko J, et al. 21-O-angeloyltheasapogenol E3, a novel triterpenoid saponin from the seeds of tea plants, inhibits macrophagemediated inflammatory responses in a NF-κB-dependent manner[J]. Mediators of Inflammation, 2014, 2014:658351.
[13]Feng SM, Luo ZS, Zhang YB, et al. Phytochemical contents and antioxidant capacities of different parts of two sugarcane(Saccharum officinarum L. )cultivars[J]. Food Chemistry, 2014, 151:452-458.
[14]Liu X, Zhu LC, Tan J, et al. Glucosidase inhibitory activity and antioxidant activity of flavonoid compound and triterpenoidcompound from Agrimonia Pilosa Ledeb[J]. BMC Complementary and Alternative Medicine, 2014, 14:12.
[15]Zhang YN, Song M, Ng TB, et al. Purification and characterization of antioxidant components from the fruiting bodies of Pleurotus abalonus including 9-beta-d-ribofuranosidoadenine, 5'-deoxy-5'-(methylthio)adenosine, and atriterpenoid[J]. Environmental Toxicology and Pharmacology, 2013, 36(2):689-696.
[16]Yuan HB, Meng SH, Wang GZ, et al. Hypoglycemic effect of triterpenoid-rich extracts from Euryale ferox shell on normal and streptozotocin-diabetic mice[J]. Pakistan Journal of Pharmaceutical Sciences, 2014, 27(4):859-864.
[17]Qin JH, Ma JZ, Yang XW, et al. A triterpenoid inhibited hormoneinduced adipocyte differentiation and alleviated dexamethasoneinduced insulin resistance in 3T3-L1 adipocytes[J]. Natural Products and Bioprospecting, 2015, 5(3):159-166.
[18]Koneri RB, Samaddar S, et al. Antidiabetic activity of a triterpenoid saponin isolated from Momordica cymbalaria Fenzl[J]. Indian Journal of Experimental Biology, 2014, 52(1):46-52.
[19]Singh S, Farswan M, Ali S, et al. Antidiabetic potential of triterpenoid saponin isolated from Primula denticulate[J]. Pharmaceutical Biology, 2014, 52(6):750-755.
[20]Yuan HB, Gong ZB, Meng SH, et al. Hypoglycemic and hypolipidemic effects of a triterpenoid-rich extract from Euryale shell on streptozotocin-induced diabetic mice[J]. Pharmazie, 2013, 68(3):227-231.
[21]Alam N, Yoon KN, Lee JS, et al. Consequence of the antioxidant activities and tyrosinase inhibitory effects of various extracts from the fruiting bodies of Pleurotus ferulae[J]. Saudi Journal of Biological Sciences, 2012, 19(1):111-118.
[22]Wang WL, Chen KX, Liu Q, et al. Suppression of tumor growth by Pleurotus ferulae ethanol extract through induction of cell apoptosis, and inhibition of cell proliferation and migration[J]. PLoS One, 2014, 9(7):e102673.
[23]Alam N, Yoon KN, Lee TS. Antihyperlipidemic activities of Pleurotus ferulae on biochemical and histological function in hypercholesterolemic rats[J]. Journal of Research in Medical Sciences, 2011, 16(6):776-786.
[24]杨琳, 巩平, 王冬慧, 等. 阿魏菇增强免疫机制的研究进展[J].现代生物医学进展, 2010, 20:3957-3959.
[25]Li JY, Wang XH, Wang WL, et al. Pleurotus ferulae water extract enhances the maturation and function of murine bone marrowderived dendritic cells through TLR4 signaling pathway[J]. Vaccine, 2015, 33(16):1923-1933.
[26]Pensec F, Pączkowski C, Grabarczyk M, et al. Changes in the triterpenoid content of cuticular waxes during fruit ripening of eight grape(Vitis vinifera)cultivars grown in the Upper Rhine Valley[J]. Journal of Agricultural and Food Chemistry, 2014, 62(32):7998-8007.
[27]王为兰, 陈开旭, 郑秀芬, 等. 阿魏菇药理功能的研究进展[J].安徽农业科学, 2013, 41(21):8827-8828, 8831.
[28]宋旭红, 张月明, 刘金宝, 等. 新疆阿魏菇粗提物抗肿瘤效应研究[J]. 营养学报, 2004, 26(2):127-130.
[29]王冬慧, 巩平, 杨琳, 等. 阿魏菇抗肿瘤作用的研究进展[J].现代肿瘤医学, 2010, 18(11):2271-2273.
[30]Yang XD, Wu X, Hu LC, et al Effect of different solvents on extraction of effective components from Ligusticum chuanxiong[J]. Chin J Chin MaterMed, 2012, 37:1942-1945.
[31]Sun YY, Wang WH. Ultrasonic extraction of ferulic acid from Ligusticum chuanxiong[J]. J Chin Chem Eng, 2008, 39:653-656.
[32]Chi YS, Zhang ZD, Li CP, et al. Microwave-assisted extraction of lactones from Ligusticum chuanxiong Hort. using protic ionic liquids[J]. Green Chem, 2011, 13:666-670.
[33]Zhu JX, He W, Li Y, et al. Optimization extraction processes of ligustilide from Chuanxiong using RSM[J]. Chin Tradit Pat Med, 2011, 33:2172-2175.
[34]Yan YL, Yu CH, Chen J, et al. Ultrasonic-assisted extraction optimized by response surface methodology, chemical composition and antioxidant activity of polysaccharides from Tremella mesenterica[J]. Carbohydrate Polymers, 2011, 83:217-224.
[35]Chen XP, Wang WX, Li SB, et al. Optimization of ultrasoundassisted extraction of Lingzhi polysaccharides using response surface methodology and its inhibitory effect on cervical cancer cells[J]. Carbohydrate Polymers, 2010, 80:944-948.
(责任编辑 马鑫)
Antitumor Activity of the Ethanol Extract of Pleurotus ferulae and the Extraction Procedure of Triterpenoid Components
WANG Wei-lan CHEN Kai-xu LIU Jun DUAN Wei-wei XU Ya-nan ZHANG Fu-chun
(Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046)
This work aims to explore the antitumor activity of alcohol soluble components from Pleurotus ferulae(PFECs),and to optimize the extraction condition of triterpenoids from P. ferulae(PFTPs)for maximum extraction yield. MTT was used to detect the inhibitory activity of PFECs to 5 kinds of tumor cells,no significant inhibition to 2 kinds of normal cells was observed. Ultrasonic-assisted,hot-water leaching with ultrasonic-assisted,single-factor experiment,and response surface methodology were jointly employed to optimize the extraction process of PFTPS. The results showed that PFECs presented significant antitumor activity. The optimal process parameters for the PFTPs extraction were:the ratio of ethanol to material 1∶19(g/mL),extraction time 22 min and extraction temperature 7℃,and the extracting yield of PFTPs was 4.42%.
Pleurotus ferulae;ethanol extracts;active components;antitumor activity;triterpenoids;optimization of extraction;response surface methodology
10.13560/j.cnki.biotech.bull.1985.2016.07.030
2015-07-14
国家自然科学基金项目(31260267),新疆自治区动物学重点学科资助(2011001),新疆大学天山学者特聘教授科研项目资金,新疆生物资源基因工程重点实验室开放课题(XJDX0201-2014-08),新疆大学博士启动资金项目(210-61287)
王为兰,女,博士,研究方向:功能性食品的开发与应用,E-mail:wwlbiology@163.com
刘军,男,博士,研究方向:功能性食品的开发与应用,E-mail:105506757@qq.com;张富春,男,博士,研究方向:生物资源的开发及分子生物学,E-mail:zfcxj@sina.com

