四种果皮中橙皮苷含量的测定
曹峰
莱芜市食品药品检验检测中心,山东莱芜271100
四种果皮中橙皮苷含量的测定
曹峰
莱芜市食品药品检验检测中心,山东莱芜271100
摘要:为建立一种测定橙皮、橘皮、柚皮及柠檬皮中橙皮苷含量的高效液相色谱法。以Symmertry Shield RP18柱为分离柱,甲醇-2.5%乙酸溶液(40:60 V:V)为流动相,柱温30℃,紫外检测器在波长283 nm条件下检测,一次进样7 min内完成分析过程。橙皮苷在2.0~100.0 mg/L范围内有良好的线性关系(R=0.9999);平均加标回收率为98.9%,检出限为2.0×10-3g/kg;精密度实验(n=6)表明,橙皮苷峰面积的相对标准偏差(RSD)为0.05%。该方法简便快捷,可准确测定四种果皮中橙皮苷的含量。
关键词:高效液相色谱法;四种果皮;橙皮苷
橙皮苷(Hesperidin)是一种双氢黄酮类糖苷[1],为黄酮类化合物中最重要的一种。研究表明,橙皮苷具有抗氧化、抗过敏、抑菌消炎、抗病毒、抗癌、维持渗透压、降低血压、降低低密度胆固醇、调节免疫、改变体内酶活性、改善微循环等生理功能[2,3],具有很高的药用价值,是治疗心血管疾病药物的重要原料[4]。此外,橙皮苷还可作为天然抗氧化剂和食品添加剂的原料,在食品及保健品领域有着广泛的用途[5]。
橙皮苷主要存在于柑橘类水果中,尤其是在柑、橘、甜橙和柠檬等的果皮中含量较多[1],但除橘皮可作为中药材陈皮外,橙皮、柚皮、柠檬皮等常作为废弃物扔掉,从环境、经济和资源利用角度都不尽科学合理。因此,准确测定橙皮、橘皮、柚皮及柠檬皮中橙皮苷含量,为橙皮苷提取原料的选择提供理论依据,对充分利用四种果皮具有重要意义。目前橙皮苷的检测方法主要有高效液相色谱法[6]、紫外分光光度法[7]、高效液相色谱-串联质谱联用法[8],核磁共振氢谱法[9]等,其中高效液相色谱法具有灵敏度高、重现性好、操作简便等优点,是最常用的测定方法之一。
为充分提取果皮中的橙皮苷,本实验参考相关文献[10-12]并加以改进,以甲醇作为提取液,超声提取3次,大大提高了橙皮苷的提取率,并建立了一种准确、简便、快速测定四种果皮中橙皮苷含量的高效液相色谱法,旨在为为橙皮、橘皮、柚皮、柠檬皮资源的充分利用提供理论支持。
1 材料与方法
1.1设备与材料
Waters e2695高效液相色谱仪(带自动进样器,Empower 3工作站),美国Waters公司;Waters 2489紫外/可见光检测器,美国Waters公司;UV-9000S双光束紫外可见分光光度计,上海元析仪器有限公司;JAC-300N超声波振荡器,济宁市奥波超声电气有限公司;TGL-20M台式高速离心机,上海卢湘仪离心机仪器有限公司。
橙皮苷标准品,美国ACROS公司;甲醇(色谱纯)、冰乙酸(优级纯),天津市科密欧化学试剂有限公司;实验用水为超纯水。
1.2色谱条件
色谱柱为Symmertry Shield RP18柱(4.6 mm×150 mm,5.0 μm;美国Waters公司),流动相为甲醇-2.5%乙酸溶液(40:60 V:V),流速为1 mL/min,进样量20 μL,柱温30℃,紫外检测器波长283 nm。以保留时间定性,峰面积定量。
1.3样品处理
将干燥后的橙皮、橘皮、柚皮及柠檬皮四种果皮样品粉碎,过60目筛,分别称取样品0.2 g(精确至0.001 g),放入250 mL具塞三角瓶中,加入50 mL甲醇,于超声波振荡器中超声提取45 min(功率200 W,温度50℃),然后以6000 r/min的转速离心15 min,移取上清液于250 mL容量瓶中,剩余残渣再超声提取2次,每次20 mL甲醇,超声提取10 min,合并提取液,用甲醇定容至250 mL,经0.22 μm滤膜过滤后待测。
1.4标准品溶液的配制
精确称量橙皮苷标准品5.00 mg,用甲醇超声溶解并定容至50 mL,即得100.0 mg/L橙皮苷标准品溶液,作为储备液。
分别精确移取橙皮苷标准品储备液0.20 mL、0.50 mL、1.00 mL、2.50 mL、5.00 mL于5只10 mL的容量瓶中,用甲醇溶解并定容至刻度,即得2.0 mg/L、5.0 mg/L、10.0 mg/L、25.0 mg/L、50.0 mg/L橙皮苷标准品溶液。
2 结果与分析
2.1色谱条件的优化
2.1.1检测波长的选择利用紫外可见分光光度计对橙皮苷标准品溶液在波长200~350 nm范围内进行紫外扫描,结果见图1所示。
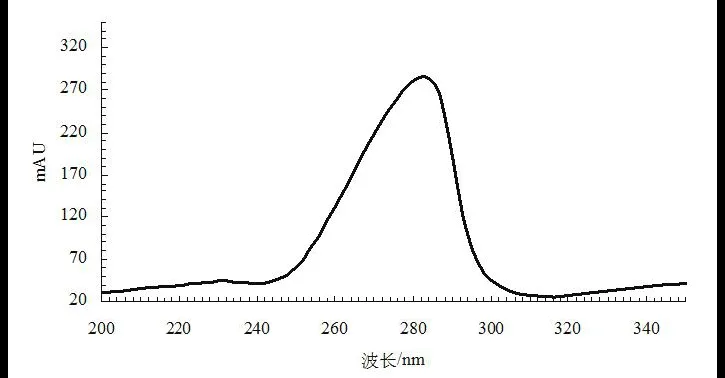
图1 橙皮苷的扫描光谱图Fig.1 Absorption spectrum of hesperidin
由图1可以看出橙皮苷在波长283 nm左右有最大吸收,与《中国药典》中药材陈皮质量标准中橙皮苷含量测定的检测波长一致,且在最大吸收波长条件下检测干扰少,灵敏度高,因此本研究选择283 nm作为检测波长。
2.1.2流动相及洗脱条件的选择参照相关文献[13,14],本研究对比了乙腈-0.5%磷酸、乙腈-0.5%乙酸、甲醇-2.5%乙酸溶液、甲醇-0.5%磷酸4种流动相体系,结果表明乙腈-0.5%磷酸、乙腈-0.5%乙酸、甲醇-2.5%乙酸溶液3种流动相体系的分离效果较好,由于甲醇毒性小于乙腈且乙酸腐蚀性要小于磷酸,因此本研究选择甲醇-2.5%乙酸溶液为流动相。
将甲醇与2.5%乙酸溶液在体积比分别为10:90、20:80、30:70、40:60及50:50的条件下对橙皮苷标准品及4种果皮提取液进行等度洗脱,结果发现两者体积比为20:80时橙皮苷在30 min内未能出峰,30:70时橙皮苷出峰时间在15 min左右,而体积比在40:60时橙皮苷5 min左右就能出峰,且峰形良好。尽管提高有机相甲醇的比例,橙皮苷的出峰时间能够提前,但橙皮苷色谱峰与杂质峰不能很好分离,考虑到检测效果,选择甲醇与2.5%乙酸溶液体积比为40:60。
2.1.3柱温及色谱条件的确定柱温对色谱柱的分离效果有一定影响,随着温度升高,柱压下降,被分析物质的保留时间缩短,由于橙皮苷耐热性较好,考虑到分析效果及分析时间,选择柱温为30℃。
通过以上实验,最终确定色谱条件为:流动相为甲醇-2.5%乙酸溶液(体积比40:60),流速为1 mL/min,进样量20 μL,紫外检测器波长283 nm,柱温30℃。在此条件下橙皮苷标准物质及四种果皮样品色谱图见图2所示。

图2 橙皮苷标准物质及四种果皮色谱图A:橙皮苷标准物质;B:橙皮;C:橘皮;D:柚皮;E:柠檬皮Fig.2 Chromatogram of hesperidin standard materials and four kinds of peels A:Hesperidin standard;B:Orange peel;C:Citrus peel;D:Pomelo peel;E:Lemon peel
2.2橙皮苷的线性和检出限
在优化的色谱条件下,对1.4中配制的不同浓度的橙皮苷标准物质溶液进行测定,结果显示在此范围内浓度和峰面积之间有良好的线性关系。橙皮苷的标准曲线见图3,回归方程、相关系数(R)、检出限(在优化的色谱条件下以3倍信噪比为检出限)、相对标准偏差(RSD)见表1。
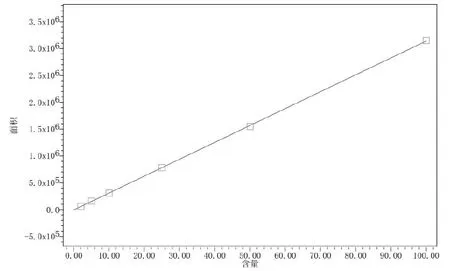
图3 橙皮苷的标准曲线Fig.3 Standard curve of hesperidin

表1 回归曲线的基本参数及检出限Table 1 Fundamental parameters of regression equation and detection limit
2.3检测方法的精密度实验
将浓度为10.0 mg/L的橙皮苷标准品溶液进样20 μL,连续重复6次,测其峰面积,结果见表2。
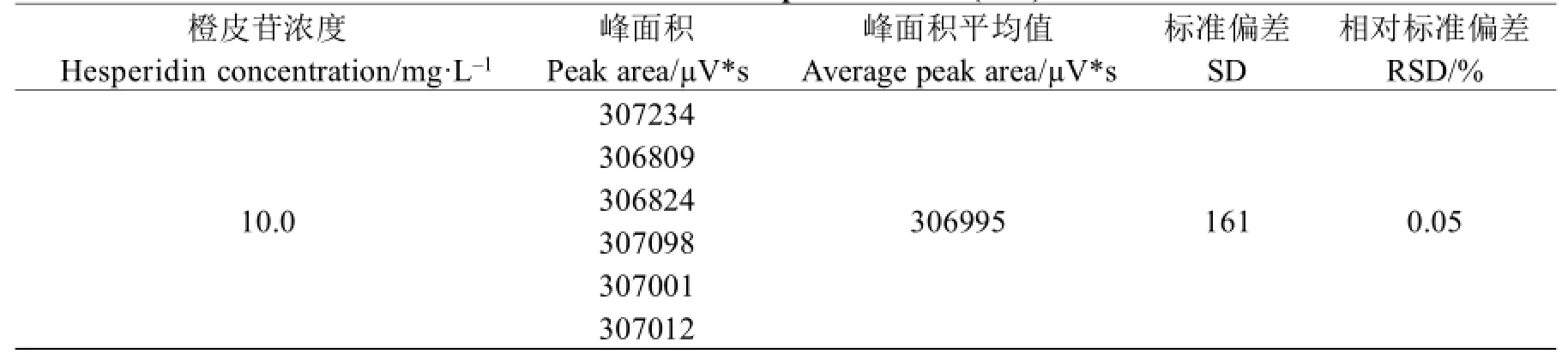
表2 精密度实验结果(n=6)Table 2 Results of precision test(n=6)
由表2可以看出,连续6次测定的橙皮苷峰面积的RSD为0.05%,因此本方法精密度良好。
2.4样品加标回收率的测定
以橙皮为样品,按线性范围加入一定量的橙皮苷标准物质,按照1.3中的方法处理后进行加标回收实验,平行测定6次,结果见表3。
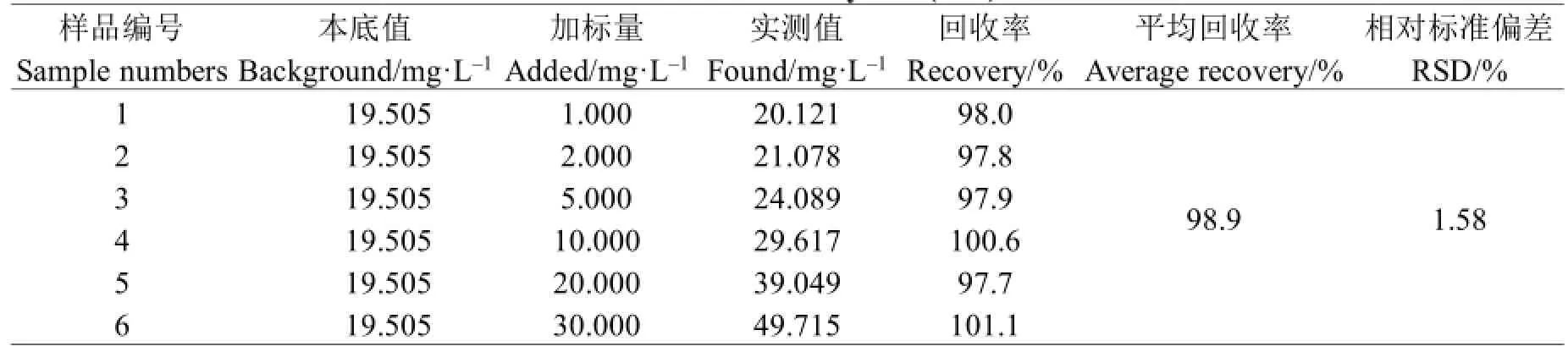
表3 加标回收实验(n=6)Table 3 The recovery test(n=6)
从表中结果可以看出,在优化的分析条件下橙皮苷的平均加标回收率为98.9%,相对标准偏差(RSD)为1.58%,测定结果准确可靠,完全满足样品的检测要求。
2.5样品中橙皮苷含量的测定
将1.3项制备的橙皮、橘皮、柚皮及柠檬皮供试样品溶液按1.2色谱条件平行测定6次,结果见表4。
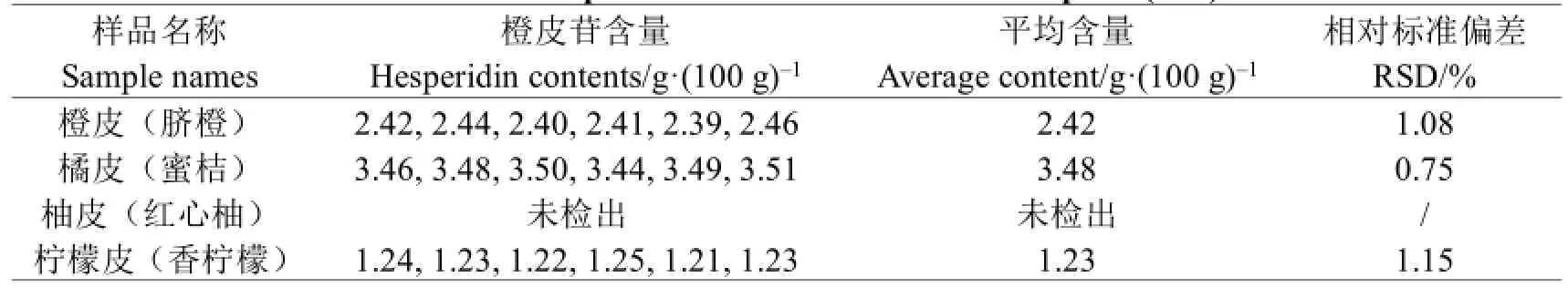
表4 四种果皮中橙皮苷含量(n=6)Table 4 The hesperidin contents in four kinds of peels(n=6)
由表4可以看出,4种果皮中橘皮(蜜桔)的橙皮苷含量最高,为3.48 g/100 g,其次为橙皮(脐橙)2.42 g/100 g,柠檬皮(香柠檬)1.23 g/100 g,其中柚皮(红心柚)中未检出橙皮苷,与但俊峰[15]的研究结果相似。
3 结论
本方法采用甲醇为提取液,甲醇-2.5%乙酸溶液(体积比为40:60)为流动相,紫外检测器波长为283 nm,橙皮苷在2.0~100.0 mg/L范围内有良好的线性关系(R=0.9999);平均加标回收率为98.9%,检出限为2.0×10-3g/kg;精密度试验显示6次测定橙皮苷标准品,其峰面积的相对标准偏差为0.05%。研究结果表明该方法分离效果好、快速简便、精密度好,可以准确测定4种果皮中橙皮苷的含量,适合检测机构的日常检测。
参考文献
[1]张凤,黄芳,李健.正交试验优化橘皮中橙皮苷提取工艺[J].安徽农业科学,2012,40(21):11048-11049
[2]宁方刚,许建中,李小波,等.橙皮苷的高效液相色谱定量分析[J].中国食品添加剂,2011(11):220-223,234
[3]齐兵,何志勇,秦肪,等.陈皮中橙皮苷的提取与纯化工艺研究[J].食品工业科技,2012,33(24):343-346
[4]朱玉昌,周大寨,王成.甜橙皮中橙皮苷提取工艺[J].食品科学,2010,31(22):264-267
[5]朱荣莉,高少洁,雷杰,等.桔皮中橙皮苷提取工艺的研究[J].食品与发酵科技,2012,48(6):57-60
[6]WANG Ningfang. Determination of Hesperidin in Citrus Peel by HPLC[J]. Agricultural Science & Technology,2013,14(4):554-556,576
[7]贺丽娜,叶华,郭方遒.橙皮苷分析方法研究[J].广州化工,2012,40(14):126-128
[8]许海棠,李家璇,陈其锋,等.HPLC-MS/MS法测定四季感冒胶囊中的4种有效成分[J].广西民族大学学报:自然科学版,2013,19(3):91-94
[9]李建发,全志利,蓝丹,等.核磁共振氢谱定量分析橙皮苷含量[J].实验室研究与探索,2012,31(6):18-21
[10]谈安群,吴厚玖,王华,等.索氏法与超声波辅助提取甜橙橙皮苷比较研究[J].中国食品学报,2012,12(6):80-87
[11]梁志鸿,刘晓红,李建敏,等.从柑桔皮中超声提取橙皮苷[J].食品科技,2012,37(3):225-228
[12]朱红菊,丁玉,贾亚伟.桔皮中橙皮苷的新型双水相萃取[J].食品与生物技术学报,2013,32(9):995-1001
[13]甘伟发,黄庆华,吉国辉,等.茶枝柑皮提取物中黄酮类成分的含量测定[J].广东药学院学报,2013,29(3):273-276
[14]杨慈海,杨春丽.高效液相色谱法测定养胃颗粒中橙皮苷的含量[J].北方药学,2013,10(10):5-6
[15]但俊峰.不同生长期柚果中功能性成分的分析研究[D].杭州:浙江大学生物系统工程与食品科学学院,2008:10-23
Determination of Hesperidin Contents in Four Kinds of Peels
CAO Feng
Laiwu Food and Drug Inspection Center,Laiwu 271100,China
Abstract:In order to develop a method for determination of hesperidin contents in orange peel,citrus peel,pomelo peel and lemon peel by HPLC. Hesperidin was qualitatively analyzed through a Symmertry Shield RP18 column. The mobile phase was methanol-2.5%acetic acid(40:60 V:V)and the column temperature was 30℃. A UV detector detected at 283 nm and the separation was achieved within 7 min. The standard working curve of hesperidin had a good liner relation in the concentration ranging from 2.0 to 100.0 mg/L(R=0.9999). The average recovery was 98.9%and detection limit was 2.0×10-3g/kg. The precision test(n=6)showed that the relative standard deviation(RSD)for the peak areas was 0.05%. This method was simple and rapid and could determine the content of hesperidin in four kinds of peels.
Keywords:HPLC;four kinds of peels;hesperidin
中图法分类号:O657.7
文献标识码:A
文章编号:1000-2324(2016)03-0404-04
收稿日期:2014-06-03修回日期:2014-06-30
作者简介:曹峰(1978-),男,硕士,工程师,主要从事食品检验检测工作. E-mail:caofeng3709@163.com

