微生物对暗棕壤添加玉米秸秆腐殖化进程的影响
李 艳,窦 森*,刘艳丽,2,王 帅,3,李立波(.吉林农业大学资源与环境学院,长春308;2.沧州市农林科学院,河北沧州06000;3.吉林农业科技学院植物科学学院,吉林320)
微生物对暗棕壤添加玉米秸秆腐殖化进程的影响
李艳1,窦森1*,刘艳丽1,2,王帅1,3,李立波1
(1.吉林农业大学资源与环境学院,长春130118;2.沧州市农林科学院,河北沧州061000;3.吉林农业科技学院植物科学学院,吉林132101)
摘要:针对微生物如何在土壤外源添加有机质的腐殖化进程中发挥作用这一科学问题,采用定量分析、元素组成、差热分析和红外光谱法,研究微生物对暗棕壤添加玉米秸秆腐殖化进程的影响并揭示不同微生物处理间的差异。结果表明,微生物处理能够显著促进有机物料的腐殖化,细菌由于对有机物料和腐植酸的利用度不高而产生的影响最小,真菌和放线菌的影响显著。腐植酸结构分析及PQ值(表征腐殖化程度)结果进一步揭示,微生物处理有利于HA(胡敏酸)的合成,并且FA(富里酸)有向HA转化的可能;细菌、真菌分别对腐植酸的N、H元素含量影响大,放线菌对腐植酸结构的影响主要表现在C=O键上;在培养后期,放线菌由于对纤维素类物质的充分利用而对腐植酸结构的影响超过了其他类群微生物。定量与定性分析结果能够相互印证,肯定了不同微生物对腐殖化进程的影响表现在不同培养阶段对不同物质和官能团的利用上。
关键词:腐殖化;土壤微生物;腐植酸;元素组成;红外光谱
李艳,窦森,刘艳丽,等.微生物对暗棕壤添加玉米秸秆腐殖化进程的影响[J].农业环境科学学报, 2016, 35(5):931-939.
LI Yan, DOU Sen, LIU Yan-li, et al. Effects of different microorganisms on humification of corn stover incorporated in dark brown soil[J]. Journal of Agro-Environment Science, 2016, 35(5): 931-939.
腐殖化过程是土壤自然肥力形成的重要过程,是陆地生态系统养分循环的中间枢纽。一般认为,当携带各类有机基质(如碳水化合物、木质素、脂类等)的新鲜物料进入土壤后,土壤中的原生动物及微生物会对其进行“改装”与“重组”[1],这是腐殖化过程的关键环节。在此过程中,有机质的添加使土壤理化性能发生改变,特别是土壤中原有腐植酸平衡被新形成的腐植酸打破,这个变化非常显著,国内外许多学者已对此进行过研究。张晋京等[2]将玉米秸秆施入灼烧后的土壤中,发现土壤的胡敏酸(HA)和富里酸(FA)含量均增加,但随着培养时间的延长,HA和FA含量逐渐减少且腐植酸的O/C比值下降。肖彦春等[3]研究表明,加入大量玉米秸秆后,HA的绝对含量和相对含量均随土/秸的增加而降低。这些变化很大程度上来自于微生物的作用。土壤微生物对有机物料的分解与利用直接影响着新的腐植酸平衡的形成。来航线等[4]在灭菌后的土壤中施入不同C/N的植物秸秆,并分别接种培养细菌、真菌和放线菌,试验结果表明灰褐类群链霉菌形成的FA含量最高,球孢类群链霉菌形成HA的分子量最大,芳构化程度最高,而木霉形成的HA含量最高,HA/FA最大。大量研究表明,微生物尤其是真菌可将木质素降解并氧化为醌型化合物参与形成HS[5-6]。同时,微生物通过降解原有腐植酸及合成新的腐植酸来增强其在腐殖化进程中的贡献。真菌绝大多数具有降解腐殖质和木质素的能力[7-10]。细菌、放线菌在腐殖化进程中同样有所贡献[11-17]。但不同类群的微生物在腐殖化过程中起的作用有何差异,这种差异是如何影响新的腐植酸平衡的形成,这些问题还有待突破。本文通过源头控制与连续培养实验,获得了不同培养时间和不同微生物处理下暗棕壤添加玉米秸秆后的腐殖化产物,采用元素组成、差热分析和红外光谱法,初步研究其腐植酸组成与结构,旨在探索不同微生物类群对玉米秸秆在暗棕壤中腐殖化进程影响的差异。
1 材料与方法
1.1供试土壤
暗棕壤采自黑龙江省北部黑河市农科院试验田(47°42′~51°03′N,124°45′~129°18′E),属高纬度寒带气候区域,该土壤已种植小麦至少10年。土壤类型为白浆化暗棕壤,试验前土壤基本性质如下:有机质39.5 g·kg-1、全氮2.19 g·kg-1、全磷0.42 g·kg-1、pH值为5.7、C/N为10.5。采样时间为2009年8月,深度为0~20 cm。将采集到的土样风干后,通过2 mm筛,备用。
1.2供试有机物料
玉米秸秆采自吉林农业大学玉米实验田。将采集到的整株玉米秸秆剪成适当大小,在恒温干燥箱中于50~70℃下烘干,用粉碎机粉碎后,通过60目筛。该玉米秸秆含有机碳432.3 g·kg-1,全氮5.5 g·kg-1,全磷7.6 g·kg-1,全钾4.2 g·kg-1,C/N为79。
1.3供试菌种
本实验所用细菌、放线菌和真菌是从供试暗棕壤中分离出来的。细菌为枯草芽孢菌(Brevibacterium sp.)和巨大芽孢杆菌(Bacillus megaterium);放线菌为链孢囊菌(Streptosporangium)和链霉菌(Strepto -myces);真菌为绿色木霉菌(Trichoderma viride)、青霉(Penicillium)和黑曲霉(Aspergillus)。实验所涉及的细菌、放线菌和真菌均为经提取纯化的各种纯菌株同类等比例混合的菌群,而混合菌系指以上三类菌的等比例混合菌群。
1.4实验设计
在约7.5 kg暗棕壤中加入约300 g玉米秸秆,混合均匀后,用硫酸铵调节C/N约为20:1,分装至100 mL三角瓶内,每瓶约50 g,调节土壤含水量至田间最大持水量的80%左右,塞上棉塞,灭菌。然后分别接种细菌、放线菌、真菌和混合菌。具体操作为:从暗棕壤中分离出来的细菌、放线菌和真菌经过纯化、扩培后,按照种群混合配制成等体积的4种菌悬液,加入到灭菌后的土壤中,每个三角瓶接种10 mL菌悬液。同时设1个不接种微生物的对照(CK)处理,共5个处理。在25℃条件下恒温恒湿培养,分别于30、60、90、120、180 d采样进行定量分析。另外将细菌处理120 d的样品,真菌、放线菌、混合菌、CK处理180 d的样品分别标记为A、B、C、D、E,统一进行定性结构分析。为了保证数据的可靠性,实验需要对供试土壤执行严格的灭菌方案,即利用日本ALP CL-32全自动高压锅湿热灭菌法在127℃下间歇性灭菌3次,每次4 h。并且在接种前,抽样检测土样的灭菌效果。每个样本设3次重复。
1.5分析测定方法
1.5.1菌种的分离、纯化、鉴定方法
细菌和放线菌的分离采用稀释平板法,纯化采用划线法;真菌的分离采用稀释平板法,纯化采用单孢子分离法;采用DNA测序法与传统镜检结合进行菌种鉴定。
1.5.2FA、HA的提取和分组
采用腐殖质组成修改法[18]。用0.1 mol·L-1NaOH+ Na4P2O7混合溶液提取腐殖物质,1 mol·L-1H2SO4溶液溶解FA,0.05 mol·L-1NaOH溶液溶解HA。
1.5.3FA、HA数量分析与结构特征的测定
土壤有机碳(SOC)含量、HA与FA含碳量均采用TOC分析仪(日本岛津TOC-VCPH)测定;HA与FA碳、氢、氧、氮元素含量采用元素分析仪测定(Elementar Vario EL-CHN);差热分析采用岛津TA-60差热分析仪测定;红外光谱(IR)采用KBr压片法测定,所用仪器为美国尼高力公司生产的AV360型红外光谱仪。
1.5.4相关参数计算
FA、HA相对含量表示FA、HA的含碳量与对应土壤样本中SOC含量的比值;PQ值即HA/(FA+HA)。
1.6数据分析
文中定量分析数据均采用3次重复的平均值±标准偏差来表示,并采用Sigmastat 3.5统计分析软件进行95%置信区间下的S-N-K检验以明确差异显著性。采用Excel 2003进行数据整理与绘图。
2 结果与分析
2.1培养过程中SOC含量、FA、HA相对含量及PQ值变化
经微生物处理后添加玉米秸秆的暗棕壤的SOC含量下降(表1)。整个培养期间细菌对SOC的影响都不显著,30 d时放线菌和细菌间差异不大,之后二者拉开距离。在180 d的培养期内放线菌、真菌、混合菌处理都能使体系的SOC含量显著降低,但三者之间差异不明显。
添加有机物料后,体系中FA和HA的含量均下降,低于土壤样本的17.78%和19.79%。从图1中可发现,经微生物处理后,整个培养期间FA含量略有提升但各处理间差异不明显,HA含量明显提高。前60 d细菌与其他微生物处理一样能够明显提高HA含量,但之后影响不显著。放线菌、真菌、混合菌处理均能显著提高体系HA含量,尤其是真菌处理下HA含量增幅最大,但三种处理间差异并不显著,特别是中后期放线菌处理与真菌处理的影响基本齐平。从图1中还可看到,FA、HA含量随时间的动态变化非常复杂,规律不明确。

表1 不同微生物处理下暗棕壤添加玉米秸秆后土壤SOC含量(g·kg-1)Table 1 Content of SOC in dark brown soil amended with corn stover under different microbial treatments(g·kg-1)

图1 各微生物处理下暗棕壤添加玉米秸秆后FA、HA相对数量的动态变化Figure 1 Dynamic changes of relative amount of FA and HA extracted from dark brown soil amended with corn stover under different microbial treatments
在观察体系PQ值变化(表2)时发现,30 d时除细菌外其他微生物处理均使PQ值显著升高,60 d时细菌处理对PQ值的影响也比较显著,之后各微生物处理间的影响差异不显著,直到180 d培养时放线菌对PQ值的提升作用凸显。
2.2培养末期FA及HA的元素组成
培养末期(即细菌处理120 d,其他处理180 d,下同)体系中FA与HA的元素组成特征(表3)显示,与对照相比各微生物处理下FA的C、N元素含量均降低,而HA的相应上升;各微生物处理下FA的C/H均下降,而(O+S)/C相应上升,HA的变化趋势相反。不同微生物处理间也存在一些区别。放线菌对腐植酸的C、(O+S)元素含量影响大,经放线菌处理后,添加玉米秸秆的土壤中HA的C元素含量上升最多,(O+ S)含量下降最多,直接导致其(O+S)/C比值由0.573下降至0.359,和其他微生物处理相比下降幅度最大,而FA的(O+S)/C比值上升最少。细菌对腐植酸的N含量影响大,相对于放线菌和真菌,经细菌处理后,FA的N元素含量下降最少,HA的N元素含量上升最多,总体来说细菌处理的腐植酸含N量较高。真菌对腐植酸的H含量影响大,经真菌处理后,腐植酸的H元素含量均下降最多,含H量较低;基于不同菌群处理的特点,混合菌处理具有综合效应,即经混合菌处理的腐植酸各元素原子比变化幅度最大(除放线菌对HA的(O+S)/C比值的影响外)。2.3培养末期FA、HA的热性质(DTA)

表2 不同微生物处理下暗棕壤添加玉米秸秆后的PQ值变化(%)Table 2 Ratios of PQ in dark brown soil amended with corn stover under different microbial treatments(%)

表3 不同微生物处理下暗棕壤添加玉米秸秆180 d后FA、HA的元素组成Table 3 Elemental composition of FA and HA extracted from dark brown soil amended with corn stover after 180 days of different microbial treatments
培养末期添加玉米秸秆的暗棕壤经不同微生物处理后FA、HA的差热曲线见图2,放热及失重详情见表4。由图2可知,FA、HA的热处理过程基本经历了低温吸热、中温放热、高温放热三个阶段,各微生物处理下峰形类似但有些许区别。细菌处理的腐植酸差热曲线与对照最为接近,在FA的DTA图中(图2a)放线菌处理的中温和高温放热峰峰温均最低,而HA 的DTA图中混合菌和放线菌处理高温放热峰峰温较其他处理高。结合表4可看出,经微生物处理后,土壤腐植酸中FA的热量高/中及失重高/中均降低,接近原土值。这种表现尤其以混合菌与放线菌为甚,其热量高/中由1.840分别降低至0.158和0.114,而失重高/中由0.839分别降低至0.416和0.365,此时真菌的影响不是特别突出。对HA来说,放线菌处理的这两个比值在各微生物处理中都最低。
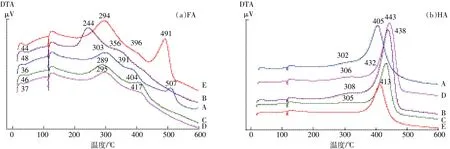
图2 不同微生物处理下暗棕壤添加玉米秸秆180 d后FA(a)、HA(b)的DTAFigure 2 DTA of FA(a)and HA(b)extracted from dark brown soil amended with corn stover after 180 days of different microbial treatments
表4 不同微生物处理下暗棕壤添加玉米秸秆180 d后FA、HA差热分析中的放热和失重(半定量)Table 4 Heat release and weight loss of FA and HA extracted from dark brown soil amended with corn stover after 180 days of different microbial treatments during DTA(Semi-quantitative)
2.4培养末期FA、HA的红外光谱(IR)

图3 不同微生物处理下暗棕壤添加玉米秸秆180 d后FA(a)、HA(b)的FTIR光谱Figure 3 FTIR spectra of FA(a)and HA(b)extracted from dark brown soil amended with corn stover after 180 days of different microbial treatments
利用红外光谱可以推断和半定量测定分子的官能团特征,进一步验证有机化合物的结构组成。各处理下FA、HA的红外光谱曲线(图3)具有大致相似的特征,只在某些特征峰的吸收强度上有一定的差异(表5、表6)。从图3上看,接种微生物后土壤FA的2920 cm-1峰(代表不对称脂族C-H伸展)、2850 cm-1峰(代表对称脂族C-H伸展)和1720 cm-1峰(代表酰胺C=O伸展)均减弱,表5数据显示混合菌处理降低幅度最大,其次是细菌处理,真菌处理对FA的C=O键含量影响程度最小;HA的2920 cm-1峰和1720 cm-1峰(除细菌处理外)均有所增强,表6数据显示放线菌对其作用最大。图3还显示,微生物处理使FA和HA 的1600 cm-1峰(表示芳香C=C伸展、酰胺化合物及氨基酸N-H面内变形)均增强,结合表5、表6数据可知,增幅为放线菌最大。另外除混合菌外,土壤FA、HA中代表多糖组分的1030~1040 cm-1峰均有所增强。表5、表6数据还显示,接种微生物后土壤FA的(2920+2850)/1720比值均增大,增幅为放线菌最大,真菌最小;土壤HA的2920/1720比值除细菌外均有所降低,降幅放线菌最大,真菌其次。

表5 不同微生物处理下暗棕壤添加玉米秸秆180 d后FA红外光谱主要吸收峰的相对强度(半定量)Table 5 Relative intensity of major absorption peaks of FTIR spectra of FA extracted from dark brown soil amended with corn stover after 180 days of different microbial treatments(Semi-quantitative)

表6 不同微生物处理下暗棕壤添加玉米秸秆180 d后HA红外光谱主要吸收峰的相对强度(半定量)Table 6 Relative intensity of major absorption peaks of FTIR spectra of HA extracted from dark brown soil amended with corn stover after 180 days of different microbial treatments(Semi-quantitative)
3 讨论
本体土壤中的腐植酸含量相对稳定,当添加有机物料后,在微生物作用下,土壤腐植酸含量将会发生改变[18]。研究显示,微生物能够使土壤中原有腐植酸矿化,同时也能够降解有机物料合成新的腐植酸[19],在后一腐殖化过程中,细菌、放线菌、真菌都起到一定的作用。以往的研究主要放在特定微生物对特定有机质的降解上,譬如真菌对木质素[9-10]、放线菌对纤维素[13],或者考察有机物料降解形成腐殖质的时间效应,如腐植酸含量的动态变化[20]。较少关注不同微生物类群对新添加有机质的土壤体系腐殖化影响的差异。本文采用多种手段从数量和结构两方面对这种影响进行分析,揭示其中的差异,并寻求合理的解释。
SOC含量、FA和HA相对含量以及PQ值是研究土壤体系腐殖化进程的一些特征量,为了明确这些特征量变化的控制因素,本文对培养时间和微生物处理这两个因子进行了双因素方差分析。结果发现,培养时间对上述各特征量的影响并不显著,而微生物处理的影响极为显著,说明微生物确实能促进体系的腐殖化。进一步发掘各微生物处理间影响的差异(表1、图1和表2),发现放线菌和真菌(包括混合菌)是土壤腐殖化进程的主要推动者,细菌的作用最小。经微生物处理后SOC含量下降(表1),说明玉米秸秆中的有机质经微生物降解后部分碳以CO2的形式流失,其中细菌由于对纤维素和木质素的利用度不高而造成的影响最小。土壤中腐植酸的含量反映出腐植酸的合成与分解两种共存形式之间的较量。微生物处理对FA含量的影响不大,却能显著提高HA的含量(图1),说明在添加了新的有机质情况下微生物对土壤FA的合成与分解率大致相当,而对HA的合成效率显然要高于分解效率。在上述过程中FA与HA之间也存在相互转化,结果HA净增长率高,这一点从PQ值的变化上可以看出(表2)。PQ值表征土壤体系的腐殖化程度,PQ值高,则腐殖化程度高[18-19]。接种微生物后,土壤体系的腐殖化程度提升(除180 d细菌与混合菌处理外)。虽然培养时间长短并不能显著提高体系中腐植酸的含量,但不同微生物处理对腐殖化的影响程度有时间效应,譬如真菌对PQ值的影响在培养前期(30~60 d)最大,而放线菌的影响在培养中后期(90~ 180 d)比较明显,这可能是与不同种群微生物对环境的适应能力及对有机质的利用程度有关。
本文中土壤腐植酸的C、N、H及含氧官能团含量均大致在已报道的前期研究范围内[19]。微生物对FA 与HA元素含量及相应比值的影响存在差别。C/H反映样品缩合度(芳香程度),(O+S)/C比值则代表腐植酸结构中氧代换的程度[21]。经微生物处理后,FA的前一比值下降,后一比值相应上升,而HA的变化趋势相反(表3)。由此可知,土壤样品中FA的缩合度及不饱和度低,氧化程度变高;而HA分子中芳香组分增多,氧化官能团变少,结构更为复杂。另外,FA的C、N含量降低,而HA的相应上升,结合表2的PQ值变化,可大致推测出:微生物对添加玉米秸秆的土壤系统中HA的形成更为有利,腐殖化程度升高,并且从元素变化角度来看,FA有向HA转化的趋势。以往的研究有类似结果,例如田相玲等[22]在研究链孢囊菌利用纤维素形成的类腐殖物质组分结构特征时发现,类FA组分会向类HA组分转化。这种转化的原因可能是,FA苯环上含有更多的羧基官能团和多肽成分(表现在其高N和高氧化度上),羧基容易被攻击,而多肽有利于聚合,给予充足时间,FA将以这种方式逐步转化为HA。细菌、放线菌、真菌对腐植酸元素含量的影响分别具体表现在N元素、C和(O+S)元素、H元素上,这种影响偏好及其背后的机理还有待进一步验证与研究。
在研究腐植酸的热性质时,一般用高温放热量与中温放热量的比值(热量高/中)表示该物质芳香性与脂族性的比,而失重高/中也可作为评价物质芳构化程度的一个指标[18,23]。从上述两比值来看(表4),玉米秸秆中的木质素类物质使混合体系的芳香化程度提高,而经微生物处理后该值降低,更趋近暗棕壤原土数值,说明微生物能够利用并降解新添加的有机物料,加速腐殖化进程。其中放线菌和混合菌的影响得到了彰显,真菌的影响在培养末期不突出。这可能说明在培养末期,放线菌由于对秸秆中纤维素类物质的充分利用而占据了主导地位[22,24]。具体原因可能是培养前期玉米秸秆中纤维素的复杂网络结构使放线菌产生的纤维素酶聚物难以发挥功效[25]。而真菌作为降解木质素的主体,因为攻击目标的不同可免受纤维素干扰,主要在培养初期充分发挥其先锋作用[26],这也解释了前文PQ值的结果。Yu等[27]的研究也证明了不同微生物种群在发挥作用的时间上确有此区别。
红外光谱分析能够验证部分元素分析的结果。相比于对照处理,微生物处理使FA的脂族含量和代表芳香组分的C=O含量均减弱,而HA的增强(表5、6)。这可能是FA的官能团向HA转化的结果。另外放线菌对FA结构中C=O的减弱效应及HA相应量的增强效应都是最大的,也对应了元素分析中放线菌主要对腐植酸中C和(O+S)元素产生影响的结论。王帅等[28]在应用红外光谱研究微生物对黑土添加麦秸后腐殖质结构特征影响时发现,放线菌能有效减少FA羧基含量,与本文结论相符。FA的(2920+2850)/1720比值和HA的2920/1720比值可说明相应腐植酸的结构复杂程度,比值高代表脂族成分多,比值低代表芳香程度高[18]。表5、表6的结果表示放线菌处理下,FA的脂族性最强,HA的芳香度最高,也就是说腐殖化程度最高,这与前文所述放线菌在培养末期发挥主导降解作用有关。经微生物处理后,腐植酸中代表C= C键的1600 cm-1峰增强(图3),说明微生物能降解外源添加的玉米秸秆,促进腐植酸结构的复杂化,且此时放线菌的作用最强。接种微生物后腐植酸多糖组分增强(图3),与王帅等[28]在前述文献中提到的微生物可消耗和利用HA中的多糖加速腐殖化进程的结论似乎相悖,不过从另一个角度说明了微生物在降解腐植酸的同时也在不断分解外源有机质生成腐植酸的一种前体物质即多糖。
综上所述,微生物对暗棕壤添加玉米秸秆的腐殖化进程具有影响,且不同微生物类群间的影响存在一些差异。图4为上述结论的示意图,主要显示微生物间作用差异。
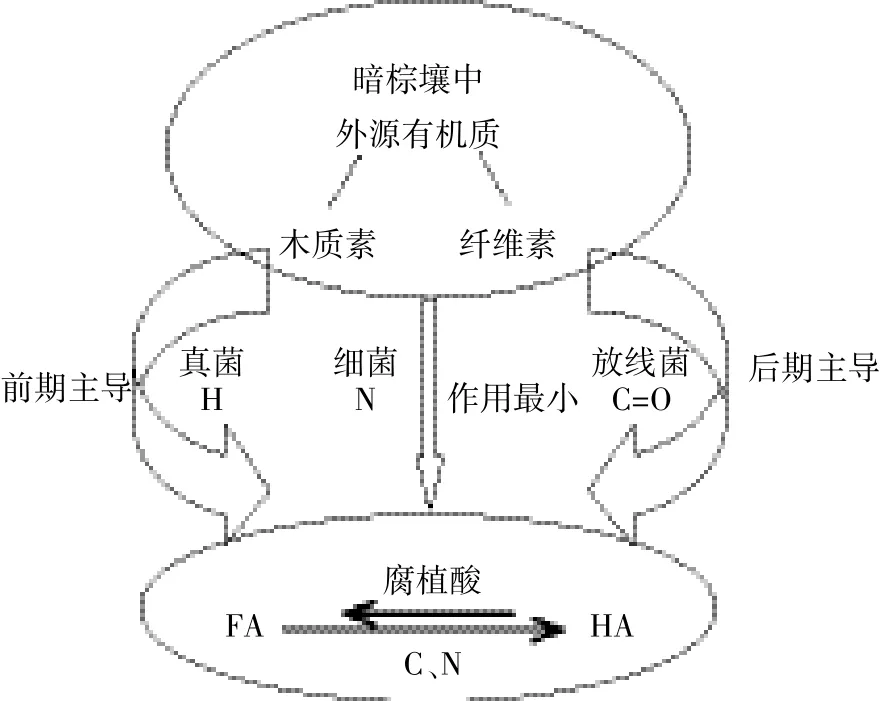
图4 微生物对暗棕壤添加外源有机质腐殖化进程的影响Figure 4 Effects of different microorganisms on humification of neworganic materials incorporated in dark brown soil
4 结论
(1)微生物能够促进添加玉米秸秆的暗棕壤体系的腐殖化,其中细菌的作用最小,真菌和放线菌是该过程的主要推动者。放线菌主要在培养后期占主导地位,真菌主要在培养初期起先锋作用。
(2)该体系下接种微生物有利于HA的合成,且FA有向HA转化的可能。细菌、放线菌、真菌对腐植酸的影响分别具体表现在N元素、C=O键、H元素上。
参考文献:
[1]Vanhees P A W, Johansson E, Jones D L. Dynamics of simple carbon compounds in two forest soils as revealed by soil solution concentrations and biodegradation kinetics[J]. Plant and Soil, 2008, 310(12):11-23.
[2]张晋京,窦森.灼烧土中玉米秸秆分解期间胡敏酸、富里酸动态变化的研究[J].吉林农业大学学报, 2002, 24(3):60-64. ZHANG Jin-jing, DOU Sen. Dynamic changes of humic acid and fulvic acid in ignited soil during corn stalk decomposition[J]. Journal of Jilin Agricultural University, 2002, 24(3):60-64.
[3]肖彦春,李凯,窦森.黑土底土加入大比例玉米秸秆后胡敏素组分的变化[J].水土保持学报, 2007, 21(3):61-64. XIAO Yan-chun, LI Kai, DOU Sen. Changes of black subsoil humin fractions added large proportion corn stock[J]. Journal of Soil and Water Conservation, 2007, 21(3):61-64
[4]来航线,程丽娟,王中科.几种微生物对土壤腐殖质形成的作用[J].西北农业大学学报, 1997, 25(6):79-82. LAI Hang-xian, CHENG Li-juan, WANG Zhong-ke. Effect of several microorganisms on the formation of soil humus[J]. Acta Universitatis A-griculturalis Boreali-occidentalis, 1997, 25(6):79-82.
[5]Thevenot M, Dignac M F, Rumpel C. Fate of lignins in soils:A review[J]. Soil Biology and Biochemistry, 2010, 42(8):1200-1211.
[6]Bahri H, Rasse D P, Rumpel C, et al. Lignin degradation during a laboratory incubation followed by13C isotope analysis[J]. Soil Biology and Biochemistry, 2008, 40(7):1916-1922.
[7]Kluczek-Turpeinen B, Steffen K T, Tuomela M, et al. Modification of humic acids by the compost-dwelling deuteromycete Paecilomyces inflatus[J]. Applied Microbiology and Biotechnology, 2005, 66(4):443-449.
[8]Barrico L, Rodríguez-Echeverría S, Freitas H. Diversity of soil basidiomycete communities associated with Quercus suber L. in Portuguese montados[J]. European Journal of Soil Biology, 2010, 46(5):280-287.
[9]Tuomela M, Vikman M, Hatakka A, et al. Biodegradation of lignin in a compostenvironment:Areview[J].Bioresource Technology,2000,72(2):169-183.
[10]Šnajdr J, Steffen K T, Hofrichter M, et al. Transformation of14C-labelled lignin and humic substances in forest soil by the saprobic basidiomycetes Gymnopus erythropus and Hypholoma fasciculare[J]. Soil Biology and Biochemistry, 2010, 42(9):1541-1548.
[11]窦森,王帅.不同微生物对形成不同腐殖质组分的差异性研究进展[J].吉林农业大学学报, 2011, 33(2):119-125. DOU Sen, WANG Shuai. Review of different microorganisms effect on humus formation[J]. Journal of Jilin Agricultural University, 2011, 33 (2):119-125
[12]Qi B C, Aldrich C, Lorenzen L, et al. Degradation of humic acids in a microbial film consortium from landfill compost[J]. Industrial and Engineering Chemistry Research, 2004, 43(20):6309-6316.
[13]吴文韬,鞠美庭,刘金鹏,等.一株纤维素降解菌的分离、鉴定及对玉米秸秆的降解特性[J].微生物学通报, 2013, 40(4):712-719. WU Wen-tao, JU Mei-ting, LIU Jin-peng, et al. Isolation, identification and corn stalk degradation characteristics of cellulose-degrading bacterial strain NH11[J]. Microbiology, 2013, 40(4):712-719.
[14]崔俊涛.微生物在土壤腐殖质形成与转化中的作用研究[D].长春:吉林农业大学, 2005. CUI Jun-tao. Studies on the role of microorganism in the formation and transformation of humus[D]. Changchun:Jilin Agricultural University, 2005
[15]Bibollet X, Bosc N, Matulova M, et al.13C and1H NMR study of cellulose metabolism by Fibrobacter succinogenes S85[J]. Journal of Biotechnology, 2000, 77(1):37-47.
[16]Cervantes F J, Duong-Dac T, Akkermans A D L. Richment and immobilization of quinone-respiring bacteria in anaerobic granular sludge[J]. Water Science and Technology, 2003, 48(6):9-16.
[17]Kupryszewski G D, Pempkowlak J, Kedzia A. The effect of humic substances isolated from a variety of marine and lacustrine environments on different microorganisms[J]. Oceanologla, 2001, 43(2):257-261.
[18]窦森.土壤有机质[M].北京:科学出版社, 2010. DOU Sen. Soil organic matter[M]. Beijing:Science Press, 2010.
[19]斯蒂文森F J著.夏荣基译.腐殖质化学[M].北京:北京农业大学出版社, 1994. Stenvson F J, XIA Rong-ji, Trans. Humus chemistry:genesis, composition, reactions[M]. Beijing:Beijing Agricultural University Publishing House, 1994.
[20]窦森,张晋京, Eric E,等.用δ13C方法研究玉米秸秆分解期间土壤有机质数量的动态变化[J].土壤学报, 2003, 40(3):329-334. DOU Sen, ZHANG Jin-jing, Eric E, et al. Study on dynamic change of soil organic matter during corn stalk decomposition by δ13C method[J]. Acta Pedologica Sinica, 2003, 40(3):329-334
[21]牛灵安,郝晋珉,李吉进.盐渍土熟化过程中腐殖质特性的研究[J].土壤学报, 2001, 38(1):114-122. NIU Ling-an, HAO Jin-min, LI Ji-jin. Characteristics of humus in maturing salt-affected soil[J]. Acta Pedologica Sinica, 2001, 38(1):114-122.
[22]田相玲,窦森,李艳,等.链孢囊菌利用纤维素形成菌体及其碱提取组分研究[J].农业环境科学学报, 2014, 33(4):744-750. TIAN Xiang-ling, DOU Sen, LI Yan, et al. Characteristics of Streptosporangium mycelia and their alkali extractable components during cellulose decomposition[J]. Journal of Agro-Environment Science, 2014, 33(4):744-750.
[23]梁重山,刘丛强,党志.现代分析技术在土壤腐殖质研究中的应用[J].土壤, 2001, 33(3):154-158. LIANG Chong-shan, LIU Cong-qiang, DANG Zhi. Application of modern instruments on soil humus research[J]. Soils, 2001, 33(3):154-158.
[24]Thierie J, Penninckx M J. Modeling of competitive mutualistic relationships, application to cellulose degradation by Streptomyces sp. Strains [J]. Current Microbiology, 2007, 55(6):507-511.
[25]Hua B B, Lü Y C, Wang J G, et al. Dynamic changes in the composite microbial system MC1during and following its rapid degradation of lignocellulose[J]. Applied Biochemistry and Biotechnology, 2014, 172 (2):951-962.
[26]王帅,窦森,王晓平,等.真菌及混合菌对玉米秸秆类腐殖质形成和转化的影响[J].农业环境科学学报, 2012, 31(4):773-779. WANG Shuai, DOU Sen, WANG Xiao-ping, et al. Effect of fungi and mixed strains on the formation and transformation of humic-like substances of the corn stalks[J]. Journal of Agro-Environment Science, 2012, 31(4):773-779.
[27]Yu H Y, Zeng G M, Huang H L, et al. Microbial community succession and lignocellulose degradation during agricultural waste composting[J]. Biodegradation, 2007, 18(6):793-802.
[28]王帅,窦森,刘艳丽,等.微生物对黑土添加麦秸后腐殖质结构特征影响的红外光谱研究[J].光谱学与光谱分析, 2012, 32(9):2409-2413. WANG Shuai, DOU Sen, LIU Yan-li, et al. Characterization of soil humus by FTIR spectroscopic analyses after being inoculated with differentmicroorganismspluswheatstraw[J].Spectroscopyand Spectral Analysis, 2012, 32(9):2409-2413.
中图分类号:S154
文献标志码:A
文章编号:1672-2043(2016)05-0931-09
doi:10.11654/jaes.2016.05.017
收稿日期:2015-10-25
基金项目:吉林省重点科技攻关项目(2011CB100503NY);国家自然科学基金(41571231,40971141)
作者简介:李艳(1984—),女,博士研究生,从事土壤微生物及环境化学研究。E-mail:lileah2012@163.com
*通信作者:窦森E-mail:dousen1959@126.com
Effects of different microorganisms on humification of corn stover incorporated in dark brown soil
LI Yan1, DOU Sen1*, LIU Yan-li1,2, WANG Shuai1,3, LI Li-bo1
(1.College of Resources and Environmental Sciences, Jilin Agricultural University, Changchun 130118, China; 2.Academy of Agriculture and Forestry Sciences of Cangzhou City, Cangzhou 061000, China; 3.Institute of Plant Science, Jilin Agriculture Science and Technology College, Jilin 132101, China)
Abstract:Humification of organic materials in soil is greatly controlled by soil microbes. Different soil microbial communities may have different roles in this process. Here the effects of different microbial communities on the humification of corn stover incorporated in dark brown soil were studied by quantitative analysis, element composition analysis, differential thermal analysis, and Fourier transform infrared spectroscopy. Results showed that microorganisms could obviously promote the humification of the amended organic material. Fungi and actinomycetes had remarkable effects on relative content of humic acids, and were main drivers of the humification process. However, bacteria played small role in the humification process. The structure analysis of humic acids and the change of PQ values(an indicator of humification degree)further revealed the promotion of HA synthesis by microbial treatments and the possibility of FA conversion to HA. Actinomycetes affected the structure of humic acids mainly via C=O bond, while bacteria and fungi respectively impacted the N and H contents of humic acids. The influence of actinomycetes on humification process was more significant at the late stage of incubation than that of other microbes for actinomycetes could make full use of fiber materials. In the actinomycete treatment, the aliphatic characteristic of FA was the most obvious and the aromaticity of HA was the highest. Fungi played a pioneering role at the early stage, mainly in the degradation of lignin. Our results affirm that the influences of different groups of microorganisms on the humification process reflect in the differences in their uses of different materials and the functional groups at different incubation stages. These findings would advance the understanding of the relationship between microorganisms and soil humus.
Keywords:humification; soil microorganisms; humic acids; element composition; FTIR

