镰刀菌毒素对断奶小母猪阴户、生殖器官指数、子宫雌激素受体分布和表达的影响
牛群升 杨维仁 黄丽波 张崇玉 张桂国 梁才芝 姜淑贞
(山东农业大学动物科技学院,泰安271018)
镰刀菌毒素对断奶小母猪阴户、生殖器官指数、子宫雌激素受体分布和表达的影响
牛群升杨维仁*黄丽波张崇玉张桂国梁才芝姜淑贞*
(山东农业大学动物科技学院,泰安271018)
摘要:本试验旨在研究自然霉变饲粮中镰刀菌毒素对断奶小母猪阴户、生殖器官指数、子宫雌激素受体(ERs)分布和表达影响。选用35日龄平均体重(8.45±0.94) kg的健康三元杂交(杜×长×大)断奶小母猪40头,随机分为2个处理,每个处理20头。对照组饲喂基础饲粮,试验组饲喂含镰刀菌毒素的饲粮[玉米赤霉烯酮(ZEN)0.90 mg/kg;呕吐毒素(DON)1.43 mg/kg;烟曲霉毒素(FUM)5.85 mg/kg)]。预试期7 d,正试期35 d。结果表明:试验组35 d仔猪的阴户长、宽和面积及断奶母猪生殖器官指数均显著高于对照组(P<0.05)。雌激素受体α(ERα)免疫阳性物质主要见于子宫内膜的腺上皮细胞和子宫肌层细胞的细胞质;雌激素受体β(ERβ)免疫阳性物质主要见于内膜的动脉管壁平滑肌和肌层平滑肌细胞的胞质内。与对照组相比,试验组仔猪子宫内膜腺上皮细胞ERα免疫阳性反应明显增强,且腺泡数量明显增多;而ERβ在试验组仔猪子宫肌层平滑肌和动脉管壁平滑肌细胞的阳性细胞数量明显多于对照组。试验组断奶母猪子宫中ERα和ERβ的mRNA相对表达量显著高于对照组(P<0.05)。由此可见,镰刀菌毒素能够对断奶小母猪生殖系统造成不良影响,这种影响是通过ERs基因的转录来调控ERs在子宫中的相对表达量,进而改变生殖器官的发育实现的。
关键词:镰刀菌毒素;断奶小母猪;阴户;子宫;雌激素受体
镰刀菌毒素是产毒霉菌在基质(粮食、作物及饲料)上生长繁殖过程中产生的次级代谢产物,是造成全球谷物经济损失最大的一类污染性霉菌毒素[1-2]。对动物健康及生产危害最大的镰刀菌毒素包括玉米赤霉烯酮(zearalenone,ZEN)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和烟曲霉毒素(fumonisin,FUM)等。镰刀菌毒素中ZEN对动物繁殖危害最大,诱发母猪雌激素过多症,如外阴红肿、直肠脱落、子宫和乳腺增生等[3]。报道证实ZEN能够改变雌激素受体(estrogen receptors,ERs)mRNA在子宫中的表达量[4-5]。国内外研究镰刀菌毒素对动物生殖系统的影响多以纯毒素形式进行,但实际生产中,镰刀菌产生的毒素往往具有多样性[6]。且镰刀菌毒素对断奶母猪子宫角内ERs分布的影响尚未见报道。因此,本试验旨在研究自然霉变玉米和霉变玉米蛋白粉中镰刀菌毒素对断奶母猪生殖器官发育、ERs的分布及表达的影响,为生猪健康生产提供理论依据。
1材料与方法
1.1试验动物和饲养管理
选择35 d的三元杂交(杜×长×大)断奶小母猪40头,平均体重(8.45±0.94) kg,随机分为2个处理,每个处理20头,各处理间初始体重差异不显著(P>0.05)。
试验在山东农业大学畜牧科技园进行。仔猪采用单体笼(0.48 m2)饲养。单体笼使用塑料漏缝地板,安装有乳头饮水器和料槽,仔猪自由采食和饮水。试验开始前对猪舍进行全面清扫、消毒,试验期间每周进行1次猪舍消毒。舍内安装红外保温灯,第1周猪舍内环境温度维持在30 ℃左右,之后将猪舍内环境温度调整在26~28 ℃,猪舍相对湿度为65%左右。
1.2试验设计及试验饲粮
断奶母猪基础饲粮参考NRC(2012)[7]营养需要配制,饲粮组成及营养水平见表1。试验采用单因子试验设计,对照组饲喂基础饲粮,试验组用50%自然霉变玉米和50%霉变玉米蛋白粉代替基础饲粮中的玉米和玉米蛋白粉,预试期7 d,正试期35 d。

表1 饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of diets:VA 3 300 IU,VD3330 IU,VE 24 IU,VK30.75 mg,VB11.50 mg,VB25.25 mg,VB62.25 mg,VB120.026 mg,泛酸 pantothenic acid 15.00 mg,尼克酸 niacin 22.5 mg,生物素 biotin 0.075 mg,叶酸 folic acid 0.45 mg,Mn 6.00 mg, Fe 150 mg, Zn 150 mg, Cu 9.00 mg, I 0.21 mg, Se 0.45 mg。
2)粗蛋白质和钙为实测值,其他为计算值。CP and Ca were analyzed values, while the others were calculated values.
3)实测值 Analyzed values。
1.3样品采集及指标测定
1.3.1阴户面积测定
试验期间每隔3 d用游标卡尺测量仔猪阴户长、宽,并计算阴户面积。仔猪阴户俯视近似菱形,所以本研究以菱形的面积公式(长×宽)/2来近似计算仔猪阴户面积(图1),以便比较各处理仔猪阴户的增大效果。
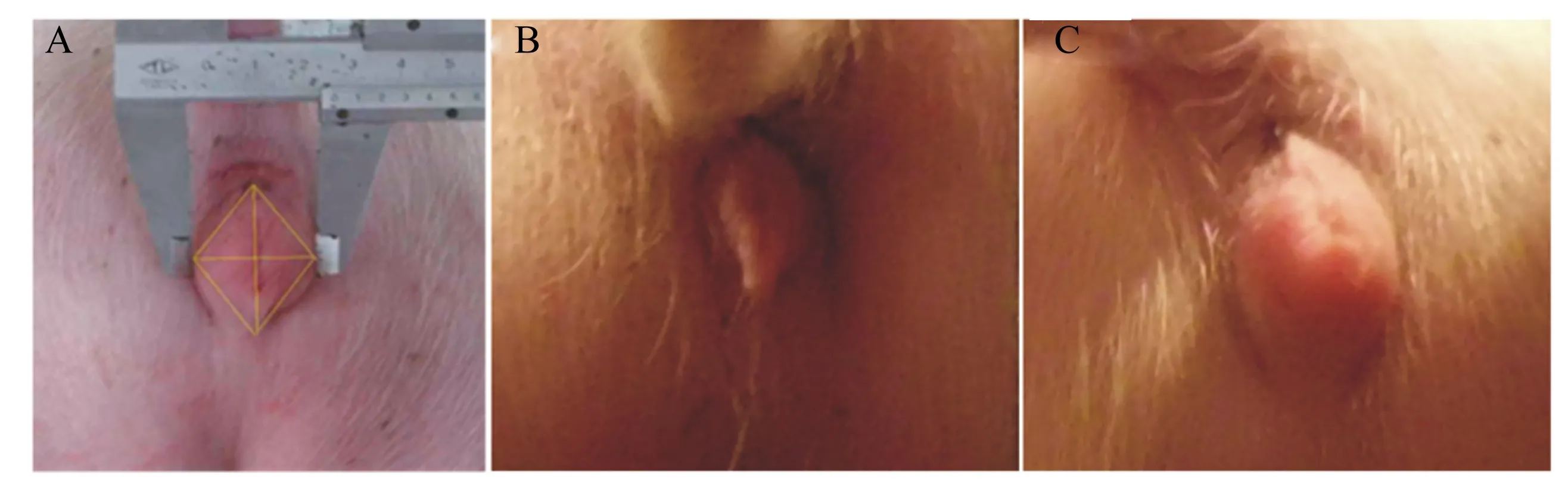
A:示意图 Diagram;B:对照组 Control group;C:试验组 Experimental group。
图1阴户大小的测量与计算
Fig.1Measurement and calculation of vulva size
1.3.2生殖器官指数
试验结束后,每个处理随机选取10头仔猪进行屠宰,电击致死后放血,打开胸腔和腹腔,首先对生殖器官(卵巢+子宫角+阴道前庭)进行肉眼观察,记录病变情况并称重,计算生殖器官指数。快速取2份子宫角样品,一份置于Bouin’s液中固定,用于检测免疫组化指标;一份置于液氮中,-80 ℃保存,用于测定ERs的mRNA相对表达量。
生殖器官指数(g/kg)=生殖器官重量(g)/
猪活体重量(kg)。
1.3.3免疫组化[链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)法]
取Bouin’s液中固定好的组织块,用乙醇逐级脱水,二甲苯透明,采用BMJ23型包埋机包埋。1)切片机(LEICA RM2135,德国)进行切片(5 μm),常规脱蜡至水。2)柠檬酸缓冲液(0.01 mol/L,pH 6.0)进行抗原热修复,磷酸缓冲盐溶液(PBS)(0.01 mol/L,pH 7.2)洗3次,5 min/次(下同)。3)3% H2O2室温避光孵育30 min,用以阻断内源性过氧化物酶,PBS洗3次。4)10%胎牛血清37 ℃封闭孵育1 h。5)分别加一抗兔抗雌激素受体α(Erα)(1∶150)多克隆抗体(140113W,北京博奥森生物技术有限公司)和兔抗雌激素受体β(ERβ)(1∶150)多克隆抗体(999882W,北京博奥森生物技术有限公司),4 ℃ 孵育过夜,PBS洗3次。6)加生物素化羊抗兔免疫球蛋白G(IgG)(1∶200)二抗(K132429E,北京中杉金桥生物技术有限公司),37 ℃恒温箱中孵育1 h,PBS洗3次。7)加辣根过氧化物酶-链霉素亲和素(1∶150),37 ℃孵育45 min,PBS洗3次。8)二氨基联苯胺(DAB)显色,显微镜下观察显色程度,控制显色时间。9)苏木素复染、脱水、透明、封片,在明视野显微镜下观察免疫阳性细胞分布规律。
1.3.4ERsmRNA相对表达量的测定
根据GenBank已报道的猪的Erα、ERβ和甘油醛-3-磷酸脱氢酶(GAPDH)基因(内参基因)序列,用Primer 6.0设计相应特异性引物,引物由上海生物工程公司合成(表2)。
取出-80 ℃保存的子宫角样品50~100 mg,按照Trizol试剂盒说明书(Invitrogen公司,美国)提取总RNA,利用紫外分光光度计检测RNA的质量和浓度,结果显示光密度(OD)比值均在1.8~2.0之间。检测后的总RNA立即进行反转录。反转录按照PrimeScript@RTMaster Mix Perfect Real Time试剂盒说明书进行操作(TaKaRa Coad:DDR036A,Lot:BK1302,反应体积为20 μL)。RT-PCR的反应体系为20 μL,按照TaKaRa公司的荧光定量试剂盒说明书加入相应的反应试剂,其扩增条件均为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸34 s,95 ℃ 15 s,60 ℃ 60 s,40个循环,60 ℃检测荧光信号。目的基因和内参基因分别在不同的PCR管中进行反应,每个样品做3个重复。

表2 ERα、ERβ和GAPDH基因的引物序列
1.4数据统计与处理
荧光定量PCR检测结果用2-△△Ct进行数据处理,分析基因ERα、ERβ的mRNA在子宫中的相对表达量。数据采用SAS 9.2统计软件进行均值的双样本成对t检验分析(two sample pairedt-test for the means),P<0.05为差异显著。
2结果与分析
2.1镰刀菌毒素对断奶母猪阴户和生殖器官指数的影响
自然霉变饲粮中镰刀菌毒素对断奶母猪阴户大小的影响见表3。试验开始(0 d)时所有处理仔猪的阴户长、宽和面积差异均不显著(P>0.05);试验结束(35 d)时试验组仔猪的阴户长、宽和面积都显著大于对照仔猪(P<0.05)。试验组断奶母猪生殖器官指数较对照组显著升高(P<0.05)。
2.2镰刀菌毒素对断奶母猪子宫中ERα、ERβ分布的影响
免疫组化结果显示仔猪子宫中ERα、ERβ免疫阳性反应为黄色、棕黄色或棕色,阴性对照组织不着色。说明本试验采用的免疫组化SABC法具有免疫反应的特异性。
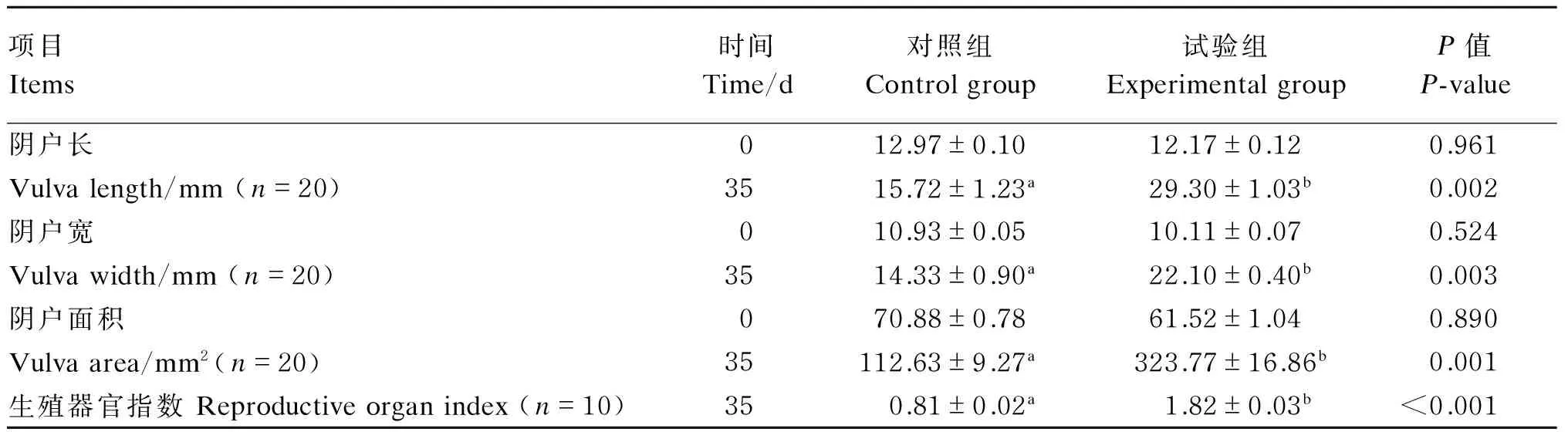
表3 镰刀菌毒素对断奶母猪阴户大小和生殖器官指数的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。
In the same row, values with different small letter superscripts mean significant difference (P<0.05).
2.2.1镰刀菌毒素对断奶母猪子宫中ERα分布的影响
本试验观察结果显示,ERα主要见于子宫内膜的腺上皮细胞和子宫肌层细胞,且为细胞质着色,而在子宫腔上皮及血管内皮细胞均未发现ERα分布(图2-A、图2-D)。与对照组(图2-B、图2-C)相比,试验组仔猪子宫腺ERα免疫阳性反应明显增强,且腺泡数量也明显增多(图2-E、图2-F)。试验组的腺上皮细胞大部分呈强阳性反应(图2-E、图2-F),而对照组的腺上皮细胞ERα免疫反应弱,且有不着色的上皮细胞存在,但2组子宫内膜基质呈ERα免疫阳性的细胞数量无明显差别。

A、D为低倍图,B、C、E、F为高倍图;LE为子宫腔上皮,G为子宫腺,S为固有层基质,M为子宫肌层,V为血管;红色箭头示ERα免疫阳性细胞,绿色箭头为阴性。
A and D were macroscopical pictures. B, C, E and F were microscopic pictures. LE was epithelium of uterine. G was uterine gland. S was stroma of lamina propria. M was myometrium. V was blood vessel. Red arrows showed immunoreactive cells of ERα, and green arrows showed immune-negative cells of ERα.
A、B、C:对照组;D、E、F:试验组。下图同。
A, B and C: control group; D, E and F: experimental group. The same sa below.
图2镰刀菌毒素对断奶母猪子宫中ERα分布的影响
Fig.2Effects ofFusariumtoxins on the ERα distribution in uterus of weaning gilts
2.2.2镰刀菌毒素对断奶母猪子宫中ERβ分布的影响
ERβ免疫阳性反应物质主要见于内膜的动脉管壁平滑肌和子宫肌层平滑肌细胞的胞质内(图3-A、图3-D),呈强阳性反应,而在子宫腺上皮细胞及基质细胞大多呈阴性(图3-B、图3-C、图3-E、图3-F),偶见有ERβ免疫阳性物质分布在腺上皮细胞及基质细胞的细胞核内,着色较弱。与对照组相比,试验组ERβ着色更强,阳性细胞数量更多,多分布在肌层平滑肌和动脉管壁平滑肌细胞(图3-E、图3-F)。对照组中发现少量基质细胞中存在ERβ(图3-C)。2组对比ERβ在动脉管壁平滑肌分布无明显区别。
2.3镰刀菌毒素对断奶母猪子宫ERs的mRNA相对表达量的影响
镰刀菌毒素对断奶母猪子宫ERs的mRNA相对表达量的影响见图4,与对照组相比,试验组子宫中ERα和ERβ的mRNA相对表达量均显著升高(P<0.05)。
3讨论
试验中尽管我们选择优质原料配制对照饲粮,但是遗憾的是对照饲粮中也检测到不同程度的毒素含量,这进一步说明我国镰刀菌毒素污染的普遍性及本研究的迫切性。本试验对照饲粮中ZEN、DON和FUM的含量低于我国饲料卫生标准(ZEN含量<0.5 mg/kg,GB13078.2—2006;DON含量<1 mg/kg,GB13078.3—2007;我国对于饲料中FUM含量还没有制定相应的限量标准)以及欧盟关于仔猪饲粮中ZEN、DON和FUM含量分别<0.1、0.9和5 mg/kg[8]的最高限量规定。而试验饲粮中ZEN、DON和FUM含量均超过我国饲料卫生标准和欧盟仔猪饲粮中的最高限量,因此对照组镰刀菌毒素的含量不影响试验组结果的判断。本试验条件下,镰刀菌毒素显著降低了断奶母猪平均日采食量和平均日增重,料重比则显著升高[9]。

A、B、D为肌层和动脉管壁平滑肌,C为基质细胞,E为肌层和腺上皮细胞,F为动脉管壁平滑肌细胞和腺上皮细胞;LE为子宫腔上皮,G为子宫腺,S为固有层基质,M为子宫肌层,V为血管;红色箭头示ERβ免疫阳性细胞,绿色箭头为阴性。
A, B and D were smooth muscle of muscular layer and arterial wall. C was stromal cell. E was cell of muscle layer and glandular epithelium. F was arterial smooth muscle and gland epithelial cell. LE was epithelium of uterine. G was uterine gland. S was stroma of lamina propria. M was myometrium. V was blood vessel. Red arrows showed immunoreactive cells of ERβ, and green arrows showed immune-negative cells of ERβ.
图3镰刀菌毒素对断奶母猪子宫中ERβ分布的影响
Fig.3Effects ofFusariumtoxins on the ERβ distribution in uterus of weaning gilts

数据柱标不同小写字母表示差异显著(P<0.05)。
Value columns with difference small mean significant difference (P<0.05).
图4镰刀菌毒素对断奶母猪子宫中ERα和ERβ的mRNA相对表达量的影响
Fig.4Effects ofFusariumtoxins on the relative mRNA expression ofERαandERβin uterus of weaning gilts (n=10)
3.1镰刀菌毒素对断奶母猪生殖器官的影响
镰刀菌毒素中对生殖系统危害最大的是ZEN。ZEN具有雌激素效应,能与动物体内的ERs结合[10],诱发母猪雌激素过多症,典型症状如阴户红肿潮湿、阴道直肠脱落、子宫增生以及乳腺增大等[3]。Rainey等[11]发现母猪采食1.5 mg/kg ZEN的饲粮后,7 d便出现阴户红肿现象。James等[10]报道仔猪摄入ZEN(3.61和4.33 mg/kg)污染饲粮,子宫重量几乎增加1倍。Chen等[12]研究发现,低剂量ZEN(1.1~3.2 mg/kg)能够显著增加断奶母猪生殖器官指数和阴户面积,且随ZEN增加呈剂量依赖特性。本试验条件下,试验组仔猪阴户明显红肿,阴户长、宽和面积均显著大于对照组仔猪,说明自然霉变饲粮中的镰刀菌毒素(0.90 mg/kg ZEN)对试验仔猪生殖器官产生毒害作用,这与前人研究结果一致。但本试验饲粮中除了ZEN外,还有一定剂量的DON(1.43 mg/kg)和FUM(5.85 mg/kg)。体外试验证实,ZEN的代谢产物α-玉米赤霉烯醇(7.5 μmoL/L)、β-玉米赤霉烯醇(30.0 μmoL/L)和DON(1.88 μmoL/L)都能够显著抑制卵母细胞核成熟,然而2种毒素的作用机制尚不明确[13]。ZEN和DON(剂量均为3.12 μmoL/L)都能够诱导纺锤体结构畸形,进而导致卵母细胞数量减少和胚胎异常,但是并没有发现ZEN和DON之间有协同作用[14],更未见DON影响外阴和生殖器官指数的报道,也未见FUM对动物生殖系统的危害报道。而且镰刀菌毒素在动物体内的代谢过程复杂,体外试验不足以定论。本试验条件下的镰刀菌毒素对仔猪生殖器官的毒性影响是毋庸置疑的。有关ZEN、DON和FUM对断奶母猪生殖器官影响的相互关系,本课题组动物试验正在进行中。
3.2镰刀菌毒素对断奶母猪ERα、ERβ在子宫中分布的影响
在哺乳动物中,ERs主要有ERα及ERβ 2种亚型,均属核受体,但近些年发现其在细胞膜、细胞质广泛分布[15]。ERα及ERβ在不同组织中均有分布,但有所差别,如ERβ主要集中在生殖系统、心血管系统、中枢神经系统、大脑以及骨组织中,而ERα则主要分布在生殖系统和乳腺组织中[16]。ERα及ERβ与雌激素具有相似的结合能力,但是在雌激素作用下,ERα转录活性大于ERβ,表明雌激素作用主要通过ERα调控[17]。
许琴[18]报道显示,ERα主要表达于比格犬子宫内膜腺体细胞中,而ERβ主要表达于子宫内膜腺体细胞核及胞质,同时血管内皮细胞及平滑肌细胞胞质内也有表达。ZEN能与动物体内的ERs结合,从而刺激ERs介导的信号转导过程。不同亚型ERs与ZEN的亲和力不同,Mueller等[19]报道ERα比ERβ与ZEN更具亲和力。研究表明,ZEN可能是通过影响雌二醇与ERs结合,提高去卵巢大鼠子宫ERs数量[20]。DON和FUM对断奶母猪ERs在子宫中的表达分布尚未见报道。本试验免疫组化结果表明,断奶母猪子宫中各细胞成分均有ERα、ERβ分布。子宫中ERα主要分布在子宫腺上皮细胞,而ERβ则主要分布于动脉管壁平滑肌细胞、肌层平滑肌细胞、腺上皮细胞以及基质细胞。与对照组相比,试验组仔猪子宫腺中ERα分布广泛且子宫腺增生,促进了子宫腺发育,与ERα在子宫中的相对表达量显著增加的结果一致。试验组仔猪子宫中ERβ不仅广泛分布在动脉管壁平滑肌细胞和肌层平滑肌细胞,而且腺上皮细胞也有大量分布。本研究发现ERβ在血管内皮、肌层平滑肌细胞和基质细胞均有广泛分布,从而引起子宫平滑肌细胞增生,使得子宫壁增厚,这与生殖器官指数增大结果一致,但ERβ能否通过血管内皮进入血液以及DON和FUM是否影响母猪ERs在子宫中的分布和表达尚需进一步试验证实。
3.3镰刀菌毒素对断奶母猪子宫ERα、ERβ的mRNA相对表达量的影响
在正常大鼠子宫中,ERα与ERβ的mRNA均有表达,但ERα的表达占优势[21]。研究显示ERα的mRNA主要分布在子宫中,而ERβ的mRNA则主要分布在卵巢中[22-23]。Kuiper等[24]研究表明,子宫中ZEN及其衍生物与ERs结合后从胞汁进入胞核的时间比雌激素进入胞核的时间长,从而引起RNA和RNA聚合酶活性增加。Zhang等[4]用含有不同剂量ZEN饲粮饲喂妊娠小鼠时发现,小鼠子宫和卵巢中ERs表达量与ZEN含量之间存在剂量关系,均随ZEN剂量的增加而增加。王定发等[5]在饲粮中分别添加0.5和2.0 mg/kg ZEN,均显著增加了青年母猪子宫中ERα的mRNA表达量,分别比对照组提高了15%和38%;而ERβ的mRNA的表达量则显著降低。仔猪采食1.5 mg/kg ZEN污染饲粮28 d,子宫ERα的mRNA表达量变化不显著,而ERβ的mRNA表达量却是对照组的2倍[25]。DON和FUM是否会影响断奶母猪子宫ERα、ERβ的mRNA表达量尚未见报道。本研究表明,断奶母猪饲喂自然霉变饲粮35 d,显著上调断奶母猪子宫中ERα和ERβ的mRNA相对表达量,该结果与ERs在子宫中的分布一致。但多种毒素(ZEN、DON和FUM)之间的相互作用尚需进一步证实。本研究表明,镰刀菌毒素(尤其ZEN)对断奶母猪阴户(红肿)和生殖器官(指数增大)的影响是通过改变子宫中 ERs的分布和表达水平来调控的。
4结论
本研究条件下,镰刀菌毒素(ZEN 0.90 mg/kg,DON 1.43 mg/kg,FUM 5.85 mg/kg)显著增加断奶母猪阴户和生殖器官指数,显著增强ERα和ERβ在子宫中的分布和表达量。因此,镰刀菌毒素(尤其ZEN)是通过增强ERα和ERβ在子宫中的分布和表达量来调控断奶母猪生殖器官发育的。
参考文献:
[1]陈心仪.亚洲地区饲料和畜禽养殖业霉菌毒素危害实况[J].饲料广角,2008(10):39-42.
[2]敖志刚,陈代文.2006~2007年中国饲料及饲料原料霉菌毒素污染调查报告[J].中国畜牧兽医,2008,35(1):152-156.
[3]STOB M,BALDWIN R S,TUITE J,et al.Isolation of an anabolic,uterotrophic compound from corn infected withGibberellazeae[J].Nature,1962,196(4861):1318.
[4]ZHANG Y Y,JIA Z Q,YIN S T,et al.Toxic effects of maternal zearalenone exposure on uterine capacity and fetal development in gestation rats[J].Reproductive Sciences,2014,21(6):743-7533.
[5]王定发,彭运智,张妮娅,等.日粮中玉米赤霉烯酮和大豆异黄酮联合作用对后备母猪生殖器官发育和雌激素受体基因转录的影响[J].畜牧兽医学报,2011,42(2):243-250.
[6]杨晓飞.四川地区主要饲料霉菌毒素分布规律的研究[D].硕士学位论文.雅安:四川农业大学,2007.
[7]NRC.Nutrient requirements of swine[M].11th ed.Washington D.C.:National Academy Press,2012.
[8]European Commission.Commission recommendation (2006/576/EC) of 17 August 2006 on the presence of deoxynivalenol,zearalenone,ochratoxin A,T-2 and HT-2 and fumonisins in products intended for animal feeding[S].Official Journal of the European Union L 229,2006.
[9]陈祥兴,杨维仁,张崇玉,等.镰刀菌毒素对断奶仔猪生长性能、小肠二糖酶活性和抗氧化能力的影响[J].动物营养学报,2015,27(6):1875-1882.
[10]JAMES L J,SMITH T K.Effect of dietary alfalfa on zearalenone toxicity and metabolism in rats and swine[J].Journal of Animal Science,1982,55(1):110-118.
[11]RAINEY M R,TUBBS R C,BENNETT L W,et al.Prepubertal exposure to dietary zearalenone alters hypothalamo-hypophysial function but does not impair postpubertal reproductive function of gilts[J].Journal of Animal Science,1990,68(7):2015-2022.
[12]CHEN X X, YANG C W,HUANG L B,et al.Zearalenone altered the serum hormones,morphologic and apoptotic measurements of genital organs in post-weaning gilts[J].Asian-Australasian Journal of Animal Sciences,2015,28(2):171-179.
[13]ALM H,GREISING T,BRÜSSOW K P,et al.The influence of the mycotoxins deoxynivalenol and zearalenol oninvitromaturation of pig oocytes andinvitroculture of pig zygotes[J].Toxicology in Vitro,2002,16(6):643-648.
[14]MALEKINEJAD H,SCHOEVERS E J,DAEMEN I J J M,et al.Exposure of oocytes to theFusariumtoxins zearalenone and deoxynivalenol causes aneuploidy and abnormal embryo development in pigs[J].Biology of Reproduction,2007,77(5):840-847.
[15]LEVIN E R.Invited review:cell localization,physiology,and nongenomic actions of estrogen receptors[J].Journal of Applied Physiology,2001,91(4):1860-1867.
[16]WANG L,ANDERSSON S,WARNER M,et al.Estrogen receptor (ER)β knockout mice reveal a role for ERβ in migration of cortical neurons in the developing brain[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(2):703-708.
[17]COUSE J F,KORACH K S.Estrogen receptor null mice:what have we learned and where will they lead us?[J].Endocrine Reviews,1999,20(3):358-417.
[18]许琴.比格犬子宫与卵巢Erα、ERβ的表达及ERβ新剪接异构体的研究[D].博士学位论文.长春:中国人民解放军军事医学科学院,2013.
[19]MUELLER S O,SIMON S,CHAE K,et al.Phytoestrogens and their human metabolites show distinct agonistic and antagonistic properties on estrogen receptor α (ERα) and ERβ in human cells[J].Toxicological Sciences,2004,80(1):14-25.
[20]吕斌,闻京伟,李振国,等.玉米赤酶烯酮对大鼠子宫雌激素受体影响的探讨[J].医药论坛杂志,2010,31(18):37-38.
[21]HIROI H,INOUE S,WATANABE T,et al.Differential immunolocalization of estrogen receptor α and β in rat ovary and uterus[J].Journal of Molecular Endocrinology,1999,22(1):37-44.
[22]COUSE J F,LINDZEY J,GRANDIEN K,et al.Tissue distribution and quantitative analysis of estrogen receptor-α (ERα) and estrogen receptor-β (ERβ) messenger ribonucleic acid in the wild-type and ERα-knockout mouse[J].Endocrinology,1997,138(11):4613-4621.
[23]KUIPER G G,ENMARK E,PELTO-HUIKKO M,et al.Cloning of a novel receptor expressed in rat prostate and ovary[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93(12):5925-5930.
[24]KUIPER-GOODMAN T,SCOTT P M,WATANABE H.Risk assessment of the mycotoxin zearalenone[J].Regulatory Toxicology and Pharmacology,1987,7(3):253-306.
[25]OLIVER W T,MILES J R,DIAZ D E,et al.Zearalenone enhances reproductive tract development,but does not alter skeletal muscle signaling in prepubertal gilts[J].Animal Feed Science and Technology,2012,174(1/2):79-85.
(责任编辑武海龙)
Effects ofFusariumToxins on Vulva, Reproductive Organ Index,Distribution and Expression of Estrogen Receptors in Uterus of Weaning Gilts
NIU QunshengYANG Weiren*HUANG LiboZHANG ChongyuZHANG Guiguo LIANG CaizhiJIANG Shuzhen*
(College of Animal Science and Technology, Shandong Agricultural University, Taian 271018, China)
Abstract:The aims of the study were to investigate the effect of Fusarium toxins on vulva, reproductive organ index, distribution and expression of estrogen receptors (ERs) of uterus in weaning gilts. A total of 40 healthy weaning gilts (Duroc×Large White×Landrace) aged at 35 d with an average body weight of (8.45±0.94) kg were used in the study. Gilts were randomly allocated into 2 treatments with 20 gilts in each group. Control group was fed a basal diet, and experimental group were exposed to feed naturally contaminated with Fusarium toxins [zearalenone (ZEN) 0.90 mg/kg; deoxynivalenol (DON) 1.43 mg/kg; fumonisin (FUM) 5.85 mg/kg] for 35 days after 7 days adaptation. The results showed that the length, width and area of vulva and reproductive organ index of weaning gilts at 35 days in experimental group were significantly higher than those in control group (P<0.05). There was a higher intensity of immunopositive staining for estrogen receptors α (ERα) in cytoplasm of endometrial glandular epithelial cells and uterine muscle cells. Whereas immunopositive staining for estrogen receptors β (ERβ) was most expressed in cytoplasm of smooth muscle cells in the intima of arteries and muscle layer smooth muscle cells. The ERα positive reaction and acinus number of the endometrial glandular epithelial cells in experimental groups were higher than that in control group. However, the ERβ positive reaction of the toxins-treated gilts was found in the smooth muscle cells of the uterine muscle and the arterial wall smooth muscle cells. The relative mRNA expressions of ERα and ERβ in uterus of weaning gilts in experimental group were significantly higher than those in control group (P<0.05). The results suggested Fusarium toxins have deleterious effect on reproductive system. This effect is mediated through changing the expression of ERs regulated by the transcription of ERs gene in uterus, and then changed the development of the reproductive organs.[Chinese Journal of Animal Nutrition, 2016, 28(5):1525-1533]
Key words:Fusarium toxins; weaning gilts; vulva; uterus; estrogen receptors
doi:10.3969/j.issn.1006-267x.2016.05.029
收稿日期:2015-12-04
基金项目:山东省现代农业产业技术体系生猪创新团队建设项目(SDAIT-08-05)
作者简介:牛群升(1988—),男,山东临沂人,硕士研究生,从事动物营养与饲料科学研究。E-mail: qunshengniu@163.com *通信作者:杨维仁,教授,博士生导师,E-mail: wryang@sdau.edu.cn;姜淑贞,副教授,硕士生导师,E-mail: shuzhen305@163.com
中图分类号:S828
文献标识码:A
文章编号:1006-267X(2016)05-1525-09
*Corresponding authors: YANG Weiren, professor, E-mail: wryang@sdau.edu.cn; JIANG Shuzhen, associate professor, E-mail: shuzhen305@163.com

