益生菌抵御大鼠急性腹泻的效果及其对肠道黏膜屏障的影响
庞 敏 卢庆萍 朱丽媛 夏 冰 张宏福
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193)
益生菌抵御大鼠急性腹泻的效果及其对肠道黏膜屏障的影响
庞敏卢庆萍*朱丽媛夏冰张宏福
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193)
摘要:本试验旨在研究酪酸梭菌或唾液乳酸菌对预防急性腹泻、保护肠道黏膜屏障的作用效果。选取清洁级21日龄断奶Wistar大鼠[平均体重(57.45±6.23) g]48只,随机分在4个组:正常对照组(C1组)、模型对照组(C2组)、酪酸梭菌组(T1组)、唾液乳酸菌组(T2组)。每个组6个重复,每个重复2只大鼠。试验期共9 d,C1、C2组经口灌服生理盐水, T1、T2组分别灌服酪酸梭菌和唾液乳酸菌。第8天开始除C1组外,其余各组灌服番泻叶制剂致泻,记录各组大鼠腹泻情况。试验结束后处死所有大鼠并采集血液及肠道样品。结果显示:1)灌服番泻叶后各组大鼠均出现腹泻。C2组稀便率、腹泻指数、血清内毒素及D-乳酸含量极显著高于C1组(P<0.01);而与C2组相比,T1、T2组腹泻指数、血清内毒素及D-乳酸含量均极显著降低(P<0.01)。2)与C2组相比,T1、T2组隐窝深度显著降低(P<0.05),绒毛高度与隐窝深度的比值极显著升高(P<0.01),且T1组回肠闭锁小带蛋白1(ZO-1)、闭锁蛋白(occludin) mRNA的相对表达量分别极显著(P<0.01)和显著(P<0.05)升高。3)C2组回肠白细胞介素-10(IL-10)、白细胞介素-1β(IL-1β)mRNA的相对表达量分别极显著(P<0.01)和显著(P<0.05)高于C1组;而与C2组相比,T1组回肠IL-10 mRNA的相对表达量极显著降低(P<0.01)。以上结果说明,在本试验中,酪酸梭菌与唾液乳酸菌在一定程度上可以缓解由番泻叶引起的大鼠急性腹泻,降低肠道通透性,同时具有增强和保护肠道黏膜屏障的作用。
关键词:酪酸梭菌;唾液乳酸菌;大鼠;急性腹泻;肠道黏膜屏障
腹泻是动物养殖过程中常见的疾病,引起腹泻的原因多且复杂,尤其在仔猪断奶阶段的腹泻一直是养猪生产的难题,影响到仔猪的生长发育。腹泻一般会造成胃肠道分泌、消化吸收功能紊乱,严重时会引起肠道通透性增加,肠绒毛受损、排列紊乱,紧密连接蛋白表达下降,同时还会伴随着细菌内毒素过量分泌、炎症反应加剧等症状[1-3],因此,加强幼畜生长阶段的肠道发育与健康对抵御腹泻具有重要意义。在过去的20年中,益生菌被广泛地用于治疗和预防腹泻类疾病,像腹泻型肠易激综合征(IBS)、抗生素相关性腹泻及流行性腹泻等[4-6]。有研究表明,益生菌如屎肠球菌、鼠李糖乳杆菌、干酪乳酸菌等可以通过改善肠道黏膜屏障而达到缓解腹泻的目的[6-7]。Ling等[8]发现酪酸梭菌可以减少小鼠由抗生素引起的腹泻,促进肠道组织的修复,降低肠道通透性,减轻炎症反应。此外,酪酸梭菌还可以减少由大肠杆菌或轮状病毒引起的腹泻,增强小肠黏膜上皮紧密连接蛋白的表达,降低炎症因子的产生,促进分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)的分泌[9-10]。Bisson等[11]报道乳酸菌可以抵御大肠杆菌的入侵,促进机体免疫功能。也有研究发现乳酸菌可以增加应激模型小鼠肠道sIgA的分泌,减少炎症因子的含量[12]。目前有关益生菌对预防急性腹泻及保护肠道黏膜屏障方面的研究还相对较少[6]。因此,本试验采用番泻叶(番泻叶是中医中制备肠易激综合征模型的常用药物[13])制备大鼠腹泻模型,选取唾液乳酸菌和酪酸梭菌2种益生菌,研究它们对抵御大鼠急性腹泻及维护肠道黏膜屏障的作用,为益生菌维护肠道健康提供理论依据与数据支持。
1材料与方法
1.1试验饲粮与试剂准备
试验饲粮为鼠维持料,购自北京华阜康生物科技股份有限公司。
酪酸梭菌(Clostridiumbutyricum),购自于青岛某生物技术有限公司。菌液制备:用强化梭菌培养基培养至对数生长期后,将菌液离心,用灭菌生理盐水洗2次,利用生理盐水将菌液浓度调整到6.28×109CFU/mL,4 ℃冷藏备用。唾液乳酸菌(LactobacillussalivariusZJ614),来自于浙江农林大学动物科技学院。菌液制备:用MRS液体培养基培养至对数生长期,用相同方法将浓度调整到4.80×109CFU/mL,4 ℃冷藏备用。
番泻叶(购自于北京同仁堂药店)制剂制备:取番泻叶15 g加水500 mL,煮沸约10 min,2层纱布过滤,过滤液减压浓缩成0.3 g/mL,-20 ℃冷存备用,用时水浴加温至25 ℃[14]。
1.2试验设计与饲养管理
选取清洁级21日龄断奶雄性Wistar大鼠48只[平均体重(57.45±6.23) g],温度控制在(22±2) ℃。所有大鼠随机分在4个组中,即正常对照组(C1组)、模型对照组(C2组)、酪酸梭菌组(T1组)、唾液乳酸菌组(T2组),每个组6个重复,每个重复2只大鼠。试验期共9 d,试验于每日08:30按每100 g体重1 mL的剂量灌胃,对照组(C1、C2组)经口灌服生理盐水,试验组(T1、T2组)经口灌服相应益生菌剂;第8天开始C1组在正常灌胃0.5 h后再按照每100 g体重1 mL的剂量灌服生理盐水,其余各组在正常灌胃0.5 h后灌服等量番泻叶制剂,观察各组大鼠腹泻情况。试验期间大鼠自由采食。记录大鼠初始体重、第8天体重及耗料量。试验结束后处死所有大鼠并采集血液及肠道样品。
1.3样品采集与检测指标
1.3.1腹泻率及腹泻指数
第8天大鼠灌服番泻叶3 h后连续记录大鼠腹泻情况,计算腹泻率与腹泻指数。
腹泻率(%)=100×腹泻的动物数/该组动物总数;
腹泻指数=稀便率×平均稀便级(式中稀便率为每只动物所排的稀便数与总便数之比。稀便级表示每只动物稀便的程度,以稀便污染滤纸的直径定级,分为4级:<1 cm为1级,1~1.9 cm为2级,2~3 cm为3级,>3 cm为4级。平均稀便级=所有稀便级数/稀便次数)[14]。
1.3.2血清采集及肠道通透性指标的测定
第9天灌胃结束4 h后,采用摘眼球法采集血液,然后放入促凝真空采血管中,4 ℃静置过夜,3 000 r/min(4 ℃)离心15 min,分离血清,分装于0.2 mL离心管中,-80 ℃保存。采用D-乳酸试剂盒(Sigma公司)和显色基质鲎试剂盒(含偶氮化试剂终点显色法,厦门市鲎试剂实验厂有限公司)分别测定血清中D-乳酸和内毒素的含量。
1.3.3肠道组织采集及肠道黏膜屏障指标的测定
采血后断颈处死,剖开腹腔,分离肠道组织,剪取4 cm左右回肠中段肠段,用预冷的无菌生理盐水轻轻除净肠道内容物,后将肠段等分为3份,一份用4%多聚甲醛固定过夜后,石蜡包埋,连续切片,苏木精-伊红(HE)染色,封固。光镜(Nikon ECLIPSE Ci光学显微镜)观察,拍照(Tucsen图森CCD ICE5.0拍照系统),采用Image-Pro Insight 8.0采集、测量图片,每个切片选择5~10个左右肠绒毛和隐窝测量肠绒毛长度及隐窝深度。
另取一份肠段放于RNAlater溶液中,采用实时荧光定量(real-time fluorescene quantitative PCR,qRT-PCR)方法测定回肠细胞因子白细胞介素-10(IL-10)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(IL-1β)及紧密连接蛋白闭锁小带蛋白1(ZO-1)、闭锁蛋白(occludin) mRNA的相对表达量(引物信息见表1),以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为参比基因。再另取一份肠段置于冻存管中,液氮预冻后于-80 ℃保存,采用酶联免疫吸附试验(ELISA)试剂盒(USCN公司)检测回肠组织中sIgA的含量。

表1 实时荧光定量PCR引物序列信息
1.4统计分析
根据单因素完全随机设计,以SAS 9.2的MEANS模块对基本统计量进行分析,采用GLM模块对数据进行方差分析,采用LSD法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2结果与分析
2.1酪酸梭菌与唾液乳酸菌对大鼠生长及抵御急性腹泻的影响
试验期内各组大鼠的生长情况及灌服番泻叶
后大鼠的腹泻情况列于表2。由表中数据可知,各组大鼠灌服番泻叶之前与灌服8 d后平均日增重及料重比均无显著差异(P>0.05)。第8天灌服番泻叶后,C2、T1、T2组均出现稀便,腹泻率为100%,稀便率分别为76%、69%、72%,相互之间差异不显著(P>0.05)。而T1与T2组的腹泻指数极显著低于C2组(P<0.01),分别降低27%和21%。

表2 各组大鼠的生长及腹泻情况
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). The same as below.
2.2酪酸梭菌与唾液乳酸菌对急性腹泻大鼠肠道通透性的影响
灌服番泻叶后,酪酸梭菌与唾液乳酸菌对大鼠肠道通透性的影响如表3所示。由表中数据可知,C2组大鼠血清中内毒素及D-乳酸含量极显著高于C1组(P<0.01)。而与C2组相比,T1、T2组血清中内毒素与D-乳酸含量极显著降低(P<0.01),其中血清中内毒素含量分别降低43%和45%,D-乳酸含量分别降低44%和40%。

表3 各组大鼠血清内毒素及D-乳酸含量
2.3酪酸梭菌与唾液乳酸菌对急性腹泻大鼠回肠组织形态的影响
试验各组大鼠回肠组织形态情况如表4所示。番泻叶对回肠绒毛高度、隐窝深度及绒毛高度与隐窝深度的比值无显著影响(P>0.05)。与C2组相比,T1、T2组回肠隐窝深度显著降低(P<0.05),同时回肠绒毛高度与隐窝深度的比值极显著升高(P<0.01)。各组大鼠回肠组织结构如图1所示。

表4 各组大鼠回肠绒毛高度及隐窝深度
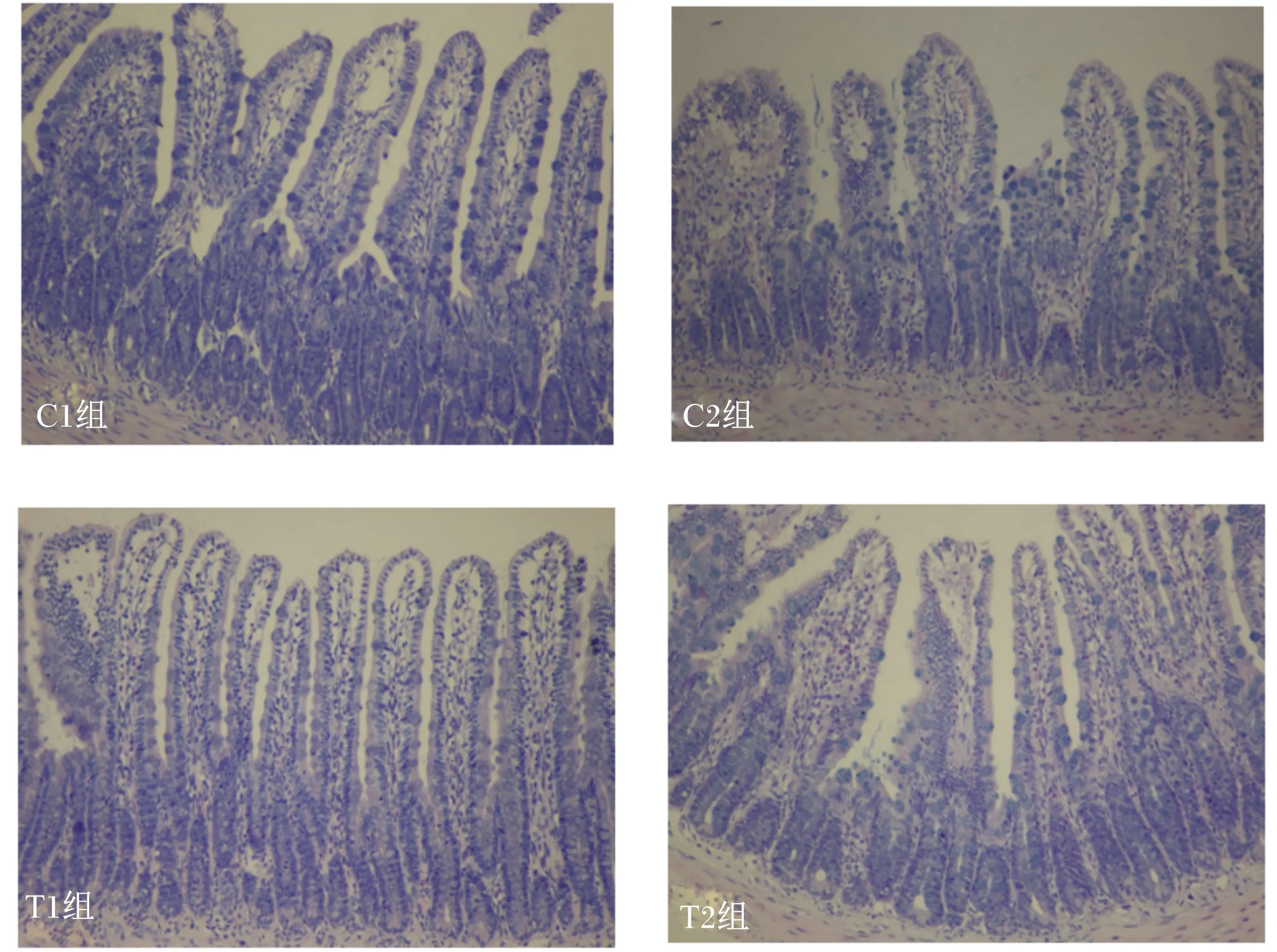
图1 各组大鼠回肠组织结构
2.4酪酸梭菌与唾液乳酸菌对急性腹泻大鼠回肠紧密连接蛋白基因表达的影响
试验各组大鼠回肠紧密连接蛋白表达情况如表5所示。T1组回肠ZO-1及occludin mRNA的相对表达量分别极显著(P<0.01)和显著(P<0.05)高于其他3组,而唾液乳酸菌对2种回肠紧密连接蛋白mRNA的相对表达量无显著影响(P>0.05)。
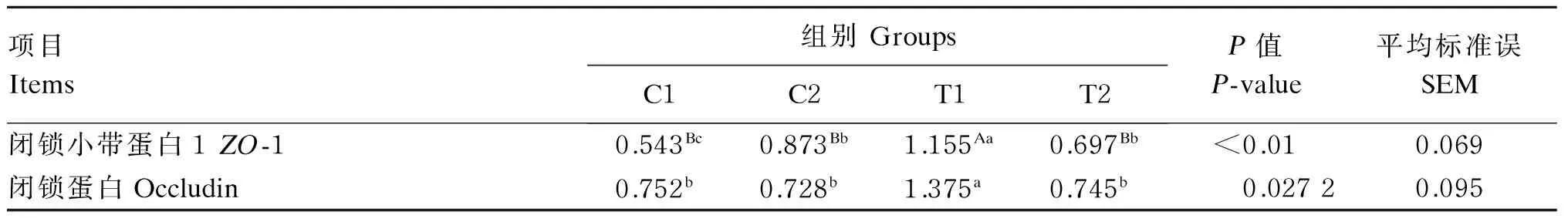
表5 各组大鼠回肠ZO-1、occludin mRNA相对表达量
2.5酪酸梭菌与唾液乳酸菌对急性腹泻大鼠回肠黏膜免疫屏障的影响
试验各组大鼠回肠细胞因子mRNA相对表达量及sIgA含量如表6所示。与C1组相比,C2组回肠抗炎性因子IL-10及促炎性因子IL-1βmRNA的相对表达量分别极显著(P<0.01)和显著(P<0.05)升高;与C2组相比,T1组回肠IL-10的mRNA相对表达量极显著降低(P<0.01),T2组则差异不显著(P>0.05)。番泻叶、酪酸梭菌及唾液乳酸菌对回肠TGF-β1、TNF-αmRNA相对表达量及sIgA含量的影响则无显著差异(P>0.05)。
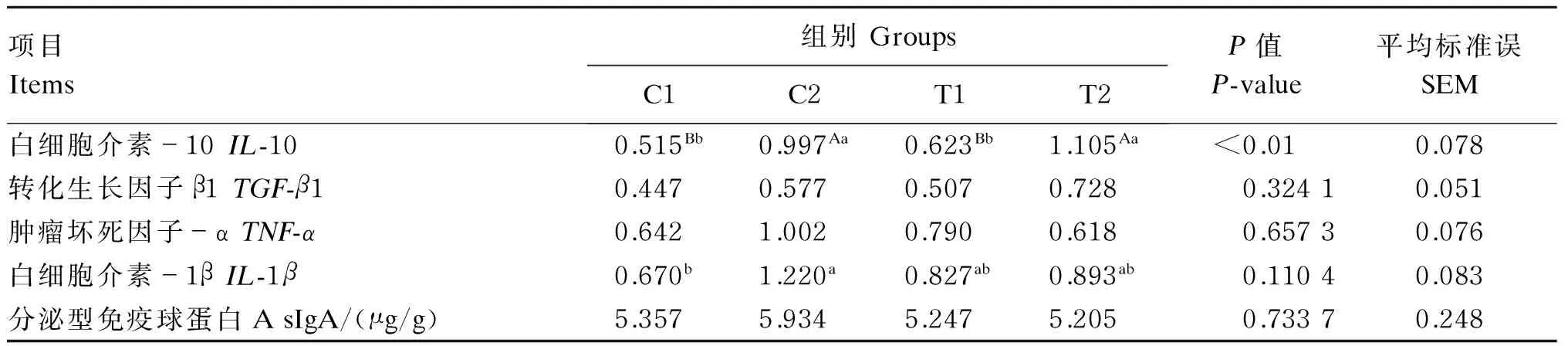
表6 各组大鼠回肠细胞因子mRNA相对表达量及sIgA含量
3讨论
番泻叶在中医中常用来制备肠易激综合征模型,其主要化学成分是番泻总甙类物质,可以导致小肠和结肠的剧烈运动,同时还会引起消化道黏膜的损伤[15]。前人研究表明,按照每100 g体重0.2 g的剂量灌服番泻叶后小鼠会在3 h左右出现腹泻症状[13],同时存在量效依赖关系[15]。当番泻叶提取物浓度大于25 g/L时,可致使细胞生长缓慢或死亡,造成细胞贴壁能力差,细胞间隙明显加大[16]。在本试验中,灌服番泻叶引起了大鼠急性腹泻,使得大鼠稀便率与腹泻指数极显著升高,说明试验急性腹泻模型建立成功。
本试验中,唾液乳酸菌是从仔猪肠道分离、筛选后获得的高黏附性乳酸杆菌,良好的定植能力可以提高乳酸杆菌在肠道的生存时间,竞争抑制病原菌对宿主肠道细胞的黏附。酪酸梭菌又名丁酸梭菌,临床试验证明其对治疗腹泻、肠道应激综合征、腹部症状的有效率可达80%以上。研究表明,益生菌FF1能够显著改善由大肠杆菌引起的大鼠失重问题[11]。口服酪酸梭菌可以显著地改善动物生长性能,降低动物腹泻率[17],还可以有效地治疗和预防小鼠由大肠杆菌O157∶H7引起的腹泻,减少死亡率[10,18]。但Ventola等[19]研究发现鼠李糖乳杆菌对于预防由轮状病毒引起的大鼠腹泻作用并不显著。在本试验中,唾液乳酸菌和酪酸梭菌对大鼠增重及料重比方面未显现出明显优势,但显著降低了由番泻叶导致的腹泻指数的升高,说明这2种益生菌对由番泻叶引起的急性腹泻均有一定的预防作用。
腹泻常常与肠道黏膜屏障改变有关。目前认为肠道黏膜屏障包括黏膜黏液层、sIgA、紧密连接蛋白及抗菌肽等化学物质。研究发现,益生菌可以维护肠道组织形态,减少肠道通透性,促进先天性免疫系统发挥作用,同时可以抵抗感染,抑制炎症[7]。血清中D-乳酸含量往往与肠道黏膜通透性的改变有关,同时能够反映肠道黏膜损坏的状态[20-21]。内毒素是革兰氏阴性菌细胞壁的脂多糖成分,正常情况下机体肠腔内含有大量细菌和内毒素。当肠道通透性加大时,有害菌分泌的内毒素会经肠道吸收入血,导致血清中内毒素含量的上升。本试验中,模型对照组大鼠血清中的D-乳酸与内毒素的含量极显著高于正常对照组,说明番泻叶可能引起了肠道黏膜损伤,肠道菌群紊乱,并使肠道通透性增加。Luyer等[22]报道乳酸菌能够减少出血性休克大鼠的血浆内毒素含量,阻止细菌易位。本试验中,酪酸梭菌与唾液乳酸菌均显著降低了急性腹泻大鼠血清中D-乳酸与内毒素的含量,这可能是由于这2种益生菌前期加强了肠道黏膜的发育,抵御了肠黏膜的损伤,巩固了肠道屏障功能,同时维持了肠道菌群的稳定性。
小肠绒毛长度和隐窝深度是衡量肠上皮细胞生长发育状况的指标。益生菌可以促进肠道发育,显著增加空肠、回肠肠道绒毛高度,降低回肠隐窝深度[23]。在本试验中,酪酸梭菌与唾液乳酸菌均显著降低了急性腹泻大鼠回肠隐窝深度,极显著地提高了绒毛高度与隐窝深度的比值,说明这2种益生菌促进了肠道绒毛的发育,缓解了急性腹泻应激对肠道绒毛的损害,减弱了由番泻叶引起的肠道通透性的增加。
肠上皮细胞以及上皮细胞之间的紧密连接分子构成一道连续和完整的物理屏障,能够机械性地阻挡肠腔中病原微生物的入侵。紧密连接蛋白包括occludin、claudins、闭锁小带蛋白(ZOs)和连接或黏附分子[24-25]。细胞间紧密连接的通透性决定着整个肠上皮细胞的屏障功能[26]。本试验发现,酪酸梭菌可以极显著地增加急性腹泻大鼠回肠ZO-1 mRNA的相对表达量,显著增加occludin mRNA的相对表达量;而唾液乳酸菌则没有显著改变这2种紧密连接蛋白mRNA的相对表达量。由此可以认为,酪酸梭菌调节了肠道上皮之间的紧密连接,提高了肠道上皮的屏障功能。这与Endo等[27]发现酪酸梭菌MIYAIRI 588可以减少非酒精性脂肪肝模型大鼠的血清内毒素含量,增加肠道ZO-1和occludin蛋白的表达量一致。
益生菌可直接作用于宿主的免疫系统,刺激胸腺、脾脏等免疫器官的发育,提高巨噬细胞活力,活化肠黏膜内相关淋巴组织,使免疫球蛋白A生物合成与分泌增加,提高消化道黏膜免疫功能[23]。sIgA是保护肠道上皮细胞远离肠毒素和致病性微生物的第1道防线[28]。大量研究表明,在体内或体外试验中,益生菌可以提高肠道对sIgA的分泌量[7]。但本试验中,番泻叶、唾液乳酸菌及酪酸梭菌均对回肠黏膜sIgA含量没有产生显著影响,这可能与大鼠自身恢复力较强有关。IL-10是由一些白细胞或非血管性细胞分泌的一类重要的免疫抑制性细胞因子[29],可以增强先天性免疫的免疫耐受[30]。IL-10或其受体缺失时会引起严重的肠道炎症和一系列促炎性细胞因子的分泌[31]。一定剂量的唾液乳酸菌可以诱导T淋巴细胞分泌IL-10、TGF-β等细胞因子[32]。本试验中,灌服番泻叶可引起大鼠回肠IL-10 mRNA相对表达量的上升,说明肠道存在一定的炎症,而自身已产生抵御炎症的反应,产生了大量的IL-10;同时,唾液乳酸菌组与模型对照组无显著差异,酪酸梭菌组与正常对照组无显著差异,这可能是由于酪酸梭菌协助了自身免疫应答,并没有引起肠道炎症,而唾液乳酸菌则没有实现这样的作用。近期的研究表明,IL-1β可以通过招募粒细胞和刺激固有淋巴细胞促进先天性免疫功能,而患结肠炎模型的小鼠其体内的白细胞介素-1(IL-1)家族会随着疾病的不同阶段发挥不同的功能[33-34]。本试验中,模型对照组大鼠回肠IL-1βmRNA相对表达量比正常对照组有升高的趋势,说明了大鼠体内仍存在炎症问题,而酪酸梭菌和唾液乳酸菌均有抑制炎症反应的趋势。
4结论
断奶大鼠连续灌服唾液乳酸菌或酪酸梭菌后,可以有效地抵御由番泻叶引起的急性腹泻,降低肠道通透性,同时具有增强和保护肠道黏膜屏障的作用。
参考文献:
[1]CAMILLERI M,NULLENS S,NELSEN T.Enteroendocrine and neuronal mechanisms in pathophysiology of acute infectious diarrhea[J].Digestive Diseases and Sciences,2012,57(1):19-27.
[2]徐立新.嗜酸乳杆菌和亚油酸治疗抗生素引起大鼠腹泻的研究[D].硕士学位论文.泸州:泸州医学院,2011:4-5.
[3]曾娟.肠易激综合征肠黏膜屏障功能的研究[D].博士学位论文.济南:山东大学,2008:10-12.
[4]GAREAU M G,SHERMAN P M,WALKER W A.Probiotics and the gut microbiota in intestinal health and disease[J].Nature Reviews Gastroenterology & Hepatology,2010,7(9):503-514.
[5]SUN Y J,CAO H J,SONG D D,et al.Probiotics can alleviate cardiopulmonary bypass-induced intestinal mucosa damage in rats[J].Digestive Diseases and Sciences,2013,58(6):1528-1536.
[6]GUARINO A,GUANDALINI S,LO VECCHIO A.Probiotics for prevention and treatment of diarrhea[J].Journal of Clinical Gastroenterology,2015,49(Suppl.1):S37-S45.
[7]OHLAND C L,MACNAUGHTON W K.Probiotic bacteria and intestinal epithelial barrier function[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2010,298(6):G807-G819.
[8]LING Z X,LIU X,CHENG Y W,et al.Clostridiumbutyricumcombined withBifidobacteriuminfantisprobiotic mixture restores fecal microbiota and attenuates systemic inflammation in mice with antibiotic-associated diarrhea[J].BioMed Research International,2015,2015:582048.
[9]胡长霞.益生菌对轮状病毒性腹泻小鼠肠道屏障的影响及机制的探讨[D].硕士学位论文.武汉:华中科技大学,2013:5-6.
[10]TAKAHASHI M,TAGUCHI H,YAMAGUCHI H,et al.The effect of probiotic treatment withClostridiumbutyricumon enterohemorrhagicEscherichiacoliO157∶H7 infection in mice[J].FEMS Immunology & Medical Microbiology,2004,41(3):219-226.
[11]BISSON J F,HIDALGO S,ROZAN P,et al.Preventive effects of different probiotic formulations on travelers’ diarrhea model in Wistar rats: preventive effects of probiotics on TD[J].Digestive Diseases and Sciences,2010,55(4):911-919.
[12]PALOMAR M M,GALDEANO C M,PERDIGN G.Influence of a probiotic lactobacillus strain on the intestinal ecosystem in a stress model mouse[J].Brain,Behavior,and Immunity,2014,35:77-85.
[13]李丹,吕妍,唐方.腹泻型肠易激综合征大鼠模型的建立[J].天津中医药,2009,26(3):240-242.
[14]周干南,胡芝华,汪亚先,等.小鼠腹泻模型的制备与腹泻指数的应用[J].中草药,1994,25(4):195-196,199.
[15]王新,韩月东,吴汉平,等.番泻叶提取物对小鼠胃肠运动及其组织形态学的影响[J].中国中西医结合杂志,2001,21(增刊):66-68.
[16]兰梅,王新,吴汉平,等.番泻叶提取物对人肠上皮细胞生物学特性的影响[J].世界华人消化杂志,2001,9(5):555-559.
[17]SONG Z F,WU T X,CAI L S,et al.Effects of dietary supplementation withClostridiumbutyricumon the growth performance and humoral immune response inMiichthysmiiuy[J].Journal of Zhejiang University Science B,2006,7(7):596-602.
[18]刘宗正,徐轲,王剑,等.酪酸菌对腹泻小鼠的治疗效果及其安全性[J].山东大学学报:医学版,2009,47(9):32-35.
[19]VENTOLA H,LEHTORANTA L,MADETOJA M,et al.Effects of the viability ofLactobacillusrhamnosusGG on rotavirus infection in neonatal rats[J].World Journal of Gastroenterology,2012,18(41):5925-5931.
[20]JOHNSTON S D,SMYE M,WATSON R P.Intestinal permeability tests in coeliac disease[J].Clinical Laboratory,2000,47(3/4):143-150.
[21]李亚杰,赵献军.益生菌对肠道黏膜免疫的影响[J].动物医学进展,2006,27(7):38-41.
[22]LUYER M D,BUURMAN W A,HADFOUNE M,et al.Strain-specific effects of probiotics on gut barrier integrity following hemorrhagic shock[J].Infection and Immunity,2005,73(6):3686-3692.
[23]刘虎传,张敏红,李素霞,等.益生菌制剂对早期断奶仔猪肠道pH、黏膜形态结构和挥发性脂肪酸含量的影响[J].动物营养学报,2012,24(7):1329-1335.
[24]BRANISTE V,JOUAULT A,GAULTIER E,et al.Impact of oral bisphenol A at reference doses on intestinal barrier function and sex differences after perinatal exposure in rats[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(1):448-453.
[25]EBNET K,AURRAND-LIONS M,KUHN A,et al.The junctional adhesion molecule (JAM) family members JAM-2 and JAM-3 associate with the cell polarity protein PAR-3:a possible role for JAMs in endothelial cell polarity[J].Journal of Cell Science,2003,116(19):3879-3891.
[26]TURNER J R.Molecular basis of epithelial barrier regulation:from basic mechanisms to clinical application[J].The American Journal of Pathology,2006,169(6):1901-1909.
[27]ENDO H,NIIOKA M,KOBAYASHI N,et al.Butyrate-producing probiotics reduce nonalcoholic fatty liver disease progression in rats:new insight into the probiotics for the gut-liver axis[J].PLoS One,2013,8(5):e63388.
[28]MANTIS N J,ROL N,CORTHÉSY B.Secretory IgA’s complex roles in immunity and mucosal homeostasis in the gut[J].Mucosal Immunology,2011,4(6):603-611.
[29]SHOUVAL D S,OUAHED J,BISWAS A,et al.Interleukin 10 receptor signaling:master regulator of intestinal mucosal homeostasis in mice and humans[J].Advances in Immunology,2014,122:177-210.
[30]SHOUVAL D S,BISWAS A,GOETTEL J A,et al.Interleukin-10 receptor signaling in innate immune cells regulates mucosal immune tolerance and anti-inflammatory macrophage function[J].Immunity,2014,40(5):706-719.
[31]MORAN C J,WALTERS T D,GUO C H,et al.IL-10R polymorphisms are associated with very-early-onset ulcerative colitis[J].Inflammatory Bowel Diseases,2012,doi:10.1002/ibd.22974.
[32]任大勇.益生乳酸杆菌的黏附及免疫调节作用研究[D].博士学位论文.长春:吉林大学,2013:4-6.
[33]COCCIA M,HARRISON O J,SCHIERING C,et al.IL-1β mediates chronic intestinal in-flammation by promoting the accumulation of IL-17A secreting innate lymphoid cells and CD4+Th17 cells[J].The Journal of Experimental Medicine,2012,209(9):1595-1609.
[34]NEURATH M F.Cytokines in inflammatory bowel disease[J].Nature Reviews Immunology,2014,14(5):329-342.
(责任编辑菅景颖)
Effects of Probiotics to Against Acute Diarrhea and on Intestinal Mucosal Barrier of Rats
PANG MinLU Qingping*ZHU LiyuanXIA BingZHANG Hongfu
(State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Science, Beijing 100193, China)
Abstract:The purpose of this study was to evaluate the effects of Clostridium butyricum or Lactobacillus salivarius ZJ614 on prevention of acute diarrhea and protection of intestinal mucosal barrier function. Forty-eight 21-day-weanned Wistar rats with the average body weight of (57.45±6.23) g were selected and randomly divided into four groups: normal control group (C1 group), model control group (C2 group), Clostridium butyricum group (T1 group) and Lactobacillus salivarius ZJ614 group (T2 group). Each group had six replicates, and each replicate had two rats. This experiment lasted for 9 days. C1 and C2 groups were orally administered saline, and T1 and T2 groups were administered probiotics accordingly. On the 8th day, every group except C1 group was administered folium senna to cause acute diarrhea and then record diarrhea condition of rats. All rats were sacrificed, and blood and intestinal samples were collected at the end of experiment. The results showed as follows: 1) all rats displayed diarrhea symptoms as long as administered folium senna. Loose stools rate, diarrhea index, serum endotoxin and D-lactic acid contents were significantly increased in C2 group compared with C1 group (P<0.01). The diarrhea index, serum endotoxin and D-lactic acid contents decreased significantly in T1 and T2 groups compared with C2 group (P<0.01). 2) Compared with C2 group, the crypt depth in T1 and T2 groups was significantly decreased (P<0.05), the ratio of villus height to crypt depth in T1 and T2 groups was significantly increased (P<0.01), and the relative expression levels of ileum zonula occludens-1 (ZO-1) (P<0.01) and occludin mRNA (P<0.05) in T1 group were significantly improved. 3) C2 group significantly up-regulated the relative expression levels of ileum interleukin-10 (IL-10) (P<0.01)and interleukin-1β (IL-1β) mRNA (P<0.05) compared with C1 group, and T1 group down-regulated the relative expression level of IL-10 mRNA compared with C2 group (P<0.01). In summary, Clostridium butyricum or Lactobacillus salivarius ZJ614 can alleviate the actue diarrhea induced by senna on a certain degree, and also decrease the intestinal permeability, and enhance intestinal mucosal barrier.[Chinese Journal of Animal Nutrition, 2016, 28(5):1462-1470]
Key words:Clostridium butyricum; Lactobacillus salivarius ZJ614; rats; actue diarrhea; intestinal mucosal barrier
doi:10.3969/j.issn.1006-267x.2016.05.022
收稿日期:2015-12-07
基金项目:国家科技支撑项目(2012BAD39B01);中国农业科学院创新团队(ASTIP-IAS07)
作者简介:庞敏(1990—),女,山东淄博人,硕士研究生,从事单胃动物营养与饲料科学研究。E-mail: pangmin_caas@163.com *通信作者:卢庆萍,副研究员,硕士生导师,E-mail: luqingping@sina.com
中图分类号:S816
文献标识码:A
文章编号:1006-267X(2016)05-1462-09
*Corresponding author, associate professor, E-mail: luqingping@sina.com

