C-FOS、STAT 3在PCOS患者着床窗口期子宫内膜的表达及意义
杨雪峰 刘丽伟 李爱杰
C-FOS、STAT 3在PCOS患者着床窗口期子宫内膜的表达及意义
杨雪峰 刘丽伟 李爱杰
目的 探讨C-FOS,STAT 3对多囊卵巢综合征(PCOS)患者窗口期子宫内膜容受性的影响。方法 选取15例已婚PCOS患者(PCOS组),14例其他原因导致不孕的妇女(对照组),在窗口期收集其子宫内膜组织,经HE染色判断组织学分期,用免疫组织化学SP法检测C-FOS,STAT 3在窗口期子宫内膜的表达。结果 PCOS组窗口期C-FOS表达高于对照组,STAT 3表达低于对照组,二者呈显著负相关,差异均具有统计学意义(P<0.01)。结论C-FOS高表达、STAT 3低表达可能影响PCOS组窗口期子宫内膜容受性的建立,是造成PCOS患者妊娠率低、流产率高的原因之一。
多囊卵巢综合征;子宫内膜容受性;C-FOS因子;STAT 3因子
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是常见的内分泌、代谢紊乱性疾病,主要以月经不规则,不孕,雄激素过高,高胰岛素血症为临床特征。PCOS在生育年龄女性的发病率为6%~8%,占无排卵性不孕的50%~70%,约50%PCOS患者有复发性流产史。具有妊娠率低、流产率高的特点。本研究用免疫组织化学方法,检测C-FOS,STAT 3在促排卵后PCOS患者和其他原因不孕患者着床窗口期子宫内膜的表达,探讨PCOS患者经过纠正内分泌紊乱后,妊娠率低、流产率高的可能原因,现报道如下。
1 资料与方法
1.1 一般资料 随机抽取2014年3月~2015年2月在郑州大学第三附属医院门诊就诊的15例已婚PCOS患者为实验组。符合条件:诊断标准符合2003年鹿特丹标准,年龄25~35岁,平均年龄(28.8±3.3)岁。经药物治疗后,月经规律,内分泌恢复正常,自然排卵或促排卵治疗后正常排卵,丈夫精液检查正常,无其他内科合并病症等。随机抽取同期在郑州大学第三附属医院门诊就诊的14例因输卵管或男方因素导致不孕患者为对照组。符合条件:年龄25~35岁,平均年龄(27.7±2.5)岁。月经规律、内分泌正常,正常排卵,近3个月未用过激素类药物,阴道B超检查未发现子宫、卵巢器质性病变,无其他内科合并症及并发症等。2组一般资料比较差异无统计学意义,具有可比性。
1.2 实验方法
1.2.1 标本采集 PCOS组采用自然周期排卵或者用促排卵治疗方案[克罗米芬(CC)50 mg/d,月经周期第5~9天连续服用],月经第12天开始,经阴道B超监测卵泡发育及子宫内膜厚度。当卵泡直径为18~23 mm,子宫内膜厚度大于8 mm时肌肉注射人绒毛膜促性腺激素HCG 10000 U,指导患者同房。于注射HCG后第3天,经阴道B超检查确认优势卵泡已破。对照组于月经周期第12天开始经阴道B超监测卵泡发育及子宫内膜厚度,于排卵日指导患者同房。PCOS组和对照组均于着床窗口期,即排卵后第8~10天,晨空腹抽取肘静脉血3 mL,检测血E2、P、HCG水平。当血THCG<30 IU/L时(本院检验科标准),认为患者本月无妊娠可能。并于抽血当日下午,在无菌操作下,用一次性子宫内膜取样管吸取少许子宫内膜组织。将所取新鲜子宫内膜组织立即放入10%甲醛溶液中固定,常规梯度酒精脱水后石蜡包埋,切片,HE染色,经同一个经验丰富的病理科医生观察子宫内膜病理组织学情况。本研究所有实验对象均于取样前签署知情同意书。
1.2.2 子宫内膜C-FOS,STAT 3的测定 C-FOS,STAT 3一抗均用鼠抗人单克隆抗体工作液,二抗均用羊抗鼠工作液,按照标准免疫组化SP法进行操作。
1.2.3 结果判定 免疫组化SP法染色切片呈棕黄色(低表达)或棕褐色(高表达)。每张切片分别选取5个不重叠的阳性区域(高倍镜视野下,40×10倍),用病理图像分析系统检测其表达情况。每个因子的平均光密度值(OD)表示该因子在相应组子宫内膜的表达情况。
1.3 统计学方法 采用SPSS 17.0统计分析软件,计量资料采用“x±s”表示,组间比较采用t检验,定性资料比较采用Fishers确切概率法,相关性分析用pearson相关性分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 2组着床窗口期血雌激素(E2)、孕激素(P)水平比较 着床窗口期PCOS组血清E2值为(267.3±19.7),对照组为(225.5±18.6),差异具有统计学意义(P<0.01)。着床窗口期PCOS组血清P值为(11.2±2.6),对照组P值为(13.5±2.5),差异具有统计学意义(P<0.05)。见表1。
2.2 2组子宫内膜病理组织学结果 对照组子宫内膜分泌早期4例,分泌晚期10例,分泌反应欠佳3例(占21.4%)。PCOS组分泌早期3例,分泌晚期12例,分泌反应欠佳10例(占66.7%),2组比较差异具有统计意义(P<0.05)。见表2。
表1 2组着床窗口期血清E2、P水平比较(±s)

表1 2组着床窗口期血清E2、P水平比较(±s)
组别例数E2(ng/L)P(μg/L) PCOS组15267.3±19.711.2±2.6对照组14225.5±18.613.5±2.5 t值5.880-2.359 P值<0.01<0.05

表2 2组子宫内膜病理组织学结果(n)
2.3 子宫内膜组织中C-FOS,STAT 3的表达 2组子宫内膜组织中,C-FOS主要表达于子宫内膜腺上皮细胞、基质细胞的细胞核,STAT 3表达于子宫内膜腺上皮细胞的细胞浆和细胞核,均呈棕黄色或棕褐色。PCOS组C-FOS表达高于对照组,差异有统计学意义(P<0.01);STAT 3表达低于对照组,差异有统计学意义(P<0.01)。见表3。二者表达呈显著负相关(r=-0.985,P<0.01)。
表3 PCOS组和对照组窗口期子宫内膜C-FOS和STAT 3的表达(±s)
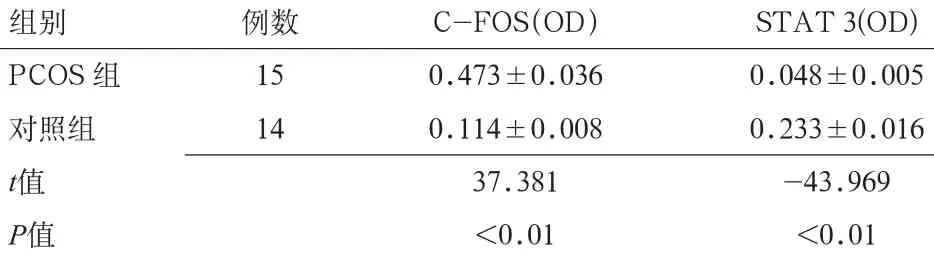
表3 PCOS组和对照组窗口期子宫内膜C-FOS和STAT 3的表达(±s)
组别例数C-FOS(OD)STAT 3(OD) PCOS组150.473±0.0360.048±0.005对照组140.114±0.0080.233±0.016 t值37.381-43.969 P值<0.01<0.01
3 讨论
3.1 PCOS组和对照组子宫内膜病理结果分析 本研究中,PCOS组子宫内膜分泌反应欠佳发生率高于对照组,提示PCOS患者经过纠正内分泌及代谢紊乱和促排卵治疗后,虽然可以正常排卵,但由于PCOS患者窗口期雌、孕激素分泌不足,不仅造成PCOS患者子宫内膜组织形态发生改变,分泌反应欠佳,而且引起PCOS患者子宫内膜容受性降低,造成其妊娠率低流产率高的临床特点。Roemer KL等[1]认为,PCOS患者子宫内膜孕激素抵抗和长期雌激素作用,导致PCOS患者子宫内膜容受性降低。本研究与国外报道基本一致。
3.2 C-FOS在PCOS组和对照组子宫内膜表达情况C-FOS由即刻早期基因(IEGS)C-FOS表达产生。C-FOS在绝大多数细胞中呈低表达状态,参与细胞生长、增殖、分化、信号传递等生理过程。孙雪艳[2]等研究发现EM患者窗口期在位子宫内膜C-FOS蛋白表达明显升高,推测EM患者窗口期在位子宫内膜C-FOS蛋白的高表达可能会降低子宫内膜容受性而影响胚胎着床。Fujimoto J[3]等通过对子宫内膜癌细胞和来源于子宫内膜的纤维母细胞研究发现,雌激素促进C-FOS表达,孕激素抑制C-FOS表达,认为C-FOS在人子宫内膜周期性表达,且增生期表达高于分泌期。Maldonado Vicente[4]研究表明,性激素通过C-FOS等因子发挥对子宫内膜的周期性调节作用。本研究中,PCOS组窗口期C-FOS表达高于对照组,说明PCOS患者虽然内分泌紊乱纠正后,可以正常排卵,由于孕激素分泌不足,不能抑制子宫内膜C-FOS表达,导致窗口期子宫内膜C-FOS高表达。异常表达的C-FOS可能使性激素不能发挥对子宫内膜周期性作用,影响子宫内膜蜕膜化,降低PCOS患者窗口期子宫内膜容受性。对照组窗口期PCOS表达低于对照组,推测低表达的C-FOS在维持窗口期子宫内膜形态和功能方面起重要作用。
3.3 STAT 3在2组子宫内膜的表达情况 信号转导和转录活化因子(STATS)家族是一种存在于胞浆并在激活后能够转入核内与DNA结合的蛋白家族,具有信号转导和转录调控双重功能。目前在哺乳动物中已鉴定出STAT家族成员有STATl(a/ B)、STAT 2、STAT 3(a/13/'y)等。STAT 3是STATS家族中与肿瘤关系最为密切的一员,参与肿瘤细胞多种重要的生理活动。Sun X[5]等通过控制性地删除小鼠STAT 3基因的表达,发现这些小鼠雌激素反应性基因上调,孕激素反应性基因下调,这些变化导致子宫腔上皮细胞分化失败,阻止容受态子宫内膜的建立,从而导致胚胎种植失败,认为STAT 3对子宫内膜容受性和胚胎种植至关重要。本研究中,PCOS组窗口期STAT 3表达低于对照组,可能通过下调孕激素反应性基因,降低孕激素对子宫内膜的蜕膜化作用,不利于子宫腔上皮分化。TSLP通过STAT 3通路抑制蜕膜细胞凋亡[6],低表达的STAT 3可能使TSLP抑制蜕膜细胞凋亡的作用减弱,加速蜕膜细胞凋亡,削弱PCOS患者窗口期子宫内膜容受性,不易于妊娠的建立和维持,可能是PCOS患者妊娠率低流产率高的原因之一。对照组窗口期STAT 3表达较高,说明高表达的STAT 3利于子宫内膜容受性建立。与国外报道[7]基本一致。
本研究中,PCOS患者窗口期C-FOS高表达,STAT 3低表达,这些变化,可能通过一定环节影响PCOS患者子宫内膜容受性的建立。C-FOS,STAT 3作为PCOS患者内膜容受性的新的影响因子,仍需要进一步的研究与证实,但是期待通过干预窗口期二者的表达,为改善多囊患者妊娠率低、流产率高的临床状态提供理论依据。
[1] Roemer KL,Young SL,Savaris RF.Characterization of GAB1 expression over the menstrual cycle in women with and without polycystic ovarian syndrome provides a new insight into its pathophysiology[J].J Clin Endocrinol Metab,2014,99(11):162-168.
[2] 孙雪艳,李艳萍.C-fos和整合素β3在子宫内膜异位症窗口期在位子宫内膜的表达[J].中国妇幼保健杂志,2009,24(7):985-988.
[3] Fujimoto J, Hori M;,Ichigo S,et al.Estrogen induces expression of c-fos and c-jun via activation of protein kinase C in an endometrial cancer cell line and fibroblasts derived from human uterin eendometrium[J]. Gynecological Endocrinology,1996,10(2):109-118.
[4] Maldonado Vicente,Castilla,Jose Antonio,et al.Expression of transcription factors in endometrium during natural cycles[J].Journal of Assisted Reproduction and Genetics,2003,20(11):474-481.
[5] Sun Xiaofei,Bartos Amanda,Whitsett,et al.Uterine deletion of gp130 or stat3 shows implantation failure with increased estrogenic responses[J].J MolEndocrinol,2013,27(9):1492-1501.
[6] Duan J,Jiang XP,Li MQ,et al.Thymic Stromal Lymphopoietin Suppresses the Apoptosis of Decidual Gamma-delta T Cells via Regulation of the Signal Transduction and Activation of Transcription 3/Caspase-3 Signaling Pathway[J].Am J Reprod Immunol,2013,70(6):464-471. [7] Tanaka T, Bai T,Utsunomiya H,et al.STAT3 enhances intracellular Fasmediated apoptotic signals in HHUA human endometrial epithelial cells[J]. Mol Med Report,2011,4(2):301-312.
Objective To explore the effect of C-FOS and STAT 3 on endometrial receptivity of polycystic ovarian syndrome (PCOS). Methods The endometrial samples were obtained from 15 marride cases with PCOS (PCOS group) and 14 infertile women cause of other factors (Control guoup) at the window of implatation, hematoxylin-eosin staining to determin the samples' histologic staging,immunohitochemical method to test the expression of C-FOS and STAT 3. Results At the window of implantation, the expression levels of C-FOS in PCOS group were higher than those in Control group, while the expression levels of STAT 3 were on the contrary, the differences was statistically signif i cant (P<0.01). Conclusion The high expression of C-FOS and the low expression of STAT 3 may affect the establishment of endometrial receptivity in PCOS, which may be one of the reasons of the low pregnancy rate and high rate of abortion in them.
Polycystic ovarian syndrome;Endometrial receptivity;C-FOS;STAT 3
10.3969/j.issn.1009-4393.2016.1.001
河南 450052 河南省郑州市郑州大学第三附属医院妇产科 (杨雪峰 刘丽伟 李爱杰)

