进展期胃癌新辅助化疗原发灶病理完全缓解5例报告及文献复习*
吴留成 黄名威 覃宇周 陈建思 莫显伟 茹海明
进展期胃癌新辅助化疗原发灶病理完全缓解5例报告及文献复习*
吴留成黄名威覃宇周陈建思莫显伟茹海明
摘要进展期胃癌不可切除率及术后复发率较高,新辅助化疗联合手术切除是最常见的胃癌多学科综合治疗方法之一,具有以下优点:使肿瘤降期,提高R0切除率;对于高强度化疗的耐受性较辅助化疗好,化疗完成率较辅助化疗高;提供活体药敏检测从而避免不必要的手术。虽然高强度化疗产生更高的客观反应率,但是进展期胃癌经新辅助化疗获得病理完全缓解的仍然较少,且缺乏相关诊治规范。现介绍在广西医科大学附属肿瘤医院胃肠外科予新辅助化疗后获得病理完全缓解的5例进展期胃癌,以探讨该类患者的临床病理特征、合理的综合治疗决策及预后的相关因素,使临床诊疗更加规范,患者更多获益。
关键词胃癌新辅助化疗预后
作者单位:广西医科大学附属肿瘤医院胃肠外科(南宁市530021)
*本文课题受广西壮族自治区卫生和计划生育委员会自筹经费科研项目(编号:Z2015716)资助
1 病历摘要
选取2011年1月至2015年7月广西医科大学附属肿瘤医院胃肠外科收治的5例进展期胃癌接受新辅助化疗(neoadjuvant chemotherapy,NAC)后原发灶获得病理完全缓解(pathological complete response,pCR)者。其中男性3例,女性2例;中位年龄67(42~86)岁;胃底贲门癌2例,胃体癌3例;中分化腺癌2例,低分化腺癌3例。化疗前临床分期均为T4N+M0期。5例胃癌患者一般资料见表1。
其中4例NAC方案为SOX(替吉奥胶囊40 mg/m2,2次/d,d1~14;奥沙利铂130 mg/m2,d1;21 d为1个周期),2例NAC为4个周期,2例NAC为3个周期;另外1例行2个周期多西他赛+奥沙利铂+替加氟(多西他赛75 mg/m2,d1;奥沙利铂130 mg/m2,d2;替加氟800 mg/m2,d1~5;21 d为1个周期)的NAC。NAC不良反应主要为0~Ⅰ级胃肠道反应和0~Ⅲ级血液学毒性。
疗效评估全部经CT检查并按照实体肿瘤疗效评价标准(RECIST 1.1)进行。术前评估4例为部分缓解,1例为完全缓解。
5例均行胃癌D2根治术(全胃切除),其中2例行腹腔镜全胃切除术。术后淋巴结检出中位数22(9~36)枚,所有淋巴结均为阴性;1例病理提示胃壁浆膜下可见淋巴管内癌栓。术后1例患者出现不全性肠梗阻,经保守治疗后好转;1例患者出现肺部感染及腹腔淋巴漏,1例患者发生颈静脉导管感染,以上2例患者均治愈,余未见相关手术并发症及手术死亡。
术后仅2例行辅助化疗并按要求完成,1例仅行1个周期的辅助化疗,另外2例未行辅助化疗。辅助化疗的不良反应包括0~Ⅲ级胃肠道反应,0~Ⅲ级血液学毒性及Ⅰ~Ⅱ级的外周神经毒性。5例患者均随访至2015年8月,中位随访时间24(14~44)个月,均生存。5例胃癌患者的治疗及随访情况见表2。
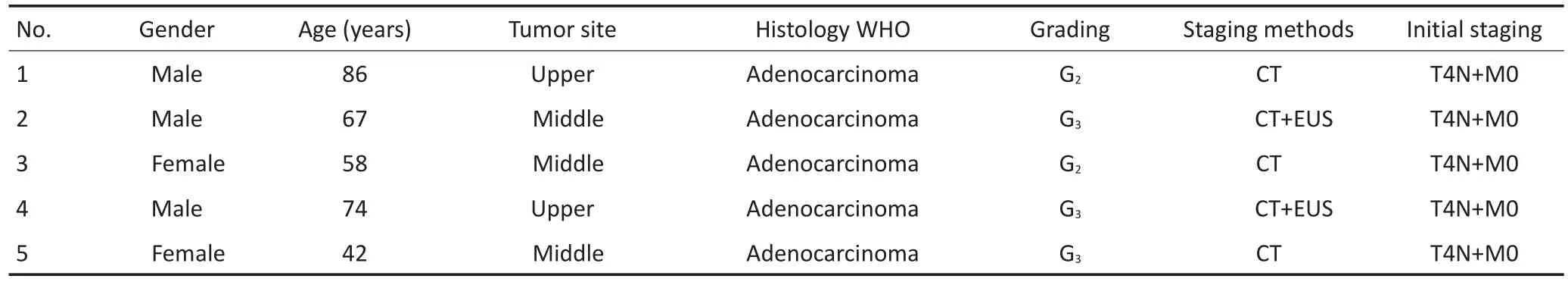
表1 5例胃癌患者一般资料Table 1 Characteristics of the five cases of gastric cancer after neoadjuvant chemotherapy
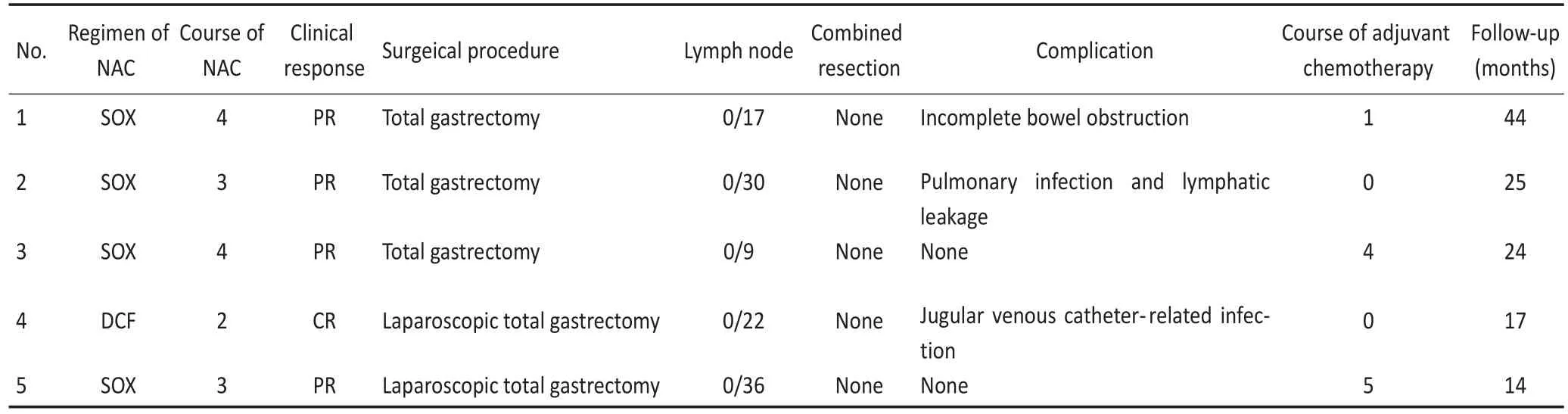
表2 5例胃癌患者新辅助化疗后pCR的治疗及随访情况Table 2 Pre-surgical/surgical/post-surgical treatments and follow-up of the five cases of gastric cancer
2 讨论要点
1)新辅助化疗方案的选择及最佳疗程;2)pCR是否可以成为预后好的指标;3)胃癌新辅助化疗的疗效预测评估及pCR患者的临床病理特征;4)pCR后的治疗方案及问题;5)新辅助化疗后的手术问题;6)靶向药物在新辅助化疗中的应用。
3 临床讨论
马韵主任医师(病理科):pCR的判断有比较明确的病理学特征:即局部进展期胃癌经新辅助治疗并行胃癌根治术后,大体观察未见明确肿瘤残留,且原发肿瘤区域广泛取材镜下仍未见肿瘤细胞残留。但pCR的判断要求广泛取材及大量切片,对于病理科工作强度及工作流程提出了更高的要求。而我国大多数医院病理科欠缺pCR准入制度和判读规范,这也限制了pCR病理学判读的推广和进一步发展。pCR的镜下表现为:大片状坏死、纤维组织增生及修复性瘢痕的形成[1]。虽然本组pCR患者未见淋巴结残留,但武爱文等[2]对5例pCR患者进行病理学观察时发现2例淋巴结仍然有癌残留,说明胃癌新辅助化疗后原发灶和转移淋巴结的反应程度并不一致。因此,不应通过单纯的原发灶pCR推断淋巴结的状态。另外其1例免疫组织化学检测Ki-67表达阳性,提示可能仍存在活性肿瘤细胞。因此,对于pCR的判断除了依据肿瘤坏死的程度和范围外,还需要对分子标志物的价值及相关的生物学信息进行深入研究[2]。
在进行胃癌NAC的患者选择时,部分研究试图阐明哪些临床病理特征更加可能获得pCR。Bichev等[3]分析pCR的病例时发现性别、年龄、BMI、ECOG评分、肿瘤位置、T分期、N分期、WHO分型、Lauren分型及病理分级这些临床病理特征均与pCR无相关性。同时有5例印戒细胞癌患者在NAC后却获得pCR并长期生存,也说明NAC对于印戒细胞癌这一特殊组织类型的胃癌同样有效。因此,基于Lauren分型或印戒细胞癌而针对性选择治疗方式仍缺乏证据支持。虽然Bichev等[3]未能发现肿瘤位置与pCR有相关性,但是本组5例pCR患者均为胃体或胃底贲门癌。李子禹等[4]研究11例pCR患者中有6例为胃体或胃底贲门癌,而在Cho等[5]研究中胃体或胃底贲门癌占所有pCR患者的77%。从这一角度可以推测胃体或胃底贲门癌对于NAC更加敏感而获得pCR,但尚需继续探索明确。同样在分子生物学方面,可能预测NAC治疗效果的分子指标包括分子靶点相关指标及药物敏感性指标等,但是这些预测因素尚需验证。有研究提示联合检测cyclin D1和IL-1RN基因型与预后相关,可做为评估胃癌经NAC治疗预后的指标[6]。未来分子生物学方面的相关研究可为预测疗效及评估预后提供新的解决方案。
李永强主任医师(消化肿瘤内科):胃癌NAC方案的选择应将患者的身体状况、合并症及化疗药物毒性等因素综合考虑权衡。虽然我国指南推荐ECF及其改良方案类似的两药或三药联合化疗,但是临床实际应用中如同4例获得pCR的NAC方案一样,我国较多诊疗中心选择SOX或XELOX方案(卡培他滨,奥沙利铂)等方案。而以多西紫杉醇为主的TCF方案(多西紫杉醇,顺铂,氟尿嘧啶)在应用于胃癌新辅助化疗时,pCR率达到12%[7],明显高于已报道的其他NAC方案,说明TCF方案用于新辅助化疗可能比两药联合化疗具有一定优势。总体而言,国内外共识认为胃癌NAC应选择以氟尿嘧啶为主的化疗方案,但具体方案仍无定论,亟待大型临床研究验证。
胃癌NAC疗程的选择目前也同样缺乏定论,不同指南推荐亦有差异。大多数日本研究中新辅助化疗为2个周期,而在证实化疗受益的MAGIC研究中新辅助化疗为3个周期。Baba等[8]回顾性研究中比较了胃癌NAC使用替吉奥联合顺铂1个周期与2个周期的疗效,无患者达到pCR,而且偶尔有NAC化疗1个周期或2个周期达到pCR的病例报道[9]。因此不管何种方案,短程NAC能达到pCR的病例极其罕见。支持短程NAC的依据包括:2个周期NAC可以达到CR;可切除的肿瘤应尽早手术治疗以免继续化疗后疾病进展而丧失手术机会;临床缓解和肿瘤切除可以改善预后。本组病例中,1例在2个周期NAC后胃周淋巴结显著缩小,后行2个周期NAC后淋巴结缩小更为显著。若该患者在2个周期NAC后手术治疗,也许就无法达到pCR。即患者在2个周期NAC后评估为部分缓解,再增加2个或更多周期的化疗可能提高达到pCR的机率。而一项随机对照的Ⅱ期研究(COMPASS)在比较2个周期和4个周期化疗差异以及2个化疗方案紫杉醇加顺铂(PC)与替吉奥加顺铂(SC)的差异时,发现无论是何种方案,pCR均发生在4个周期的NAC组,而2个周期的化疗组中无一例达到pCR。虽然两组间pCR率比较无显著性差异(P=0.055),但是该研究提示pCR很有可能发生在NAC的第3个或第4个周期[10]。目前为止,其他行1个、2个或3个周期NAC的研究从未达到COMPASS研究报道的pCR率。同样,本组5例患者中4例(80%)在3~4个周期化疗后达到pCR。李子禹等[4]报道11例pCR患者中,9例(81.8%)接受4个周期的NAC。
长疗程NAC可能提高肿瘤进展的风险而导致肿瘤无法切除,但这类患者很可能在手术和辅助化疗后短期内复发转移。因此,长疗程NAC可以甄别这类患者而避免不必要的手术。
覃宇周副主任医师(胃肠外科):临床研究已经证实NAC可以改善局部进展期胃癌的预后,NAC后病理缓解可以获得更好的生存,但是获得病理部分缓解的患者生存时间是否同获得pCR的患者一样,目前鲜见相关报道,COMPASS研究将会阐明这一问题。
虽然pCR是评价NAC疗效最为直观可信的指标,但pCR是否可以成为独立的预后良好的标志一直存在争议。从理论上推测,新辅助化疗获得pCR的患者属于化疗敏感者,既然新辅助化疗能使原发灶及转移淋巴结“完全消失”,那么潜在的远处微小转移也会消失,另行根治性手术,则该人群理应已经治愈而获得良好的预后[1]。但是Fields等[11]回顾性分析发现60例局部进展期胃或胃食管交界部腺癌患者在经新辅助治疗后获得pCR,虽然总体pCR者总生存期(overall survival,OS)及无进展生存期(progression free survival,PFS)明显优于非pCR者,但若将非pCR者根据术后病理分为Ⅰ期、Ⅱ期,前两者的复发率与pCR者基本一致,而仅新辅助治疗后病理分期仍为Ⅲ期患者预后较差。由于Ⅲ期患者经新辅助治疗后降期不明显,Ⅰ期和Ⅱ期患者降期可能性大,提示若新辅助治疗有效,预后较好,则获得pCR患者并无特别生存优势。而且该组pCR病例随访发现复发率高达23%。同样,Cheedella等[12]研究发现经新辅助放、化疗后获得pCR与非pCR者相比,OS的差异无统计学意义(94.8个月vs.54.8个月,P=0.168)。而Bichev等[3]回顾性分析77例经NAC治疗的胃体或胃食管交界部腺癌患者,术后随访发现pCR者5年生存率明显高于非pCR者(80.0%vs.29.7%,P=0.01)。Cho等[5]检索和纳入经NAC治疗后获得pCR的个案报道进行系统性综述,随访这些病例发现pCR者的3年和5年OS及RFS分别为96%、85%和91%、75%。由此可见,Fields 及Cheedella等[11-12]研究未能证实pCR可以作为新辅助治疗患者预后良好的标志,但Fields等[11]研究的60例经新辅助治疗获得pCR病例中有47例行新辅助放疗(78%),Cheedella等[12]的病例均行新辅助放化疗;相比之下,两个分析NAC治疗后获得pCR的研究却证实pCR是患者预后良好的标志。本组5例pCR患者中,其中位生存时间为24(14~44)个月,目前均生存,提示新辅助化疗后pCR的预后较好。尽管在化疗的基础上加用放疗可以增加局部控制而获得更高的pCR率,但是对于潜在的远处微小转移的控制差于经NAC治疗后获得pCR的病例,毕竟胃癌更加容易出现远处转移。综上所述,同样是新辅助治疗后的pCR,但是经NAC治疗后获得的pCR与新辅助放化疗后的pCR意义不一致,提示在分析局部进展期胃癌治疗后获得pCR的病例时,需要将经NAC治疗后获得pCR的病例单独研究。
苏丹柯主任医师(影像诊断科):在新辅助化疗中本研究应用CT做为疗效评估的主要手段,但是在本组5例pCR患者中,仅1例通过CT临床评估为CR,提示CT对于获得pCR的评效差强人意。应用CT对于局部进展期胃癌NAC疗效评估欠准确,主要基于两个原因:胃是一个不规则空腔脏器,原发灶是无法准确测量的;胃周转移淋巴结在治疗后被结缔组织替代,但淋巴结可能未变小,也增加了判断疗效的难度。而结合功能影像的PET-CT理论上可以同时反映病灶的病理生理变化和形态结构,可以更加准确的评估胃癌NAC的疗效,但是由于其价格昂贵在国内尚难以普及,所以PET-CT是否可以准确预测pCR仍缺乏相关经验。既然单靠器械检查难以准确的判断pCR,那么临床完全缓解(clinical complete response,cCR)是否可以更加准确的判断pCR仍是问题。Cheedella等[12]对284例局部进展期食管胃交界部腺癌患者进行回顾性研究,所有患者在基线及放、化疗完成5~6周后必须接受PET-CT、超声内镜及多学科会诊,多学科会诊判断cCR标准包含“内镜下未见癌细胞,且PET-CT扫描显示局部病灶为生理性代谢特点”,由多学科会诊决定是否手术及手术方式。该研究发现cCR为218例(76.8%),pCR为69例(24.0%),其中67例术前判为cCR,2例判断为非cCR,cCR预测pCR的敏感性为97.1%,特异性为29.8%,阳性预测值为30.7%,而阴性预测值为96.7%。该研究为目前样本量最大的cCR和pCR相关性分析,提示即便是cCR对于pCR的预测价值仍然有限,如何建立局部进展期胃癌经NAC治疗后获得pCR及生存预后的预测模型,以及收集该类患者的生物学信息是未来亟待解决的问题。
李永强主任医师(消化肿瘤内科):对于NAC后获益,甚至达到CR的患者,目前仍不建议缩小手术范围。切除范围取决于原发肿瘤在化疗前的大小和位置,即使在化疗后已经完全缓解,切除方案也不应该改变。本组5例pCR患者中,1例病理检查示淋巴管内可见癌栓,也提示标准D2根治术的必要性。而且,术后病理检查对于明确NAC疗效特别是否达到pCR的诊断是无法取代的唯一标准,即只有标准的手术才能为准确的病理评效提供保证。对于pCR术后的辅助治疗,目前仍倾向于按照NAC治疗前的分期决定辅助化疗,辅助化疗继续原有的NAC方案。问题是此类人群是否一定要接受辅助化疗。本组3例pCR患者未行辅助化疗均获得长期生存且至今未见复发转移,说明该类人群中存在预后较好者,如何判断从而实现个体化治疗;经过NAC后未获得pCR的这类人群,是否在行辅助化疗时更换方案,均为临床实践中常见的问题。
然而pCR患者对于辅助化疗的依从性较差,本组仅2例能完成辅助化疗,2例术后未进行任何治疗,另外1例仅接受了1个周期的辅助化疗。Fields等[11]随访60例经过新辅助治疗获得pCR患者时发现,60 例pCR患者中仅1例接受辅助化疗,而非pCR组有28%的患者接受辅助化疗。然而在无pCR病例的MAGIC研究中,86%的患者完成NAC,其中42%的患者仍能按要求完成围手术期的化疗,提示相对于未获得pCR的患者,pCR者继续行辅助化疗的依从性非常差。Biffi等[7]研究发现化疗的严重不良反应是患者无法耐受辅助化疗的主要原因,尤其是术后患者的胃肠道毒性反应,这也导致辅助化疗比新辅助化疗更加难以实施和完成。因此对于pCR患者的辅助化疗,医生应该更加关注和处理化疗相关的胃肠道毒性反应,是否直接更换为低强度辅助化疗方案以减轻毒性反应仍是疑问。
对本组3例未完成辅助化疗的患者随访时,本研究组发现pCR会带给患者及家属疾病治愈的假象,也会使医生放松警惕而不坚持辅助化疗,从而导致pCR患者放弃辅助化疗。这也提示在临床工作中,医生应该对获得pCR的患者及家属强调:pCR的患者不能等同于治愈,近期的反应好并不意味着长期生存,术后的辅助化疗和定期随访与非pCR患者一样重要。目前,对于该类人群复发转移的监测同非pCR患者一样进行常规影像学检查,而如循环肿瘤细胞这样的特殊检测手段对于pCR患者是否有其独特优势也是亟待解决的问题。
黄名威副主任医师(胃肠外科):胃癌D2根治术是一种安全可行的手术方式,但经新辅助化疗再行D2根治术是否安全可行仍备受质疑。虽然MAGIC 和FNCLCC/FFCD研究均未发现新辅助化疗组与对照组的手术并发症有显著性差异,但是MAGIC研究中大部分病例未行D2根治术,而FNCLCC/FFCD研究未能准确描述手术方式。目前唯一对比新辅助化疗后予以D2根治术(试验组)与直接手术(对照组)的Ⅲ期临床研究(EORTC 40954)中两组均有超过90%的病例行D2根治术,实验组的并发症率明显高于对照组,分别为27.1%与16.2%[13]。本组5例患者中有3例出现术后并发症(1例不全性肠梗阻,1例肺部感染及淋巴漏,1例颈静脉导管感染),提示新辅助化疗后行D2根治术的术后并发症不容忽视。尽管部分Ⅱ期的单组研究提示新辅助化疗后行D2根治术安全可行[14],但除非是随机研究,否则单组研究的并发症结果说服力较差,因为不同研究中纳入人群、化疗方案、化疗周期甚至是并发症的定义各不相同。
鉴于目前新辅助化疗及腹腔镜手术在进展期胃癌的开展情况,可以预见未来新辅助化疗再行腹腔镜手术的联合治疗必然会成为进展期胃癌的标准治疗方式。但是新辅助化疗后再行腹腔镜手术的有效性尚不明确,一旦新辅助化疗成为胃癌的标准治疗,腹腔镜手术的可行性、安全性及长期生存必须得到保证。虽然日本的学术会议上报道这样的治疗模式安全可行,但是新辅助化疗后行腹腔镜手术的应用并未在前瞻性的临床研究中得到验证。而且胃癌D2根治术的并发症率及死亡率分别达到20.9%和0.8%[15],那么新辅助化疗后的腹腔镜胃癌D2根治术的并发症率及死亡率不能高于上述的数值。未来的研究需要证实两个问题:1)新辅助化疗后开放手术与腹腔镜手术是否一样有效可行;2)新辅助化疗后行腹腔镜手术是否与未经过新辅助化疗的直接开放手术一样安全有效。
刘志辉主任医师(消化肿瘤内科):目前包括免疫治疗及靶向治疗等治疗方法均在胃癌的新辅助化疗中进行了有益的探索,特别是在乳腺癌治疗中广泛应用的抗人表皮生长因子受体-2(HER2)的曲妥珠单抗也应用于胃癌并取得可喜的效果。ToGA试验是首个靶向HER2的单抗药物用于晚期胃癌临床试验,研究结果表明曲妥珠单抗联合化疗优于单纯化疗,对于HER2阳性(IHC3+或IHC2+/FISH+)的晚期胃癌患者,曲妥珠单抗是一种新型有效、安全的治疗药物,也在个体化治疗层面开启了胃癌靶向治疗的新篇章。对于曲妥珠单抗在胃癌术前治疗中的应用,已有不少的病例报道表明术前化疗加用曲妥珠单抗取得不错的疗效,而且偶有获得pCR病例[16],甚至腹腔广泛种植转移的病例获得pCR[17]。对于曲妥珠单抗在胃癌围手术期的运用,两项Ⅱ期临床试验的结果确实令人振奋。2014年ASCO报道德国的HER-FLOT研究,该研究选取HER2阳性的进展期胃或胃食管结合部腺癌患者,给予术前4个周期的HER-FLOT方案(曲妥珠单抗+多西他赛+奥沙利铂+氟尿嘧啶),术后继续给予4个周期的HER-FLOT方案,随后给予9个周期曲妥珠单抗单药维持治疗,主要终点为pCR,次要终点为PFS、OS、R0切除率和安全性。58例患者纳入研究并接受术前4个疗程的HER-FLOT方案,术前治疗中未出现非预期的不良事件。结果其R0切除率为93%,5例患者发生吻合口漏,1例患者术后死亡,12例患者达到pCR,另有13例患者接近pCR。该联合方案达到主要研究终点,其中69%的患者完成了计划内的术前/术后联合治疗,研究者认为该研究是安全可靠的,目前生存数据还在进一步随访中[18]。同样在2015年ASCO报道西班牙的NeoHx研究最新结果,入组对象及研究设计同HER-FLOT研究,治疗方案为XELOX-T方案(曲妥珠单抗+卡培他滨+奥沙利铂),随后给予曲妥珠单抗12个周期维持治疗,主要终点:18个月无病生存期(disease free survival,DFS),次要终点为pCR、R0切除率、R0切除患者的DFS及安全性。36例患者入组该研究,其中2例死于手术并发症,24例接受辅助治疗,其中22例接受了曲妥珠单抗辅助治疗,7例因不良反应终止治疗。R0切除率为78%,在31例手术患者中,7例获得pCR。中位随访24.1个月,18个月DFS率为71%,24个月DFS率为60%,达到预期的主要研究终点。研究者认为该方案切实可行且疗效确切,但仍需要大型Ⅲ期随机对照研究证实。胃癌的发生发展复杂且早诊率低,多数患者发现时已处于进展期,目前靶向药物HER2联合化疗为胃癌带来了新的希望,当然作为分子肿瘤学的补充,靶向药物围手术期的使用价值仍需进一步评估。
4 小结
我国胃癌发病率和死亡率均高于全球平均水平,且胃癌死亡率居癌症死亡的第3位。局部进展期胃癌不可切除率较高,且术后复发率较高,严重影响远期疗效。胃癌的治疗需多学科协作的综合治疗,而胃癌的新辅助化疗值得推广和应用。胃癌NAC的最佳方案仍需积极探索,而长疗程NAC是值得研究的方向之一;经NAC后获得pCR不但提示近期反应好,也预示着长期生存;pCR的患者辅助化疗总体依从性非常差,值得临床医师深思如何改善;如何预测可以通过NAC获得pCR者,并且对该类人群的分子生物学深入研究并建立pCR预测模型;而NAC后再行D2根治术的安全有效性也同样值得验证,特别是新辅助化疗后行腹腔镜D2根治术;靶向药物特别是曲妥珠单抗在新辅助化疗中的疗效值得期待和探索。
参考文献
[1]Zhang XT.Treatment after pathological complete response following neoadjuvant therapy in gastric cancer[J].Chin J Gastrointest Surg,2014,17(2):185-187.[张小田.新辅助治疗完全缓解后的胃癌治疗何去何从[J].中华胃肠外科杂志,2014,17(2):185-187.]
[2]Wu AW,Shan F,Xue WC,et al.Clinicopathological observation of gastric cancer with pathological complete response following neoadjuvant chemotherapy[J].Chin J Gastrointest Surg,2011,14(8): 596-598.[武爱文,陕飞,薛卫成,等.胃癌新辅助化疗后原发灶病理完全缓解患者的病理学观察[J].中华胃肠外科杂志,2011,14(8): 596-598.]
[3]Bichev D,Treese C,von Winterfeld M,et al.High impact of histopathological remission for prognosis after perioperative chemotherapy with ecf and ecf-like regimens for gastric and gastroesophageal adenocarcinoma[J].Oncology,2015,89(2):95-102.
[4]Li ZY,Yuan P,Tang L,et al.Clinical characteristics of gastric cancer patients with pathological complete response following neoadjuvant chemotherapy: an analysis of 11 patients[J].Chinese Journal of Practical Surgery,2012,32(4):319-322.[李子禹,袁鹏,唐磊,等.胃癌新辅助化疗原发灶病理完全缓解11例临床特征分析[J].中国实用外科杂志,2012,32(4):319-322.]
[5]Cho H,Nakamura J,Asaumi Y,et al.Long-term survival outcomes of advanced gastric cancer patients who achieved a pathological complete response with neoadjuvant chemotherapy: a systematic review of the literature[J].Ann Surg Oncol,2014,22(3):787-792.
[6]Stocker G,Ott K,Henningsen N,et al.CyclinD1 and interleukin-1 receptor antagonist polymorphisms are associated with prognosis in neoadjuvant-treated gastric carcinoma[J].Eur J Cancer,2009,45 (18):3326-3335.
[7]Biffi R,Fazio N,Luca F,et al.Surgical outcome after docetaxelbased neoadjuvant chemotherapy in locally-advanced gastric cancer[J].World J Gastroenterol,2010,16(7):868-874.
[8]Baba H,Yamamoto M,Endo K,et al.Clinical efficacy of S-1 combined with cisplatin for advanced gastric cancer[J].Gastric Cancer,2003,6 suppl 1:45-49.
[9]Mori S,Kishimoto H,Tauchi K,et al.Histological complete response in advanced gastric cancer after 2 weeks of S-1 administration as neoadjuvant chemotherapy[J].Gastric Cancer,2006,9(2): 136-139.
[10]Yoshikawa T,Tanabe K,Nishikawa K,et al.Induction of a pathological complete response by four courses of neoadjuvant chemotherapy for gastric cancer: early results of the randomized phase II COMPASS trial[J].Ann Surg Oncol,2014,21(1):213-219.
[11]Fields RC,Strong VE,Gönen M,et al.Recurrence and survival after pathologic complete response to preoperative therapy followed by surgery for gastric or gastrooesophageal adenocarcinoma[J].Br J Cancer,2011,104(12):1840-1847.
[12]Cheedella NK,Suzuki A,Xiao L,et al.Association between clinical complete response and pathological complete response after preoperative chemoradiation in patients with gastroesophageal cancer: analysis in a large cohort[J].Ann Oncol,2013,24(5):1262-1266.
[13]Schuhmacher C,Gretschel S,Lordick F,et al.Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954[J].J Clin Oncol,2010,28(35):5210-5218.
[14]Yoshikawa T,Sasako M,Yamamoto S,et al.Phase II study of neoadjuvant chemotherapy and extended surgery for locally advanced gastric cancer[J].Br J Surg,2009,96(9):1015-1022.
[15]Sano T,Sasako M,Yamamoto S,et al.Gastric cancer surgery: morbidity and mortality results from a prospective randomized controlled trial comparing D2 and extended para-aortic lymphadenectomy-Japan Clinical Oncology Group study 9501[J].J Clin Oncol,2004,22(14):2767-2773.
[16]Wang J,Saukel GW,Garberoglio CA,et al.Pathological complete response after neoadjuvant chemotherapy with trastuzumab-containing regimen in gastric cancer: a case report[J].J Hematol Oncol,2010,3(26):4094-4099.
[17]Kiyozumi Y,Watanabe M,Iwatsuki M,et al.Pathological complete response in a case of HER2-positive gastric cancer with peritoneal dissemination treated with trastuzumab in combination with chemotherapy[J].International Cancer Conference Journal,2013,2(1): 51-55.
[18]Hofheinz R,Hegewisch-Becker S,Thuss-Patience PC,et al.HERFLOT: Trastuzumab in combination with FLOT as perioperative treatment for patients with HER2-positive locally advanced esophagogastric adenocarcinoma: A phase II trial of the AIO Gastric Cancer Study Group[J].J Clin Oncol,2014,32(15):suppl 4073.
(2015-12-28收稿)
(2016-03-02修回)
(编辑:邢颖校对:郑莉)
Pathological complete response of locally advanced gastric cancer after neoadjuvant chemotherapy: a report of five cases and a literature review
Liucheng WU,Mingwei HUANG,Yuzhou QIN,Jiansi CHEN,Xianwei MO,Haiming RU
Correspondence to: Yuzhou QIN;E-mail:qyz402@126.com
Department of Gastrointestinal Surgery,Affiliated Tumor Hospital of Guangxi Medical University,Nanning 530021,China
This work was supported by the Self-funded Research Project of Guangxi Zhuang Autonomous Region's Health and Family Planning Commission(No.Z2015716)
AbstractAdvanced gastric cancer without distant metastasis remains a potentially curable disease,but the prognosis is poor in this condition because of the high unresectability rate at presentation and the high recurrence rate after radical surgery.Administration of neoadjuvant chemotherapy has several potential benefits for advanced gastric cancer.This treatment can decrease tumor stage and improve R0 resection rate.Neoadjuvant chemotherapy has higher patient tolerability and a higher rate of chemotherapy completion than adjuvant chemotherapy.In vivo drug sensitivity tests can also be conducted to avoid unnecessary surgeries.Although high-intensity chemotherapy results in a high overall response rate,a few advanced gastric patients can achieve a pathologically complete response.However,no standardized treatment has been achieved.This article introduces five cases of advanced gastric cancer treated with neoadjuvant chemotherapy in the Affiliated Tumor Hospital of Guangxi Medical University.The five cases achieved a pathological complete response.This article also aims to explore the clinicopathological characteristics of these patients,proper cooperative treatment practices,and prognostic factors for the benefit of future patients.
Keywords:gastric cancer,neoadjuvant chemotherapy,prognosis
doi:10.3969/j.issn.1000-8179.2016.06.436
通信作者:覃宇周qyz402@126.com
作者简介
吴留成专业方向为胃肠肿瘤外科治疗。
E-mail:wuliucheng04@163.com


