基于磁性分离测定水样中的吲哚美辛
王 斌
核工业二〇三研究所,陕西 咸阳 712000
基于磁性分离测定水样中的吲哚美辛
王 斌
核工业二〇三研究所,陕西 咸阳 712000
免疫磁性微球(SMPPA)应用于水样中吲哚美辛的分离富集,并应用高效液相色谱法对吲哚美辛进行测定。在优化的淋洗和洗脱条件下,70%甲醇和10%甲醇分别作为洗脱液和淋洗液,其回收率能达到90%。选择了湖水、河水、自来水、污水厂进口水以及医院排水为真实样品进行测定,其中湖水、河水、自来水3种真实水样中未能检测出吲哚美辛,污水厂进口水以及医院排水中吲哚美辛的含量分别为0.762、35.4 ng/mL。对这5种水进行加标回收吲哚美辛,加标回收率为92.7%~113%,RSD为1.09%~7.73%。该方法具有简便、快速、特异性等特点,能有效地分离富集水样中的目标物,对其他目标物具有广泛的实际应用价值。
免疫磁性微球;吲哚美辛;抗体;水样
在过去数十年里,磁性纳米粒子因其性能优异和用途广泛激起了科研工作者们广泛的兴趣。Fe3O4纳米粒子的无毒性、强磁性、制备简单等优点得到了广泛的研究[1],已经在生物分离[2-3]、污染物去除[4-5]、药物传递[6-7]、医学诊断[8-9]及治疗[10-11]、分析化学[12-14]等各方面得到了应用。
吲哚美辛作为一种非甾体类消炎药广泛应用于关节炎及颈椎疼的治疗,其对人体有副作用并能在环境中长期稳定地残留。吲哚美辛的副作用影响在短时间内并不明显,但是,长时间积累以及生物富集后,会导致水生动物内分泌失调,生长抑制以及细胞中毒[15]。随着人们生活水平的提高,环境安全意识的不断加强,近年来,不断有报道称水中有毒有害的抗生素、消炎药、生长素等,含量超过国家相关标准。所以建立一种快速、特异性方法来检测水中的吲哚美辛非常必要。贺莉等[16]建立了酶联免疫吸附分析方法测定环境水样中的痕量吲哚美辛,此方法有很好的灵敏度和检出限,但是需要专业的酶联免疫吸附方法所需要的技术和设备,而且分析时间较长。研究拟以自制连接有吲哚美辛抗体的复合纳米免疫磁性微球(SMPPA)[17]为分离载体,分离富集水中的吲哚美辛,通过高效液相色谱法快速、高效、特异性测定水中的吲哚美辛。
1 实验部分
1.1 仪器与试剂
仪器:BS 124S电子天平,426 HPLC Pump高效液相色谱仪(美国),DZG-303A型纯水机,KJ-201C型台式震摇器,KJ-201C微量振荡器。试剂有纯度为99.9%吲哚美辛,甲醇(色谱纯),乙腈(色谱纯),其他未提及试剂均为分析纯。
1.2 洗脱条件
洗脱条件在优化条件过程当中非常重要,是获得良好回收率的保证。洗脱条件优化是将目标物用洗液洗脱以备检测,而且还应该考虑淋洗条件对免疫微球上固定抗体的影响。以50%~90%甲醇-水溶液作为洗脱溶液,选择最佳洗脱条件。向含有20 mg粒子的PV管中加入2 mL含有50 ng吲哚美辛的溶液,震荡吸附30 min后,以不同比例的甲醇-水溶液进行洗脱,收集洗脱液,用旋转蒸发仪干燥后以0.2 mL甲醇定容转移,以HPLC-UV测定回收率。
1.3 淋洗条件
为获得较高的萃取率,同样对淋洗条件进行了优化,淋洗条件需要在去除非特异性吸附的同时保持特异性吸附不受影响。实验以纯水,PBS(0.01 mmol/L,pH=7.4),甲醇-水(体积比为1∶9),甲醇-水(体积比为2∶8)分别作为淋洗液。向含有20 mg粒子的PV管中加入2 mL含有50 ng吲哚美辛的溶液,震荡吸附30 min后,分别用这4种淋洗液进行淋洗,淋洗后,用最佳洗脱条件洗脱,收集洗脱液经旋转蒸发仪旋干后以0.2 mL甲醇定容转移,用HPLC测定。作为对照,另一种未交联抗体的粒子,用BSA封阻活性位点,其他实验条件相同。
1.4 真实样品
5种水样分别采自湖水、河水、自来水、污水厂进口水、医院排水。加标回收实验,湖水、河水和自来水分别取100 mL清液加入1、2、5 mL 浓度分别为10、5、2 ng/mL的吲哚美辛溶液,总上样量为10 ng。污水厂进口水和医院排水分别加入0.2、0.5、1 mL的50 ng/mL吲哚美辛溶液。用优化的条件回收吲哚美辛,计算回收率。
1.5 HPLC条件
Alltech HPLC系统, UV-vis 201检测器,液相色谱柱为Alltech C18柱(4.6 mm×250 mm×5 μm),流动相为乙腈- 0.2%磷酸溶液(体积比为7∶3),流速为0.9 mL/min,检测波长为237 nm,柱温为室温。HPLC标准曲线的浓度范围为10~500 ng/mL。其线性方程为y=25.493x+247.6,r=0.999 9。
1.6 方法检出限
将10 ng的吲哚美辛分别稀释于50、100、150、200、500 mL的纯水中,在优化的条件下测定回收率来评价方法的检出限。
1.7 方法特异性
抗体的特异性决定了方法的特异性。抗体的特异性已经在相关文献中有详细研究[16],不再在此累赘。
2 结果与讨论
2.1 洗脱条件优化
抗体-抗原的结合力容易受到环境的影响,在强酸性、高温和强碱性环境中,抗体将会不可逆失活而失去结合抗原的能力,弱酸性、弱碱性等缓冲溶液和有机溶剂也可以破坏抗体-抗原的相互作用,达到洗脱目标物的目的。考虑到吲哚美辛在水溶液中溶解度比较小而在甲醇中溶解度大,选用不同浓度的甲醇溶液作为洗脱条件,考察了甲醇含量为50%~90%的水溶液作为洗脱液的洗脱效果,见图1。
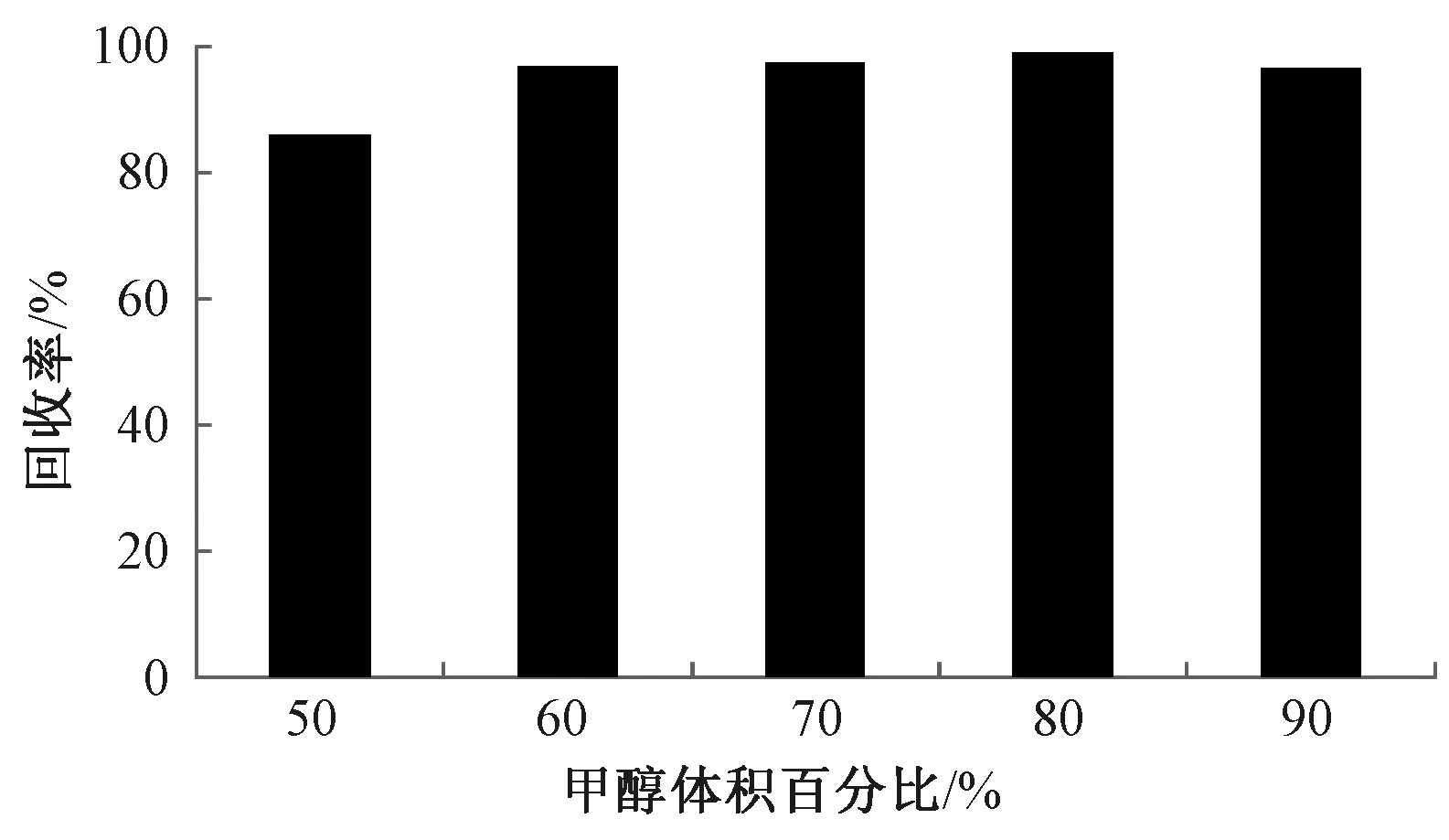
图1 洗脱条件优化
如图1所示,用3 mL 50%甲醇洗脱,吲哚美辛的回收率仅为86%,当甲醇含量大于60%时,3 mL 洗脱液可以使回收率达到96%以上,为了尽量将粒子上的吲哚美辛完全洗脱且尽量减少对抗体的影响,研究选用70%甲醇作为洗脱条件。
2.2 淋洗条件的优化
粒子表面修饰了抗体,抗体对抗原为特异性吸附,而复合磁性粒子表面也存在非特异性的吸附,非特异性的存在将杂质带入测量中,直接影响后续测定,必须采用合适途径去除非特异性吸附,达到富集纯化目的,选取20%甲醇、10%甲醇、PBS、纯水为淋洗条件,其淋洗效果如图2所示。
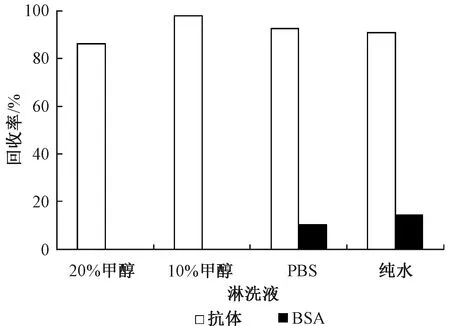
图2 优化淋洗条件
如图2所示,选用PBS和纯水为淋洗液时,吲哚美辛的回收率在90%左右,大约10%的吲哚美辛因为非特异性吸附被保留。采用10%甲醇溶液淋洗,吲哚美辛回收率达到95%以上,当甲醇含量达到20%时,回收率降低至86%。说明20%的甲醇对特异性吸附造成了影响。采用10%、20%的甲醇溶液作为淋洗液,不存在非特异性吸附现象。所以我们选用10%甲醇作为淋洗液,它能够完全除去非特异性吸附,且不影响复合磁性粒子吸附目标物。
2.3 环境水样测定
5种水样收集后放置于室温沉淀24 h以上,除去沉淀,取上层清液进行实验。取湖水、河水以及自来水样品各100 mL在优化的条件下直接测试,3个样品均未能检测到吲哚美辛,对其进行加标回收,分别向100 mL真实样品中加入1、2、5 mL浓度分别为10、5、2 ng/mL的吲哚美辛溶液,总上样量为10 ng,加标后水样中吲哚美辛浓度为0.1 ng/mL。取污水厂进口水和医院排水10 mL进行同样的测试,检出量为76.2、35.4 ng,即吲哚美辛含量分别为0.762、3.54 ng/mL。分别向污水厂进口水和医院排水加标0.2、0.5、1 mL 50 ng/mL吲哚美辛标准溶液,测试回收率。5种样品的测试结果及回收情况如表1所示,其平均回收率为92.7%~113%,RSD为1.09%~7.73%。满足测试要求。说明所制备SMPPA成功萃取了水样中的吲哚美辛,可以在实际检测中应用。
2.4 方法的检出限
不同浓度吲哚美辛的回收率实验结果如表2所示,当水中吲哚美辛浓度为0.2、0.1 ng/mL,吲哚美辛的回收率介于90%~110%之间,当水中吲哚美辛的浓度为0.05 ng/mL时,回收率降低至78.68%,当吲哚美辛的浓度降到0.02 ng/mL时其回收率仅仅为62.45%。主要是由于吲哚美辛在水中和复合粒子表面的抗体上存在一个动态平衡,浓度越低分配在水中的吲哚美辛就越多,从而使回收率偏低。由回收率的情况来看,这种方法的检出限可以达到0.1 ng/L的级别。
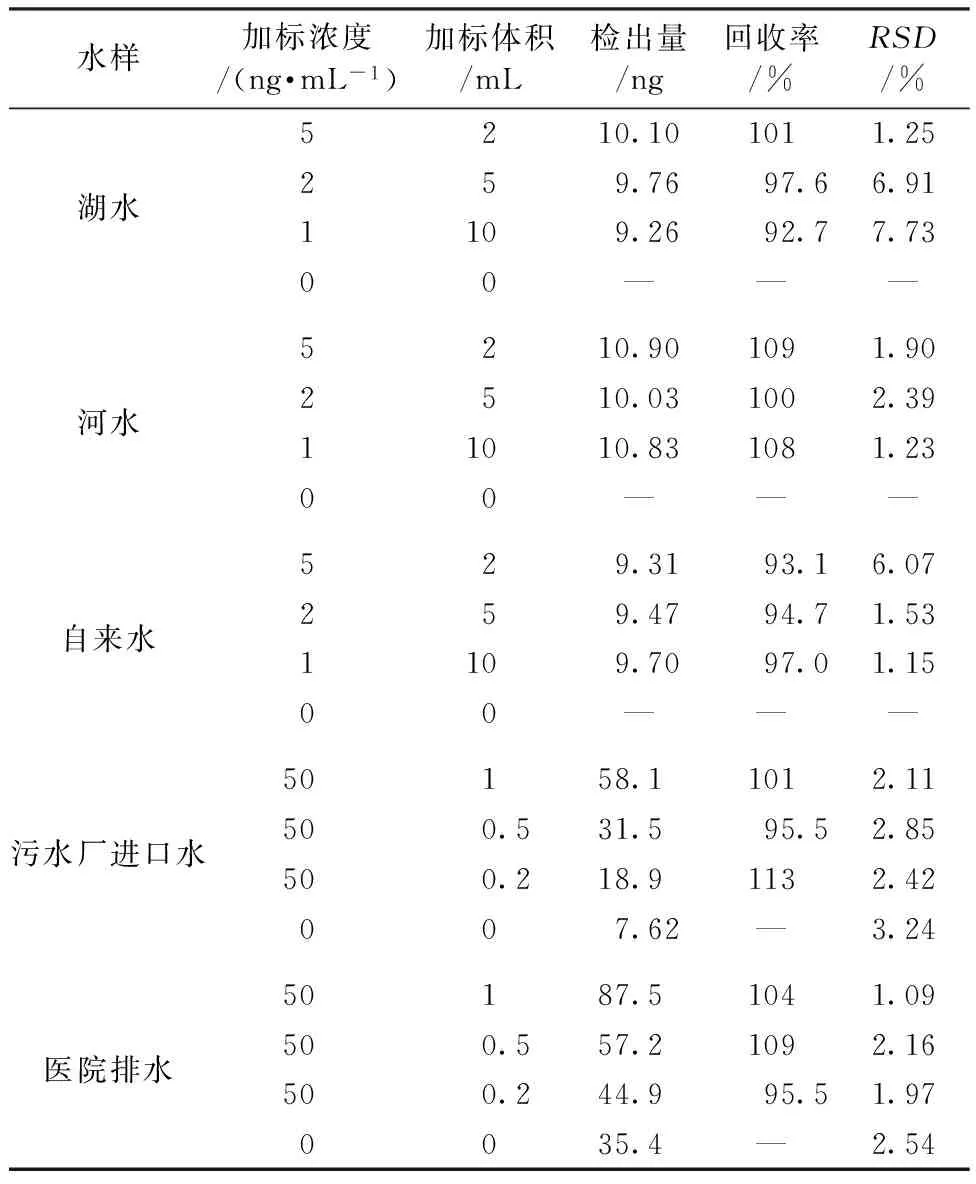
表1 真实样品中萃取吲哚美辛
注:“—”表示未检出。
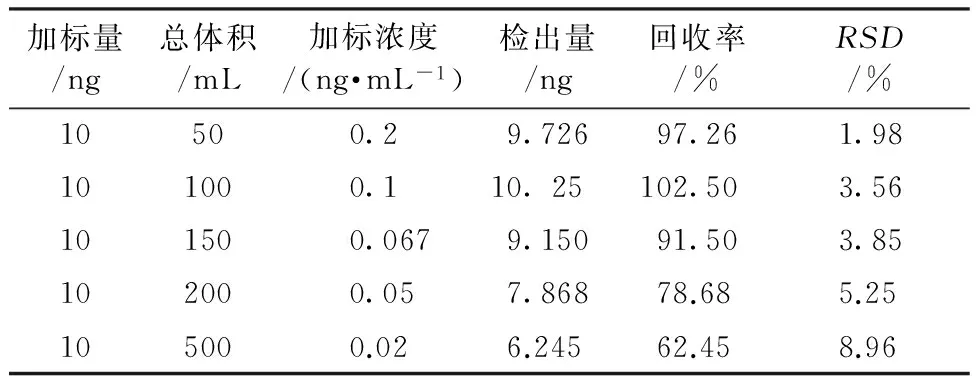
表2 不同浓度吲哚美辛的回收率
3 结论
SMMPA用来萃取水中的吲哚美辛,在加标回收实验,能够很好地回收吲哚美辛,在优化的淋洗和洗脱条件下,5种水样的加标回收率为92.7%~113%,RSD为1.09%~7.73%,满足分析要求,方法的检出限优于0.1 ng/L。这种方法能够特异性的、快速、简单分离富集水中的吲哚美辛,作为一种分离富集工具具有实际意义,并有普遍应用性。
[1] GUBIN S P.Magnetic Nanoparticles[M].Weinheim:Wiley-VCH,2009.
[2] HERR J K,SMITH J E,MEDLEY C D,et al.Aptamer-conjugated nanoparticles for selective collection and deterction of cancer cells[J]. Anal Chem,2006,78(9):2 918-2 927.
[3] ABUDIAB T,BEITLE R R.Preparation of magnetic immobilized metal affinity separation media and its use in the isolation of proteins[J].J Chromatogr A,1998,795(2):211-217.
[4] RAJESH C,SUKUMARAN V.Cyclodextrin-Functionalized Fe3O4·TiO2:reusable,magnetic nanoparticles for photocatalytic degradation of endocrine-disrupting chemicals in water supplies[J].ACS Nano,2013,7(5):4 093-4 104.
[5] GIULIANA M,ALEX A,ENZO M,et al.Novel magnetite nanoparticles coated with waste-sourced biobased substances as sustainable and renewable adsorbing materials[J].ACS Sustainable Chem Eng,2014,2(6):1 518-1 524.
[6] AVILES M O,EBNER A D,RITTER J A.In vitro study of magnetic particle seeding for implant-assisted-magnetic drug targeting: Seed and magnetic drug carrier particle capture[J].J Magn Magn Mater,2009,321(10):1 586-1 590.
[7] CHERTOK B,MPFFAT BA,DAVID A E,et al.Iron oxide nanoparticles as a drug delivery vehicle for MRI monitored magnetic targeting of brain tumors[J].BioMaterials,2008,29(4):487-496.
[8] XU C J,XU K M,GU H W,et al.Dopamine as a robust anchor to immobilize functional molecules on the iron oxide of magnetic nanoparticles[J].J Am Chem Soc,2004,126(32):9 938-9 939.
[9] WANG S X,ZHOU Y,SUN W T.Preparation and characterization of antifouling thermosensitive magnetic nanpaticles for applications in biomedicine[J].Mat SciEng C,2009,29(4):1 196-1 200.
[10] KIM J,PARK S,LEE J E,et al.Designed fabrication of multifunctional gold nanoshells and their application to magnetic resonance imaging and photothermal therapy[J].Angew Chem Int Ed,2006,45(46):7 754-7 758.
[11] MCCARTHY J R,WEISSLEDER P.Multifunctional magnetic nanoparticles for targeted imaging and therapy[J].Adv Drug Deliver Rev,2008,60(11):1 241-1 251.
[12] SULEIMAN J S,Hu B,Peng H Y,et al.Separation/preconcentration of trace amounts of Cr, Cu and Pb in environmental samples by magnetic solid-phase extraction with bismuthiol-Ⅱ-immobilized magnetic nanoparticles and their determination by ICP-OES[J].Talanta,2009,77(5):1 579-1 583.
[13] BOWIE A R,TIWNSEND A T,LANNUZEL D,et al.Modern sampling and analytical methods for the determination of trace marine particulate material using magnetic sector inductiverly coupled plasma-mass spectrometry[J].Anal Chim Acta,2010,676(1-2):15-27.
[14] WANG J L,MUNIR A,ZHU Z Z,et al. Magnetic nanopariticle enhanced surface plasmon resonance sensing and its application for the ultrasensitive detercton of magnetic nanoparticle enriched small molecules[J].Anal Chem,2010,82(16):6 782-6 789.
[15] LI DW,WEI S,YANG H,et al.A sensitive immunochromatographic assay using colloidal gold-antibody probe for rapid detection of pharmaceutical indomeithacin in water samples[J].Biosens Bioelctron,2009,24(7):2 277-2 280.
[16] 贺莉,霍松敏,杨红,等.酶联免疫吸附分析法测定环境水样中痕量药物吲哚美辛[J].化学研究与应用,2008,20(8):984-987.
[17] 王斌.免疫磁性纳米微球的制备与表征[J].化学通报,2015,78(9):847-850.
Detection of Indomethacin in Water Sample Based on Magnetic Separation
WANG Bin
No.203 Research Institute of Nuclear Industry,Xianyang 712000,China
Immunonogic magnetic microsphere was used to separate indomethac(IDM) from water sample. Under the optimized conditions, 70% of methanol and 10% of methanol were selected as eluant and washing solution respectively. Lake water, river water, tap water, imported water to sewage plant, drainage of hospital were choose as real sample. Indomethacin was not detected in lake water, river water and tap water,but 0.762 ng/mL and 35.4ng/mL in imported water to sewage plant and drainage of hospital. Recovery tests on this five kinds of water sample. The recovery rate of five kinds of spiked water samples was found to be 92.7%-113% with the relative standard deviations (RSD) of 1.09%-7.73%. This method is simple, fast and specificity for the separation and enrichment of target analyte(indomycin) from water samples. This separation technology would be applied for other compounds.
immunonogic magnetic microsphere;indomethacin;antibody;water sample
2015-12-02;
2016-02-17
王 斌(1985-),男,湖南涟源人,硕士,工程师。
X832.02
A
1002-6002(2016)05- 0116- 04
10.19316/j.issn.1002-6002.2016.05.22

