CASP1在非小细胞肺癌组织中的表达与生物学意义*
吴敬,林佳,张艳艳,裴娜,张雪梅
(华北理工大学生命科学学院,河北唐山063000)
CASP1在非小细胞肺癌组织中的表达与生物学意义*
吴敬,林佳,张艳艳,裴娜,张雪梅
(华北理工大学生命科学学院,河北唐山063000)
摘要:目的探讨含半胱氨酸的天冬氨酸蛋白水解酶caspase-1(CASP1)表达在非小细胞肺癌(NSCLC)发生、发展中的作用。方法收集华北理工大学附属医院2010~2014年确诊为NSCLC患者的肺癌及癌旁组织25对。采用免疫组织化学染色方法,比较CASP1基因在肺癌和癌旁组织以及不同病理类型及分化程度肺癌组织中的表达差异。使用正常和肿瘤组织表达数据库(GENT)提供的数据,分析CASP1在肺癌组织及正常组织中的表达差异。结果免疫组织化学结果显示,CASP1在肺癌组织中的表达量(0.021±0.004)低于相应的癌旁组织(0.083±0.008),差异有统计学意义(t=-8.554,P=0.000)。进一步对GENT数据库进行分析,发现在U133plus2提供的数据中,CASP1在肺正常组织中的表达量为(1137±42.17),高于其在肺肿瘤组织中的表达量(844± 19.35),差异有统计学意义(Z=-7.037,P=0.000)。同样的结果出现在U113A提供的数据中,CASP1在肺正常组织的表达(467±11.19)高于其在肺肿瘤组织(423±8.44)中的表达,差异有统计学意义(Z=-2.898,P=0.004)。不同分化程度肺癌组织的免疫组织化学结果显示,CASP1的表达水平在高分化(0.027±0.006)、中分化(0.017±0.003)、低分化(0.007±0.002)肺癌组织中的差异有统计学意义(F=6.653,P=0.006)。组间比较显示,CASP1在高分化组织中的表达高于其在低分化肺癌组织中的表达,差异有统计学意义(P=0.001),但与中分化组织中的表达比较无统计学意义(P=0.056)。笔者未发现CASP1在肺腺癌(0.019±0.003)和鳞癌(0.012± 0.004)中表达差异有统计学意义(t=1.382,P=0.180)。结论CASP1在非小细胞肺癌组织中表达下调,表明其在NSCLC的发生、发展过程中可能发挥重要作用。
关键词:Caspase-1;非小细胞肺癌;免疫组织化学;细胞凋亡
肺癌是严重影响人类生存质量的重大疾病之一。在全球范围内,肺癌的发病率呈逐年上升趋势,位于全部肿瘤死因的首位[1]。肺癌分非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)两种。其中NSCLC约占全部肺癌发病的85%,而且70%~80%的患者发现时已处于中晚期,5年生存率极低。
Caspase(cysteinyl aspartate-specific proteases,CASP)是一组半胱氨酸天冬氨酸特异的蛋白水解酶。Caspase-1(cysteinyl aspartate-specific proteases-1,CASP1)作为最早发现的CASP家族成员之一,不仅参与细胞因子介导的炎症反应,还与细胞凋亡过程有着密不可分的关系。研究发现,CASP1与多种疾病有关,例如:CASP1作为炎症趋化因子在2型糖尿病发生过程中起着重要作用,可能成为治疗2型糖尿病的作用靶点[2];CASP1在多种肿瘤细胞中(如结肠癌、前列腺癌和肝癌)表达降低[3-5],与肿瘤的发生、发展具有相关性。本研究拟通过比较肺癌与癌旁组织中CASP1的表达差异,探讨CASP1在肺癌发病过程中的作用。
1 资料与方法
1.1标本收集
研究标本选取自华北理工大学附属医院2010~2014年期间病理存档的石蜡标本,非小细胞肺癌组织标本和距肿瘤边缘≥5 cm的癌旁组织各25例。非小细胞肺癌组中,男性13例,女性12例,年龄37~70岁,平均年龄57.1岁。经病理学诊断,9例鳞癌和16例腺癌。低分化7例,中分化10例,高分化8例。所有患者术前均未接受放疗或化疗。
1.2主要试剂
兔抗人CASP1多克隆抗体购自美国Cell Signaling公司,辣根过氧化酶标记的山羊抗兔免疫球蛋白G和免疫组织化学二氨基联苯胺(Diaminobenzidine,DAB)显色试剂购自北京中杉金桥生物技术公司。
1.3实验方法
石蜡标本制成4μm厚的切片,免疫组织化学程序按照DAB显色试剂盒说明书进行。每批实验均设阴性对照,以磷酸缓冲盐溶液代替一抗。组织病理切片经二甲苯脱蜡、梯度酒精水化后,滴加3%过氧化氢H2O2进行高压抗原修复;加入CASP1一抗(1∶80稀释),4℃过夜孵育;37℃复温后,加二抗37℃孵育1 h后,DAB显色。经苏木素复染,乙醇脱水,二甲苯透明和中性树胶封片后,使用Olympus BX53型显微镜进行图像采集。
1.4结果判定
于每张切片随机选取3个高倍视野(×400),用Image-Pro Plus 7.0分析软件计算每个标本的平均积分光密度(累积积分光密度/面积),平均光密度值表示免疫组织化学强度,反映CASP1在组织中的表达水平。
1.5统计学方法
采用SPSS 16.0统计软件进行数据分析,使用正常和肿瘤组织基因表达数据库(gene expression database of normal and tumor tissues,GENT),分析Affymetrix U133A和U133plus2两个平台提供的CASP1表达数据[6]。计量资料用均数±标准(±s)表示,使用配对t检验比较CASP1在肺癌组织与癌旁组织中的表达差异;使用成组设计t检验进行两组样本之间的分析;使用方差分析进行多组样本间的统计分析,组间比较用LSD-t检验。GENT表达数据分析采用两独立样本秩和检验(Mann-Whitney U检验),P<0.05为差异有统计学意义。
2 结果
2.1CASP1在肺癌组织和癌旁组织中的表达
免疫组织化学结果显示,CASP1表达于细胞质中,呈棕黄色和棕褐色的颗粒样物质,见图1。CASP1在肺癌组织中呈弱阳性表达,其相对表达量为(0.021±0.004)。CASP1在肺癌旁组织中的表达量为(0.083±0.008),高于其在肺癌组织中的表达,差异具有统计学意义(t=-8.554,P=0.000)。
笔者随后对GENT数据库进行分析,发现在U133plus2提供的数据中,CASP1在肺正常组织中的表达量为(1 137±42.17),高于其在肺肿瘤组织中的表达量(844±19.35),差异有统计学意义(Z= -7.037,P=0.000)。同样的结果出现在U113A提供的数据中,CASP1在肺正常组织的表达量(467± 11.19),高于其在肺肿瘤组织(423±8.44)中的表达,差异有统计学意义(Z=-2.898,P=0.004)。
2.2CASP1表达水平与临床病理特征之间的关系
通过对不同分化程度肺癌组织的免疫组织化学结果进行比较,发现CASP1的表达水平在高分化(0.027±0.006)、中分化(0.017±0.003)、低分化(0.007±0.002)肺癌组织中的比较,差异有统计学意义(F=6.653,P=0.006)。组间比较显示,CASP1在高分化组织中的表达高于其在低分化肺癌组织中的表达,差异有统计学意义(P=0.001),但与中分化组织中的表达,差异无统计学意义(P=0.056),见图2。对不同病理类型肺癌组织中的CASP1表达水平进行分析,笔者发现在肺腺癌和鳞癌组织中CASP1的表达水平分别为(0.019±0.003)和(0.012±0.004),差异无统计学意义(t=1.382,P=0.180)。
3 讨论
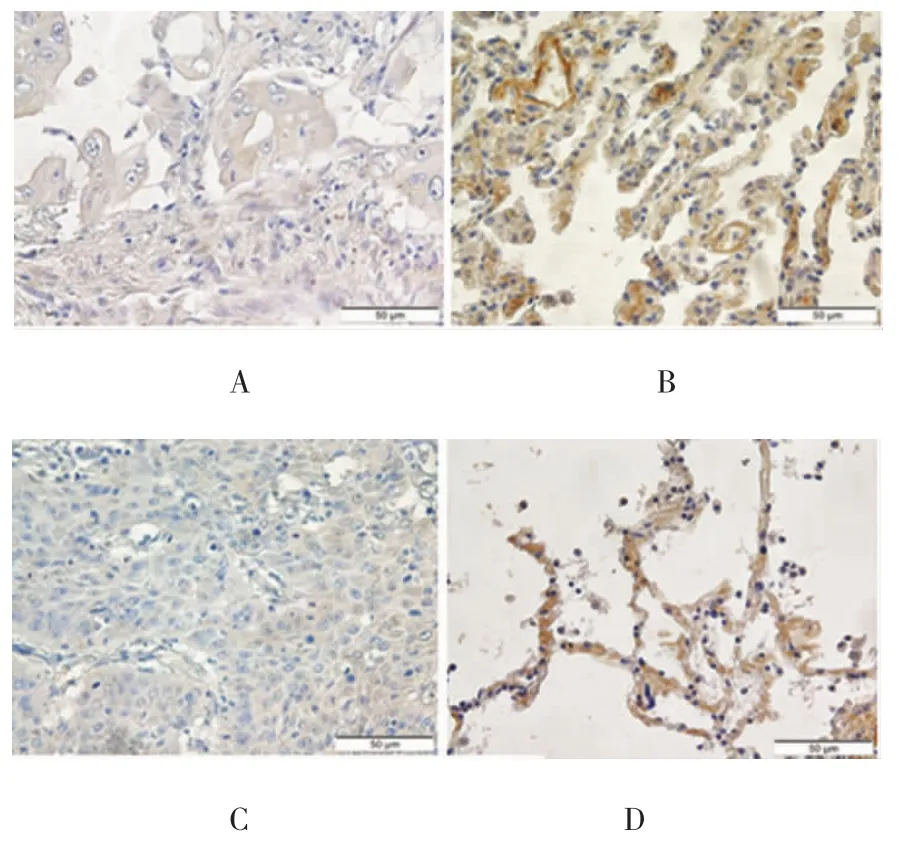
图1 CASP1在NSCLC患者肺组织中的表达,阳性表达定位于胞浆(×400)
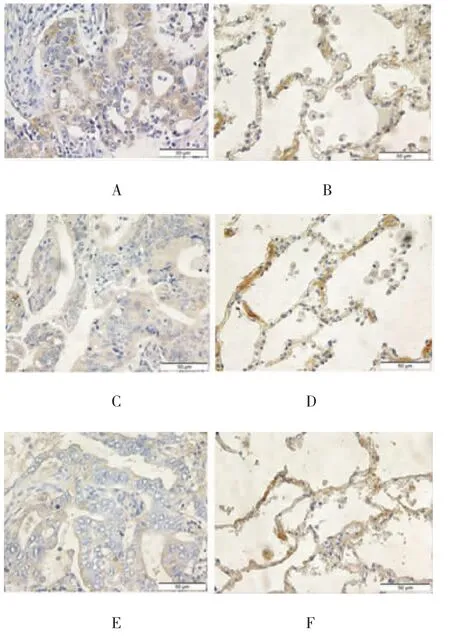
图2 CASP1在不同病理分级NSCLC组织中的表达(×400)
CASP1定位于11q22,属于炎症型半胱氨酸蛋白水解酶家族成员,经活化后可激活IL-1β和IL-18等一系列炎症因子,在炎症反应中起核心调控作用[7-9]。此外,CASP1还参与细胞凋亡过程。在神经元细胞中,CASP1通过激活Caspase-6而引发细胞凋亡[10]。动物实验表明,CASP1在成纤维细胞Rat-1中的过表达可导致细胞发生程序性死亡,而且该过程可被CASP1抑制剂所逆转[11]。在CASP1敲除的嗜中性粒细胞也出现自发性细胞凋亡延迟的现象[12]。CASP1参与的炎症反应与细胞凋亡能有效提高机体抵抗外源性和内源性破坏的能力,达到保护宿主的目的[13]。
笔者研究发现,CASP1在非小细胞肺癌组织中表达降低可能和CASP1在细胞炎症反应和细胞凋亡中的重要作用有关。与笔者研究结果类似,一项卵巢癌的研究发现,CASP1在癌细胞中表达下降,而且过表达CASP1可引起癌细胞凋亡[14]。CASP1表达水平的下降也见于结肠癌和淋巴瘤细胞中[5,15]。此外,笔者还发现,CASP1在肺癌不同分化程度组织中表达量有显著差异。高分化肺癌组织中CASP1表达量显著高于低分化程度肺癌,提示CASP1下调与肺癌的恶化程度有关。
通常情况下CASP1以无活性的酶原存在于细胞中。CASP1的活性复合物叫做“炎症小体”,由NLRP1、Caspase-5相互作用,并通过ASC分子与CASP1作用形成的高分子量蛋白复合体[16]。在某些创伤刺激或急性炎症下,各种免疫细胞被募集到症灶,分泌大量的细胞因子(如白细胞介素IL-1β和IL-18),构成炎症微环境,对机体起到保护作用。但如果靶器官受到长期低强度刺激,会导致某些细胞原癌基因激活,使正常细胞开始向恶性细胞转化[17],增加肿瘤的发病风险[18-19]。目前认为,CASP1对肿瘤的调控作用在两个方面[20]。一方面,CASP1介导IL-1β的释放通过调控外周组织和肿瘤微环境中髓源性抑制细胞的发育,从而对肿瘤的发生、发展起到关键的调控作用[21]。另一方面,CASP1通过激活机体的获得性免疫或诱导肿瘤细胞的凋亡而抑制肿瘤的生长。以无活性酶原形式存在于细胞中的CASP1,被大分子ASC二聚体激活[22],进一步催化caspase-7和其他作用底物的蛋白水解活性[23],引发细胞凋亡[24]。在肠炎相关的结肠癌模型中,激活的CASP1介导IL-18的释放,有效保护上皮细胞的完整,可以防止肠炎和结肠癌的发生[25-26]。肿瘤细胞释放危险信号,激活NLRP3炎症小体和释放IL-1β,诱发IL-1β依赖性的获得性免疫,抑制肿瘤的生长[27]。这些表明CASP1发挥着重要的抗肿瘤作用。
正常情况下机体内的细胞损伤-修复和增殖-凋亡处于动态的平衡状态,当平衡一旦被破坏就可能导致机体正常组织发生损伤,从而引起肿瘤的发生。笔者的研究证实CASP1在非小细胞肺癌发生、发展中的作用,为进一步证实细胞凋亡及炎症反应在肺癌发生中的重要作用提供了理论基础。
参考文献:
[1]SIEGEL R,MA J,ZOU Z,et al. Cancer statistics,2014[J]. CA Cancer J Clin,2014,64(1):9-29.
[2]张华,石志红,曹平. Caspase-1和IL-1β在2型糖尿病发生过程中的作用机制[J].中国现代医学杂志,2013,23(12):31-33.
[3]WINTER R N,KRAMER A,BORKOWSKI A,et al. Loss of caspase-1 and caspase-3 protein expression in human prostate cancer[J]. Cancer Res,2001,61(3):1227-1232.
[4]FUJIKAWA K,SHIRAKI K,SUGIMOTO K,et al. Reduced expression of ICE/caspase1 and CPP32/caspase-3 in human hepatocellular carcinoma[J]. Anticancer Res,2000,20(3B):1927-1932.
[5]JARRY A,VALLETTE G,CASSAGNAU E,et al. Interleukin 1 and interleukin 1 beta converting enzyme(caspase 1)expression in the human colonic epithelial barrier. Caspase 1 downregulation in colon cancer[J]. Gut,1999,45(2):246-251.
[6]SHIN G,KANG TW,YANG S,et al. GENT:gene expression database of normal and tumor tissues[J]. Cancer Inform,2011,10:149-157.
[7]CHOWDHURY I,THARAKAN B,BHAT G K. Caspases-an update[J]. Comp Biochem Physiol B Biochem Mol Biol,2008,151 (1):10-27.
[8]NADIRI A,WOLINSKI M K,SALEH M. The inflammatory caspases:key players in the host response to pathogenic invasion and sepsis[J]. J Immunol,2006,177(7):4239-4245.
[9]NICHOLSON D W. Caspase structure,proteolytic substrates,and function during apoptotic cell death[J]. Cell Death Differ,1999,6(11):1028-1042.
[10]GUO H,PETRIN D,ZHANG Y,et al. Caspase-1 activation of caspase-6 in human apoptotic neurons[J]. Cell Death Differ,2006,13(2):285-292.
[11]YUAN J,SHAHAM S,LEDOUX S,et al. The C. elegans cell death gene ced-3 encodes a protein similar to mammalian interleukin-1 beta-converting enzyme[J]. Cell,1993,75(4):641-652.
[12]ROWE S J,ALLEN L,RIDGER V C,et al. Caspase-1-deficient mice have delayed neutrophil apoptosis and a prolonged inflammatory response to lipopolysaccharide-induced acute lung injury[J]. J Immunol,2002,169(11):6401-6407.
[13]BERGSBAKEN T,FINK S L,COOKSON B T. Pyroptosis:host cell death and inflammation[J]. Nat Rev Microbiol,2009,7(2):99-109.
[14]FENG Q,LI P,SALAMANCE C,et al. Caspase-1alpha is down-regulated in human ovarian cancer cells and the overexpression of caspase-1alpha induces apoptosis[J]. Cancer Res,2005,65(19):8591-8596.
[15]江兴林,左云飞.细胞凋亡相关的斑点样蛋白与半胱氨酸蛋白酶-1在淋巴瘤中的表达及临床意义[J].中国医药导报,2011,8(14):22-24.
[16]MARTINON F,BURNS K,TSCHOPP J. The inflammasome:a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta[J]. Mol Cell,2002,10(2):417-426.
[17]LI N,GRIVENNIKOV S I,KARIN M. The unholy trinity:inflammation,cytokines,and STAT3 shape the cancer microenvironment[J]. Cancer cell,2011,19(4):429-431.
[18]GUREL B,LUCIA M S,THOMPSON I M,et al. Chronic inflammation in benign prostate tissue is associated withhigh-grade prostate cancer in the placebo arm of the prostate cancer prevention trial[J]. Cancer Epidemiol Biomarkers Prev,2014,23(5):847-856.
[19]KANDA Y,KAWAGUCHI T,KURAMITSU Y,et al. Fascin regulates chronic inflammation-related human colon carcinogenesis by inhibiting cell anoikis[J]. Proteomics,2014,14(9):1031-1041.
[20]ZITVOGEL L,KEPP O,GALLUZZI L,et al. Inflammasomes in carcinogenesis and anticancer immune responses[J]. Nat Immunol,2012,13(4):343-351.
[21]陈勇军,郑微,牛志远,等. Caspase-1影响乳腺癌介导的生长及其对髓源性抑制细胞发育的调控作用[J].中国免疫学杂志,2013,29(11):1128-1134.
[22]FEMANDES-ALNEMRI T,WU J,YU J W,et al. The pyroptosome:a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation[J]. Cell Death Differ,2007,14(9):1590-1604.
[23]LAMKANFI M,KANNEGANTI T D,VAN DAMME P,et al. Targeted peptidecentric proteomics reveals caspase-7 as a substrate of the caspase-1 inflammasomes[J]. Mol Cell Proteomics,2008,7(12):2350-2363.
[24]KROEMER G,GALLUZZI L,VANDENABEELE P,et al. Classification of cell death:recommendations of the nomenclature committee on cell death 2009[J]. Cell Death Differ,2009,16(1):3-11.
[25]ZAKI M H,BOYD K L,VOGEL P,et al. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J]. Immunity,2010,32(3):379-391.
[26]DUPAUL-CHICOINE J,YERETSSIAN G,DOIRON K,et al. Control of intestinal homeostasis,colitis,and colitis-associated colorectal cancer by the inflammatory caspases[J]. Immunity,2010,32(3):367-378.
[27]GHIRINGHELLI F,APETOH L,TESNIERE A,et al. Activation of the NLRP3 inflammasome in dendritic cells induces IL-1beta-dependent adaptive immunity against tumors[J]. Nat Med,2009,15(10):1170-1178.
(张蕾编辑)
论著
Significance of CASP1 protein expression in non-small cell lung cancer*
Jing Wu,Jia Lin,Yan-yan Zhang,Na Pei,Xue-mei Zhang
(College of Life Science,North China University of Science and Technology,Tangshan,Hebei 063000,China)
Abstract:Objective To explore the role of caspase-1(CASP1)in the development of non-small cell lung cancer (NSCLC). Methods Lung tumor and adjacent normal samples from 25 NSCLC patients were collected at the Affiliated Hospital of North China University of Science and Technology from 2010 to 2014. CASP1 protein expression was analyzed by immunohistochemistry. Gene expression database of normal and tumor tissues(GENT)was used to analyze the difference of CASP1 expression between lung cancer and normal lung tissues. Results Immunohistochemistry analysis revealed that CASP1 protein expression in the lung tumor tissues(0.021±0.004)was lower than that in the adjacent tissues[(0.083±0.008),t = -8.554,P = 0.000]. Analysis of the CASP1 data from GENT revealed thatbook=41,ebook=46CASP1 expression in the lung cancer tissues was significantly lower than that in the normal tissues in both U133plus2(Z = -7.037,P = 0.000)and U133A platforms(Z = -2.898,P = 0.004). The protein expression of CASP1 in the well-differentiated lung cancer(0.027±0.006)was higher than that in the poorly-differentiated lung cancer[(0.007±0.002),P =0.001],but not significantly different from that in the moderately-differentiated lung cancer[(0.017±0.003),P = 0.056]. There was no significant difference in the CASP1 expression between the lung adenocarcinoma(0.019±0.003)and squamous cell carcinoma[(0.012±0.004),t = 1.382,P = 0.180]. Conclusions CASP1 expression is down-regulated in non-small cell lung cancer tissues,which indicates that CASP1 protein expression may contribute to the development of NSCLC.
Keywords:caspase-1;non-small cell lung cancer;immunohistochemistry;apoptosis
中图分类号:R734.2
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.10.009
文章编号:1005-8982(2016)10-0040-05
收稿日期:2015-11-17
*基金项目:河北省高等学校创新团队领军人才培育计划(No:LJRC001)
[通信作者]张雪梅,E-mail:jyxuemei@aliyun.com

