一种新型鸭呼肠孤病毒SYBR Green II荧光定量PCR方法的建立
丁明洋,戚伟强,陈宗艳,朱 杰,吴巧梅,缪秋红,李传峰,吴 润,刘光清
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 甘肃农业大学动物医学院,兰州 730070)
一种新型鸭呼肠孤病毒SYBR Green II荧光定量PCR方法的建立
丁明洋1,2,戚伟强1,2,陈宗艳1,朱 杰1,吴巧梅1,缪秋红1,李传峰1,吴 润2,刘光清1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 甘肃农业大学动物医学院,兰州 730070)
摘 要:该研究旨在建立一种快速、敏感和特异性检测新型鸭呼肠孤病毒(Novel duck reovirus,NDRV)的荧光定量PCR诊断方法。本实验以感染新型鸭呼肠孤病毒的鸭组织RNA提取物为模板,根据GenBank数据库中呼肠孤病毒S1基因全序列,设计合成了一对特异性引物,PCR扩增基因片段,将其克隆至pET-30a载体,重组质粒测序并进行同源性分析;以阳性质粒为模板,建立SYBR Green II荧光定量PCR检测方法,并进行敏感性和特异性检测。经测序证实扩增片段与预期目的片段相符,所建立的SYBR Green II荧光定量PCR检测S1的反应在101~108copies/uL之间具有良好的线性关系,反应的检出下限为10 copies/μL,而H5型禽流感病毒、H9型禽流感病毒、鸡传染性支气管炎病毒、C型鸭肝炎病毒、新城疫病毒、鹅细小病毒、鸭瘟病毒等病毒的检测为阴性,表明该方法敏感、特异。本研究成功建立了SYBR Green II荧光定量PCR检测新型鸭呼肠孤病毒的方法,为新型鸭呼肠孤病毒致病机制和机体免疫保护机制的研究提供了技术平台。
关键词:新型鸭呼肠孤病毒;S1;荧光定量PCR;熔解曲线;检测
禽呼肠孤病毒(Avian reovirus,ARV)属于呼肠孤病毒科,正呼肠孤病毒属成员。ARV相继从患有病毒性关节炎/腱鞘炎、心肌炎、矮小综合症、肠道疾病和“吸收不良综合症”等病的鸡体内分离出来[1]。番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)的感染,最早由Kaschula报道发生于非洲[2],1997年以来我国福建省、浙江省等省雏番鸭也发生类似疫病,吴宝成等[3]在国内首次确认该病原为番鸭呼肠孤病毒。此后,黄瑜等[4]、王永坤等[5]先后报道了半番鸭、鹅感染呼肠孤病毒。刘红等[6]从北京鸭病料中分离到一株呼肠孤病毒DRV-GZ株。研究表明MDRV对北京鸭、麻鸭、鹅和鸡不具有致病性[7,8]。在四川省、广东省、安徽省等省份陆续报道鸭群中出现一种新的病毒病,威胁着水禽养殖业的健康发展,陈少莺等[9,10]从肝脏不规则坏死和出血混杂为主要特征的发病麻鸭群中分离到新的呼肠孤病毒,随后,各地陆续报道新型鸭源呼肠孤病的流行[11,12]。NDRV感染宿主的范围逐渐扩大,现已成为危害家禽养殖业重要传染病之一。
禽弧肠孤病毒无囊膜,呈二十四面体双层衣壳结构,核酸为线性双链 RNA,基因组由10 个双链RNA 基因片段组成,根据它们的电泳迁移率分为三组:L(大),M90(中),S(小)。L 组有三个片段(L1、L2、L3),M 组三个片段(M1、M2、M3),S组四个片段(S1、S2、S3、S4)[13],其中S1基因的第三个ORF为σC基因,该基因编码σC蛋白,与NDRV的致病机制有关。
目前该病的诊断包括病毒分离和血清学方法。但这些方法繁琐、费时,不适用于本病的快速诊断[14]。根据GenBank数据库中呼肠孤病毒S1 基因全序列,设计合成了一对特异性引物,以NDRV TH11分离株为模板,建立了检测NDRV的实时荧光定量RT-PCR方法。该方法操作简便、敏感性高、重复性好、特异性强,为临床上NDRV的快速诊断及分子流行病学调查提供了有效手段。
1 材料与方法
1.1毒株 新型鸭呼肠孤病毒(Novel duck reovirus
TH11,DRV TH11)、H5禽流感病毒(H5 subtype avian in-fluenza virus,H5-AIV)、H9禽流感病毒(H9 subtype avian in-fluenza virus,H9-AIV)、鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)、C型鸭肝炎病毒(Duck hepatitis virus type C,C-DHV)、新城疫病毒(New castle disease virus,NDV)、鹅细小病毒(Goose Parvovirus,GPV)及鸭瘟病毒(Duck viral enteritis,DEV)为本实验室保存。
1.2试剂和仪器 Trizol购自invitrogen公司;禽源反转录酶(AMV)、T4 DNA连接酶载体购自Promega公司;pET-30a购自Novagen公司;SYBR Premix ExTaq II购自康为世纪公司;质粒提取试剂盒、大肠杆菌DH5α感受态细胞均购自天根生化科技有限公司;胶回收试剂盒、荧光定量PCR管购自Axygen公司;Taq酶、RNA酶抑制剂、dNTP、DNA Marker等均购自大连宝生物有限公司。主要仪器为Mastercycler ep realplex 4荧光定量PCR仪(Eppendorf公司)。
1.3引物 使用MegAlign软件对本实验室分离毒株NDRV TH11株σC基因序列(GenBank登录号:JX826587)及GenBank数据库中其他呼肠孤病毒σC基因核苷酸序列进行同源性分析,在高度保守区域设计并合成一对特异性引物。F:5'-GGAGTCGTCTCACTCCAAGC-3';R:5'-TTTGCGAAGACATGAGCAAC-3'。预计扩增目的片段长度为189bp。引物交由上海杰李生物技术有限公司合成。
1.4病毒RNA的提取和cDNA的合成 按照Trizol法说明书提取各病毒的总RNA:取反复冻融三次的病料上清500μL至EP管中,加入500μLTrizol试剂混匀,室温静置5 min后加入0.2mL氯仿,剧烈震荡15 s,室温静置3 min,4℃ 12 000×g离心10 min,小心吸取上清至另一EP管中,加入500μL预冷的异丙醇,-20℃沉淀30 min,4℃ 12 000×g离心10 min,弃上清,加入1 mL预冷的75%乙醇洗涤沉淀,4℃7500×g离心5 min,弃上清,室温自然干燥5 min,用Nuclease-Free Water 20 μL溶解RNA沉淀,分装后置于-20℃储存备用。cDNA的合成:2 μg总RNA模板,1 μL随机引物,5 μL 5×反转录Buffer,2 μL dNTP mix(10 mmol/L),1 μL反转录酶(200U/μL)、1 μL RNA RNase Inhibitor(20U/ μL),补足Nuclease-Free Water至25 μL体系,将上述溶液涡旋混匀后,于37℃孵育60 min后,置于75℃孵育10 min灭活反转录酶,反应结束后,即得到反转录产物cDNA,用于后续实验。
1.5阳性标准模板的制备 以cDNA为模板使用特异性引物,扩增NDRV TH11株病毒的σC基因,反应体系:2×Premix ExTaq 10μL、上下游引物各1 μL、cDNA 2μL、ddH2O 6μL。S1基因PCR反应程序:95℃预变性5 min;94℃变性30s,55℃退火30 s,72℃延伸30 s,共30个循环;72℃延伸10 min。反应结束后,在1%琼脂糖凝胶上电泳检测扩增结果。用胶回收试剂盒回收纯化的片段,与pET-30a载体连接克隆,构建重组质粒pET-30aσC。将该质粒转化至DH5α大肠埃希氏菌种感受态细胞挑取阳性菌落,提取质粒进行PCR鉴定和序列测定,挑选结果正确的质粒并测定其浓度,根据公式计算出重组质粒pET-30a-σC标准品的拷贝数。
1.6SYBR Green II实时荧光定量PCR检测方法的建立
1.6.1SYBR Green II荧光定量PCR反应体系的建立及优化 以重组质粒pET-30a-σC标准品为模板,采用矩阵法筛选引物的最佳浓度,并对反应条件进行优化。优化反应条件为采用两步法PCR,并绘制熔解曲线。
1.6.1.1荧光定量 RT-PCR 引物浓度的优化 取1×105copies/μL阳性质粒标准品pET-30a-σC为模板。分别以0.2 μL、0.5 μL、1.0 μL、1.5 μL、2.0 μL的引物(10 μm/mL)进行 PCR 反应,以获得最佳引物浓度。
1.6.1.2荧光定量 RT-PCR 退火温度的优化 取1×105copies/μL阳性质粒标准品pET-30a-σC为模板,分别以55℃、56℃、57℃、58℃、59℃、60.0℃、61℃、62℃、63℃、64℃、65℃为退火温度对病毒进行 PCR扩增,以确定最佳退火温度。
1.6.2标准曲线的建立 将S1基因PCR扩增产物克隆于pET-30a载体中,构建重组质粒pET-30a-σC,以重组质粒为标准品,紫外分光光度计测定阳性标准品的OD260值,根据阳性标准品的分子量与质量浓度,计算其拷贝浓度,调整浓度后,将重组pET-30a-σC质粒做10倍梯度稀释,获得1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102copies/μL的系列标准模板,采用优化好的条件进行SYBR GreenⅡ实时荧光定量PCR,得到各自的Ct值。以Ct值为横坐标,起始模板浓度的对数为纵坐标,建立标准曲线。
1.7特异性试验 利用本研究建立的荧光定量RTPCR检测方法,对新型鸭呼肠孤病毒的基因组RNA,以及对照病原AIV、IBV、C-DHV、NDV、GPV、DEV等病毒的核酸进行特异性检测。
1.8敏感性试验 对阳性重组质粒标准品以10倍极限稀释后,取1.0×105copies/μL~1.0×101copies/μL共5个浓度进行敏感性试验。
1.9重复性试验 对阳性重组质粒标准品的1×106copies、1×105copies、1×104copies等3个浓度进行批内3个重复和批间3个重复检测。
1.10实验室感染样品的检测 将NDRV TH11株病毒以病毒原液、400TCID50、200TCID50三组不同剂量病毒液通过腿部肌肉途径接种3日龄麻鸭,每一组10只,设立对照组。选取经NDRV TH11株病毒感染后d7病鸭,采集的病鸭脾脏组织共30份,分别运用SYBR Green II荧光定量PCR方法和本实验室建立的常规RT-PCR方法进行检测,并对比检测结果。
2 结果
2.1阳性标准品的制备 RT-PCR扩增获得NDRV的σC基因片段,将其克隆到pET-30a载体中构建重组质粒pET-30a-σC, 对其进行PCR鉴定,得到1条大小约189bp的特异片段,与预期目的片段大小相符(图1),表明σC基因片段已克隆到pET-30a载体中。重组阳性质粒的浓度100.3ng/μL, 大小为5611bp,拷贝数(Copies)=(amount×6.022×1023)/ (DNA length×109×660),经计算,调整重组阳性标准质粒的DNA分子数为1.0×108copies/μL。

图1 标准品目的片段PCR产物的电泳结果Fig. 1 Amplication results of standard fragmentM: DNA分子量标准 (DL2000 plusⅡ); 1: 空白对照; 2: 标准品扩增产物M: DNA Marker DL2000 plusⅡ; 1: Negative control ; 2: Standard fragment
2.2SYBR Green II实时荧光定量PCR反应条件的确定及标准曲线的建立 将阳性重组质粒经10倍系列稀释为1.0×108~1.0×101copies/μL 共8个浓度,作为标准品进行实时荧光定量RT-PCR 反应。反应体系为 25 μL,包括 SYBR Premix Ex Taq II 12.5μL、ROX Reference DyeII 0.5μL、上下游引物各 0.5μL (0.2mmol/L)、模板(质粒或cDNA)2 μL、补Nuclease-Free Water 25 μL。反应条件:94℃ 预变性30 s;94℃ 变性5 s,63℃退火30 s,扩增40 个循环。结果各浓度有很好的线性关系。阴性对照无扩增反应。得到标准曲线方程为Y=-3.486X+32.38;Efficiency=0.94;R2=0.997(见图2)。
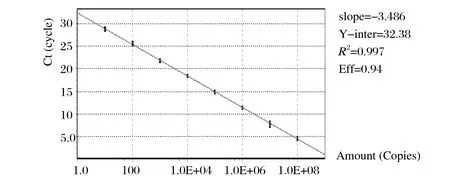
图2 荧光定量PCR标准曲线Fig.2 Standard curve of real-time fl uorescent quantitative PCR
2.3SYBR GreenΠ实时荧光定量PCR的熔解曲线 根据参数 95℃ 15 s、60℃~95℃ 20 min、95℃ 30 s绘制溶解曲线。结果显示,标准样品均出现了窄且尖的单峰,说明扩增产物单一,无非特异性扩增,而阴性对照没有出现熔点峰,熔解温度为(85±0.4)℃(图3),表明该SYBR Green II实时荧光定量 PCR反应为特异性扩增。
2.4特异性试验结果 NDRV TH11株病毒的荧光定量RT-PCR 检测结果为阳性,而AIV、IBV、C-DHV、NDV、GPV、EDSV、DEV等毒株的检测结果均为阴性(荧光信号未到检测可信阈值)(图4),说明本方法具有很好的特异性。
2.5敏感性试验结果 用建立的方法对不同拷贝浓度阳性标准品(1.0×101~1.0×105copies/μL)进行实时荧光定量RT-PCR检测。阳性标准品均出现特异性荧光扩增,阴性对照无荧光扩增,结果表明该方法最低可以检出1.0×101copies/μL的标准品(图5)。
2.6SYBR GreenΠ实时荧光定量PCR的重复性 对 3批次的S1基因标准品分别做 3 个批内重复和3 个批间重复,组内变异系数均小于1%,组间变异系数均小于 1%,重复性良好(表1)。
2.7麻鸭感染NDRV实验室样品的检测 对采集的30份病鸭肝脾组织,进行研磨,提取病毒RNA,并反转录为cDNA,运用建立的SYBR Green II荧光定量PCR方法和本实验室建立的常规RT-PCR方法进行检测。结果发现,用SYBR Green II荧光定量PCR方法检测所有接种病毒样品,均为阳性,对照组均为阴性;常规的RT-PCR检测接种病毒样品中阳性率仅为83.3%,对照组均为阴性。结果见表2。
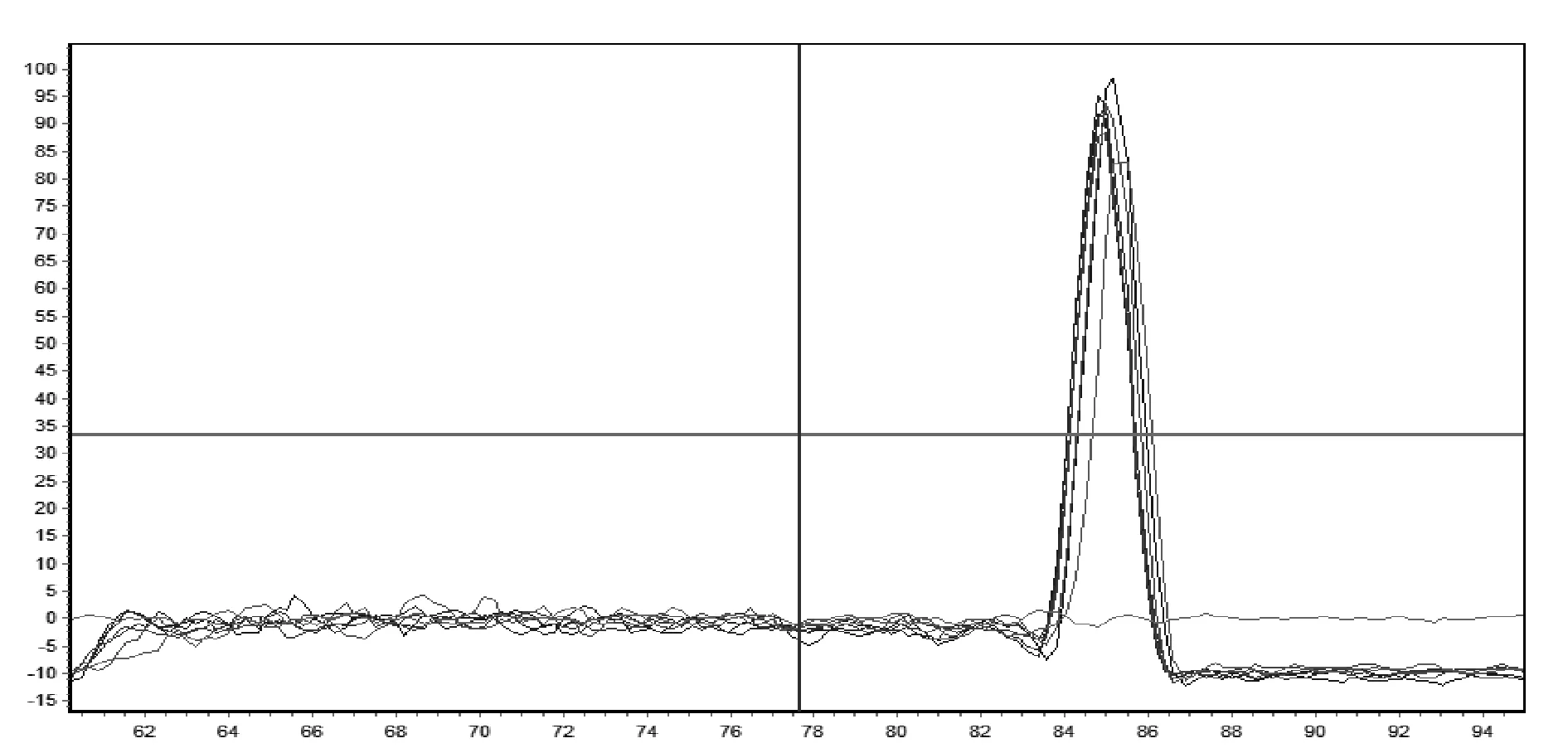
图3 实时荧光定量RT-PCR溶解曲线Fig .3 The melting curve of real-time RT-PCR
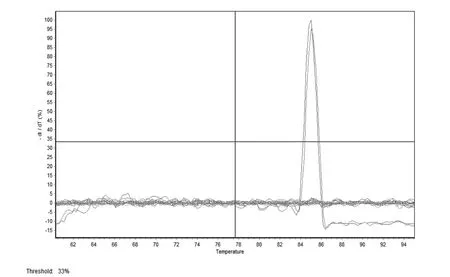
图4 NDRV SYBR Green II 实时荧光定量PCR检测方法的特异性Fig. 4 Specifi city of NDRV SYBR Green II real-time fl uorescent quantitative PCR detecting method
3 讨论
NDRV的自然宿主相对ARV和MDRV更广泛,自然状态下对各种品种鸭(番鸭、半番鸭、北京鸭、麻鸭)均有致病性[6,9,10],人工感染亦可引起SPF鸡的发病甚至死亡。发病日龄约为3~25日龄,其中以5~10日龄居多,不同的毒株之间发病率和死亡率有很大差异[10]。该病临床症状主要表现为精神萎靡,羽毛凌乱、粗糙、排白色稀粪。剖检眼观病变为肝脏呈土黄色、质脆、有点状出血点和白色坏死灶,脾脏肿大、坏死严重,肾脏出血、肿大[9,10]。

图5 NDRV实时荧光定量PCR检测方法的敏感性Fig. 5 Sensitivity of NDRV real-time fl uorescent quantitative PCR detecting method1~5: 1.0×105~1.0×101拷贝数1-5: 1.0×105-1.0×101copies, respectively
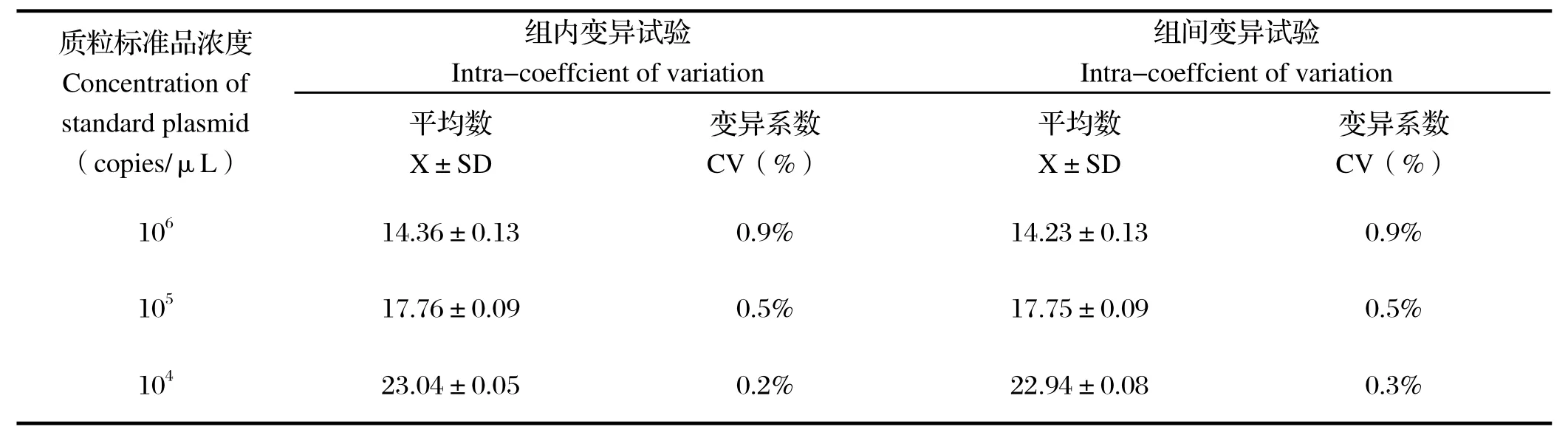
表1 荧光定量PCR组内、组间重复性试验结果Table 1 Intra-and inter-assay of real-time PCR reproducibility
刘红等[6]从广东省一种以肿头、软脚、流泪、拉黄绿色稀粪,肝脏出血和坏死及食道泄殖腔有溃疡和结痂为主要特征的北京鸭病料中分离到1株呼肠孤病毒以来,福建省、浙江省、重庆市、安徽省等地不断报道番鸭、北京鸭、麻鸭群发生该疫病的流行,并且有逐年增加趋势。建立快速、准确、敏感的新型鸭呼肠孤病毒检测方法,是临床上防控该病的前提。

表2 荧光定量PCR从人工感染鸭组织中对新型鸭呼肠孤病毒的检测Table 2 Detection of Novel duck reovirus from the infected tissues by SYBR Green Ⅱfl uorescent quantitative RT-PCR
本研究建立的实时荧光定量RT-PCR检测NDRV的方法,特异性好,不与检测的其他常见家禽传染病发生特异性反应。实验所建立的标准曲线的相关系数R2=0.997,扩增效率E=0.94说明核酸拷贝数的对数值与Ct之间有极显著的线性关系,优化体系和条件很好地满足了实验要求。重复性实验得出组内变异系数为0.2%~0.9%组间变异系数为0.3%~0.9%,说明此方法具有很好的重复性,可以稳定地用于NDRV核酸的定量检测。该试验中建立的曲线可检测到10 copies/μL的初始模版量,比常规RT-PCR敏感性高100倍。利用本实验建立的荧光定量RT-PCR方法对30份实验室样品进行了检测,结果检出阳性样品30份,而常规RT-PCR检出阳性样品25份,该方法比RT-PCR具有更高的敏感性,而且从收到样品到得出检测结果时间短,因此非常适合NDRV的早期诊断、定量分析以及流行病学监测。本试验检测速度快,比其他的血清学检测方法节省时间,准确性高。操作简便、敏感性高、重复性好、特异性强,为临床上NDRV的快速诊断及分子流行病学调查提供了有效手段。
参考文献
[1] Rosenberger J K. Reovirus infections [M]. 11th ed. Ames Iowa: Iowa State Press, 2003.
[2] Vr K. A new virus disease of the Muscovy duck present in Natal [J]. J S Afr Vet Med Assoc, 1950, 21: 18-26.
[3] 吴宝成, 陈家祥, 姚金水, 等. 番鸭呼肠孤病毒的分离与鉴定[J]. 福建农业大学学报, 2001, (2): 227-230.
[4] 黄瑜, 程龙飞, 李文杨, 等. 雏半番鸭呼肠孤病毒的分离与鉴定[J].中国兽医学报, 2004, (1): 14-15.
[5] 王永坤, 钱钟, 严维巍, 等. 鹅出血性坏死性肝炎的初步研究[C]//中国畜牧兽医学会2003年学术年会, 北京, F, 2003.
[6] 刘红, 廖明. 一株北京鸭呼肠孤病毒的分离鉴定[C]//中国畜牧兽医学会禽病学分会第十四次学术研讨会, 扬州, 2008 [C].
[7] 吴宝成, 陈家祥, 姚金水. 番鸭呼肠孤病毒B3分离株的致病性研究[J]. 中国预防兽医学报, 2001, (6): 22-25.
[8] 胡奇林, 陈少莺, 林锋强, 等. 番鸭呼肠孤病毒的鉴定[J].病毒学报, 2004, (3): 242-248.
[9] 陈少莺, 陈仕龙, 林锋强, 等. 一种新的鸭病(暂名鸭出血性坏死性肝炎)病原学研究初报[J]. 中国农学通报, 2009, (16): 28-31.
[10] 陈宗艳, 朱英奇, 王世传, 等. 一株新型鸭源呼肠孤病毒(TH11株)的分离与鉴定[J].中国动物传染病学报, 2012, (1): 10-15.
[11] Chen Z, Zhu Y, Li C, et al. Outbreak-associated novel duck Reovirus,China,2011[J].Emerging infectious diseases, 2012, 18(7): 1209-1211.
[12] Liu Q, Zhang G, Huang Y, et al. Isolation and characterization of a reovirus causing spleen necrosis in Pekin ducklings[J].Vet microbiol, 2011, 148(2-4): 200-206.
[13] Spandidos D A, Graham A F. Physical and chemicalcharacterization of an avian reovirus[J]. J virol, 1976, 19(3): 968-976.
[14] 陈仕龙, 陈少莺, 程晓霞, 等. 新型鸭呼肠孤病毒分离株的致病性研究[J]. 西北农林科技大学学报(自然科学版), 2010, (4): 14-18.
·研究论文·
DETECTION OF NOVEL DUCK REOVIRUS USING SYBR GREEN II FLUORESCENT QUANTITATIVE PCR ASSAY
DING Ming-yang1,2, QI Wei-qiang1,2, CHEN Zong-yan1, ZHU Jie1, WU Qiao-mei1, MIAO Qiu-hong1, LI Chuan-feng1, WU Run1, LIU guang-qing1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2.College of Animal Medicine,Gansu Agricultural University, Lanzhou 730070, China)
Key words:Novel duck reovirus; S1; fl uorescent quantitative PCR; melting curve; detection
Abstract:To develop a fast, sensitive, specifi c SYBR Green II fl uorescent quantitative PCR assay for detecting Novel duck reovirus (NDRV) infection, S1 gene was amplifi ed in RT-PCR from the NDRV infected-duck tissues, and cloned into pET-30a vector. The resulting recombinant plasmid was used as the template for making a standard curve. Subsequently, the sensitivity and specifi city of the SYBR Green II fl uorescent quantitative PCR assay that was developed were determined. The results showed that the NDRV real-time PCR assay had a dynamic range of detection between 101and 108copies/μL with a sensitivity of 10 copies/μL. There was no cross reaction with H5 subtype Avian infl uenza virus, H9 subtype Avian infl uenza virus, Infectious bronchitis virus, Duck hepatitis virus type C, New castle disease virus, Goose parvovirus and Duck viral enteritis. In conclusion, a SYBR Green II fl uorescent quantitative PCR assay has been developed for quantifi cation of NDRV, which can be sued for investigating the pathogenesis of NDRV.
中图分类号:S852.659.4
文献标志码:A
文章编号:1674-6422(2016)01-0007-08
收稿日期:2015-09-15
基金项目:上海市科委创新项目(13391901600);国家自然科学基金项目(31270194)
作者简介:丁明洋,男,硕士研究生,预防兽医专业;戚伟强,男,硕士研究生,预防兽医专业
通信作者:刘光清,liugq@shvri.ac.cn;吴润,E-mail:wurun@gsau.edu.cn

