鸡球虫DNA疫苗在生产推广过程中的安全性评价
杨锦昌 周晓波
(盐城市畜牧兽医站,江苏盐城 224002)
鸡球虫DNA疫苗在生产推广过程中的安全性评价
杨锦昌 周晓波
(盐城市畜牧兽医站,江苏盐城 224002)
鸡球虫病是鸡常见的一种急性流行性原虫病。以消瘦、贫血、血痢、生长发育受阻为特征;病原为艾美耳属的7种球虫,其中危害最大的有两种:柔嫩艾美耳球虫和毒害艾美耳球虫,前者寄生于盲肠中,后者寄生于小肠粘膜中,临床上往往表现为多种球虫混合感染。本病以湿热多雨的夏季多发,主要发生于3个月以内的幼鸡,其中以2~7周龄鸡最易感,10日龄以内雏鸡少发,成年鸡感染则不表现症状;1月龄左右鸡多患盲肠球虫,2月龄以上鸡多患小肠球虫。一旦发病,重则引起大面积的死亡,轻则导致生长发育受阴,影响其正常生产性能。目前生产实践中多采用在饲料中添加抗球虫药物预防和治疗,由于药物的长期使用,逐渐产生了抗药性,导致防控效果越来越差。如何找到一种更好的预防办法是当务之急,使用疫苗防疫可以起到事半功倍的效果。
鸡球虫DNA疫苗;检测;质粒DNA
鸡球虫DNA疫苗是免疫效果较好的基因疫苗之一。这些疫苗大部分在实验鸡体内可以提供对球虫卵囊的免疫保护力,但对其安全性的认识只停留在理论分析阶段,缺乏对鸡球虫DNA疫苗的生物安全性评价,致其还不能用于生产实际。为了充分评价DNA疫苗的生物安全性,我们选取四种有代表性的球虫疫苗,分别为pVAX1.0-TA4-IL-2,pVAX1.0-NA4-IL-2,pVAX1.0-EM8-IL-2,pVAX1.0-LDH-IL-2进行试验。旨在为该疫苗应用的可行性提供相关数据。
1 实验方法及步骤
1.1 实验材料及仪器的准备
质粒,主要试剂及仪器的准备,所需溶液及其配置。
1.2 质粒DNA的转化及制备
用大肠杆菌DH5α制备感受态细胞,按分子常规克隆方法进行DNA转化。裂解法制备大量质粒,PEG沉淀法进行纯化。
1.3 质粒的定量定性及鉴定
分光光度计测定质粒的含量,双酶酶切质粒,跑电泳进行鉴定。
1.4 试验动物的分组和免疫
选择1日龄小公雏,将制备的四种DNA疫苗混合,通过腿部肌肉分别注射给不同组别的实验动物,同时每组设置PBS注射的空白对照。分组如下:

组别 鸡日龄(d) 数量(只) 接种方式 剂量(μg/只) 接种次数(次) 间隔天数(d) 疫苗批次1 1 120 肌肉注射 25 1 0 同一批2 120 肌肉注射 25 3 7 同一批3 14 240 肌肉注射 75 1 0 3个批次7
1.5 引物的设计
根据四种质粒的结构和序列,分别设置四对特异性引物。
1.6 受试动物临床反应的观察
每天观察实验动物的精神状态、饮水、进食、粪便、活动及死亡情况等,并进行详细的记录。
1.7 质粒在组织中的分布和存留时间
免疫后每2~4周随机处死5只鸡,分别采取血液、心、肝、脾、肾脏、注射部位肌肉,RT-PCR检测。
1.8 病理学变化检测
处死试验鸡的同时多点采取心、肝、脾、肾、肠及腿部注射部位肌肉,按常规方法制备石蜡切片,苏木精——伊红(H.E)染色方法进行染色并镜检分析。
2 实验结果
2.1 对疫苗的临床反应
实验动物免疫前后精神状态良好;采食量、饮水没有明显变化;粪便情况良好;活动情况正常;没有发生实验动物突然死亡的情况;说明受试动物对该疫苗无不良生理反应。
2.2 质粒在注射部位及主要脏器的分布和存留
(1)实验组1组实验结果如下表:

?

M:.MarkerDL2000,1.阳性对照,2.阴性对照,3.心,4.肝,5.脾,6.肾,7.注射部位,8.血液A:免疫后1个月EM8基因组扩增结果 B:免疫后1.5个月EM8基因组扩增结果C:免疫后2个月EM8基因组扩增结果D:免疫后3个月EM8基因组扩增结果E:免疫后4个月EM8基因组扩增结果
(2)实验组2组实验结果如下表:

及注射部位 逐渐减少 2至4月龄 质粒DNA也未与染色体DNA发生整合EM8 心、肝、脾、肾NA4 心、肝、脾、肾检测基因 检出部位 变化趋势 最晚检出时间 结论TA4 心、肝、脾、肾及注射部位 逐渐减少 3至4月龄 质粒DNA也未与染色体DNA发生整合NA4 心、肝、脾、肾及注射部位 逐渐减少 2至4月龄 质粒DNA也未与染色体DNA发生整合EM8 心、肝、脾、肾及注射部位 逐渐减少 3至4月龄 质粒DNA也未与染色体DNA发生整合LDH 心、肝、脾、肾及注射部位 逐渐减少 2至4月龄 质粒DNA也未与染色体DNA发生整合及注射部位 逐渐减少 3至4月龄 质粒DNA也未与染色体DNA发生整合LDH 心、肝、脾、肾
(3)实验组3组实验结果:注射疫苗后,前两个月三个批次的疫苗均在注射部位组织、心、肝、脾和肾中能扩增出特异性DNA片段,随着时间的延长,疫苗DNA在体内存在的量越来越少,到2至4月龄,在所有组织中几乎检测不到特异性DNA,说明质粒DNA也未与染色体DNA发生整合。
2.3 脏器组织病理学变化
(1)免疫后1个月,组织脏器均未见病理变化。

免疫后免1个疫后月1主个要月组主织要组图织片图(片4(0040×0×))A.心 B.肝A. 心C.B脾.肝 CD..脾肾D .肾E.E肌.肌肉肉 FF..十十二二肠肠
2)免疫后1.5个月,组织脏器均未见病理变化。
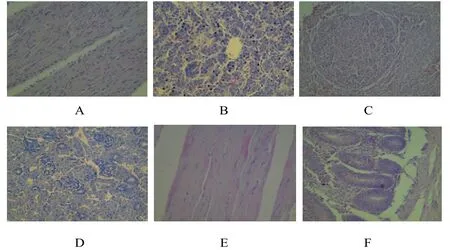
免疫后1.5个月主要组织图片(400×)A.心 B.肝 C.脾 D.肾 E.肌肉 F.十二指肠
(3)免疫后2个月,组织脏器均未见病理变化。

免疫后2个月主要组织图片(400×)A.心 B.肝 C.脾 D.肾 E.肌肉 F.十二指肠
(4)免疫后3个月,组织脏器均未见病理变化。
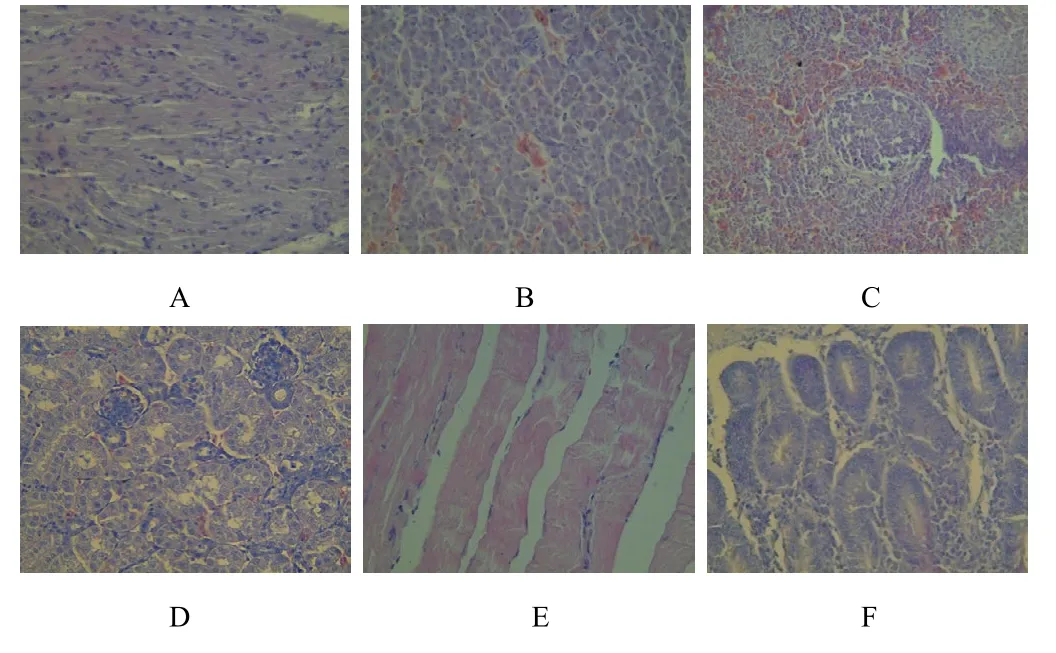
免疫后3个月主要组织图片(400×)A.心 B.肝 C.脾 D.肾 E.肌肉 F.十二指肠
(5)免疫后4个月,组织脏器均未见病理变化。
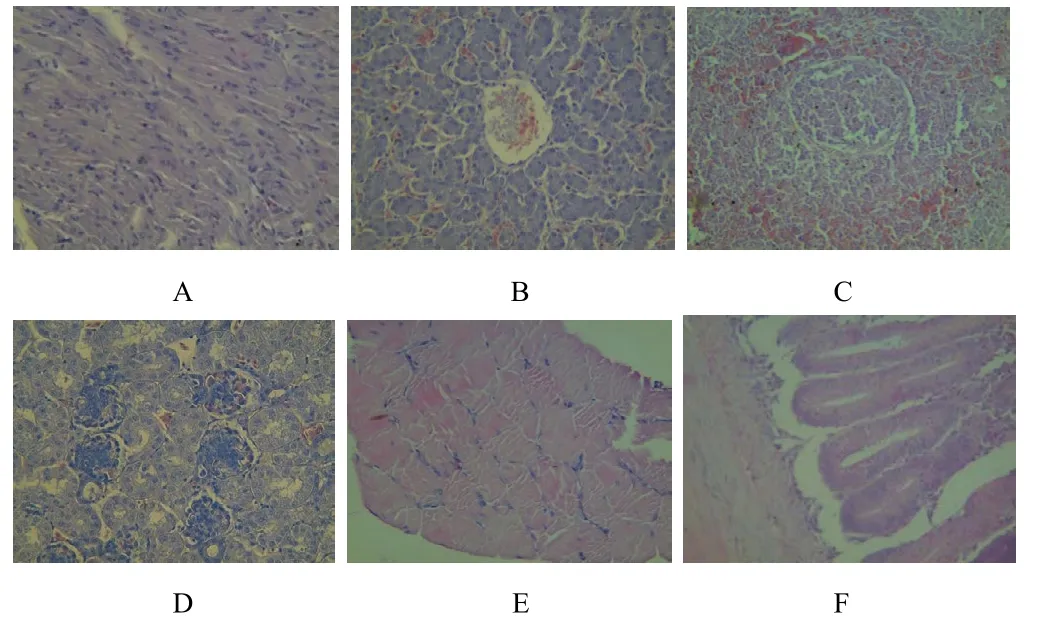
免疫后4个月主要组织图片(400×)A.心 B.肝 C.脾 D.肾 E.肌肉 F.十二指肠
3 讨论
DNA疫苗是近年发展起来的一种新型疫苗,由于它既具有亚单位苗和灭活苗的安全性,又兼备只有毒苗或重组疫苗才具有的诱导保护性免疫应答的特点。DNA疫苗很可能给免疫预防治疗领域带来一场根本性的变革。然而,在大范围的应用于临床实验之前,还有许多急需解决的问题。而首先应考虑的问题就是DNA 疫苗的安全性问题。主要是确定其是否被整合到宿主基因组 DNA中。本试验室选择美国食品与药物管理局(FDA)认可的安全性较高的pVAX1.0作为球虫DNA疫苗的表达载体。
本试验通过PCR检测了四种DNA疫苗在注射部位的存留以及在主要脏器的分布和存留。经,疫苗在免疫后的1~2个月在血液,心脏,肝脏,脾脏,肾脏和疫苗注射部位的肌肉都能检测到。说明免疫后质粒可能会随血液分布到各组织,并在组织中停留一段时间。随着时间的推移,在免疫后的3个月之后就一直检测不出质粒的存在。说明质粒在机体内经过一段时间的代谢,可以被宿主清除。并且四种质粒DNA的代谢速度较为一致,仅有个别组在免疫后的2个月就检测不到质粒,分析原因应为由实验动物的个体差异和实验动物生活环境差异导致的,并不影响本实验对四种疫苗的安全性评价。
基因疫苗致使组织产生病理学损害的可能原因有三,一是因质粒纯度不够,宿主菌残留成分导致过敏反应或毒性反应;二是质粒的表达产物可能具有某种程度的毒性或刺激机体产生超敏反应;三是质粒序列可能与受试动物基因组发生整合,整合后可能导致原癌基因的表达或抑癌基因失活,使被整合细胞发生恶性变。本试验所应用的质粒DNA本身没有任何毒副作用,也不刺激机体产生免疫应答,在组织中以附加体的形式存在,并随着细胞的代谢逐渐消失,不应引起炎性反应,并且质粒DNA为纯化制品,细菌蛋白成分已经被最大限度的抽提去除,DNA样品在紫外分光定量时,纯度在95%以上,蛋白质达到“检不出”的水平,可以认为不存在宿主菌蛋白成分,同时溶解质粒的介质是0.01M pH值为7.4的磷酸盐缓冲液,该介质自身无任何毒副作用,也不会“诱导”质粒DNA产生任何毒副作用。因此,虽然质粒DNA分布到了心脏,肝脏,脾脏,肾脏和肌肉,但无可见的组织病理学变化。质粒DNA与受试动物染色体整合的可能性及激活原癌基因或灭活抑癌基因的可能性均很小或无。因此,从理论上来看,不可能导致机体脏器产生组织病理学变化。本试验结果也进一步印证了这一点。
本试验在进行生物安全性评定的同时,还对该疫苗的免疫程序进行了初步探索。本试验发现重复接种后质粒在机体组织中的存留与一次接种后质粒在组织中的存留无太大差别,有关基因免疫是否需要加强免疫说法不一。有报道认为,DNA疫苗免疫大动物一次后即可诱发较好的体液免疫,且持续时间长;但也有报道认为,须经加强免疫后方可达到较高水平。本试验重复接种组与其他组并没有太大差别,引起这种结果的原因可能有多种:第一,DNA免疫后肌细胞和如何受纳质粒DNA,受纳率和受纳量是多少还不是很清楚,不同的鸡只间可能有差异;第二,不同的受试动物所受纳的含有完整表达盒的质粒DNA的量不同,从而导致表达的蛋白量不同,表达量低,相对来说免疫反应就比较弱;第三,不同机体对所表达外源蛋白的免疫应答反应强弱不同。因此在保证安全性的前提下,要探索一种免疫程序延长质粒在组织中的存留时间,使得延长在体内的免疫保护效果。
本试验也对超剂量接种的情况作了研究,研究表明质粒在三个月的时候已经检测不到,在组织中也没检测到病理变化,因此,超剂量接种对鸡体是安全的。
目前国外有关DNA疫苗安全性报道的研究不多,就从本试验结果来看,实验中的四种球虫DNA疫苗对鸡体都是相对安全的。
[1]黄金贵,李运娜,张西臣.鸡球虫病疫苗的研究进展[J].中国生物制品学杂志,2011,(8):983-987.
[2]张择扬. 四种鸡球虫DNA疫苗在机体组织中的分布和在环境中的释放[D].南京农业大学,2011.

