OrexinA、OrexinB和 AMH受体在性腺轴的分布及其生殖生物学意义的研究
海米提•阿布都力木李 艳郭 琼荣小灵李 甜阿地力江•伊明
1. 新疆医科大学基础医学院组胚教研室(乌鲁木齐 830011);
2. 新疆医科大学第二附属医院检验科;3. 新疆医科大学基础医学院人体解剖学研室
·论 著·
OrexinA、OrexinB和 AMH受体在性腺轴的分布及其生殖生物学意义的研究
海米提•阿布都力木1李 艳1郭 琼1荣小灵2李 甜1阿地力江•伊明3*
1. 新疆医科大学基础医学院组胚教研室(乌鲁木齐 830011);
2. 新疆医科大学第二附属医院检验科;3. 新疆医科大学基础医学院人体解剖学研室
目的研究食欲素受体1(OX1R)、食欲素受体2(OX2R)、抗中肾旁管激素受体Ⅱ(AMHR2)在下丘脑-垂体-睾丸轴中分布与细胞定位,探讨其对生精功能的调节机制。方法用免疫组织化学法检测OX1R,OX2R和AMHR2受体在性未成熟和性成熟SD大鼠的下丘脑、垂体、睾丸表达情况。结果性未成熟组:OX1R,OX2R和AMHR2受体在下丘脑室周带、内侧带、外侧带神经元细胞质及细胞膜表达阳性,在腺垂体少数细胞细胞质阳性,在睾丸只有间质细胞细胞膜及细胞质表达阳性。性成熟组:OX1R、OX2R和AMHR2受体在下丘脑室周带、内侧带、外侧带神经元细胞质及细胞膜表达阳性,在腺垂体少数细胞细胞质阳性,在睾丸间质细胞和精原细胞细胞膜及细胞质表达阳性。结论OX1R、OX2R和AMHR2受体在性成熟与未成熟的大鼠下丘脑、脑垂体表述无差异,在睾丸分布上具有不同,上述3种受体可能参与性腺轴调节精原细胞分化功能。
食欲素受体; 中肾旁管激素受体; 大鼠, Sprague-Dawley; 莱迪希细胞; 精原细胞
1998 年美国德克萨斯大学Sakurai 等在探索控制进食新药的试验中,在大鼠下丘脑腹外侧核内发现2种与食欲有关的神经肽,分别为食欲素A(Orexin A,OXA )和食欲素B(Orexin B,OXB)[1],亦称为食欲肽和增食欲素。Orexin的主要作用表现在刺激动物采食、能量代谢、内分泌调节和睡眠-觉醒循环等方面,近年来,有研究表明Orexin除上述生理功能外,对下丘脑-垂体-性腺轴(HPG)可能具有一定的调节作用,但具体机制不详。故本研究对OX1R,OX2R和AMHR2受体在下丘脑-垂体-睾丸中分布与细胞定位进行了研究,并就其对睾丸生精功能可能的调节机制进行了探讨,现具体报道如下。
材料与方法
一、实验动物与分组
正常清洁级雄性(SD)大鼠40只,其中性成熟组(75~90d)20只,性未成熟组(30d)20只,两组体质量分别为230~450g和100~150g,由新疆医科大学实验动物中心提供。
二、主要仪器与试剂
切片机(Leica RM2245),一抗订购于Abcom公司多克隆抗体(兔抗OX1R ab68718、兔抗OX2R ab104701、鼠抗Anti-AMHR2 antibody [MIG7] ab64762);二抗等试剂订购于MaixinBio公司(即用型快速免疫组化MaxVisionTM试剂盒、PBS磷酸盐缓冲液、柠檬酸抗原修复液、DAB显色液),其他基础试剂购自于MaixinBio公司。
三、试验方法
(一)实验动物准备
将性成熟和未成熟两组SD雄性大鼠各20只,适应性饲养1周,饲养环境温度为(23±3)℃,湿度为(50+5)%,照明昼夜比12h : 12h ,自由进水进食。
(二)取材与包埋
1周后,大鼠腹腔注射10%水合氯醛(0.5mL/100g体质量)麻醉下实施心脏4%多聚甲醛固定,并取出脑、垂体和睾丸组织,进行固定与石蜡包埋。
(三)观察指标与方法
脑、垂体与睾丸用石蜡切片机连续切片,切片厚度脑为10μm,垂体与睾丸为4μm。行HE常规染色,MaxVision免疫组织化学法检测OX1R,OX2R和AMHR2等指标,光镜下观察并摄片,其中棕黄色为阳性染色。
结 果
一、各组大鼠下丘脑、垂体和睾丸HE切片观察结果
通过石蜡包埋组织切片HE染色,观察发现性未成熟和性成熟大鼠下丘脑室周带,穹窿内侧为内侧带,穹窿外侧是外侧带均有神经元分布,两组腺垂体内分布有嗜酸性、嗜碱性及嫌色细胞,但是性未成熟组睾丸里有间质细胞、生精小管里仅有支持细胞和精原细胞,性成熟组睾丸里有间质细胞、生精小管里除有支持细胞外,还有精原细胞、初级精母细胞、精子细胞、精子等,见图1、图2。

图1 性未成熟SD大鼠下丘脑、腺垂体、睾丸正常组织H-E染色

图2 性成熟SD大鼠下丘脑、腺垂体、睾丸正常组织H-E染色
二、各组大鼠免疫组织化学检测结果
用MaxVision法在下丘脑、脑垂体和睾丸检测了OX1R,OX2R和AMHR2;光镜观察结果发现OX1R, OX2R和AMHR2等3个受体在两组大鼠下丘脑、腺垂体、睾丸中阳性表达的细胞、细胞质及细胞膜呈棕黄色,这3种受体两组中表达主要不同之处是在性成熟组睾丸间质细胞和精原细胞均表达阳性,而在性未成熟组仅仅在睾丸间质细胞阳性表达(图3至图8)。
1. 性未成熟SD大鼠下丘脑、垂体、睾丸中OX1R,OX2R和AMHR2的表达(图3至图5)。
2. 性成熟SD大鼠下丘脑、垂体、睾丸中OX1R,OX2R和AMHR2的表达(图6至图8)。
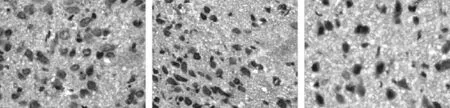
图3 性未成熟大鼠下丘脑中OX1R, OX2R, AMHR2的表达

图4 性未成熟大鼠垂体中OX1R, OX2R, AMHR2的表达

图5 性未成熟大鼠睾丸组织中OX1R, OX2R, AMHR2的表达
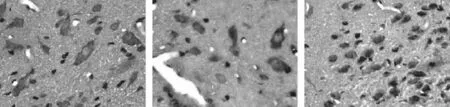
图6 性成熟大鼠下丘脑中OX1R, OX2R, AMHR2的表达

图7 性成熟大鼠垂体中OX1R, OX2R, AMHR2的表达
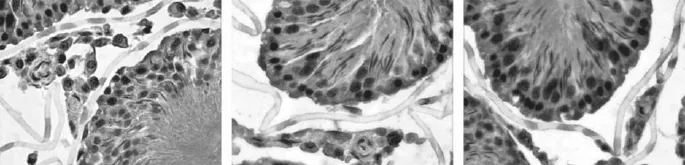
图8 性成熟大鼠睾丸组织中OX1R, OX2R, AMHR2的表达
讨 论
OXA 和OXB来源于同一前体,人类 Orexins 前体(PPO)基因有1432个碱基对,有2个外显子和1个内含子[2]。人类PPO基因位于染色体17q21 位点,其氨基酸序列与大鼠的有83%的同源性,大鼠和小鼠则有95%的同源性[1]。已分离出的OXA为含有33个氨基酸的神经肽,N端是焦谷氨酰残基,C端酰氨化,4个半胱氨酸残基形成两套链内的双硫键。OXB为含有28个氨基酸的小肽,其中46 %(13/28)的氨基酸与OXA一致。人和小鼠、大鼠、猪、牛的OXA氨基酸序列完全相同,而人类OXB序列中仅有两个氨基酸不同于啮齿类,这提示了Orexins在生物进化中的保守性[1]。
Orexins的受体分为OX1R、OX2R两型,其基因定位于OX1R-1p33;OX2R-6cen(p11-Q11)。OX1R、OX2R均为具有7个跨膜结构区的G蛋白耦联受体,均可被OXA、OXB所激活,其中OX2R与OXA、OXB两种食欲素具有较强的亲合力,属OXA、OXB 的非选择性受体,但OX1R则具有选择性,其与OXA的亲合力较OXB大100~1000倍[1]。其他相关研究显示[3],OX1R与OX2R的氨基酸序列同源性达64%明显高于其他G蛋白耦联受体,人类的OX1R、OX2R与大鼠的一致性分别达到94%和95%。提示OX1R 、OX2R与Orexins,在种系发育中具有高度保守性。
下丘脑75%~85%的促性腺激素释放激素(Gonadotropin -Releasing Hormone,GnRH)神经元与Orexin神经元纤维接触,OX可能直接作用于脑垂体性腺激素的释放和OXR的表达;提示OX参与垂体调控性腺功能的过程[6]。进一步的深入研究表明,OX1R、OX2R在GnRH神经元有,其中OX1R与Orexin神经纤维末端亦发生接触[4],且OXA能直接通过OX1R刺激GnRH神经元GnRH转录并释放神经肽,提示OXA对GnRH的转录并释放相关激素的调控作用可能发生于GnRH神经元水平上[5]。
免疫组化方法研究显示人睾丸组织中,间质细胞、支持细胞OX1R和OX2R阳性[7]。在羊驼睾丸间质细胞上OX1R阳性表达,体外培养睾丸组织检测睾酮浓度发现,OXA可提高间质细胞睾酮分泌水平,同时,支持细胞亦可产生OXA和AMH[8],而体外培养大鼠睾丸组织研究中发现OX1R抑制剂可阻止OXA提高睾酮水平的作用,并由此推测OXA通过拮抗AMH,竞争性的与OX1R结合,并通过激活该通路来调控哺乳动物睾丸睾酮的水平[9]。
抗中肾旁管激素(AMH)又称中肾旁管抑制物(MIS),是转化生长因子家族的成员,是男性性别分化的重要因子,相关研究表明[8],OXA增加间质细胞睾酮分泌,AMH抑制间质细胞睾酮分泌,但OXA和MIS同时加在培养液里,AMH某种程度上抑制OXA增加睾酮作用,另外支持细胞产生OXA和AMH。研究离体培养性成熟的成年AMH缺陷鼠发现,间质细胞欠分化,从而导致雄激素水平质变,这有助于不育症的发生[10]。
最近一些资料显示,食欲素在下丘脑-脑垂体-睾丸轴不同层面对性腺有直接作用,食欲素在睾丸内通过自分泌/旁分泌方式调节睾丸功能;食欲素这些新作用即调控雄性生殖腺轴作用,提示食欲素直接连接能量平衡和生殖功能[11]。
OX1R、OX2R在下丘脑表达主要作用表现在刺激动物采食、能量代谢和内分泌调节等作用,食欲素两类受体mRNA在大鼠脑内的分布不尽相同。OX1R的mRNA在丘脑服内侧核含量较高,而OX2R的mRNA在丘脑室旁核、小脑皮质、斜方体核、顶盖前核前端等处含量较高[12]。用免疫组化方法可观察到OX1R、OX2R在大鼠下丘脑、丘脑、中脑和网状结构的多种核团内出现,尤其在下丘脑、丘脑等处[13,14]。本实验性未成熟、性成熟组SD雄鼠OX1R、OX2R在下丘脑外侧带神经元细胞质及细胞膜表达阳性并含量较高。两组SD雄鼠OX1R、OX2R在腺垂体少数细胞细胞质阳性, Blanco等研究人垂体OXR发现,OX1R分布于腺垂体嗜酸性细胞内,其同时表达OX1R和GH。OX2R分布于垂体中间部和垂体前叶的嗜碱性细胞中,同时表达OX2R和ACTH[15]。但是本实验所使用的MaxVision染色法没有能够区分嗜酸性和嗜碱性细胞。两组SD雄鼠OX1R、OX2R在睾丸的表达却不同,性未成熟组OX1R、OX2R在睾丸只有间质细胞细胞膜及细胞质表达阳性;而性成熟组OX1R、OX2R在睾丸间质细胞及精原细胞细胞膜、细胞质均表达阳性,这与Karteris等[7,8]结果显示的睾丸组织中间质细胞、支持细胞OX1R和OX2R阳性有所不同,本实验性成熟组睾丸组织里除间质细胞OX1R、OX2R均阳性表达之外,精原细胞也表达阳性。
AMH有两个受体,分别为AMHR1和AMHR2[16]。AMH通过AMHR2调节间质细胞分化[17],出生后,AMH抑制未成熟大鼠的间质细胞增殖和分化,且抑制成年大鼠间质细 胞睾酮分泌[18]。AMHR2在未分化间质细胞表达,支持了出生后AMH直接调节大鼠睾丸的发育假说[19]。
据文献[20]脑组织里含有AMH、AMHR2,本实验两组AMHR2在下丘脑外侧带神经元细胞质及细胞膜阳性表达比较高,两组AMHR2在腺垂体少数细胞细胞质表达阳性,尚未见报道。两组SD雄鼠AMHR2在睾丸的表达却不同,性未成熟组AMHR2在睾丸只有间质细胞细胞膜及细胞质表达阳性;而性成熟组AMHR2在睾丸间质细胞及精原细胞均表达阳性,这两组中间质细胞均阳性表达,此结果中两组间质细胞均阳性表达,与性未成熟、性成熟大鼠睾丸间质细胞AMHR2的阳性表达报道相似[21],性未成熟组与Wu等[17,19]结果显示 的AMHR2在未分化间质细胞表达并AMH通过AMHR2调节间质细胞分化相似,性成熟组与Ohyama实验结果相似;Ohyama等研究发现性成熟大鼠睾丸里AMH 、AMHRⅡ在精母细胞表达阳性[22]。
结论:两组SD雄鼠OX1R、OX2R、AMHR2等3种受体确实分别分布于下丘脑、脑垂体和睾丸中,其中最明显特点是3种受体在性未成熟组睾丸精原细胞呈现阴性,而在性成熟组精原细胞表达阳性,故我们推测3种受体参与下丘脑-脑垂体-睾丸性腺轴调节精原细胞分化。
1 Sakurai T, Amamiya A, Ishii M, et al. Orexins and orexin receptors: a family of hypothalamic neuroptides and G protein coupled receptors that regulate feeding behavior. Cell 1998; 92(4): 573-585
2 Sakurai T, Moriguchi T, Furuya K, et al. Structure and function of human prepro-orexin gene. J Bio Chem 1991; 274(25): 17771-17776
3 Baringa M. New appetite-boosting peptides found. Science 1998; 279(5354): 1134
4 Campbell RE, Grove KL, Smith MS. Gonadotropinreleasing hormone neurons coexpress orexin 1 receptor immunoreactivity and receive direct contacts by orexin fbers. Endocrinology 144(4): 1542-1548
5 Sasson R, Dearth RK, White RS, et al. Orexin A Induces GnRH Expression and Secretion from GT1-7 Hypothalamic GnRH Neurons. Neuroendocrinology 2006; 84(6): 353-363
6 Cataldi NI, Lux Lantos VA, Libertun C. Orexin A and B in vitro modify orexins receptors expression and Gonadotropins secretion of anterior pituitary cells of proestrous rats. Regul Pept 2014; 188(6): 25-30
7 Karteris E, Chen J, Randeva HS. Expression of human prepro-orexin and signaling characteristics of orexin receptors in the male reproductive system. J Clin Endocrinol Metab 2004; 89(4): 1957-1962
8 Liguori G, Assisi L, Squillacioti C, et al. Presence, distribution and steroidogenic effect of the peptides orexin A and receptor 1 for orexins in the testis of the South American camelid Alpaca(Vicugna pacos). Gen Comp Endocrinol 2012; 179(1): 137-142
9 Assisi L, Tafuri S, Liguori G, et al. Expression and role of receptor 1 for orexins in seminiferous tubules of rat testis. Cell Tissue Res 2012; 348(2): 601-607
10 Wu X, Arumugam R, Baker SP, et al. Pubertal and adult leydig cell function in mullerian inhibiting substancedifcient mice. Endocrinology 2005; 146(2): 589-595
11 Nurmio M, Tena-Sempere M, Toppari J. Orexins and the regulation of the hypothalamic-pituitary-testicular axis. Acta Physiol(Oxf) 2010; 198(3): 349-354
12 Trivedi P, Yu H, MacNeil DJ. Distribution of orexin receptor mRNA in the rat brain. FEBS Lett 1998; 438(1-2): 71-75
13 Cluderay JE, Harrison DC, Hervieu GJ. Protein distribution of orexin-2 receptor in the rat central nervoussystem. Regul Pept 2002; 104(1-3): 131-144.
14 Hervieu GJ, Cluderay JE, Harrison DC. Gene expression and protein distribution of distribution of the orexin-1 receptor in the rat brain and spinal cord. Neuroscience 2001; 103(3): 777-797
15 Blanco M, Lopez M, Garcla-Caballero T, et al. Cellular localization of orexin receptors in human pituitary. J Clin Endocrinol Metab 2001; 86(7): 1616-1619
16 Josso N, di Clemente N, Gouédard L. Anti-Müllerian hormone and its receptors. Mol Cell Endocrinol 2001; 179(1-2): 25-32
17 Wu X, Zhang N, Lee MM. Müllerian inhibiting substance recruits ALK3 to regulate leydig cell differentiation. Endocrinology 2012; 153(10): 4929-4937
18 Sriraman V, Niu E, Matlas JR. Müllerian inhibiting substance inhibits testosterone synthesis in adult rats. J Androl 2001; 22(5): 750-758
19 Lee MM, Seah CC, Masiakos PT, et al. Müllerianinhibiting substance type Ⅱ receptor expression and function in purifed rat leydig cells. Endocrinology 2014; 140(6): 2819-2827
20 Lebeurrier N, Launay S, Macrez R, et al. Anti-Mullerianhormone-dependent regulation of the brain serine-protease inhibitor neuroserpin. J Cell Sci 2008; 121(Pt20): 3357-3365
21 Mendis-Handagama SM, Di Clementi N, Ariyaratne HB, et al. Detection of anti-Mullerian hormone receptor II protein in the postnatal rat testis from birth to sexual maturity. Histol Histopathol 2006; 21(5): 125-130
22 Ohyama K, Ohta M, Hosaka YZ, et al. Expression of anti-Müllerian hormone and its type II receptor in germ cells of maturing rat testis. Endocr J 2015; 62(11): 997-1006
(2016-10-08收稿)
Study on the distribution of orexin and anti-mullerian hormone receptors in the hypothalamic-pituitary-testicular axis and their reproductive biological significance
Haimiti.Abudulimu1, Li Yan1, Guo Qiong1, Rong Xiaoling2, Li Tian1, Adilijiang.Yiming3*
1. Department of Histology and Embryology, Urumqi 830011, China;
2. Clinical Laboratory of the Second Affliated Hospital, Xinjiang Medical University;
3. Department of Anatomy, Xinjiang Medical University
Adilijiang.Yiming, E-mail: adljym@163.com
ObjectiveTo study the distribution of orexin receptor 1 (OX1R), orexin receptor2 (OX2R), antimullerian hormone receptor Ⅱ (AMHRⅡ) in hypothalamus, pituitary and testis of immature and mature male SD rats.MethodsImmunohistochemical stain was applied to detect the expressions of OX1R, OX2R, and AMHRⅡReceptors in hypothalamus ,pituitary and testis of the both rats.ResultsOX1R, OX2R, and AMHRⅡ receptors positively expressed at the neuron cell membrane and cytoplasm of periventricular zone, medial zone and lateral zone of hypothalamus in the both rats; there was also some positive cells in adenohypophysis of the both; the distribution of three receptors was obviously differences in the testis ,there were positive expressions of three receptors at cytoplasm and cell membrane of leydig cells in testis of immature rats, but there were positive expression of three receptors at cytoplasm and cell membrane of leydig cells and also spermatogonium in testis of mature rats.ConclusionHigher expression of three receptors were found in the hypothalamus-Pituitary-Testistular axis of the rats, indicating that orexin and anti-mullerian hormones may be associated with spermatogonium differentiation of male reproductive system.
orexin receptor; anti-mullerian hormone receptor; Rats, Sprague-Dawley; leydig cells; Spermatogonia
10.3969/j.issn.1008-0848.2016.11.001
R 321.1
*通讯作者,E-mail: adljym@163.com

