有氧运动与多糖干预对肥胖大鼠的血脂调节及抗炎作用
张 静,沙继斌,张 林,张成岗(.苏州大学 体育学院,江苏 苏州 2502;2.山东体育学院 运动基础科学学院,山东 济南 25002;.军事医学科学院 放射与辐射医学研究所,北京 00850)
有氧运动与多糖干预对肥胖大鼠的血脂调节及抗炎作用
张 静1,3,沙继斌2,3,张 林1,张成岗3
(1.苏州大学 体育学院,江苏 苏州 215021;2.山东体育学院 运动基础科学学院,山东 济南 250102;3.军事医学科学院 放射与辐射医学研究所,北京 100850)
目的:拟验证有氧运动与多糖干预对高脂膳食诱导肥胖大鼠的血脂调节作用及抗炎效应。方法:①分别采用跑台训练及多糖灌胃作为干预手段;②形态学指标测定;③利用ELISA法测定血清脂质及炎症因子改变。结果:①高脂膳食诱导肥胖大鼠体重、Lee指数及脂肪系数均有明显上升;有氧运动及多糖干预可使上述形态学指标下降。②高脂膳食诱导肥胖大鼠血清脂质及炎性因子水平显著升高,而HDL水平显著降低。③有氧运动及多糖干预均可使大鼠血清脂质与炎性因子水平显著降低,HDL水平显著升高。结论:高脂膳食诱导大鼠肥胖过程中同步伴有血脂升高,炎症反应加剧。有氧运动及多糖干预均可通过有效抗炎改善血脂,其中多糖的血脂调节作用更为显著。
有氧运动;多糖;肥胖;血脂;抗炎
肥胖是一种常见的生理现象,其特征是脂肪在皮下组织及内脏中的大量蓄积。除遗传因素影响外,能量代谢失衡目前被认为是肥胖的根本诱因[1]。肥胖可导致心脑血管疾病、糖尿病及肿瘤的发病率升高,因此,如何合理、有效地减肥,已成为一个日趋沉重的生活与社会问题。肥胖个体多伴有明显超重、脂肪层过厚、与机体其他部分比例失调等外在表现,而脂代谢紊乱所致高脂血症则是肥胖的典型内在表型之一。近年来有学者提出肥胖的“慢性炎症反应状态”理论[2],认为肥胖发生与机体的慢性、低度、系统性炎症发生、发展密切相关,肥胖可归因于炎性疾病[3-4]。国外学者如Jeffrey I.Gordon[5]、Patrice D.Cani[6]等,国内学者如赵立平[7]等的研究结果,均有力支持了这一理论。
适当有氧运动可有效调节血脂并控制体重已得到研究证实[8],而近年来研究发现运动具有确定的抗炎效应[9]。如上所述,炎症反应被认为是肥胖发生的重要诱因,由此提示:有氧运动的减脂控体重效果很可能通过抑制机体炎症反应而实现。有研究证实天然植物多糖可有效调节血脂[10]。近期研究发现人体不能消化吸收的植物多糖在进入大肠后,一方面可有效促进肠道内益生菌增殖,一方面可产生具有显著抗炎效应的短链脂肪酸(short chain fatty acid,SFCA)[11],由此推测植物多糖的血脂调节作用也可能通过抗炎反应来实现。
因此,本研究拟分别采用有氧跑台训练与多糖灌胃两种方式,对高脂膳食诱导肥胖大鼠进行干预,验证这两种干预措施对动物体重及体脂含量的影响,同步观察分析、比较上述措施的血清脂质调节作用与抗炎效应,并探讨两者之间的可能联系,为进一步明确肥胖发生的机理、寻求有效的减脂控体重措施提供实验依据。
1 材料与方法
1.1 高脂膳食诱导肥胖动物模型建立及动物分组
健康雄性SD大鼠70只,体重(117±15.4)g,购自军事医学科学院实验动物中心(动物许可证号:SCXK(军)2007-004)。随机选取10只为正常对照组,饲喂普通饲料;剩余60只饲以高脂饲料D12492(许可证号:SCXK(京)2014-0008),共饲喂4周,期间每周定时称量体重,测量体长。4周后参照王从容等的研究结果[12],选择体重大于对照组平均体重20%的大鼠作为肥胖大鼠。选取利用高脂膳食诱导肥胖大鼠30只,将其随机分为肥胖对照组、有氧运动组、多糖干预组,每组10只。
1.2 实验方法
1.2.1 干预方案
1.2.1.1 有氧运动方案 选择中等强度跑台训练,跑台坡度为0°,运动负荷设定为25 m/min,60 min/day,每周训练6 d,共训练6周。第一周为适应性训练阶段,从10 m/min开始,以每级速度增加5 m/min,每级持续15 min逐级递增至预定负荷。自第二周开始为正式实验阶段,每日定时按设定运动负荷进行跑台训练。
1.2.1.2 多糖干预方案 以0.9%生理盐水将多糖(购自苏州科景生物医药科技有限公司,编号为ss0627)配制为浓度为10%的溶液,以动物体重的0.5%作为灌胃剂量,其余各组代以等量生理盐水,于每日下午定时进行灌胃,共持续6周。
1.2.2 实验方法
1.2.2.1 形态指标测定 6周干预结束后,以10%水合氯醛腹腔注射麻醉动物,然后准确测量记录动物体重、身长,计算Lee指数,Lee指数=体重(g)1/3×103/体长(cm)(体长测定标准:自鼻尖至肛门处);而后分别取肾周脂肪垫、附睾脂肪垫准确称重,计算脂肪系数,脂肪系数=(肾周脂肪垫+附睾脂肪垫)/体重×100%。
1.2.2.2 血清指标测定 心内取血,3000 g离心收集血清,采用ELISA试剂盒(购自R&D Systems,USA),按照试剂盒说明书进行操作。在Bio-Rad酶标仪上首先完成标准曲线绘制,而后分别测定血清脂质(TG、TC、LDL、HDL)及炎性因子(IL-6、IL-1、TNF-α、NF-κB)水平变化。
1.2.3 统计学分析
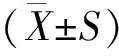
2 实验结果
2.1 高脂膳食诱导肥胖大鼠动物模型建立
如图1 A显示,以高脂饲料D12492饲喂4周后,大鼠平均体重已超过普通饲料饲喂对照组大鼠平均体重20%;如图1 B所示,高脂饲料D12492饲喂大鼠Lee指数在建模过程中均大于普通饲料饲喂对照组,表明高脂膳食诱导肥胖大鼠动物建模成功。

图1 高脂膳食诱导肥胖大鼠体重及Lee指数变化
2.2 有氧运动及多糖干预前、后动物形态学指标变化
干预前,与正常对照组相比,肥胖对照组体重明显增加且有显著性差异(P<0.01);Lee指数、脂肪系数有增加,但无显著性差异(P>0.05);干预后,与肥胖对照组相比,有氧运动组动物体重、Lee指数、脂肪系数均下降,有显著性差异(P<0.01,P<0.01,P<0.05),多糖干预组动物体重下降,有显著性差异(P<0.05),而Lee指数、脂肪系数虽有下降,但无显著性差异(P>0.05)(表1、图2)。上述结果表明多糖干预的减脂控制体重效果不如有氧运动显著。
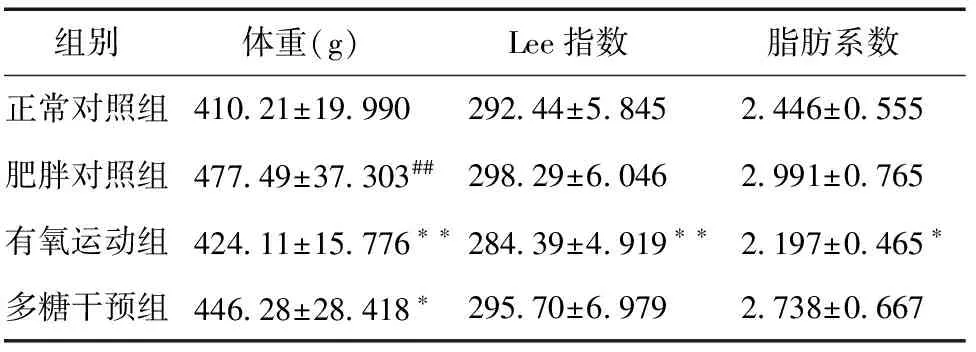
表1 干预前、后不同组别大鼠形态学指标变化
注:##P<0.01,与正常对照组相比;*P<0.05,**P<0.01,与肥胖对照组相比。
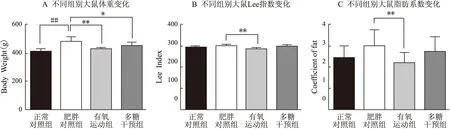
图2 干预前、后不同组别大鼠形态学指标变化
2.3 有氧运动及多糖干预前、后实验动物血清脂质指标变化
干预前,与正常对照组相比,肥胖对照组血清TG、TC、LDL水平均显著上升,HDL水平显著下降,均有显著性差异(P<0.001);干预后,与肥胖对照组相比,有氧运动组、多糖干预组动物血清TG、TC、LDL均显著降低,HDL则显著升高,均有显著性差异(P<0.001),且多糖干预的血脂调节效果比有氧运动更为显著(图3、表2)。
上述结果表明:有氧运动及多糖干预均可有效改善血清脂代谢,使可能诱发高脂血症的不良脂质浓度显著降低,同时使对机体有良好保护作用的HDL浓度显著升高。与有氧运动组相比,多糖干预表现出了更有效的改善血脂代谢作用,这与减脂控制体重的结果不尽一致。
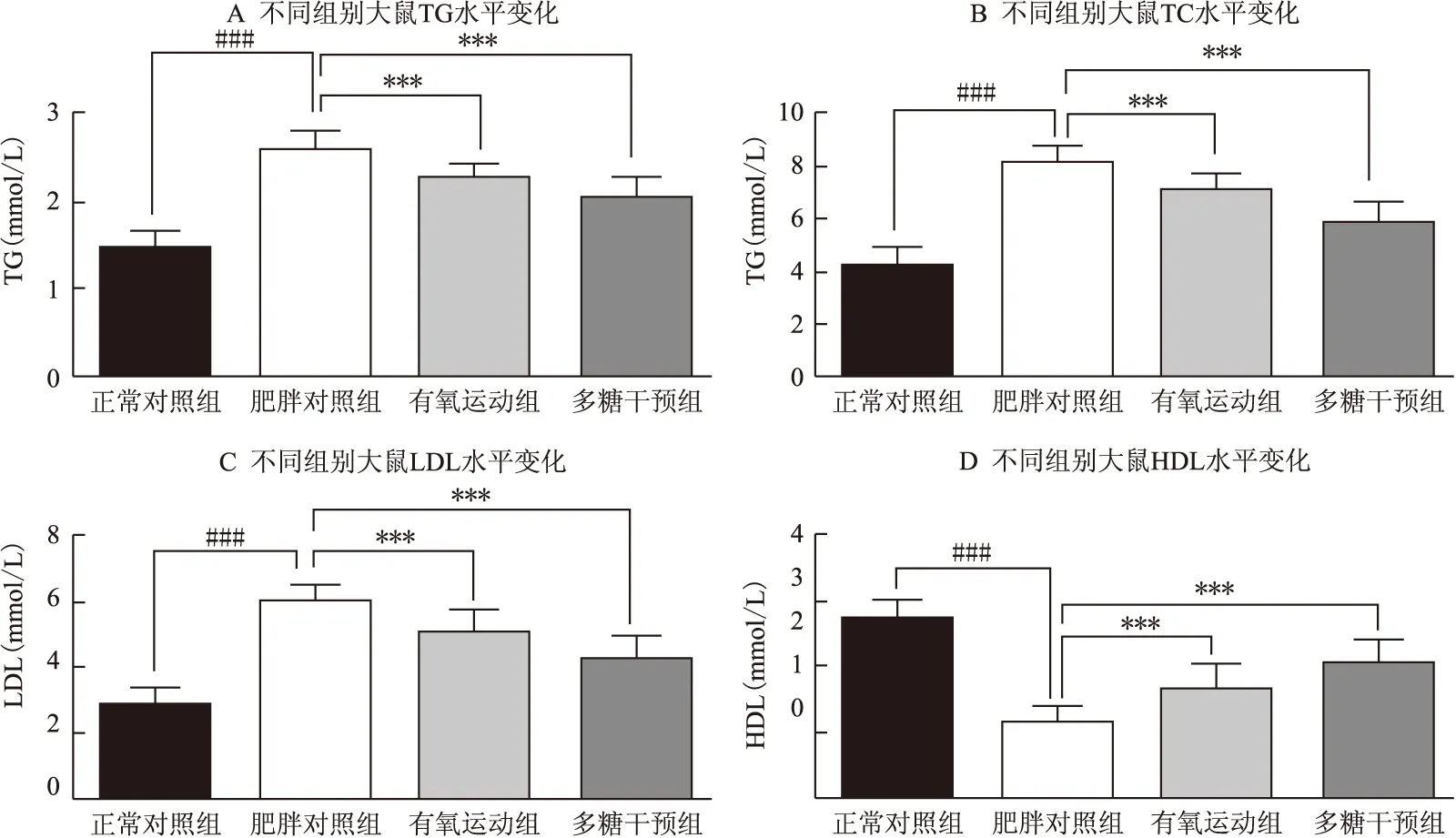
图3 干预前、后不同组别大鼠血清脂质指标水平变化

表2 干预前、后不同组别大鼠血清脂质指标水平变化
注:###P<0.001,与正常对照组相比;***P<0.001,与肥胖对照组相比。
2.4 有氧运动及多糖干预前、后炎性因子水平变化
干预前,与正常对照组相比,肥胖对照组动物血清IL-1、IL-6、TNF-α、NF-κB水平均显著上升,均有显著性差异(P<0.001);干预后,与肥胖对照组相比,有氧运动组大鼠血清IL-1、IL-6、TNF-α、NF-κB均显著下降,均有显著性差异(P<0.001);多糖干预组大鼠血清IL-1、IL-6、TNF-α、NF-κB同样显著下降,也有显著性差异(P<0.01,P<0.01,P<0.01,P<0.05)(图4、表3)。
上述结果表明有氧运动及多糖干预均具有较好的抗炎作用,可有效降低血清中IL-1、IL-6、TNF-α等多种促炎细胞因子的浓度,同时还有效下调了控制促炎因子转录的NF-κB的水平。与多糖干预组相比,有氧运动组表现出了更强烈的抗炎作用,这可能也是其血脂调节作用虽然不如多糖干预组,但最终取得更为显著的减脂控制体重效果的原因所在。
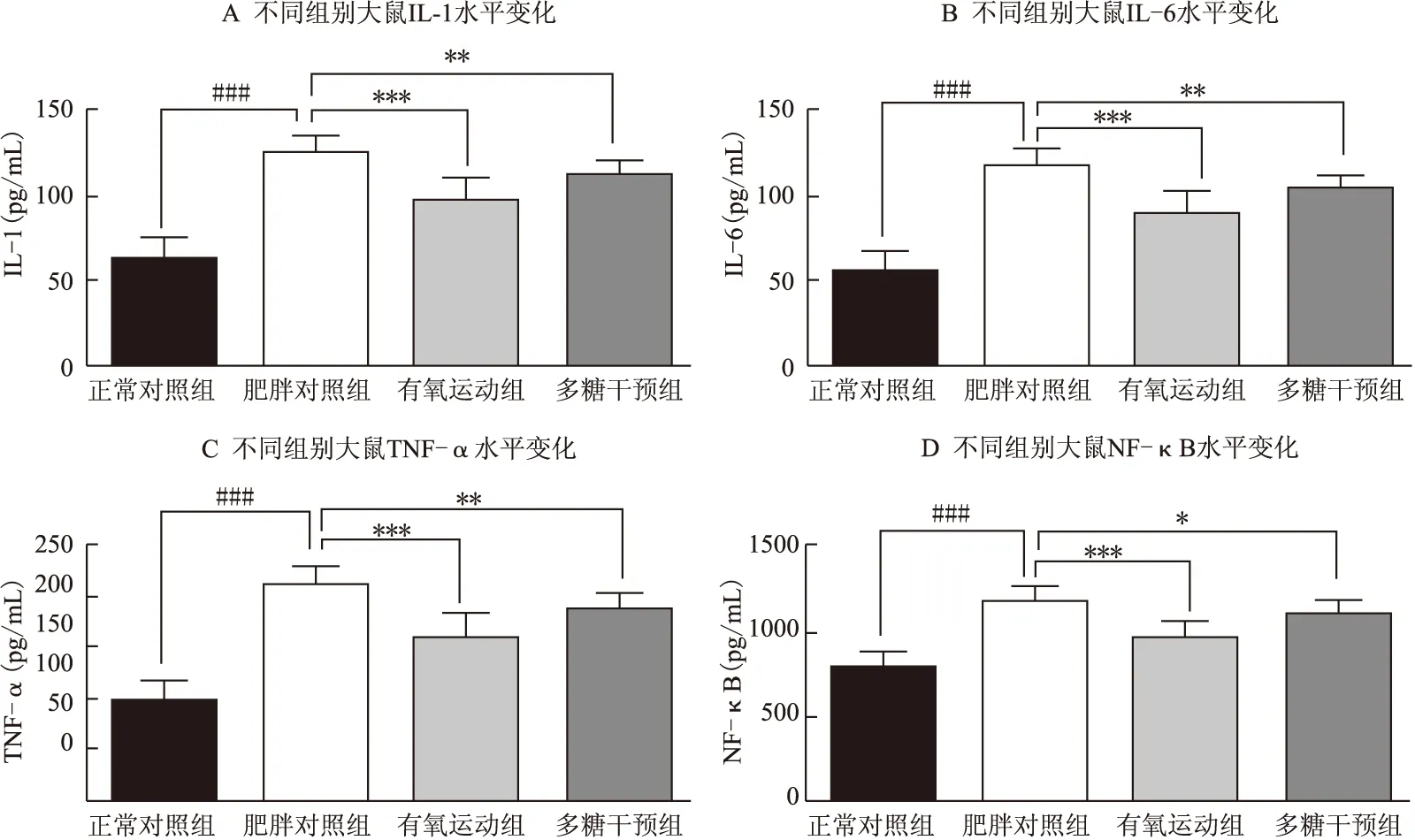
图4 干预前、后不同组别大鼠血清炎性因子水平变化

表3 干预前、后不同组别大鼠血清炎性因子水平变化
注:###P<0.001,与正常对照组相比;*P<0.05,**P<0.01,***P<0.001,与肥胖对照组相比。
3 讨论
上世纪50年代就有研究者成功建立了“下丘脑肥胖”动物模型。饮食诱导肥胖模型由于更接近人体真实生理状况,逐渐得到更广泛应用。刘利民等在国内率先建立了高脂膳食诱导肥胖的动物模型[13]。之后在杨锡让教授指导下,王从容、张勇、何玉秀等学者围绕单纯性肥胖发生机理开展了系列研究[12]。本实验采用高脂饲料饲喂大鼠4周,成功建立了高脂膳食诱导肥胖大鼠模型。高脂膳食诱导肥胖大鼠显著体征包括体内尤其是内脏脂肪堆积、体重增加、Lee指数升高等。与之前研究者报道的诱导肥胖成功率约在50%相比[12],本实验所采用高脂饲料D12492诱导肥胖成功率更高,约为75%。
3.1 有氧运动的血液脂质调节作用及抗炎作用验证
长时间中、低强度有氧运动可有效动用体内脂肪,脂肪组织贮存的甘油三酯被动员后分解为游离脂肪酸(free fat acid,FFA),经由血液转运至肌肉内,通过β氧化过程合成ATP而参与运动供能,上述过程被认为是有氧运动减肥的生理学基础[8]。近年来,陈文鹤教授课题组发现运动过程中血液FFA向肌肉转运后,继而可动员更多的甘油三酯及富含甘油三酯的脂蛋白进一步水解,由此实现调节血脂并减少体脂含量的目的[14]。本研究发现,经6周中等强度跑台训练后,大鼠体重、Lee指数、脂肪系数均显著降低。6周中等强度跑台训练可有效降低大鼠血清中TC、TG和LDL水平,同时升高对心脑血管具有保护效应的HDL水平。以上结果表明6周有氧运动在有效改善动物脂质代谢的同时,可实现有效降脂控体重。
此前已有研究证实脂肪组织中IL-6、TNF-α、Leptin等促炎因子C反应蛋白(C reaction protein,CRP)水平均随体内脂肪含量,尤其是内脏脂肪含量增加而上升。进而髓源性细胞不断向脂肪组织中浸润,使炎症反应随体脂含量升高而逐渐加剧[4,15],表明炎症反应其实是诱发肥胖主要原因之一[4,7]。同时,研究证实运动具有确定的抗炎效应,可通过:1)有效增加脂肪组织动用,降低体脂含量,从而减轻致炎淋巴细胞向脂肪组织内浸润;2)有效增加骨骼肌收缩过程中抗炎细胞因子(肌源性因子)如IL-10的产生与释放;3)有效减少单核细胞与巨噬细胞膜表面Toll样受体的表达,由此可导致其下游应答减弱等作用途径来降低机体的炎症反应[9]。
本研究发现6周有氧运动在有效改善血液脂质代谢的同时,可显著降低动物血清中IL-1、IL-6、TNF-α水平,并可使调节促炎细胞因子表达的NF-κB水平显著下降。这与目前多数已报道结果一致,也提示有氧运动的血脂调节作用可能是通过抑制炎症反应而实现。
3.2 多糖干预的血液脂质调节作用及抗炎作用验证
本研究中采用的多糖为木薯来源植物多糖+膳食纤维复合制剂,上述成分在小肠中不能进行消化、吸收。此类包含一种或多种不被消化或难以被消化的食物成分(通常为植物多糖、膳食纤维等),可以选择性剌激结肠内细菌增殖或提升其活性的物质,通常被称为益生元(Prebiotics)。研究已证实补充益生元可能使机体获得如下益处:1)增强肠上皮细胞的免疫屏障作用;2)调节巨噬细胞/淋巴细胞的细胞因子分泌;3)增强对有害菌的定植抗力;4)上调肠道粘膜表面抗菌肽、抗氧化复合物及抗氧化酶的生成;5)导调节性T细胞的产生;6)增加肠粘膜免疫系统与机体共生菌群之间的物质、信息、能量交换;7)在诱导调节性T细胞的同时,促进SFCA的生成等[11,16]。上述改变均提示补充该类多糖后可提升机体的抗炎能力。
本研究发现多糖灌胃干预6周后,大鼠体重有显著下降,Lee指数、脂肪系数下降则无统计学意义;大鼠血清TC、TG和LDL水平均显著下降,HDL水平显著升高,其调节血脂效果还优于有氧运动组;动物血清中IL-1、IL-6、TNF-α水平显著降低,同时伴有调节促炎细胞因子表达的NF-κB水平显著下降,其抗炎作用不如有氧运动干预的作用强烈。据此推测,这两种干预方式在血脂调节作用与抗炎作用两方面所表现出的不一致,恰恰是其干预后动物表型改变趋势一致,但体重及体脂含量下降幅度存在差异的原因。
综合上述结果,发现不同措施干预前、后血清促炎因子浓度的改变与血清脂质代谢的变化趋势完全一致。在高脂膳食诱导肥胖过程中高脂血症发生的同时,伴有炎症反应加剧;而在采取不同方式干预后血清脂质代谢改善的同时,则伴有炎症反应被抑制;由此证实高脂膳食所诱导肥胖过程中,炎症反应确实是重要诱因,反之,如能有效抑制、消除炎症反应,则可以实现调节血脂,并降低体脂含量、有效控制体重的目标。
4 结论
本研究比较验证了6周有氧运动与多糖灌胃两种方式干预前、后高脂膳食诱导肥胖动物形态学指标改变,及上述干预方式的血清脂质与炎性因子的变化趋势,结果发现:1)肥胖组体重、Lee指数、脂肪系数等明显增加;有氧运动与多糖干预均可使动物体重、Lee指数、脂肪系数下降,其中多糖干预的减脂控制体重效果不如有氧运动显著。2)肥胖组血清TG、TC、LDL水平均显著上升,HDL水平显著下降;有氧运动与多糖干预均可使动物血清TG、TC、LDL水平显著降低,HDL水平显著升高。二者相比,多糖干预的血脂调节效果比有氧运动更为显著。3)肥胖组动物血清IL-1、IL-6、TNF-α、NF-κB水平均显著上升,有氧运动与多糖干预均可使大鼠血清IL-1、IL-6、TNF-α、NF-κB水平显著下降,提示有氧运动及多糖干预均具有较好的抗炎作用。与多糖干预组相比,有氧运动组表现出了更强烈的抗炎作用,这可能是其减脂控制体重效果更为显著的原因。4)血清促炎因子浓度的改变与血清脂质代谢的变化趋势完全一致,提示对炎症反应的有效调控可能是调节改善血脂、降低体脂含量、有效控制体重的关键所在。
[1] Emily J.Dhurandhar,Scott W.Keith.The aetiology of obesity beyond eating more and exercising less [J].Best Practice and Research Clinical Gastroenterology,2014,28:533-544.
[2]Ramos EJ,Xu Y,Romanova I,et al.Is obesity an inflammatory disease?[J].Surgery,2003,134(2):329-335.
[3]孙明晓.有氧运动与饮食干预对肥胖少年氧化应激状态的影响和分子机制研究[D].北京:北京体育大学,2008:11-35.
[4]Wellen KE,Hotamisligil GS.Obesity-induced inflammatory changes in adipose tissue[J].J Clin Invest,2003:112(12):1785-1788.
[5]Peter J.Turnbaugh,Ruth E.Ley,Michael A.Mahowald,et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature,2006,444:1027-1031.
[6]Patrice D.Cani,Rodrigo Bibiloni,Claude Knauf,et al.Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J].Diabetes,2008,57:1470-1481.
[7]Liping Zhao.The gut microbiota and obesity:from correlation to causality[J].Nature Reviews Microbiology,2013,11:639-647.
[8]John A.Hawley,Mark Hargreaves,Michael J.Joyner,et al.Integrative biology of exercise[J].Cell,2014,159:738-749.
[9]Gleeson M,Bishop NC,Stensel DJ,et al.The anti-inflammatory effects of exercise:mechanisms and implications for the prevention and treatment of disease[J].Nature Reviews Immunology,2011,11:607-615.
[10]黄卫,曾富华,杨小舟,等.仙人掌多糖对高脂血症大鼠血脂的影响[J].中医研究,2008,21(6):13-16.
[11]David B.Pyne,Nicholas P.West,Amanda J.Cox,et al.Probiotics supplementation for athletes-Clinical and physiological effects[J].European Journal of Sport Science,2015,15(1):63-72.
[12]杨锡让,王从容,张勇,等.运动与身体成分[M].北京:北京体育大学出版社,1998:1-37.
[13]刘利民.高脂饲料致大鼠肥胖的研究[J].北京医科大学学报,1991,25(5):359-364.
[14]许汪宇,陈文鹤,沈勋章.中低强度有氧运动结合饮食控制对肥胖青少年血脂和肝脏功能的影响[J].中国运动医学杂志,2011,30(8):706-711.
[15]Kullo IJ,Hensurd DD,Allison TG.Comparison of numbers of circulating blood monocytes in men grouped by body mass index(<25,25 to <30,≥30)[J].The American Journal of Cardiology,2002,89(12):1441-1443.
[16]Pitsavos C,Panagiotakos DB,Chrysohoou C,et al.The associations between physical activity,inflammation,and coagulation markers,in people with metabolic syndrome:the ATTICA study[J].Eur J Cardiovasc Prev Rehabil,2005,12(2):151-158.
责任编辑:郭长寿
Serum Lipids Amelioration and Anti-Inflammatory Effect of Aerobic Exercise and Polysaccharide Intervention on Obese Rat
ZHANG Jing1,3,SHA Jibin2,3,ZHANG Lin1,ZHANG Chenggang3
(1.School of Physical Education,Soochow University,Suzhou 215021,Jiangsu,China;2.School of Basic Sports Science,Shandong Institute of Physical Education,Jinan 250102,Shandong,China;3.Academy of Military Medical Sciences,Beijing Institute of Radiation Medicine,Beijing 100850,China)
To estimate the role of the serum lipids amelioration and anti-inflammatory effects of different intervention methods on obese rats.Methods:①Aerobic treadmill training and polysaccharide solution lavage were used as intervention methods for 6 weeks;②Collection of the morphological indexs;③The serum lipids and inflammatory cytokines were determined by ELISA method.Results:①The body weight,Lee index and fat coefficient of the obesity group were increased to some extent;Aerobic treadmill training and polysaccharide lavage both decreased the indexes referred above.②The serum lipids of the obesity group were significantly increased,synchronously with the inflammatory cytokines,whereas HDL was decreased significantly;③All these parameters showed a significant opposite tendency after the aerobic treadmill training and polysaccharide intervention.Conclusion:The high-fat induced obesity showed a hyperlipidemia accompanied with a synchronic aggravated inflammatory response.Nevertheless,the aerobic treadmill training and polysaccharide intervention showed an obvious anti-inflammatory effect and could invert the tendency of serum lipids.The polysaccharide intervention showed a more stronger serum lipid amelioration.
aerobic exercise;polysaccharide;obesity;serum lipids;anti-inflammatory
2015-12-09;
2016-01-13
山东省自然科学基金,编号:ZR2014JL024;山东省高等学校科技计划项目资助,编号:J13LE04。
张 静(1990—),女,硕士,主要研究方向为运动与健康。
沙继斌(1974—),男,副教授,博士后,主要研究方向为运动与健康的分子生物学机制。
G804.7
A
1004-0560(2016)02-0086-06
◀运动人体科学

