环介导等温扩增技术及其在转基因作物检测中的应用
易小平 夏启玉 郭安平

摘 要 转基因作物及其产品的安全性一直存在着较大的争议,人们对转基因产品仍持谨慎态度。因此,快速、准确、灵敏的转基因检测手段对转基因生物的安全监管至关重要。环介导等温扩增(LAMP)是一种恒温核酸扩增的技术,其设备简单、成本低廉、结果可视化,且灵敏度高,现已广泛应用于细菌、病毒、寄生虫、转基因等检测行业。介绍了LAMP技术的原理、特点和联合应用其他技术,及其在转基因作物与产品检测方面的应用情况。
关键词 环介导等温扩增;转基因作物;成分检测
中图分类号 Q789 文献标识码 A
Abstract The safety of genetically modified crops and their products has always been under controversy; People remain cautious about transgenic products. Therefore, fast, accurate and sensitive detection methods for transgenic ingredients are very important to the safety supervision of genetically modified organisms. Loop-mediated isothermal amplification(LAMP)is a kind of isothermal nucleic acids amplification technology. Due to its simple equipment, low cost, result visualization and high sensitivity, LAMP has been widely used in detections of bacteria, viruses, parasites, transgenic ingredients, etc. In this paper, we reviewed the principle, characteristics, and combined application with other technology of LAMP and its applications in detection of genetically modified crops and their products.
Key words Loop-mediated isothermal amplification; Genetically modified crops; Ingredient detection
doi 10.3969/j.issn.1000-2561.2016.01.030
转基因是一项新技术,是一个新产业,具有广阔的发展前景。自1996年转基因番茄商业化种植以来,全球转基因作物的种植面积越来越大。国际农业生物技术应用服务组织发布的报告称,2014年全球转基因作物总种植面积达1.815亿hm2,比2013年增加了630万hm2[1]。但是,长期以来,人们对转基因作物及其产品的食用安全和环境安全一直存在争议。我国于2001年颁布了《农业转基因生物安全管理条例》,旨在加强农业转基因生物安全管理。目前我国对转基因问题的态度,一是确保安全,二是要自主创新。也就是说,在研究上要大胆,在推广上要慎重。迄今为止,我国只批准了转基因棉花和木瓜的商业化种植,还未批准任何转基因主粮的商品化生产。2009年,我国发放了转基因抗虫水稻华恢1号和Bt汕优63在湖北省生产应用的安全证书,并于2014年12月11日续签5年,但仍未批准商业种植。但是,我国出口的米制品中屡次检出转基因成分,非法种植销售转基因作物的现象也时有发生,因此,我国还需要进一步加强转基因生物安全的监管工作。
快速和准确的转基因检测技术是转基因安全监管的重要工具。目前转基因检测中使用最多的是基于核酸序列的PCR方法。环介导等温扩增(loop-mediated isothermal amplification,LAMP)是一种在等温条件下进行核酸扩增的技术,与常规PCR相比,其設备简单,特异性好,灵敏度高,结果肉眼可视,因此,很适合于基层或现场快速检测。该方法已广泛应用于微生物病原、寄生虫、转基因成分等领域的快速检测[2-3]。本研究介绍了LAMP的原理、特点、联合应用其他技术及其在转基因作物与产品检测中的应用。
1 环介导等温扩增技术
LAMP是日本荣研株式会社的Notomi等[4]开发的一种新型等温核酸扩增技术,在链置换DNA聚合酶(Bst DNA polymerase)的作用下,60~65 ℃恒温扩增,30~60 min左右即可完成核酸扩增,扩增时产生大量白色沉淀,用肉眼观察就能鉴定扩增与否。
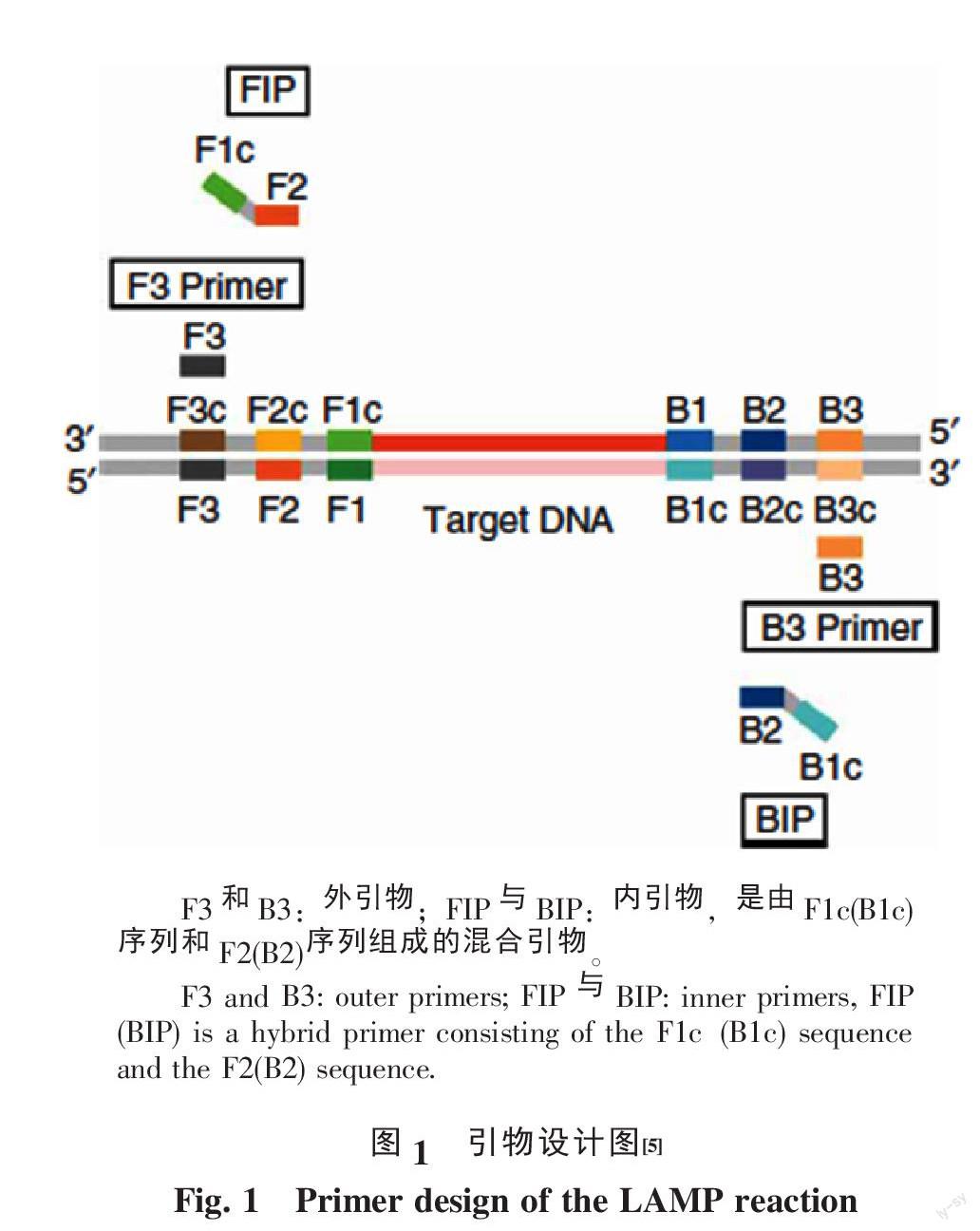
LAMP技术需要一对外引物F3与B3和一对内引物FIP与BIP特异性的识别靶序列的6个区域,其中FIP由F1c和F2组成,BIP由B1c和B2组成(图1)。
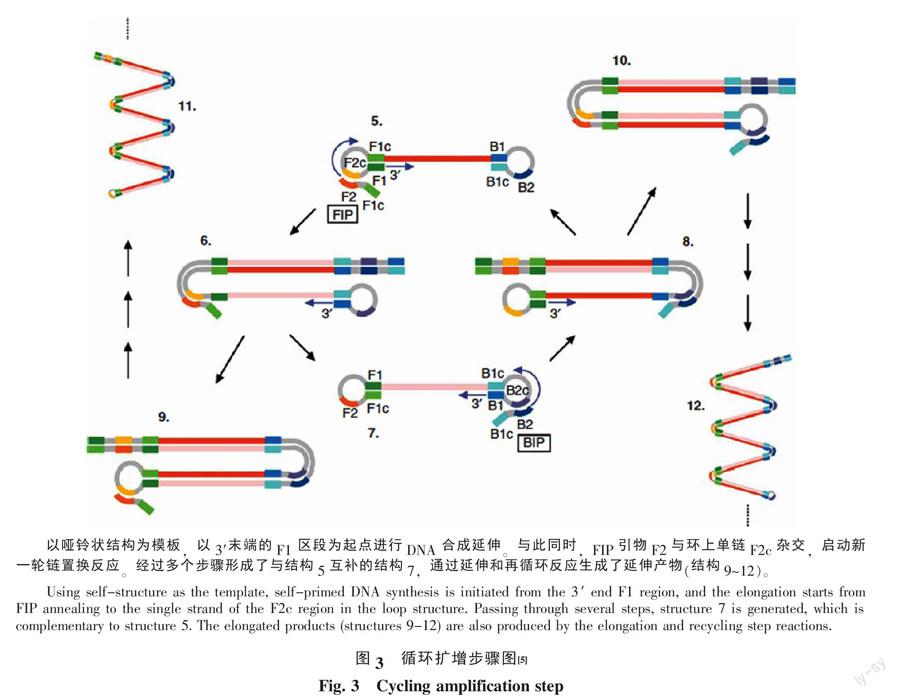
LAMP反应在Bst DNA聚合酶的作用下,在60~65 ℃下不停的进行链置换DNA合成,达到核酸扩增的目的。LAMP的扩增原理[5]见图2和图3,扩增分两个阶段:起始阶段和扩增循环与延伸阶段,最终形成的扩增产物是有许多环的花椰菜形状的茎-环结构的DNA。
1.1 特点
LAMP与最常用的PCR技术相比,具有以下几个特点:(1)设备简单,反应快速。只需要一台水浴锅或恒温箱即可;30~60 min就可完成扩增反应。(2)扩增效率高。可在30~60 min内实现109~1010倍的扩增[6],灵敏度比普通PCR技术要高2~3个数量级[7-8]。(3)特异性高。LAMP的4条引物特异性的匹配模板上的6个区域,任何一个区域不匹配就无法完成扩增。(4)结果可肉眼观察。
LAMP也存在一些缺点,如产物检测是终点检测,无法区分非特异性扩增和引物二聚体引起的假阳性;LAMP反应开盖易造成气溶胶污染。此外,LAMP反应的靶序列最好控制在300 bp以下,大的片段较难扩增。
1.2 产物检测
1.2.1 琼脂糖凝胶电泳 电泳检测可见LAMP扩增产物是大小不等的DNA片段组成,呈现出特异的梯状条带。电泳法检测扩增产物需要特定的仪器设备,耗时长,不能满足快速检测的需要。
1.2.2 浊度观察法 LAMP扩增时产生的焦磷酸根离子与反应溶液中的Mg2+反应产生大量副产物焦磷酸镁白色沉淀,因此肉眼观察即可判断扩增反应的发生与否:若反应管内液体浑浊,离心或静置后有白色沉淀则为阳性,否则为阴性。LAMP反应中焦磷酸镁沉淀的生成量与DNA生成量之间呈线性关系,因此可对起始模板定量,并且焦磷酸镁沉淀在400 nm处有吸收峰,使得LAMP反应可通过浊度进行实时定量和定性分析[9-10]。浊度法可避免开盖污染。目前已有商品化恒温扩增实时浊度仪出售。
1.2.3 颜色观察法 LAMP反应可通过添加荧光染料后的颜色变化来鉴定扩增与否。常用的有SYBR Green I、钙黄绿素[11]、羟基萘酚蓝(HNB)[12]等。添加SYBR Green I时,若发生了扩增,LAMP反应液由橙色变为绿色。添加钙黄绿素检测时,若发生了扩增,反应液由橙色变为绿色,但是加入了Mn2+导致反应灵敏度降低。HNB不需额外添加成分,灵敏度与SYBR Green I相当,发生扩增反应时,反应液由紫色变为天蓝色。钙黄绿素和HNB均可在反应前加入,可避免开盖污染;但SYBR Green I要在反应结束后才加入,因为显色需要的SYBR Green I的浓度会抑制扩增反应。有研究者在反应液上覆盖一层矿物油,再将SYBR Green I点加在管壁或管盖里,待反应完成后颠倒反应管混匀来观察颜色变化,也无需开盖;此外,还有商业化的特制的LAMP反应管。
除了以上终点检测法外,LAMP还可以利用荧光染料[13-14]、荧光素酶[15]等进行实时定性或定量检测,目前已有多家公司出售恒温荧光扩增检测仪。
1.3 技术改进
Nagamine等[16]通过在F2、F1 之间和B2、B1之间增加上游环状引物(LF)和下游环状引物(LB),可使反应时间缩短至30 min,提高了检测效率。Yano等[17]通过加入环引物的LAMP方法对肠毒素大肠杆菌(ETEC)的热敏肠毒素LT1及耐热肠毒素ST1基因进行检测,扩增反应时间仅需35 min。由于LAMP的引物设计较为复杂,为方便LAMP引物的设计,LAMP 引物设计可由专门的在线引物设计网站完成(http://primerexplorer.jp/e/)。
LAMP技术是针对DNA进行的检测,但在反应体系中直接加入反转录酶可进行RT-LAMP,用来对RNA病毒进行快速检测,省去了反转录步骤,极大缩短了RNA病毒检测的时间;RT-LAMP方法中也可以通过加入环引物的方式进一步缩短扩增反应时间,提高检测效率[18]。
此外,NEB公司开发的新型Bst链置换聚合酶(Bst 2.0 WarmStart DNA Polymerase),具有热启动活性,而且比普通的Bst酶具有更快的延伸活性,有效的提高了LAMP的扩增效率。
2 LAMP与其他技术的联合应用
2.1 结合DNA探针技术
LAMP虽然特异性较高,但是其结果观察还是不能避免非特异性产物引起的假阳性。利用探针标记技术进行LAMP,可以有效避免非特异性扩增引起的假阳性问题。Mori等[19]在LAMP反应体系中加入与模板片段互补的荧光标记的探针,反应完后,再加入阳离子多聚物聚乙烯亚胺(Polyethylenimine,PEI),PEI与LAMP扩增产物结合,产生PEI-DNA复合物沉淀,在紫外灯下观察沉淀中扩增产物DNA片段上结合的探针的荧光,可以特异性检测目的片段。申建维等[20]用多重LAMP同时扩增耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)耐药基因mecA和fem A,在反應过程中,两种分子信标荧光探针(FAM和TET)分别与mecA和femA基因的扩增产物互补序列结合,通过检测反应管中的两种荧光值来判断扩增结果,检测限为10 CFU/mL。Tani等[21]利用alternately binding quenching(AB-Q)探针建立了一种ABC-LAMP技术,快速成功的对氨氧化酶基因amoA基因进行定量分析。除了荧光标记的探针外,纳米金标记的探针也很好地应用于LAMP中。Jaroenram等[22]首次将纳米金颗粒标记的DNA探针应用于LAMP,用于虾黄头症病毒(yellow head virus,YHV)的鉴定。LAMP产物与纳米金标记的探针杂交5 min后,混合物中加入一定浓度的氯化镁溶液,若无特异性扩增产物,由于盐的屏蔽效应,纳米金颗粒会聚合到一起,使原本红色的溶液变为蓝紫色。此方法还可以用紫外可见光光谱法进行定量分析。该方法还成功应用于对虾野田村病毒(Penaeus vannamei nodavirus,PvNV)[23]、虾传染性肌肉溶解病毒(infectious myonecrosis virus,IMNV)[24]、白斑综合症病毒(white spot syndrome virus,WSSV)[25]和对虾肠孢子虫(Enterocytozoon hepatopenaei)[26]的检测。
2.2 结合横向流动试纸条技术
Kiatpathomchai等[27]首次将横向流动试纸条(Lateral flow dipstick,LFD)与LAMP结合,成功建立了对虾桃拉综合征病毒(Taura syndrome virus,TSV)的LAMP-LFD检测技术。在LFD检测反应中,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的探针与生物素标记的LAMP扩增产物特异性杂交,并与胶体金标记的抗FITC的抗体结合形成三元复合物,结合在LFD上具有生物素抗体的检测线上;未杂交的FITC标记探针与胶体金标记的抗FITC的抗体形成不含生物素的两元复合物,通过检测线而结合在控制线上,完成显色和结果判断。该方法的显色依赖于探针与目的核酸序列之间的特异性杂交,非特异性扩增无法显色,解决了终点检测时无法区分非特异性扩增的问题。Jaroenram等[28]建立了对虾白斑综合症病毒的LAMP-LFD检测方法,50 min内完成从DNA提取到LFD显色,灵敏度与巢式PCR相当。Njiru[29]建立了快速灵敏的检测非洲人类锥虫病(human African trypanosomiasis,HAT)病原的LAMP-LFD方法。国内也有一些LAMP-LFD的报道,如Wang[30]建立了转基因大豆Roundup Ready soybean(RRS)的LAMP-LFD检测方法,检测限为20拷贝质粒模板,是普通PCR的20倍。董培培等[31]利用LAMP-LFD技术实现了鳗利斯顿氏菌(Listonella anguillarum)的快速检测,整个过程可在30 min内完成,检测限为7.7 CFU/mL。其他研究者也相继建立了创伤弧菌(Vibrio vulnificus)[32]、海豚链球菌(Streptococcus iniae)[33]和单核细胞增生李斯特菌(Listeria monocytogenes)[34]的LAMP-LFD检测方法。LAMP-LFD法检测条件简单,特异性显色目的核酸片段,适用于基层实验室或现场检测时使用,目前已有商品化的核酸试纸条出售。
2.3 结合生物芯片技术
生物芯片是通过缩微技术,将生命科学领域中不连续的分析过程集成于芯片表面的微型生物化学分析系统,可以实现从生物化学反应到结果检测分析的所有功能,具有集成化、自动化、快速高效、高通量等特点。联合应用芯片技术和LAMP是一个新的研究热点。国内研究者将LAMP与芯片联合应用的报道很多。罗磊等[35]研制了一款基于芯片技术的LAMP扩增反应检测平台及相应的检测控制系统,在此LAMP芯片上进行了金葡菌(Staphylococcus aureus)LAMP反应最佳扩增条件的研究。Fang等[36]将LAMP整合于8通道的微流体芯片上,根据反应产生的白色沉淀肉眼即可观察结果,检测限为10 fg/μL,将该芯片连接于光学探测器即可定量分析。随后他们将样品DNA快速提取也整合于同一块芯片上,根据绿色荧光肉眼观察结果[37]。Zhu等[38]研发了一种无需动力装置的自吸离散式微流控芯片,用于数字LAMP定量检测。该芯片有4个独立的面板,每个面板上有1 200个独立的6 nl的小室,可同时对4个样本准确定量。Zhou等[39]研发了一种整合了实时荧光LAMP反应的微流体芯片,能同时检测10种病原细菌。Luo等[40]将LAMP反应整合于激光蚀刻的铟锡氧化物电极的多元微流体芯片,成功的检测了上呼吸道感染细菌。台湾也有一些此方面的研究。Wang等[41]将样品DNA制备和LAMP反应整合于微流体芯片上,利用光度计检测光学密度可进行半定量分析,采用该芯片检测MRSA,检测限约10 fg/μL。Chang等先后研发了检测水产养殖病原体的微流体芯片系统及检测新鲜兰花叶片中病毒的微流体芯片系统,均整合了核酸提取、LAMP及浊度检测于同一块芯片上[42-43]。Lin等[44]也研发了整合了病毒RNA纯化和RT-LAMP反应及埋式光纤检测的的微流体芯片系统,用以检测兰花病原体。
国外研究者也致力于整合LAMP反应于微流体芯片上。Tourlousse等[45]研发了一种一次性的微流体芯片,可整合实时荧光LAMP反应,利用该芯片20 min内成功的定量检测了多种病原菌,灵敏度达到10~100拷贝基因组/μL。Stedtfeld等[46]研发了一款整合了LAMP反应的微流体芯片检测装置Gene-Z,可同时检测4个样本,通过WIFI连接在智能手机上实时监测反应。该装置商业成本不超过1 000美元,一次性的芯片成本约2~10美元。Sun等[47]研制了整合样品制备与LAMP反应的多通道的微流控芯片系统,快速实时定量检测食物样品中的沙门氏菌(Salmonella spp.)。
2.4 结合生物传感器技术
生物传感器,是一种对生物物质(核酸、抗原、酶、细胞等)敏感并将其浓度转换为电信号进行检测的仪器。目前在食品分析、生物医学、临床检验、环境检测等方面有广泛的应用前景。生物传感器通常与微流体芯片联合应用到LAMP技术中,快速高效、集成化、自动化和高通量的检测扩增产物。Nakamura等[48]利用电化学DNA芯片结合LAMP检测了6个类风湿性关节炎的SNP多态性。Ahmed等[49]研发了一种利用电化学基因传感器快速分析LAMP扩增产物的简易装置DNA stick(DS),成功的检测了转基因玉米CBH 351,检测限是3×102 拷贝/反应。该装置分LAMP反应层和含染料与电化学印刷(DEP)芯片的检测层,中间以混合阀隔开;LAMP反应完后,破坏混合阀混合扩增产物和荧光染料H33258,然后颠倒装置,使混合物浸入到连接了电化学检测设备的DEP芯片,通过阳极电流信号的降低来检测扩增产物。之后他们又利用LAMP结合电化学基因传感器成功鉴定了食品原料和加工品中肉的种类[50]。Sun等[51]采用基于碳离子液体电极的电化学DNA传感器结合LAMP技术成功的检测了猪肉中小肠结肠炎耶尔森菌(Yersinia enterocolitica)。Patterson等[52]整合了LAMP及电化学DNA传感器于手提式微流体芯片系统上,检测来源于脓毒症小鼠的全血样中的沙门氏菌及血清型种内区分。Zhi等[53]首次制造了新颖的整合LAMP、线性探针杂交法和巨磁电阻传感器的微流控芯片系统,用于乙型肝炎病毒(hepatitis B virus,HBV)基因分型。Xie等[54]利用电化学适体生物传感器结合LAMP技术灵敏的检测赭曲霉毒素A(OchratoxinA,OTA)。
3 环介导等温扩增技术在转基因作物及其产品检测中的应用
LAMP技术经过十多年的发展,已广泛地应用在食品[55]、环境[56]、医学[57]等方面的快速检测。LAMP在转基因成分的快速检测方面的应用也越来越多,如外源基因的检测及转化事件检测,主要作物有玉米、大豆、水稻、油菜等。
3.1 外源基因
CaMV35S启动子、FMV35S启动子、NOS终止子、抗虫基因和抗除草剂基因Cp4-epsps是转基因植物中使用较多的外源基因,常用于转基因成分的初步筛选。Fukuta等[58]建立了CaMV35S启动子的实时浊度LAMP检测方法,用此方法检测转基因大豆Roundup Ready中的CaMV35S启动子,检测限为0.5%。熊槐等[59]将LAMP反应液和SYBR Green I在反应前同时置于特殊设计的HF反应管中,实现了闭管检测,并对转基因作物中CaMV35S启动子和NOS终止子进行了检测。王永等[60]建立了转基因作物中CaMV35S启动子的LAMP检测方法,灵敏度是常规PCR的10倍,并应用该方法对7种转基因作物进行了CaMV35S启动子检测,结果准确。李向丽等[61]建立了食用植物油中的CaMV35S启动子的实时浊度LAMP检测方法,灵敏度达0.01%。邝筱珊等[62]建立了一种检测食品和饲料中FMV35S启动子的实时浊度LAMP检测方法,检测限为0.5%。兰青阔等[63]建立了针对转基因大豆Cp4-epsps基因的LAMP 检测方法,65 ℃反应30 min即可,检测限为0.005%。刘彩霞等[64]和袁瑛娜等[65]也分别建立了Cp4-epsps基因的LAMP 检测方法,检测限为0.01%。周琳华等[66]建立了cry1Ab抗虫基因LAMP检测方法,以质粒为模板时灵敏度达20拷贝/μL。对市售的玉米面、玉米粉、甜玉米、米粉等进行LAMP检测,结果与SYBR Green I荧光PCR法一致。Li等[67]也建立了cry1Ab基因的LAMP检测方法。其他研究者也建立了cry1Ac、cry2Ab和cry3A的LAMP检测方法[68-69]。Randhawa等[70]建立了啟动子(CaMV35S和FMV35S启动子)和标记基因(aadA、nptII和uidA)的实时荧光LAMP检测方法,最低检测到4拷贝基因组DNA。Feng等[71]建立了7种外源基因(CaMV35S启动子、NOS终止子、NPTII、PAT、Bar、FMV35S启动子和Gox)的LAMP检测方法,均能检测到0.5%的转基因产品。此外,抗除草剂pat基因[72]、转基因玉米LY038外源cordapA基因[73]及转基因玉米BVLA430101植酸酶(phytase)基因[74]也均建立了相应的LAMP检测方法。
3.2 品系检测
我国已经获得安全应用的生产证书的作物有转植酸酶基因玉米BVLA430101、水稻(华恢1号和Bt汕优63)和棉花,获得进口安全证书的有棉花、大豆、玉米、油菜4种转基因作物用于加工原料。在通过外源基因检测初步筛查出含转基因成分的作物或加工品后,有必要对其所含转基因品系进一步检测。
3.2.1 玉米 目前我国进口的转基因玉米主要用于饲料加工,LAMP方法在转基因玉米品系的快速检测方面的应用很多。Chen等[75]建立了7种转基因玉米(DAS-59122-7,T25,BT176,TC1507,MON810,BT11和MON863)的LAMP 快速检测方法,采用SYBR Green I染色,检测时间在40 min内,除MON810的检测限是40拷贝基因组DNA外,其他6种转基因玉米的检测限均为4 拷贝基因组DNA。兰青阔等[76]建立了转基因玉米MON863的LAMP检测方法,检测限为0.01%;Huang等[77]也建立了MON863的荧光定性和定量LAMP 检测方法,检测限为4拷贝基因组DNA。张隽等[78]建立了转基因玉米MON89034的LAMP实时浊度检测方法,灵敏度达1 pg。凌莉等[79]建立了转基因玉米MIR604的LAMP实时浊度检测方法,检测限为0.5%,特异性和稳定性均达到100%。王小玉等[80]建立了转基因玉米MON810的LAMP实时浊度检测方法,检测限为0.5%。此外,其他研究者也建立了转基因玉米Bt11[81-82]、Bt176[83]、T25[84]、GA21[85]品系的LAMP检测方法。
3.2.2 大豆 中国每年都进口大量转基因大豆用于食用油及其他豆制品的加工原料,因此转基因大豆的快速灵敏的检测方法必不可少。Guan等[86]根据转基因大豆GTS40-3-2和MON89788的3′端转化体特异性序列分别设计LAMP引物,建立了GTS40-3-2和MON89788品系的LAMP检测方法,采用荧光染料染色,40 min内完成检测,检测限均为0.005%。刘津等[87]也根据GTS40-3-2的3′端转化体特异性序列设计LAMP引物,利用实时浊度仪对反应体系和条件进行优化,建立了GTS40-3-2品系的LAMP检测方法,检测限为0.5%。王永等[88]则根据GTS40-3-2的5′端转化体特异性序列设计LAMP引物,建立了GTS40-3-2 转化体特异性成分的LAMP检测方法,利用钙黄绿素染料观察结果,检测限为0.001%,是普通PCR方法的10倍。蔡颖等[89]和邵碧英等[90]分别建立了转基因大豆A5547-127和A2704-12品系的LAMP 检测方法,检测限均达到0.1%。
3.2.3 水稻 我国尚未批准转基因水稻的生产许可,但市面上及出口大米却屡次检出含转基因成分。为了加强转基因水稻的种植管理及种子非法生产销售的监管,建立快速灵敏的转基因水稻检测方法至关重要,目前针对转基因水稻华恢1号和Bt63品系的LAMP检测方法均有报道。Chen等[91]建立了3种转Bt水稻(KMD1,TT51-1和KF6)的LAMP检测方法,分别采用两种染料SYBR Green I和HNB染色及凝胶电泳观察反应结果,KMD1和TT51-1的检测限为0.01%,KF6的检测限为0.005%,灵敏度较普通PCR高10~100倍。吴少云等[92]建立了转基因水稻Bt63品系的实时浊度LAMP检测方法,检测限为0.01%;用该方法对市面上的24份大米样品进行Bt63品系成分检测,检出2份阳性,与荧光PCR检测结果完全一致。张明哲等[93]也建立了转基因水稻Bt63品系的LAMP检测方法,灵敏度均达0.01%。Chen等[94]建立了转基因水稻TT51-1的LAMP可视化检测方法,检测限为20拷贝基因组DNA,比传统PCR灵敏10倍。
3.2.4 其他 除了玉米、水稻和大豆等作物外,还有一些其他转基因植物也建立了相应的LAMP检测方法。Rostamkhani等[95]用LAMP法快速鉴定了转基因棉花中的chitinase(chi)and cry1A(b)基因,与传统PCR法进行了比较,LAMP法的检测限为稀释至10-8的模板DNA,为传统PCR的100倍。Zhou等[96]建立了转基因甘蔗中cry1Ac基因的LAMP检测方法,检测限为43.1拷贝质粒,1.0 ng/μL甘蔗基因组DNA。Cheng等[97]建立了转基因小麦B73-6-1的LAMP检测方法,38 min内完成扩增,灵敏度为0.1%,相当于6拷贝小麦基因组DNA。刘二龙等建立了转基因苜蓿草J163品系和J101品系的LAMP检测方法,检测限为16 pg,相当于10 拷贝苜蓿草基因组DNA[98-99]。
4 展望
虽然LAMP技术反应快速,设备简单,结果肉眼可见;但是,植物基因组DNA的提取仍需要昂贵的高速离心机等仪器,耗时也较长,这直接影响了LAMP技术在田间或基层检测的推广应用。Kaneko等[100]发现LAMP对MEM培养基和几种生物制品(盐、PBS、血清、血浆等)具有较强的耐受性。因此,可以开发更简单、经济、快速的DNA提取方法,进一步缩短检测时间,使LAMP技术更适合在田间或基层检测的应用。Zhang等[101]开发了一种新颖的适用于田间快速筛选和常规实验室诊断的转基因检测系统。该检测系统由一个DNA提取裝置结合改良的可视化LAMP技术来进行转基因的检测。DNA提取装置主要含有一个硅胶膜过滤柱和改良的注射器,操作简单,无需实验室仪器设备,可用于田间现场检测。利用该装置15 min内就能从植物组织提取出高质量的基因组DNA,利用该系统成功的检测了多种转基因作物。
此外,LAMP法的终点观察结果不能排除非特异性扩增,因此将LAMP结合横向流动试纸条技术可以很好的解决这个问题,试纸条法可以特异性指示目的扩增条带,简单快速,适合于田间现场检测。
LAMP 技術无需专用仪器,仅需水浴锅或加热块,成本低,耗时仅30~60 min,结果判定简单,特异性好,重复性好,灵敏度高,无需经过专业培训,尤其适合基层检验检疫机构,或现场快速筛查,是一项可以普及推广的检测技术。随着各种商品化专用仪器及试剂盒的出现,LAMP的操作越发简单化,如电池驱动的恒温荧光扩增仪器,仅重1 kg,可以实时观测扩增结果,非常适合田间现场检测。2014年我国颁布了转基因玉米、水稻、大豆及油菜的多个品系的LAMP检测行业标准,意味着LAMP技术在我国正式应用到转基因作物的检测中,未来LAMP技术在转基因作物及其产品的检测方面将有良好的应用前景。
参考文献
[1] James C. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2015, 35(1): 1-14.
[2] 黄一珺. LAMP技术在转基因作物检测中的应用[J]. 科技信息, 2012(35): 117.
[3] 邢宇俊, 吴季荣, 徐剑宏, 等. 环介导等温扩增技术检测转基因组分的研究进展[J]. 食品安全质量检测学报, 2014, 5(3): 853-860.
[4] Notomi T, Okayama H, Masubuchi H, et al. loop-mediated isothermal amplification of DNA[J]. Nucl Acids Res, 2000, 28(12): e63.
[5] Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J]. Nat Protoc, 2008, 3(5): 877-882.
[6] Mori Y, Nagamine K, Tomita N. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochem Bioph Res Co, 2001, 289(1): 150-154.
[7] Fukuta S, Kato S, Yoshida K, et al. Detection of tomato yellow leaf curl virus by loop-mediated isothermal amplification reaction[J]. J Virol Methods, 2003, 112(1-2): 35-40.
[8] Thai H T C, Le M Q, Vuong C D, et al. Development and evaluation of a novel loop-mediated isothermal amplification method for rapid detection of severe acute respiratory syndrome coronavirus[J]. J Clin Microbiol, 2004, 42 (5): 1 956-1 961.
[9] Mori Y, Kitao M, Tomita N, et al. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. J Biochem Biophys Methods, 2004, 59(2): 145-157.
[10] Yano A, Ishimaru R, Hujikata R. Rapid and sensitive detection of heat-labile I and heat-stable I enterotoxin genes of enterotoxigenic Escherichia coli by loop-mediated isothermal amplification[J]. J Microbiol Meth, 2007, 68(2): 414-420.
[11] Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J]. Nat Protoc, 2008, 3(5): 877-882.
[12] Goto M, Honda E, Ogura A, et al. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. BioTechniques, 2009, 46(3): 167-172.
[13] Lucchi N W, Demas A, Narayanan J, et al. Real-time fluorescence loop mediated isothermal amplification for the diagnosis of malaria[J]. PLoS ONE, 2010, 5(10): e13733.
[14] Cai T, Lou G Q, Yang J, et al. Development and evaluation of real-time loop-mediated isothermal amplification for hepatitis B virus DNA quantification: A new tool for HBV management[J]. J Clin Virol, 2008, 41(4): 270-276.
[15] Kiddle G, Hardinge P, Buttigieg N, et al. GMO detection using a bioluminescent real time reporter(BART)of loop mediated isothermal amplification(LAMP)suitable for field use[J]. BMC Biotechnol, 2012, 12(0): 15.
[16] Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probe, 2002, 16(3): 223-229.
[17] Yano A, Ishimaru R, Hujikata R. Rapid and sensitive detection of heat-labile I and heat-stable I enterotoxin genes of enterotoxigenic Escherichia coli by loop-mediated isothermal amplification[J]. J Microbiol Meth, 2007, 68(2): 414-420.
[18] 黄火清, 郁 昂. 环介导等温扩增技术的研究进展[J]. 生物技术, 2012, 22(3): 90-94.
[19] Mori Y, Hirano T, Notomi T. Sequence specific visual detection of LAMP reactions by addition of cationic polymers[J]. BMC Biotechnol, 2006, 6(0): 3.
[20] 申建維, 王 旭, 范春明, 等. 多重分子信标环介导等温扩增快速检测耐甲氧西林金黄色葡萄球菌[J]. 中华医院感染学杂志, 2006, 16(7): 729-733.
[21] Tani H, Teramura T, Adachi K, et al. Technique for quantitative detection of specific DNA sequences using alternately binding quenching probe competitive assay combined with loop-mediated isothermal amplification[J]. Anal Chem, 2007, 79(15): 5 608-5 613.
[22] Jaroenram W, Arunrut N, Kiatpathomchai W. Rapid and sensitive detection of shrimp yellow head virus using loop-mediated isothermal amplification and a colorogenic nanogold hybridization probe[J]. J Virol Methods, 2012, 186(1-2): 36-42.
[23] Suebsing R, Prombun P, Kiatpathomchai W. Reverse transcription loop-mediated isothermal amplification(RT-LAMP)combined with colorimetric gold nanoparticle(AuNP)probe assay for visual detection of Penaeus vannamei nodavirus(PvNV)[J]. Lett Appl Microbiol, 2013, 56(6): 428-435.
[24] Arunrut N, Kampeera J, Suebsing R, et al. Rapid and sensitive detection of shrimp infectious myonecrosis virus using a reverse transcription loop-mediated isothermal amplification and visual colorogenic nanogold hybridization probe assay[J]. J Virol Methods, 2013, 193(2): 542-547.
[25] Seetang-Nun Y, Jaroenram W, Sriurairatana S, et al. Visual detection of white spot syndrome virus using DNA-functionalized gold nanoparticles as probes combined with loop-mediated isothermal amplification[J]. Mol Cell Probe, 2013, 27(2): 71-79.
[26] Suebsing R, Prombun P, Srisala J, et al. Loop-mediated isothermal amplification combined with colorimetric nanogold for detection of the microsporidian Enterocytozoon hepatopenaei in penaeid shrimp[J]. J Appl Microbiol, 2013, 114(5): 1 254-1 263.
[27] Kiatpathomchaia W, Jaroenram W, Arunrut N, et al. Shrimp Taura syndrome virus detection by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. J Virol Methods, 2008, 153(2): 214-217.
[28] Jaroenram W, Kiatpathomchai W, Flegel T W. Rapid and sensitive detection of white spot syndrome virus by loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. Mol Cell Probe, 2009, 23(2): 65-70.
[29] Njiru Z K. Rapid and sensitive detection of human African trypanosomiasis by loop-mediated isothermal amplification combined with a lateral-flow dipstick[J]. Diagn Micr Infec Dis, 2011, 69(2): 205-209.
[30] Wang X M, Teng D, Guan Q F, et al. Detection of Roundup Ready soybean by loop-mediated isothermal amplification combined with a lateral-flow dipstick[J]. Food Control, 2013, 29(1): 213-220.
[31] 董培培, 李長红, 丁文超, 等. 环介导等温扩增技术与横向流动试纸条法快速检测鳗利斯顿氏菌的研究[J]. 水产科学, 2011, 30(2): 63-68.
[32] 王耀焕, 王瑞娜, 周前进, 等. 环介导等温扩增联合横向流动试纸条快速检测创伤弧菌检测方法的建立[J]. 生物技术通报, 2014(6): 81-87.
[33] 王瑞娜, 周前进, 陈 炯. 环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立[J]. 农业生物技术学报, 2014, 22(12): 1 584-1 594.
[34] 王瑞娜, 周前进, 陈 炯. 环介导等温扩增联合横向流动试纸条快速检测单核细胞增生李斯特菌的研究[J]. 中国兽医学报, 2014, 34(10): 1 615-1 621.
[35] 罗 磊, 阳小勇, 于 军. 环介导等温扩增芯片核酸最佳扩增条件研究[J]. 华中科技大学学报(自然科学版), 2009, 37(7): 42-45.
[36] Fang X E, Liu Y Y, Kong J L, et al. Loop-mediated isothermal amplification integrated on microfluidic chips for point-of-care quantitative detection of pathogens[J]. Anal Chem, 2010, 82(7): 3 002-3 006.
[37] Fang X E, Chen H, Xu L J, et al. A portable and integrated nucleic acid amplification microfluidic chip for identifying bacteria[J]. Lab Chip, 2012, 12(8): 1 495-1 499.
[38] Zhu Q Y, Gao Y B, Yu B W, et al. Self-priming compartmentalization digital LAMP for point-of-care[J]. Lab Chip, 2012, 12(22): 4 755-4 763.
[39] Zhou Q J, Wang L, J Chen, et al. Development and evaluation of a real-time fluorogenic loop-mediated isothermal amplification assay integrated on a microfluidic disc chip(on-chip LAMP)for rapid and simultaneous detection of ten pathogenic bacteria in aquatic animals[J]. J Microbiol Meth, 2014, 104(0): 26-35.
[40] Luo J, Fang X E, Ye D X, et al. A real-time microfluidic multiplex electrochemical loop-mediated isothermal amplification chip for differentiating bacteria[J]. Biosens Bioelectron, 2014, 60(0): 84-91.
[41] Wang C H, Lien K Y, Wu J J, et al. A magnetic bead-based assay for the rapid detection of methicillin-resistant Staphylococcus aureus by using a microfluidic system with integrated loop-mediated isothermal amplification[J]. Lab Chip, 2011, 11(8): 1 521-1 531.
[42] Chang W H, Yang S Y, Wang C H, et al. Rapid isolation and detection of aquaculture pathogens in an integrated microfluidic system using loop-mediated isothermal amplification[J]. Sensor Actuat B-Chem, 2013, 180(0): 96-106.
[43] Chang W H, Yang S Y, Lin C L, et al. Detection of viruses directly from the fresh leaves of a Phalaenopsis orchid using a microfluidic system[J]. Nanomedicine: NBM, 2013, 9(8): 1 274-1 282.
[44] Lin C L, Chang W H, Wang C H, et al. A microfluidic system integrated with buried optical fibers for detection of Phalaenopsis orchid pathogens[J]. Biosens Bioelectron, 2015, 63(0): 572-579.
[45] Tourlousse D M, Ahmad F, Stedtfeld R D, et al. A polymer microfluidic chip for quantitative detection of multiple water-and foodborne pathogens using real-time fluorogenic loop-mediated isothermal amplification[J]. Biomed Microdevices, 2012,14(4): 769-778.
[46] Stedtfeld R D, Tourlousse D M, Seyrig G, et al. Gene-Z: a device for point of care genetic testing using a smartphone[J]. Lab Chip, 2012, 12(8): 1 454-1 462.
[47] Sun Y, Quyen T L, Hung T Q, et al. A lab-on-a-chip system with integrated sample preparation and loop-mediated isothermal amplification for rapid and quantitative detection of Salmonella spp. in food samples[J]. Lab Chip, 2015, 15(8): 1 898-1 904.
[48] Nakamura N, Ito K, Takahashi M, et al. Detection of six single-nucleotide polymorphisms associated with rheumatoid arthritis by a loop-mediated isothermal amplification method and an electrochemical DNA chip[J]. Anal Chem, 2007, 79(24): 9 484-9 493.
[49] Ahmed M U, Saito M, Hossain M M, et al. Electrochemical genosensor for the rapid detection of GMO using loop-mediated isothermal amplification[J]. Analyst, 2009, 134(5): 966-972.
[50] Ahmed M U, Hasan Q, Hossain M M, et al. Meat species identification based on the loop mediated isothermal amplification and electrochemical DNA sensor[J]. Food Control, 2010, 21(5): 599-605.
[51] Sun W, Qin P, Gao H W, et al. Electrochemical DNA biosensor based on chitosan/nano-V2O5/MWCNTs composite film modified carbon ionic liquid electrode and its application to the LAMP product of Yersinia enterocolitica gene sequence[J]. Biosens Bioelectron, 2010, 25(6): 1 264-1 270.
[52] Patterson A S, Heithoff D M, Ferguson B S, et al. Microfluidic chip-based detection and intraspecies strain discrimination of Salmonella serovars derived from whole blood of septic mice[J]. Appl Environ Microbiol, 2013, 79(7): 2 302-2 311.
[53] Zhi X, Deng M, Yang H, et al. A novel HBV genotypes detecting system combined with microfluidic chip, loop-mediated isothermal amplification and GMR sensors[J]. Biosens Bioelectron, 2014, 54(0): 372-377.
[54] Xie S B, Chai Y Q, Yuan Y L, et al. Development of an electrochemical method for Ochratoxin A detection based on aptamer and loop-mediated isothermal amplification[J]. Biosens Bioelectron, 2014, 55(0): 324-329.
[55] 李玉锋, 李 帅, 黄丽娟, 等. LAMP 技术在食品致病菌检测中的研究进展[J]. 西华大学学报(自然科学版), 2011, 30(1): 16-18.
[56] 尹红果, 马小雪, 商 栩, 等. 环境水体中沙门菌环介导等温扩增快速检测方法[J]. 环境与健康杂志, 2013, 30(2): 146-149.
[57] 何金林, 徐云龙, 莫国华, 等. LAMP技术在疾病预防控制检验中的研究进展[J]. 中国卫生检验杂志, 2010, 20(12): 3 561-3 563.
[58] Fukuta S, Mizukami Y, Ishida A, et al. Real-time loop-mediated isothermal amplification for the CaMV-35S promoter as a screening method for genetically modified organisms[J]. Eur Food Res Technol, 2004, 218(5): 496-500.
[59] 熊 槐, 吴 凡, 冯雪梅, 等. 改良LAMP法检测转基因作物[J]. 食品安全质量检测学报, 2012, 3(3): 177-181.
[60] 王 永, 兰青阔, 赵 新, 等. 转基因作物外源转基因成分环介导等温扩增技术检测方法的建立及应用[J]. 中国农业科学, 2009, 42(4): 1 473-1 477.
[61] 李向丽, 谭贵良, 刘 垚, 等. 实时LAMP法快速检测食用植物油中的转基因成分CaMV-35S[J]. 现代食品科技, 2014, 30(2): 244-248.
[62] 邝筱珊, 胡松楠, 游淑珠, 等. 食品和饲料中转基因植物FMV35S啟动子环介导等温扩增检测方法的建立[J]. 安徽农业科学, 2014, 42(16): 4 999-5 001.
[63] 兰青阔, 王 永, 赵 新, 等. LAMP在检测转基因抗草甘膦大豆cp4-epsps基因上的应用[J]. 安徽农业科学, 2008, 36(24): 10 377-10 378.
[64] 刘彩霞, 梁成珠, 徐 彪, 等. 抗草甘膦转基因大豆及加工品LAMP检测研究[J]. 大豆科学, 2009, 28(2): 305-309.
[65] 袁瑛娜, 单潇潇, 王宗德, 等. 应用LAMP实时浊度法检测转基因大豆[J]. 现代食品科技, 2011, 27(10): 1 264-1 267.
[66] 周琳华, 肖维威, 吴永彬, 等. 苏云金芽孢杆菌Cry1A(b)抗虫基因LAMP检测方法的建立与应用[J]. 生物技术通报, 2012 (4): 165-169.
[67] Li Q C, Fang J H, Liu X, et al. Loop-mediated isothermal amplification(LAMP)method for rapid detection of cry1Ab gene in transgenic rice(Oryza sativa L.)[J]. Eur Food Res Technol, 2013, 236(4): 589-598.
[68] 于 妍, 李志辉, 王志鑫, 等. 转cry1Ac基因抗虫水稻环介导等温扩增检测方法的建立及应用[J]. 河北农业大学学报, 2013, 36(4): 86-91.
[69] Li F W, Yan W, Long L K, et al. Development and application of loop-mediated isothermal amplification assays for rapid visual detection of cry2Ab and cry3A genes in genetically-modified crops[J]. Int J Mol Sci, 2014, 15(9): 15 109-15 121.
[70] Randhawa G J, Singh M, Morisset D, et al. Loop-mediated isothermal amplification: rapid visual and real-time methods for detection of genetically modified crops[J]. J Agric Food Chem, 2013, 61(47): 11 338-11 346.
[71] Feng J W, Tang S M, Liu L D, et al. Development of a loop-mediated isothermal amplification(LAMP)assay for rapid and specific detection of common genetically modified organisms(GMOs)[J]. Int J Food Sci Nutr, 2015, 66(2): 186-196.
[72] Chen J S, Huang C L, Zhang X H, et al. Detection of herbicide-resistant maize by using loop-mediated isothermal amplification of the pat selectable marker gene[J]. Afr J Biotechnol, 2011, 10(75): 17 055-17 061.
[73] 闫兴华, 许文涛, 商 颖, 等. 环介导等温扩增技术(LAMP)快速检测转基因玉米LY038[J]. 农业生物技术学报, 2013, 21(5): 621-626.
[74] Huang X, Chen L L, Xu J M, et al. Rapid visual detection of phytase gene in genetically modified maize using loop-mediated isothermal amplification method[J]. Food Chem, 2014, 156 (0): 184-189.
[75] Chen L L, Guo J C, Wang Q D, et al. Development of the visual loop-mediated isothermal amplification assays for seven genetically modified maize events and their application in practical samples analysis[J]. J Agric Food Chem, 2011, 59(11): 5 914-5 918.
[76] 兰青阔, 王 永, 赵 新, 等. 环状等温扩增技术快速检测转基因玉米MON863的研究[J]. 玉米科学, 2011, 19(1): 31-34.
[77] Huang S C, Xu Y C, Yan X H, et al. Development and application of a quantitative loop-mediated isothermal amplification method for detecting genetically modified maize MON863[J]. J Sci Food Agr, 2015, 95(2): 253-259.
[78] 张 隽, 李志勇, 叶宇鑫, 等. 环介导等温扩增法检测转基因玉米MON89034[J]. 現代食品科技, 2012, 28(4): 469-472.
[79] 凌 莉, 刘 津, 易敏英, 等. 环介导等温扩增法检测转基因玉米MIR604[J]. 食品科技, 2012, 37(12): 305-310.
[80] 王小玉, 邝筱珊, 胡松楠, 等. LAMP实时浊度法快速检测转基因玉米MON810[J]. 现代食品科技, 2013, 29(12): 3 002-3 005.
[81] 兰青阔, 王 永, 赵 新, 等. 转基因玉米LAMP检测体系的建立及应用[J]. 华北农学报, 2010, 25(4): 49-52.
[82] 王清华, 徐君怡, 曹冬梅, 等. 转基因玉米BT11品系环介导等温扩增(LAMP)检测方法的建立[J]. 食品安全质量检测学报, 2013, 4(3): 868-872.
[83] 凌 莉, 刘静宇, 易敏英, 等. 转基因玉米Bt176品系特异性环介导等温扩增检测方法的研究[J]. 食品工业科技, 2013, 34(03): 310-313.
[84] Xu J Y, Zheng Q Y, Yu L, et al. Loop-mediated isothermal amplification(LAMP)method for detection of genetically modified maize T25[J]. Food Sci Nutr, 2013, 1(6): 432-438.
[85] 邵碧英, 陈文炳, 曾 莹, 等. 转基因玉米GA21品系LAMP检测引物的筛选及方法的建立[J]. 中国食品学报, 2014, 14(10): 216-222.
[86] Guan X Y, Guo J C, Shen P, et al. Visual and rapid detection of two genetically modified soybean events using loop-mediated isothermal amplification method[J]. Food Anal Methods, 2010, 3(4): 313-320.
[87] 刘 津, 凌 莉, 吴少云, 等. 转基因大豆GTS40-3-2品系特异性环介导等温扩增法检测方法的建立与应用[J]. 粮食与饲料工业, 2012, (12): 60-63.
[88] 王 永, 兰青阔, 朱 珠, 等. 转基因大豆GTS40-3-2成分现场可视化检测方法的建立[J]. 大豆科学, 2014, 33(4): 570-573.
[89] 蔡 颖, 周广彪, 刘 津, 等. 转基因大豆A5547-127品系成分LAMP快速检测方法的建立[J]. 食品研究与开发, 2013, 34(17): 69-73.
[90] 邵碧英, 陈文炳, 曾 莹, 等. LAMP法检测转基因大豆A2704-12品系[J]. 食品科学, 2013, 34(24): 202-207.
[91] Chen X Y, Wang X F, Jin N, et al. Endpoint visual detection of three genetically modified rice events by loop-mediated isothermal amplification[J]. Int J Mol Sci, 2012, 13(11): 14 421-14 433.
[92] 吴少云, 唐大运, 李 琳, 等. LAMP实时浊度法检测转基因水稻Bt63品系[J]. 食品与机械, 2012, 28(5): 79-82.
[93] 张明哲, 陈 曦, 徐俊锋, 等. 环介导等温扩增技术在转基因水稻Bt63检测中的应用[J]. 生物技术通报, 2014, (2): 70-74.
[94] Chen R, Wang Y, Zhu Z, et al. Development of the one-step visual loop-mediated isothermal amplification assay for genetically modified rice event TT51-1[J]. Food Sci Technol Res, 2014, 20(1): 71-77.
[95] Rostamkhani N, Haghnazari A, Tohidfar M, et al. Rapid identification of transgenic cotton(Gossypium hirsutum L.)plants by loop-mediated isothermal amplification[J]. Czech J Genet Plant Breed, 2011, 47(4): 140-148.
[96] Zhou D G, Guo J L, Xu L P, et al. Establishment and application of a loop-mediated isothermal amplification(LAMP)system for detection of cry1Ac transgenic sugarcane[J]. Sci Rep, 2014, 4: 4 912.
[97] Cheng Y, Zhang M H, Hu K, et al. Loop-mediated isothermal amplification for the event-specific detection of wheat B73-6-1[J]. Food Anal Methods, 2014, 7(2): 500-505.
[98] 劉二龙, 卢 丽, 吕英姿, 等. 转基因苜蓿草J163品系特异性LAMP检测方法的建立[J]. 食品安全质量检测学报, 2015, 6(3): 1 028-1 032.
[99] 刘二龙, 卢 丽, 吕英姿, 等. 可视化LAMP法快速检测转基因苜蓿草J101品系[J]. 食品安全质量检测学报, 2015, 6(3): 1 033-1 037.
[100] Kaneko H, Kawana T, Fukushima E, et al. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances[J]. J Biochem Biophys Methods, 2007, 70(3): 499-501.
[101] Zhang M, Liu Y N, Chen L L, et al. One simple DNA extraction device and its combination with modified visual loop-mediated isothermal amplification for rapid on-field detection of genetically modified organisms[J]. Anal Chem, 2013, 85(1): 75-82.
责任编辑:沈德发

