灵芝连作障碍土壤中的优势微生物种群对灵芝菌丝体的化感作用
马红梅 陈大雄 陈永敢

摘 要 通过对峙平板培养测定灵芝连作土壤中的优势微生物种群对灵芝菌体生长的化感效应。结果表明:细菌和霉菌对灵芝的化感效应差异达到了显著水平(p<0.05),其中化感效应最强的为细菌中的梭杆菌属、分支杆菌属和产碱杆菌属,三者的化感效应值分别为-0.844 0、-0.866 6和-0.866 6,其次为霉菌中的青霉属、木霉属、链孢霉及曲霉属,其化感效应值分别为-0.666 7、-0.755 6、-0.555 6和-0.555 6;链霉菌属的化感效应差异不明显(p<0.05)。此结果为灵芝连作障碍土传病害的控制提供了理论依据。
关键词 灵芝;微生物种群;对峙平板;化感效应
中图分类号 S567.31 文献标识码 A
Alelopathic Effect of Dominant Microflora on Its
Mycelium of Continuous Cropping Obstacles
Ganoderma lucidum in Field Cultivation
MA Hongmei, CHEN Daxiong, CHEN Yonggan
College of Tropical Biology and Agronomy, Hainan Tropical Ocean University, Sanya, Hainan 572022, China
Abstract The allelopathic effect of the dominant microflora in continuous cropping obstacles soil on Ganoderma lucidum(G.L) Mycelium.growth were tested by dual culture on the PDA plate. The results showed that the allelopathic effect of molds and bacteria on the growth of G.L. had significant difference(p<0.05). Clostridium, Mycobacterium, Alcaligenes sp. in bacteria had a stronger allelopathic effect on G.L obviously on the same plate, and the response indice on G.L mycelium was -0.844, -0.866 6 and -0.866 6, respectively, followed by all kind of dominant molds in continuous cropping soil; the response indices of Penicillium, Trichoderma, Neurospora and Aspergillus, on G.L. was -0.666 7, -0.755 6 and double -0.555 6, respectively. The allelopathic effect of Streptomyces had no significant differences. The results provided a theoretical basis for the control of soil borne disease in the continuous cropping of G.L.
Key words Ganoderma lucidum;Microflora;Flat confrontation;Aallelopathic effect
doi 10.3969/j.issn.1000-2561.2016.02.025
灵芝是一种药食两用的珍贵食用菌,随着灵芝在医学方面应用的不断探索,人们对于灵芝的需求量也越来越大,野生的灵芝已经远远无法满足人们的需求,人工种植的灵芝作为一种新兴的种植产业出现,以满足人们需求成为必然的选择。随着灵芝栽培面积的扩大,灵芝栽培开始出现类似于其他作物连作障碍的问题[1],主要表现为灵芝脱袋覆土连续种植后,其产量和品质出现大幅度的下降,同时病害的发生也越来越频繁[2],通过常规培养料配方的筛选[3]、栽培品种的选择[4]、加强栽培环境的管理等措施都很难提高灵芝的产量和质量[5],不得不丢弃原有的栽培地,寻找新的灵芝栽培地,极大地浪费了土地资源,影响了灵芝产业的可持续发展。
作物发生连做障碍的主要因素包括:土壤营养失衡、作物自毒机理、作物残渣对其生长发育的影响及土壤微生态环境恶化[6-8]。目前,对连作障碍的研究主要集中在根际土壤的研究方面,由于植物根系分泌物包含着植物对环境变化的响应信息,所以备受关注。然而根系土壤中不仅只有植物根系生长过程中分泌的物质,还有活跃的微生物种群[9]。研究微生物或植物对环境中其它微生物或植物产生的直接或间接的有利或不利的作用即为化感作用[10],其中植物的化感作用研究最为活跃,研究的关键内容是化感物质的释放机制问题[11]。然而植物研究的重要屏障之一是缺乏对微生物在化感作用中地位和作用的了解,因为植物之间、植物与微生物之间的化感作用多数也必须通过土壤微生物参与解毒或增强毒性[11],缺乏微生物对植物的化感作用研究就无法确定化感作用在自然条件下所起的作用,因此,研究土壤微生物对植物的化感作用很有必要。
本研究在前期分离鉴定灵芝连作覆土土壤微生物的基础上,分别测定了连作障碍土壤中的优势微生物种群与灵芝菌丝体之间的化感作用,以期从微生态化感作用的角度揭示灵芝栽培连作障碍的机制。
1 材料与方法
1.1 材料
供体:化感作用供体灵芝菌种为琼州学院灵芝重点实验室分离保存的菌丝体(G. lucidum. sp);受体:化感作用受体微生物菌株为我院灵芝重点实验室自灵芝连作2 a的土壤中分离[12]。
1.2 方法
1.2.1 试验设计 采用对峙平板培养法测定灵芝菌体与土壤微生物之间的化感作用[13]:采用直径为5 mm的打孔器将事先活化的灵芝及供试菌菌落均匀打上孔洞,制成5 mm的菌饼,灵芝菌饼置于9 cm的PDA平板中央,供试的微生物菌饼置于平板的边缘,与灵芝菌饼距离25 mm,每个处理做3个重复,对照仅接灵芝菌饼,接种后置于28 ℃恒温培养,3 d后开始观测灵芝菌体、各个供体微生物菌株及空白未接供试菌株的生长情况。
1.2.2 化感效应计算 按照Wiliamson[14]提供的方法计算化感作用大小-化感效应系数值(Response Indices, RI),其中C和T分别代表:对照值和处理值。
1-C/T,T≥C;
RI=
T/C-1,T当RI>0时表现为促进作用,RI<0时为抑制作用,RI绝对值等于作用强度。
1.3 数据分析
采用WPS表格对数据进行作图分析,方差分析采用SPSS Statistics 19.0统计软件进行显著性检验。
2 结果与分析
2.1 霉菌与灵芝菌丝体间的化感作用
灵芝连作覆土土壤中的优势霉菌主要为毛霉属、曲霉属、木霉属、青霉属及链孢霉属[12],其对灵芝菌丝生长的影响见图1,各菌属与灵芝间的化感效应见表1。
由图1可知,空白对照组的灵芝在第6天已经长满平板,5个霉菌处理的实验组的灵芝生长速度明显慢于空白组,其中毛霉和曲霉实验组的灵芝7 d后长满平板,而木霉、青霉、链孢霉实验处理组的灵芝无法长满平板,最终枯死。
由表1可知,5种霉菌对灵芝生长的化感效应表现为抑制作用,其中对灵芝抑制作用最强的是木霉属和青霉属,RI值分别为0.755 6和0.666 7;作用强度较小的是毛霉属,化感受效应值为0.377 8;链孢霉属的作用强度跟曲霉属的化感效应值相等,均为0.555 6。
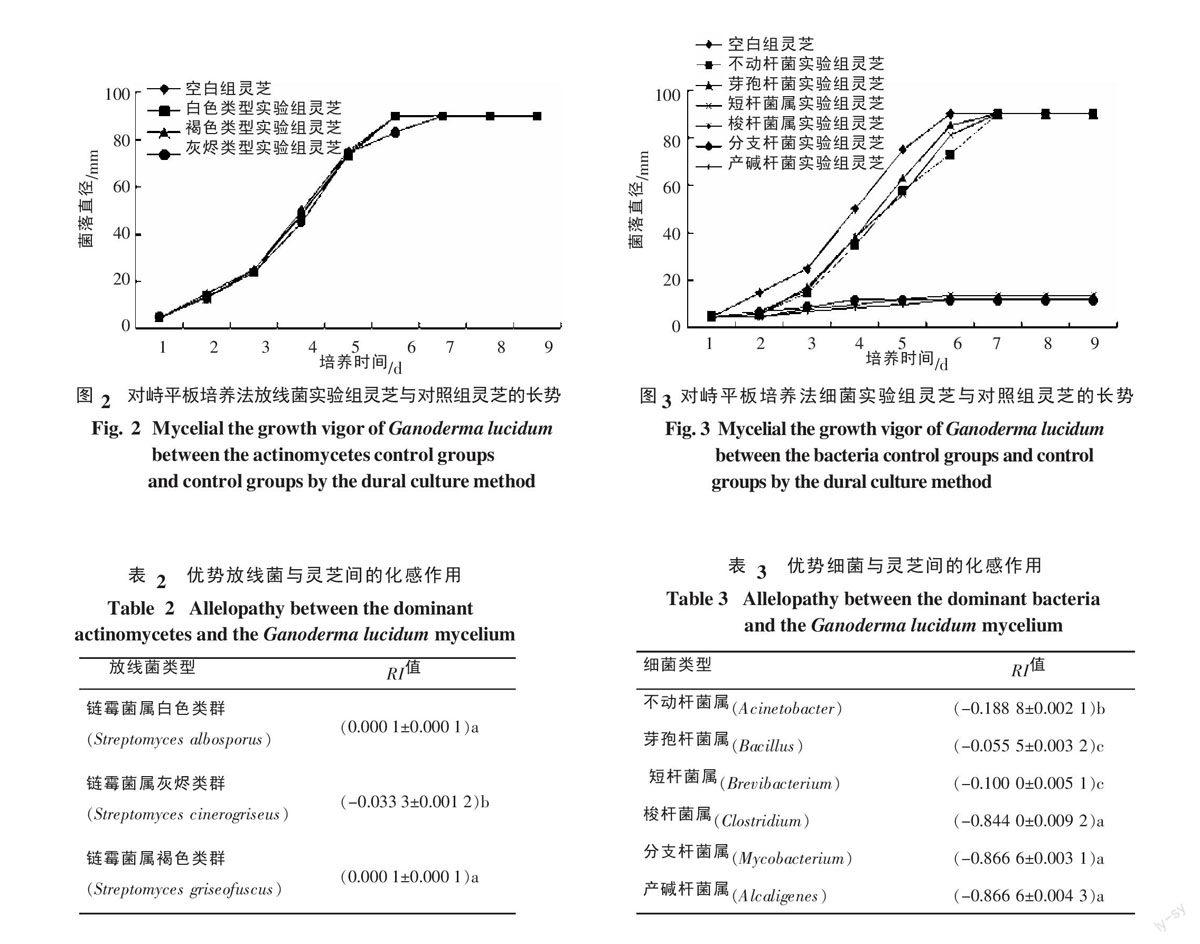
2.2 放线菌与灵芝菌丝体间的化感作用
灵芝连作覆土土壤中的优势放线菌主要为链霉菌属中的白色类群、灰烬类群、褐色类群,其对灵芝菌丝生长的影响见图2,各菌属与灵芝间的化感效应见表2。
由图2可知,白色和褐色类型的实验组中的灵芝生长速度并未受到影响,实验组上面的灵芝菌落跟空白对照组的灵芝菌落几乎同时长满平板,灰烬类型对灵芝的生长具有影响,但影响结果较小。
由表2可知,链霉菌属中的白色类群与褐色类群的差异不显著(p<0.05),其RI值均为0.000 1,几乎不影响灵芝菌的生长。链霉菌属中的灰烬类型对灵芝菌丝体生长有较小的影响,在一定程度上影响灵芝菌落向着放线菌菌落扩展的速度,但化感系数RI值仅为-0.033 3,其作用结果几乎可以忽略不计。
2.3 细菌与灵芝菌丝体间的化感作用
灵芝连作覆土土壤中的优势细菌主要为梭杆菌属、不动杆菌属、分支杆菌属、芽孢杆菌属、短杆菌属、产碱杆菌属,其对灵芝菌丝生长的影响见图3,各菌属与灵芝间的化感效应见表3。
由图3可知,不动杆菌属、短杆菌属、及芽孢杆菌属的培养基上面的灵芝长满平板的时间虽然比空白对照组灵芝慢,但实验组灵芝生长速度对比空白组灵芝的生长速度并没有明显的降低,并且能够完成对平板上细菌菌落的覆盖生长,这3种细菌的存在虽然在培养的前期能够抑制灵芝的生长,但影响结果较小;梭杆菌属、分支杆菌属及产碱杆菌属对灵芝的生长抑制作用较强。在第6天,当空白组长满平板时(直径为9 cm),实验组灵芝菌落不足15 mm。
由表3可知,6种细菌对灵芝的化感效应差异达到了显著水平(p<0.05),其中对灵芝抑制作用较强的细菌为梭杆菌属、分支杆菌属及产碱杆菌属,生长很快,三者对灵芝的化感效应值分别为-0.844 0、-0.866 6和-0.866 6;细菌中的不动杆菌属、芽孢杆菌属、短杆菌属对灵芝菌体的抑制作用较小,三者对灵芝的化感效应值分别为-0.188 8、-0.055 5和-0.100 0。
3 讨论与结论
在生产实践中,食药两用菌连续栽培出现产量和品质的下降后多归结为生产管理不当,导致病菌增多,但改善生产管理后,仍不见产量提升,致使栽培灵芝经常换地,但鲜有报导从化感作用的角度研究灵芝连作的问题。已有的化感作用研究对象多为植物,有关食用菌的化感作用研究较少,特别是有关食用菌与栽培连作土壤微生物间的化感作用的研究鲜有报导。
灵芝子实体像植物,但却没有植物的根,属于真菌,虽然连作障碍的发生机制可能跟其他的根际植物不同,但对于真菌类种植连作障碍机制的研究结果表明,覆土土壤微生物种群仍是影响连作障碍的重要因素[12]。
本研究结果表明,在连作优势土壤微生物种群中,细菌和霉菌均对灵芝菌丝体的生长具有一定影响,其中细菌中的产碱杆菌属、梭杆菌属、分支杆菌属对灵芝菌体的化感抑制作用强度较高,其抑菌方式主要是借助较快的生长速度在平板上形成霜层,这与大部分细菌对于食用菌的生长显示为抑制作用的研究结果一致[15]。真菌微生物中对灵芝抑制作用最明显的是木霉属,青霉属和链孢霉属次之。木霉属真菌对食用菌的抑制机理主要通过侵染同一平板寄主,夺取寄主营养最终杀死寄主,同时还可通过挥发性和非挥发性物质同时作用的方式抑制同一平板食用菌的生长[16-17];青霉和链孢霉真菌的主要抑制形式则是通过分泌有毒物质形成的霉层,逐步侵蚀食用菌菌落,最终杀死寄主[18-19]。本研究结果证明灵芝在与木霉属、青霉和链孢霉的对峙培养中最终枯死。由此可见,灵芝连作覆土微生物种群中的优势霉菌和某些细菌是灵芝连作中的土传病原菌,是灵芝连作障碍的重要因素之一。
参考文献
[1] 高 群, 孟宪志,于洪飞. 连作障碍原因分析及防治途径研究[J]. 山东农业科学, 2006, 44(3): 60-63.
[2] 马红梅, 陈永敢, 徐小雄, 等. 灵芝连作障碍的土壤微生态研究[J]. 山东农业大学学报(自然科学版), 2013, 44(4): 539-542.
[3] 蒋冬花. 培养基配方与栽培方式对灵芝产量和质量和影响[J]. 海南大学学报(自然科学版), 2001, 19(1): 76-79.
[4] 池小妹. 我国灵芝人工栽培技术研究现状[J]. 时珍国医国药,2005, 16(8): 791-792.
[5] 叶向花, 杨勇岐. 灵芝栽培新技术[J]. 现代农业科技, 2007, 36(16): 46.
[6] 高子勤,张淑香. 连作障碍与根际微生态研究Ⅰ根际分泌物及其生态效应[J]. 应用生态学报, 1998, 9(5): 949-554.
[7] 蒋国斌,谈献和. 中药材连作障碍原因及其防治途径研究[J]. 中国野生植物资源, 2007, 6(26): 32-34.
[8] 张耀辉, 张丽华, 周娜娜, 等. 葫芦瓜自毒作用研究[J]. 热带作物学报, 2011, 32(12): 2 264-2 267.
[9] 李淑香,高子勤. 连作障碍与根际微生态研究Ⅱ根系分泌物与酚酸物质[J]. 应用生态学报, 2000, 11(1): 152-156.
[10] Rice E I. Allelopathy[M]. New York: Academic Press, 1974.
[11] 孔垂华. 植物化感作用研究中应注意的问题[J]. 应用生态学报, 1998, 9(3): 332-336.
[12] 马红梅, 李小兵, 符 浩,等. 灵芝连作障碍的土壤微生物种群特性及其生物防治初探[J]. 河南农业科学, 2014, 43(30):53-58.
[13] 张信娣, 金叶飞, 陈 瑛. 光合细菌对鱼病原细菌生长的影响[J]. 中国生态农业学报, 2008, 16(3): 659-663.
[14] Wiliamson G B. Bioassays for allelopathy measureing treatment responses with independent control[J]. Journal of Chemical Ecology, 1988, 14(1): 181-187.
[15] 邱立友, 申进文,张继英,等. 食用菌与细菌的互作关系研究[C]//中国菌物学会第五届会员代表大会暨2011年学术年会论文摘要集. 2011.
[16] Faull J L. Production of an isonitrile antibiotic by an UV-induced mutant of Trichoderma harzianum[J]. Phytoehem,1994, 36(5): 1 273-1 276.
[17] Ghisalbert E L. Antifungal antibiotics produced by Trichoderma spp[J]. Soil Biology & Biochemistry, 1991, 23(11): 1 011-1 020.
[18] 向晶晶. 食用菌种植中污染菌青霉的拮抗菌筛选与应用研究[D]. 成都: 四川大学, 2007.
[19] 史 磊. 食用菌链孢霉防治[J]. 中国林副特产, 2010, 15(3):74-75.

