草莓炭疽菌初期侵染过程显微观察
赵玳琳 卯婷婷 赵兴丽 刘杏忠 蔡磊 陶刚
摘要:【目的】明确草莓炭疽菌(Colletotrichum fragariae)在侵染草莓叶片过程中病原菌的侵染致病过程,为防控草莓炭疽病提供理论依据。【方法】用草莓炭疽菌绿色荧光蛋白标记菌株LC0220-7GFP的分生孢子悬浮液接种离体健康草莓叶片,在荧光显微镜下观察病原菌的侵染过程及侵染结构。【结果】接种6~9 h为病原菌分生孢子萌发高峰期,接种9 h约90.00%的分生孢子已萌发;接种12~24 h为侵染结构形成高峰期,接种24 h约70.00%的芽管顶端产生附着胞并形成侵染钉开始侵染草莓叶片表皮细胞,有少量的菌丝开始直接侵染叶片表皮细胞,同时在寄主上表皮上有少量的附着枝形成;接种48 h为菌丝形成高峰期,菌丝大量形成并沿着表皮细胞延伸成网络状,叶片开始出现零星病斑;接种72~96 h为分生孢子盘形成高峰期;接种96~120 h为产孢高峰期,接种96 h产生新的分生孢子,大部分病原菌完成一个侵染循环;接种144 h形成典型的炭疽病斑。【结论】草莓炭疽菌通过产生附着胞侵入或直接侵入草莓叶片表皮细胞,使草莓叶片发病,形成典型的炭疽病斑。
关键词: 草莓炭疽菌;附着胞;荧光显微镜;侵染钉;侵染过程
中图分类号: S436.639 文献标志码:A 文章编号:2095-1191(2016)07-1140-06
0 引言
【研究意义】草莓炭疽病是草莓种植业的重要病害之一,其发生普遍,分布广泛,已成为继灰霉病和白粉病后制约我国草莓生产的第三大病害(陈宏州等,2014),近年來草莓炭疽病的发生呈上升趋势(杨敬辉等,2015)。据法国Denoyes和Baudry(1995)报道,适宜条件下草莓炭疽病最高可造成草莓减产80%;在我国,随着草莓种植面积的扩大,设施密闭及高温高湿环境等导致草莓炭疽病发生日益严重,造成草莓减产25%~30%,严重影响草莓的产量和品质(胡德玉等, 2014)。因此,尽快明确草莓炭疽病病原菌的侵染致病特征,对于寻求新的炭疽病病害防治策略,开发新的病害安全控制体系等具有重要意义。【前人研究进展】草莓炭疽病由多种炭疽菌(Colletotrichum Corda)复合侵染引起,已有文献报道的病原菌包括尖孢炭疽菌(C. acutatum Simmonds)、胶孢炭疽菌(C. gloeosporioides Penz)、草莓炭疽菌(C. fragariae Brooks)和黑线炭疽菌(C. dematiu Simmonds)(Gunnell and Gubler, 1992; Denoyes-Rothan et al., 2003)。1931年Brooks在美国佛罗里达州首次报道由草莓炭疽菌引起的草莓炭疽病。草莓炭疽菌一般情况下习惯性侵染草莓茎秆,引起草莓炭疽冠腐病(Curry et al., 2002)。多年来,草莓炭疽菌虽然在病原菌种类鉴定、病原菌生物学特性、为害症状及检测技术等方面有较多研究报道,但关于草莓炭疽病菌致病机制及其调控的研究仅限于零散报道(Howard and Albregts, 1983; Bonde et al.,1991;Sreenivasaprasad et al.,1992; Freeman et al., 1993;Curry et al.,2002;Martinez-Culebras et al.,2002, 2003;Fang et al.,2012),仅Curry等(2002)首次应用光学显微镜和透射电镜在细胞组织水平上观察草莓炭疽菌侵染草莓茎秆的过程和Fang等(2012)对草莓炭疽菌侵染草莓茎秆过程中蛋白质组学变化进行了相关研究。【本研究切入点】相对于传统的电镜技术,绿色荧光蛋白(Green fluorescent protein, GFP)标记系统由于荧光性能稳定、检测方便、灵敏度高及表达不受种属限制等特性而越来越为人们重视,并被成功地用于研究细菌、真菌在植物根部、体内的定殖观察(Ramos et al., 2002; 陈孝仁等, 2009;赵凤轩, 2010)及工程菌向环境的释放(Scott et al.,1998;Halfhill et al., 2001)等研究,应用GFP标记菌株观察病原菌在寄主体内的侵染过程,对病害过程进行实时动态追踪,将是未来重要的研究方向之一。目前,尚无应用GFP标记体系观察草莓炭疽菌侵染过程的报道。【拟解决的关键问题】用草莓炭疽菌(C. fragariae)绿色荧光蛋白标记菌株LC0220-7GFP的分生孢子液离体接种草莓叶片,在荧光显微镜下对其侵染致病过程及侵染结构等进行初步观察,旨在明确该病原菌在侵染草莓叶片过程中病原菌的侵染致病过程,为进一步揭示草莓炭疽病病害的发生、发展规律打下理论基础,同时为有效防治提供科学依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 草莓炭疽GFP标记菌株:LC0220- 7GFP,野生型菌株由中国科学院微生物研究所馈赠,荧光菌株通过ATMT遗传转化方法获得,于PDA斜面培养基上4 ℃条件下保存备用。
1. 1. 2 供试草莓品种 黔莓2号,草莓叶片采集于贵州省农业科学院园艺所大棚,用灭菌剪刀剪取大小均匀、生长周期较一致的健康草莓叶片若干备用。
1. 1. 3 供试培养基 培养基参考方中达(1998)的方法。马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯 200 g切片,放入1000 mL水煮沸,约30 min后用4层纱布过滤得滤液,加葡萄糖20 g、琼脂15 g,用玻璃棒混匀,加水定容至1000 mL。
1. 1. 4 分生孢子悬浮液制备 将于PDA斜面培养基上4 ℃保存的菌株LC0220-7GFP转移至PDA培养基,置于25 ℃培养箱内黑暗条件下培养5 d,用灭菌打孔器于菌落邊缘打取直径为6 mm的菌饼若干,将菌饼再次移至PDA培养基中,再次放入25 ℃培养箱内黑暗条件下培养7 d,病原菌在PDA培养基上大量产孢,然后在每个培养皿中加入5 mL无菌水,用灭菌玻璃棒刮取表面菌丝,经4层灭菌过滤纸过滤得到分生孢子滤液。用血球计数板计算分生孢子液浓度,通过离心浓缩或加入无菌水稀释等方法将溶液调整成浓度为1×106个/mL的分生孢子悬浮液。为提高分生孢子液在叶片上的黏着性,在接种前加入数滴Tween-20原液,Tween-20最终浓度为0.1%。
1. 2 试验方法
1. 2. 1 叶片接种方法 于大棚内用灭菌剪刀剪取大小均匀、生长周期较一致的健康草莓叶片100片,用无菌水冲洗3遍,75%酒精表面消毒,消毒后的叶片整齐放置于铺有湿润吸水纸的搪瓷盘中(搪瓷盘先用75%酒精喷洒消毒,铺4层吸水纸,然后喷洒无菌水使吸水纸保持湿润),用无菌水湿润后的湿棉花压住叶柄,确保叶片能长时间保持新鲜。用灭菌枪头吸取制备好的浓度为1×106个/mL的分生孢子悬浮液接种于草莓叶片上,每片叶片接种500 μL,用灭菌后的小刷子均匀地涂抹于草莓叶片上,以喷洒无菌水为空白对照。接种后用保鲜膜封口,置于28 ℃、湿度90%、14 h光照/10 h黑暗的培养箱中培养。
1. 2. 2 取样和显微观察方法 在接种不同时间点(接种后3、6、9、12、24、48、72、96、120、144 h)取样,每时间点随机取样6片叶片。用灭菌刀片将叶片切成若干小薄块制作成临时水装片,临时水装片置于荧光显微镜下进行观察、拍照,并统计分生孢子萌发和附着胞形成的时间点和百分率,孢子萌发和附着胞产生每次随机统计30个孢子,3次重复。显微镜设置:Diode/Argon/HeNe1- HeNe2激发光,绿色荧光通过488 nm滤镜观察。
1. 3 统计分析
参照万三连等(2014)的方法对试验数据进行统计分析。孢子萌发、附着胞形成比率计算公式:形成比率(%)=形成各结构孢子数/孢子统计总数×100。
2 结果与分析
2. 1 病原菌分生孢子在草莓叶片上的侵染过程及致病性
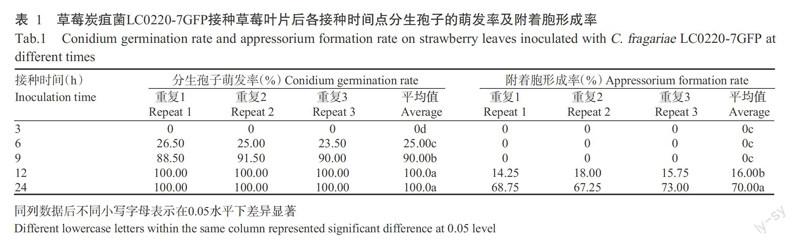
接种后3~24 h LC0220-7GFP分生孢子萌发及附着胞形成情况见表1。接种后分生孢子首先附着于叶片表面,接种6 h,25.00%的病原菌分生孢子开始从端部或近端部萌发出棒状芽管(图1-1),1个分生孢子能产生1~3根牙管(图1-2);接种9 h,约90.00%的分生孢子萌发;接种12 h,分生孢子萌发率为100.00%,约16.00%的芽管顶端开始膨大,分化成特异的侵染结构附着胞,此时的附着胞颜色较浅,尚未黑化,胞质较稀疏(图1-3),部分芽管分化形成初生菌丝和次生菌丝(图1-4);接种24 h,可观察到有少量的侵染菌丝直接侵染叶片表皮细胞(图1-5),同时约70.00%的芽管产生大量的黑化附着胞,在一些附着胞基部观察到有一黑色边缘的小圆点,是附着胞分化形成的侵染钉,即黑化附着胞分化形成侵染钉开始穿透寄主表皮细胞进行侵染(图1-6),且侵染菌丝已侵入叶片皮层细胞(图1-7),同时有少量的菌丝分化形成附着枝(图2-7~9);接种48 h,菌丝呈网络状覆盖于叶片表面,侵染菌丝在寄主皮层细胞间大量扩增(图1-8),同时通过叶片腺毛组织细胞进行侵染(图1-9),在叶片上出现肉眼可见的针尖大小病斑(图1-13),发病率为100.00%,但空白对照叶片无病斑(图1-14);接种72 h,侵染菌丝迅速扩增,从1个细胞侵染扩散到周围其他细胞,分生孢子盘开始萌发(图1-10);接种96 h,在叶片表面形成大量的分生孢子盘,分生孢子盘上的分生孢子梗产生新的分生孢子,大多数病原菌完成一个侵染循环(图1-11);接种144 h,叶片上许多小病斑相互连成大病斑或成一片,形成典型的炭疽病斑(图1-15),叶片细胞开始大量腐烂崩解(图1-12),而空白对照仍无症状(图1-16)。
经过观察可将草莓炭疽菌初期侵染草莓叶片过程分为几个关键时期:6~9 h为分生孢子萌发高峰期;12~24 h为侵染结构形成高峰期;48 h为菌丝形成高峰期;72~96 h为分生孢子盘形成高峰期;96~120 h为产孢高峰期。
2. 2 病原菌侵染结构的超微观察
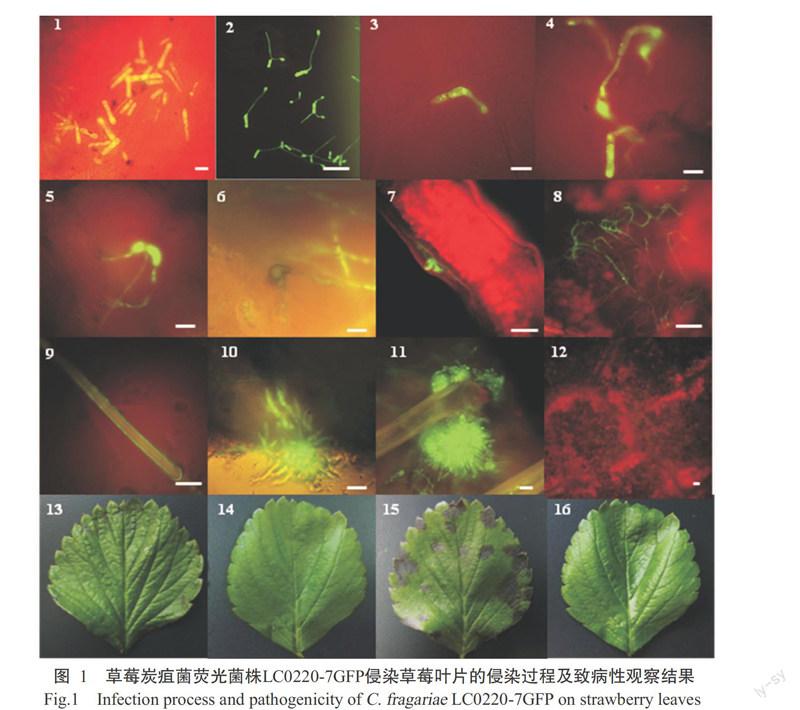
当病原菌识别寄主后,在寄主表面开始萌发形成芽管并产生一系列的侵染结构:附着胞、附着枝、侵染钉、初生菌丝、次生菌丝等。在荧光显微镜下观察,接种12 h开始形成附着胞,此时的附着胞颜色较浅,胞质较稀疏。24 h后附着胞分化成熟,胞壁逐渐黑色素化,胞质稠密,在附著胞基部形成1个圆形小点,即侵染钉,侵染钉穿透寄主角质层和细胞壁侵染寄主。接种24 h后在寄主上表皮上还可观察到少量爪状附着枝,附着枝尚未黑色素化(图2-7~9)。
侵染结构有两种形成方式:一是分生孢子端部产生芽管,芽管膨大产生附着胞或附着枝等;二是从菌丝上分化出侧枝产生附着胞或附着枝等。显微镜观察发现,LC0220-7GFP侵染草莓叶片能形成多种形态各异的附着胞,如圆形、姜瓣形、卵圆形、梨形、马蹄形和不规则形等(图2-1~6),同时,附着胞有多种着生方式,可以着生于芽管顶端(图2-1、图2-3),也可着生于菌丝分化的侧枝顶端(图2-2、图2-5)。在观察到的附着枝中,可以单个着生(图2-7),也可形成多个爪状的附着枝(图2-8、图2-9)。
3 讨论
炭疽菌属(C. Corda)是一类重要的植物病原菌,其地理分布和寄主范围均很广泛,能严重危害多种瓜果蔬菜、苗木果树等。该病菌分生孢子侵染途径有两种,一是通过自然孔口(气孔、皮孔)或伤口入侵;另一种是必须依赖于病原菌独特的侵染结构——附着胞(Appressorium)的直接侵入(王葵娣等,2007),在整个侵染过程中,附着胞的形成起着重要的致病作用。本研究观察到草莓炭疽菌通过产生附着胞侵入寄主的同时,后期还能产生附着枝。一般情况下,一些土传病原菌也能通过产生特殊的侵染结构——附着枝侵染寄主,如小麦全蚀病菌(Gaeumannomyces graminis)(Mendgen et al., 1996;Freeman and Ward, 2004;Sesma and Osbourn, 2004)。在前人的研究中尚未见草莓炭疽菌通过产生附着枝侵染寄主的报道。附着枝和附着胞在形成和结构上有许多相似之处,它们通常形成于相同的有机体上,但在特定条件下一般只有附着胞或附着枝单独形成(Howard, 1997;Money et al., 1998)。植物病原菌通常在进行腐生生活或被掩埋在土壤中时能形成附着枝,有学者认为此时附着枝扮演着附着胞入侵寄主的角色(Howard, 1997),也有人认为此时附着枝的形成可能是为了度过恶劣的生存环境,作为一种生存结构存在(Epstein, 1994)。Curry等(2002)报道, 草莓炭疽菌在经历一个短暂的活体营养阶段(小于12 h)后立即进入死体营养阶段。本研究中,接种24 h后,草莓叶片上的病原菌菌丝能形成附着枝,病原菌可从已死亡的植物有机物中吸取养分进行腐生生活,此時附着枝可能是作为一种生存结构,成为下一个侵染循环或下一个生长季节再次侵染的侵染源。
炭疽菌屬真菌主要采用两种侵染策略,即细胞内定殖和角质层下内部定殖(Perfect et al., 1999),大多数炭疽菌属于前者类型。草莓炭疽菌的侵染方式以胞内半活体营养寄生为主,与寄主建立了两种营养关系:活体营养和死体营养(Connell et al., 1985;张敬泽和徐同, 2005),即侵染初期无症状阶段(或活体营养阶段)和最后有明显症状的危害阶段。OConnell等(1985)和Leach(1922)描述区别无症状阶段和危害阶段的侵染菌丝为初生菌丝和次生菌丝,炭疽菌活体营养阶段持续一段时间后,随着初生菌丝上产生次生菌丝,活体侵染菌丝转向死体营养阶段,死体营养阶段引起典型的炭疽病症状和枯萎症状。前人研究表明,草莓炭疽菌活体营养阶段较短,一般少于12 h,之后次生菌丝产生比其更具有破坏性的次生菌丝,次生菌丝的产生标志着侵染进入死体营养阶段(Curry et al.,2002)。本研究结果与上述报道相符,说明接种草莓炭疽菌12 h前该菌进行活体营养生长。
4 结论
本研究结果表明,草莓炭疽菌能在草莓叶片表面萌发形成一系列的侵染结构,如芽管、附着胞等,草莓炭疽菌通过侵染草莓叶片,使草莓叶片发病形成典型的炭疽病斑。
参考文献:
陈宏州,肖婷,吴祥,吉沐祥,杨敬辉. 2014. 草莓灰霉病菌对10种杀菌剂的敏感性检测[J]. 江西农业学报,26(5): 65-67.
Chen H Z,Xiao T,Wu X,Ji M X,Yang J H. 2014. Sensitivity determination of strawberry Botrytis cinerea to 10 kinds of fungicides[J]. Acta Agriculturae Jiangxi, 26(5): 65-67.
陈孝仁, 程保平, 王新乐, 董莎萌, 王永林, 郑小波, 王源超. 2009. 利用绿色荧光蛋白研究大豆疫霉与大豆的互作[J]. 科学通报, 54(13): 1894-1901.
Chen X R, Cheng B P, Wang X L, Dong S M, Wang Y L, Zheng X B, Wang Y C. 2009. Green fluorescent protein(GFP) as a vital marker for studying the interaction of Phytophthora sojae and soybean[J]. Chinese Science Bulletin, 54(13): 1894-1901.
方中达. 1998. 植病研究方法[M]. 北京:中国农业出版社:46-50.
Fang Z D. 1998. Research Methods of Plant Pathology[M]. Beijing: China Agriculture Press: 46-50.
胡德玉,钱春,刘雪峰. 2014. 草莓炭疽病研究进展[J]. 中国蔬菜,(12):9-14.
Hu D Y, Qian C, Liu X F. 2014. Research progress on strawberry anthracnose[J]. China Vegetables,(12): 9-14.
万三连,梁鹏,刘文波,张宇,缪卫国,郑服丛. 2014. 橡胶树与白粉病菌Oidium heveae亲和互作组织细胞学研究[J]. 植物保护,40(3):26-36.
Wan S L, Liang P, Liu W B, Zhang Y, Miu W G, Zheng F C. 2014. Cytological analysis of compatible interations between rubber tree and Oidum beveae[J]. Plant Protection, 40(3): 26-36.
王葵娣,王文華,郑服丛. 2007. 炭疽菌附着胞的研究进展[J]. 中国农学通报,23(1):265-270.
Wang K D, Wang W H, Zheng F C. 2007. Advance research on appressorium of Colletotrichum[J]. Chinese Agricultural Science Bulletin, 23(1): 265-270.
杨敬辉,陈宏州,肖婷,吴祥,吉沐祥,庄义庆. 2015. 草莓炭疽病病原鉴定及其对12种杀菌剂的毒力测定[J]. 西南农业学报,28(6):2527-2531.
Yang J H,Chen H Z,Xiao T,Wu X,Ji M X,Zhuang Y Q. 2015. Pathogen identification and toxicity determination of 12 different fungicides of strawberry anthracnose[J]. Southwest China Journal of Agricultural Sciences,28(6):2527-2531.
张敬泽,徐同. 2005. 柿树炭疽菌侵染不同柿树种、品种和部位的细胞学特征[J]. 菌物学报,24(1):116-122.
Zhang J Z, Xu T. 2005. Cytological characteristics of the infection in different species, varieties and organs of persimmon by Colletotrichum gloeosporioides[J]. Mycosystema,24(1):116-122.
趙鳳轩. 2010. 绿色荧光蛋白标记的大丽轮枝菌的获得及其在棉花中侵染过程研究[D]. 北京: 中国农业科学院.
Zhao F X. 2010. Production of Verticillium dahliae Kleb tagged by green fluorescence protein and its infection process in cottons[D]. Beijing: Chinese Academy of Agricultural Sciences.
Bonde M R, Peterson G L, Maas J L. 1991. Isozyme comparisons for identification of Colletotrichum species pathogenic to strawberry[J]. Phytopathology, 81(12): 1523-1528.
Brooks A N. 1931. Anthracnose of Strawberry caused by Colletotrichum fragariae, n. sp.[J]. Phytopathology, 21(7): 739-744.
Connell R J, Bailey J A, Richmond D V. 1985. Cytology and physiology of infection of Phaseolus vulgaris by Colletotrichum lindemuthianum[J]. Physiological Plant Pathology, 27(1): 75-98.
Curry K J, Abril M, Avant J B, Smith Barbara J. 2002. Strawberry anthracnose: Histopathology of Colletotrichum acutatum and C. fragariae[J]. Phytopathology, 92(10): 1055-1063.
Denoyes B, Baudry A. 1995. Species identification and ecological study of the genus palaemonetes(Decapoda: Caridea) in the French Mediterranean[J]. Phytopathology, 26(2): 53-57.
Denoyes-Rothan B, Guérin G, Délye C, Smith B, Minz D, Maymon M, Freeman S. 2003. Genetic diversity and pathogenic variability among isolates of Colletotrichum species from strawberry[J]. Phytopathology, 93(2): 219-28.
Epstein L. 1994. Production of hyphopodia by wild type and three transformants of Gaeumannomyces graminis var. graminis[J]. Mycologia, 86(1):72-81.
Fang X P, Chen W Y, Xin Y, Xin Y, Zhang H M, Yan C Q, Yu H, Liu H, Xiao W F, Wang S Z, Zheng G Z, Liu H B, Jin L, Ma H S, Ruan S L. 2012. Proteomic analysis of strawberry leaves infected with Colletotrichum fragariae[J]. Journal of Proteomics, 75(13): 4074-4090.
Freeman J, Ward E. 2004. Gaeumannomyces graminis, the take-all fungus and its relatives[J]. Molecular Plant Patho-
logy, 5(4): 235-252.
Freeman S, Pham M, Rodriguez R J. 1993. Molecular genoty-
ping of Colletotrichum species based on arbitrarily primed PCR, A+ T-rich DNA, and nuclear DNA analyses[J]. Experimental Mycology, 17(4): 309-322.
Gunnell P S, Gubler W D. 1992. Taxonomy and morphology of Colletotrichum species pathogenic to strawberry[J]. Mycologia, 84(2): 157-65.
Halfhill M D, Richards H A, Mabon S A, Stewart C N. 2001. Expression of GFP and Bt transgenes in Brassica napus and hybridization with Brassica rapa[J]. Theoretical and Applied Genetics, 103(5), 659-667.
Howard C M, Albregts E E. 1983. Black leaf spot phase of strawberry anthracnose caused by Colletotrichum gloeosporioides(=C. fragariae)[J]. Plant Disease, 67(10): 1144-1146.
Howard R J. 1997. Breaching the outer barriers-cuticle and cell wall penetration[M]//Plant Relationships. Heidelberg: Springer Berlin Heidelberg: 43-60.
Leach J G. 1922. The Parasitism of Colletotrichum lindemuthianum(Sac. and Mag.) Bri. and Cav.[D]. Minnesota: University of Minnesota.
Martinez-Culebras P V, Barrio E, Suarez-Fernandez M B, Garcia-Lopez M D, Querol A. 2002. RAPD analysis of Colletotrichum species isolated from strawberry and the design of specific primers for the identification of C. fragariae[J]. Journal of Phytopathology, 150(11-12): 680-686.
Martinez-Culebras P V, Querol A, Suarez-Fernandez M B, Garcia-Lopez M D, Querol A. 2003. Phylogenetic relationships among Colletotrichum pathogens of strawberry and design of PCR primers for their identification[J]. Journal of Phytopathology, 151(3): 135-143.
Mendgen K, Hahn M, Deising H. 1996. Morphogenesis and mechanisms of penetration by plant pathogenic fungi[J]. Annual Review of Phytopathology, 34(1): 367-386.
Money N P, Caesar-TonThat T C, Frederick B, Henson J M. 1998. Melanin synthesis is associated with changes in hyphopodial turgor, permeability, and wall rigidity in Gaeumannomyces graminis var. graminis[J]. Fungal Genetics and Biology, 24(1-2): 240-251.
OConnell R J, Bailey J A, Riehmond D V. 1985. Cytology and physiology of infection of Phaseolus vuglaris by Colletotrichum lindemuhtainum[J]. Physiologial Plant Pathology, 27(1):75-98.
Perfect S E, Hughes H B, OConnell R J, Green J R. 1999. Colletotrichum: a model genus for studies on pathology and fungal-plant interactions[J]. Fungal genetics and Biology, 27(2): 186-198.
Ramos H J O, Roncato-Maccari L D B, Souza E M, Juliana R L S, Mariangela H, F bio O P. 2002. Monitoring Azospi-
rillum-wheat interactions using the gfp and gusA genes constitutively expressed from a new broad-host range vector[J]. Journal of Biotechnology, 97(3): 243-252.
Scott K P, Mercer D K, Glover L A, Flint H J. 1998. The green fluorescent protein as a visible marker for lactic acid bacteria in complex ecosystems[J]. Fems Microbiology Ecology, 26(3): 219-230.
Sesma A, Osbourn A E. 2004. The rice leaf blast pathogen undergoes developmental processes typical of root-infecting fungi[J]. Nature, 431(7008): 582-586.
Sreenivasaprasad S, Brown A E, Mills P R. 1992. DNA sequence variation and interrelationships among Colletotrichum species causing strawberry anthracnose[J]. Physiological and Mole-
cular Plant Pathology, 41(4): 265-281.
(責任編辑 麻小燕)

