黄芪多糖对血管紧张素Ⅱ介导心肌细胞炎症因子的影响*
陈添华, 周萍萍, 李志樑
(1.井冈山大学 临床医学院, 江西 吉安 343000; 2.井冈山大学附属医院, 江西 吉安 343000; 3.南方医科大学珠江医院, 广东 广州 510280)
黄芪多糖对血管紧张素Ⅱ介导心肌细胞炎症因子的影响*
陈添华1, 周萍萍2, 李志樑3
(1.井冈山大学 临床医学院, 江西 吉安343000; 2.井冈山大学附属医院, 江西 吉安343000; 3.南方医科大学珠江医院, 广东 广州510280)
[摘要]目的: 观察黄芪多糖(APS)对血管紧张素Ⅱ(AngⅡ)诱导的大鼠心肌细胞肥大及炎症反应的干预作用。方法: 原代培养大鼠心肌细胞,分为对照组、AngⅡ(10-6mol/L)刺激组、APS低溶度干预组、APS中浓度干预组和APS高浓度干预组,APS各干预组分别加入25 mg/L、50 mg/L及100 mg/L APS孵育30 min后加入10-6mol/L AngⅡ;Real-time PCR及ELISA方法测定各组心肌细胞Toll样受体4(TLR4)、心房利钠多肽(ANP)及肿瘤坏死因子-α(TNF-α) mRNA表达及细胞培养上清液TNF-α浓度; Bradford法测定心肌细胞总蛋白含量。结果: 与AngⅡ刺激组比较,不同浓度APS干预后,心肌细胞TLR4、ANP、TNF-α mRNA表达减少,心肌细胞培养液中TNF-α浓度下降,心肌细胞总蛋白含量减少,随着干预浓度的升高,这种作用逐惭增强。结论: APS对AngⅡ刺激引起的心肌细胞肥大及炎症反应有良好的保护作用,其机制可能是通过抑制TNF-α等炎症因子实现的。
[关键词]中药; 黄芪多糖; 心肌细胞; 血管紧张素Ⅱ; 肿瘤坏死因子-α; 大鼠,Sprague-Dawley
黄芪多糖(astragalus polysaccharides,APS)是中药黄芪最主要的活性成分,具有提高心肌成活率,抑制细胞凋亡,并对缺氧-复氧心肌细胞有保护作用[1]。炎症在心血管病的发生发展中起重要作用,肾素-血管血管紧张素系统(renin-angiotensin system, RAS)与心血管病炎症有关,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)与其受体结合后,可激活多种炎症因子,参与炎症损伤[2]。本实验采用Ang II诱导SD乳鼠心肌细胞肥大及炎症反应,检测心肌细胞Toll样受体4(toll like receptor 4,TLR4)、心房利钠多肽(atrial natriuretic peptide,ANP)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA的变化,探讨黄芪多糖对心肌细胞肥大及炎症反应的干预作用。
1材料与方法
1.1实验动物与试剂
出生2~3 d的SD大鼠乳鼠,雌雄不拘,由南方医科大学实验动物中心提供,动物合格证号SCKK(粤)2006-0015;黄芪多糖(天津赛诺制药有限公司,国药准字Z20040086),质量分数为98%;AngⅡ为美国Sigma公司产品,Trizol试剂盒为美国Invitrogen公司产品,大鼠TNF-α ELISA试剂盒为美国BD Biosciences公司产品。
1.2心肌细胞培养
无菌条件下开胸取出SD乳鼠心脏,分离左室心肌,用眼科剪剪成0.5~1 mm3的组织块后用胰蛋白酶分次消化,差速贴壁法分离成纤维细胞,调整细胞浓度为1×109cells/L,接种到培养瓶,于37 ℃、5% CO2孵箱中培养。培养3 d可见细胞出现不规则、整体协调一致的搏动。
1.3分组
常规培养心肌细胞72 h后,将心肌细胞分为5组:对照组,不做任何处理;Ang Ⅱ刺激组,用10-6mol/L AngⅡ处理;APS低浓度干预组,用25 mg/L APS孵育乳鼠心肌细胞30 min后,再加入10-6mol/L AngⅡ;APS中浓度干预组,用50 mg/L APS孵育乳鼠心肌细胞30 min后,再加入10-6mol/L AngⅡ;APS高浓度干预组,用100 mg/L APS孵育乳鼠心肌细胞30 min后,再加入10-6mol/L AngⅡ。各组细胞加药后继续培养24 h。
1.4检测指标
1.4.1mRNA心肌细胞TLR4、ANP及TNF-α的表达采用Real-time PCR法,各组心肌细胞继续培养24 h后,Trizol试剂盒抽提各组心肌细胞的总RNA后,取4 μL RNA模板做逆转录反应,合成cDNA。反应条件:37 ℃ 1 h,95 ℃ 3 min。扩增内参GAPDH上游引物序列为5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物序列为5′-TTTGAGGGTGCAGCGAACTT-3′;扩增TLR4上游引物序列为5′-GAATCTCAGCAAAATCCCTCA-3′,下游引物序列为5′-TCCTGGGGAAAAACTCTTGAT -3′;扩增ANP上游引物序列为5′-TGAGCCGAGACAGCAAACATC-3′,下游引物序列为5′-AGGCCAGGAAGAGGAAGAAGC-3′;扩增TNF-α上游引物序列为5′-CATGGATCTCAAAGACAACCAA-3′,下游引物序列为5′-CTCCTGGTATGAAATGGCAAAT-3′。最后将逆转录产物运用ABI7500型定量PCR仪检测基因的表达,反应条件:93 ℃ 2 min,93 ℃ 15 s、55 ℃ 25 s、72 ℃ 25 s、共40循环。结果以拷贝数进行分析,考虑到各个样本总RNA浓度的差异,最终计算结果按目的基因/内参基因比值换算。
1.4.2总蛋白含量心肌细胞继续孵育24 h后,收集各组心肌细胞, D-hanks冲洗3次后,加入SDS细胞裂解液使心肌细胞裂解,Bradford法测定各组心肌细胞总蛋白含量。
1.4.3培养液中TNF-α浓度各组心肌细胞继续孵育24 h后,收集上清液,-80 ℃保存。TNF-α采用ELISA试剂盒测定浓度,按照试剂盒操作说明进行操作。
1.5统计学处理
采用SPSS 13.0作数据处理,计量资料采用均数±标准差表示,多组间均数比较采用单因素方差分析,组间进一步比较采用LSD-t检验。P<0.05为差异有统计学意义。
2结果
2.1心肌细胞TLR4、ANP及TNF-αmRNA表达
采用Real-time PCR检测结果显示,与对照组相比,AngⅡ刺激组心肌细胞TLR4、ANP及TNF-α mRNA表达增加(P<0.05);不同溶度APS干预后心肌细胞TLR4、ANP及TNF-α mRNA表达较AngⅡ刺激组下降,差异有统计学意义(P<0.05),且随着APS干预浓度的升高,TLR4、ANP及TNF-αmRNA表达逐惭下降,差异有统计学意义(P<0.05)。见表1。
2.2心肌细胞蛋白含量
与对照组相比,AngⅡ刺激组心肌细胞蛋白含量增加,差异有统计学意义(P<0.05);不同溶度APS干预后心肌细胞蛋白含量下降,差异有统计学意义(P<0.05);且随着APS干预浓度的升高,心肌细胞蛋白含量逐惭下降差异有统计学意义(P<0.05),见表2。
2.3TNF-α浓度
与对照组相比,AngⅡ刺激组上清液TNF-α浓度增加,差异有统计学意义(P<0.05);不同溶度APS干预后上清液TNF-α浓度下降,差异有统计学意义(P<0.05);且随着APS干预浓度的升高,TNF-α浓度逐惭下降差异有统计学意义(P<0.05),见表3。
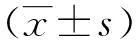
表1 各组心肌细胞TLR4、ANP及
(1)与对照组比较,P<0.05;(2)与刺激组比较,P<0.05;(3)与低溶度组比较,P<0.05;(4)与中溶度组比较,P<0.05
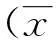
表2 各组心肌细胞总蛋白含量±s)
(1)与对照组比较,P<0.05;(2)与刺激组比较,P<0.05;(3)与低溶度组比较,P<0.05
3讨论
高血压病严重危害人类身体健康,最终导致严重的心脑肾等靶器管功能损害,其中RAS发挥着重要作用。AngⅡ是RAS的主要效应分子,参与了高血压心肌损伤的全过程,与心脏疾病的发展密切相关[3]。AngⅡ生物学功能主要体现在调节血管张力和血流、促进细胞生长和增生。研究发现,AngⅡ还具有致炎作用,AngⅡ通过调节细胞因子、化学趋化因子和黏附因子等多种炎性介质的表达参与机体炎症反应相关疾病的发生和发展,在动脉粥样硬化、心肌肥厚等心血管疾病中发挥着炎症因子的作用[4-5]。
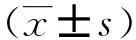
表3 各组心肌细胞培养上清液中
(1)与对照组比较,P<0.05;(2)与刺激组比较,P<0.05
TLR4属于跨膜信号传递受体家族,在免疫反应中起着重要作用。TLR4与其配体结合,通过胞内区与接头蛋白髓样细胞分化因子(myeloid differentiation factor,MyD88)的TH结构域相互作用,使胞浆内NF-κB从静息状态下激活,活化的NF-κB转移到细胞核内与DNA分子上炎症反应调节基因中启动子区域的NF-κB结合位点相结合,启动细胞因子(IL-6,TNF-α等)以及协同刺激因子CD86等基因转录和翻译,导致炎症因子大量释放[6]。TLR4可在心肌细胞膜上表达,AngⅡ可通过TLR4活化NF-κB,使心肌细胞内TNF-α表达增加,诱导心肌细胞炎症反应[7]。研究表明,TLR4-NF-κB信号转导通路活化过程中产生多种炎症因子,这些炎症因子参与了心肌细胞炎症反应过程,并且在心肌肥厚、心肌细胞调亡等病理生理过程中发挥着重要的作用[8]。
既往研究表明AngⅡ刺激可引起心肌细胞肥厚,肥厚的心肌细胞肌动蛋白重组,总蛋白含量升高,ANP上调[9-10]。ANP由心肌细胞合成和分泌,在心肌肥厚过程中,伴随有ANP升高,是公论的反映心肌细胞肥大的特征性指标[11]。早期研究表明,在许多组织或器官,如肾脏、心脏和血管中存在着独立的局部RAS系统,局部组织中的AngⅡ具有胞内作用,可促进心肌细胞的DNA合成,mRNA转录,导致细胞肥大[12]。正常心肌组织中TNF-α表达水平较低或不表达,肥厚心肌组织TNF-α表达明显增加[13]。Sriramula等[14]在动物实验研究发现,在由血管紧张素Ⅱ诱导的心肌肥厚过程中,TNF-α基因敲除大鼠相比野生型大鼠心肌肥厚明显减轻,提示TNF-α在血管紧张素Ⅱ诱导的心肌肥厚中起重要作用。Devorah Gurantz等[15]报道TNF-α使心肌中成纤维细胞的血管紧张素ⅡAT1受体上调,两者均可以在心肌组织局部合成分泌, 具有自分泌和旁分泌作用,共同参与心肌病变的进展和演变过程。本实验中用AngⅡ刺激心肌细胞后, TLR4表达增加, TNF-α分泌增多,同时心肌细胞总蛋白含量和反映心肌肥大指标ANP增多。加用黄芪多糖后,心肌细胞TLR4表达下降, TNF-α分泌下降,心肌细胞蛋白含量和ANP下降,随着剂量增加,这种作用逐惭增强,表明黄芪多糖可抑制AngⅡ刺激引起的心肌细胞肥大和炎症反应。
综上所述,黄芪多糖AngⅡ刺激引起的心肌细胞肥厚和炎症反应有良好的保护作用,黄芪多糖的这种作用为高血压心肌损害的防治研究提供了新的思路和理论依据。
4参考文献
[1] Min Q, Bai YT, Yu W, et al. Protective effects of astragalus polysaccharide on cultured myocardial cells subjected to anoxia/reoxygenation injury in neonatal rats [J]. Chin Pharmacol Bull, 2010(12):1661-1664.
[2] Holownia A,Braszko JD.The effect ofangiotensinⅡand IV on ERKl/2 and CREB signalling in cultured rat astroglial cells [J].Naunyn Schmiedebergs Arch Pharmacol, 2007(3):157-163.
[3] Rodriguez IB,Vaziri ND, Johnson RJ.Inflammation,angiotensinⅡ,and hypertension [J].Hypertension, 2008(5):135-136.
[4] De Giusti VC, Garciarena CD, Aiello EA. Role of reactive oxygen species (ROS) in angiotensin II-induced stimulation of the cardiac Na+/HCO3- cotransport [J].J Mol Cell Cardiol, 2009(5):716-722.
[5] Kaczorowski DJ, Nakao A, Vallabhaneni R, et al.Mechanisms of Toll-like receptor 4 (TLR4)-mediated inflammation after cold ischemia/reperfusion in the heart [J].Transplantation, 2009(10):1455-1463.
[6] Bernard NJ,O'Neill LA.Mal,more than a bridge to MyD88[J].IUBMB Life, 2013(9):777-786.
[7] Wang J, Zhang Y, Guo LL, et al. Salvianolic acid B inhibits the TLR4-NFκB-TNFα pathway and attenuates neonatal rat cardiomyocyte injury induced by lipopolysaccharide[J]. Chin J Integr Med, 2011(10):775-779.
[8] Hedayat M, Mahmoudi MJ, Rose NR, et al. Proinflammatory cytokines in heart failure: double edged swords [J].Heart Fail Rev, 2010(6):543-562.
[9] Yu L, She T, Li M,et al. Tetramethylpyrazine inhibits angiotensin II-induced cardiomyocyte hypertrophy and tumor necrosis factor-α secretion through an NF-κB-dependent mechanism[J]. Int J Mol Med, 2013(3):717-722.
[10]汪海宁,刘晨,李艳辉,等.自噬在血管紧张素Ⅱ诱导心肌细胞肥大中的作用[J] .中山大学学报, 2012(4):440-443.
[11]Leite MF, Page E, Ambler SK. Regulation of ANP secretion by ndothelin-1 in cultured atrial myocytes: desensitization and receptor subtype [J]. Am J Physiol, 1994(6):193-203.
[12]Griendling KK, Murphy TJ,Alexander RW. Molecular biology of therennin angiotensin system[J].Circulation, 1993(6):1816-1828.
[13]Wu QQ, Xu M, Yuan Y, et al. Cathepsin B deficiency attenuates cardiac remodeling in response to pressure overload via TNF-α/ASK1/JNK pathway[J]. Am J Physiol Heart Circ Physiol, 2015(9):1143-1154.
[14]Sriramula S,Haque M,Maild DS, et al.Involvement of tumor necrosis factor-α in angiotensin Ⅱ-mediated effects on appetite,hypertension and cardiac hypertrophy[J].Hypertension, 2008(5):1345-1351.
[15]Devorah G,Randy T,Francisco J,et al. Tumor necrosis factor-α upregulates angiotensinⅡ type 1 receptors on cardiac fibroblasts [J]. Circ Res, 1999(7):272-279.
(2016-02-17收稿,2016-03-29修回)
中文编辑: 刘平; 英文编辑: 刘华
The Influence of Astragalus Polysaccharides on Angiotensin Ⅱ Induced Cardiomyocyte Inflammation Factor TNF-α
CHEN Tianhua1, ZHOU Pingping2, LI Zhiliang3
(1.SchoolofMedicine,JinggangshanUniversity,Ji'an343000,Jiangxi,China; 2.TheAffiliatedHospitalofJinggangshanUniversity,Ji'an343000,Jiangxi,China; 3.TheAffiliatedZhujiangHospitalofSouthernMedicalUniversity,Guangzhou510280,Guangdong,China)
[Abstract]Objective: To explore the intervention effect of astragalus polysaccharides(APS) on angiotensin Ⅱ induced cardiomyocyte hypertrophy and inflammation of rats. Methods: The cardiomyocytes of rats of primary culture were divided into control group, AngⅡ stimulation group, low APS concentration intervention group, middle APS concentration intervention group and high APS concentration intervention group. Cardiomyocytes of each APS intervention were treated with different concentrations of APS for 30 minutes and stimulated with angiotensin Ⅱ to induce cardiomyocyte hypertrophy and inflammation. In each group, Real-time PCR was adopted to determine mRNA expression of TLR4, ANP, TNF-α of cardiomyocytes, Elisa was used to determine TNF-α concentration in cell culture supernatant, and Bradford's method was used to determine total protein content of cardiomyocytes. Results: Compared with AngⅡstimulation group, the mRNA expression of TLR4, ANP, TNF-α of cardiomyocytes and cardiomyocyte protein and TNF-α concentration in cell culture supernatant were decreased with APS intervention. Conclusion: APS can play a protection role in angiotensin Ⅱ induced cardiomyocyte hypertrophy and inflammation, and the mechanism may be inhibiting inflammation factors such as TNF-α.
[Key words]cardiomyocyte; astragalus polysaccharides; cardiomyocyte; angiotensin Ⅱ; tumour necrosis factor alpha; rats,Sprague-Dawley
[中图分类号]R361.3; R285.6
[文献标识码]A
[文章编号]1000-2707(2016)04-0446-04
网络出版时间:2016-04-20网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160420.1853.054.html

