PI3K/Akt/mTOR信号通路对自然衰老小鼠骨骼肌自噬的影响及不同运动方式的调控
樊申元,靳二辉
◀运动人体科学
PI3K/Akt/mTOR信号通路对自然衰老小鼠骨骼肌自噬的影响及不同运动方式的调控
樊申元1,靳二辉2
(1安徽科技学院体育部,安徽凤阳233100;2安徽科技学院动物科学学院,安徽凤阳233100)
目的:探讨不同方式运动对自然衰老小鼠骨骼肌自噬的影响及其分子生物学机制。方法:36只8周龄雌性小鼠随机分为衰老对照组(C)、衰老自主运动组(V)、衰老跑台运动组(F)。C组于鼠笼中正常饲养,V组和F组分别进行8周的自主跑轮运动和跑台运动。训练结束12~24h内,取腓肠肌,利用RT-PCR法检测相关细胞因子的mRNA表达。结果:与C组相比,V组PI3K(P<0.05)、PDK1(P<0.05)和Atg3(P<0.05)的mRNA表达均出现显著变化;与C组相比,F组PI3K(P<0.01)、PDK1(P<0.01)、Akt(P<0.05)、mTOR(P<0.05)、TSC2(P<0.05)、Atg3(P<0.01)、ULK1(P<0.05)、Beclin1(P<0.05)、LC3(P<0.05)和Atg7(P<0.05)mRNA表达均出现显著变化;与V组相比,F组PI3K(P<0.05)、PDK1(P<0.05)、Akt(P<0.05)的mRNA表达均显著上调。结论:跑台运动可通过激活PI3K/Akt/mTOR信号通路抑制衰老小鼠骨骼肌的自噬水平。
不同方式运动;衰老;骨骼肌;自噬;PI3K/Akt/mTOR
随着年龄增加,骨骼肌蛋白质合成能力下降,同时伴随着分解代谢的加快,造成骨骼肌体积和重量的下降,使得细胞中自噬水平被程序性启动,并且有研究发现自噬性程序性细胞死亡可能是衰老过程中骨骼肌体积和质量下降的重要原因之一[1]。而作为自噬发生过程中的标志基因Beclin1、LC3和Atg7,研究证实,当自噬发生时Bcl-2、LC3和Atg7表达均出现显著上调[2]。近来研究发现哺乳动物雷帕霉素靶蛋白(mTOR)作为一种丝/苏氨酸蛋白激酶,在细胞生长、增殖、分化、细胞周期调控等多个方面起到重要作用。而PI3K/Akt/mTOR信号通路与自噬的激活和发生存在密切相关[3-4],但目前有关该信号通路调控衰老骨骼肌自噬发生的相关研究还较少。运动训练作为一种重要的干预手段,在自噬激活和发生过程中发挥着重要作用。但目前有关运动训练调控衰老骨骼肌自噬的相关研究尚存在争议。Lira等[5]研究证实,长期有规律的运动可显著抑制自噬基因Atg6/Beclin1,Atg7和Atg8/LC3表达下调自噬水平。但David W等[6]研究却发现,长时间的自主跑轮运动可显著抑制衰老大鼠的骨骼肌自噬水平。Kim等[7]在其研究中利用跑台运动(40 min/d,16.3 m/min,5 d/周,8周,坡度5°)对小鼠进行训练时亦发现其可显著激活衰老小鼠骨骼肌的自噬水平。体育科学或运动医学领域内,有关PI3K/Akt/mTOR信号通路调控衰老骨骼肌自噬发生的相关研究还鲜有报道,其生物学机制尚不清晰。
综上所述,本研究利用自然衰老小鼠作为动物模型,并利用自主跑轮训练和跑台训练两种运动方式对自然衰老小鼠进行运动训练。利用RT-PCR法分别对PI3K/Akt/mTOR信号通路和自噬标志性基因相关细胞因子的mRNA表达进行检测,探究不同运动方式对自然衰老小鼠骨骼肌细胞自噬水平的影响及其分子生物学机制。
1 研究材料与方法
1.1 实验动物及分组
36只8周龄雌性C57BL/6小鼠,于2012年9月购自安徽医科大学实验动物中心提供,许可证号:SCXK(皖)2007-001。小鼠适应性喂养1周后随机分为:衰老对照组(C)、衰老自主运动组(V)和衰老跑台训练组(F)每组,另外6只备用。小鼠在(25± 3)℃温度下进行饲养,标准小鼠饲料喂养(购自安徽医科大学实验动物中心),自由饮水,每天注意观察小鼠生活习性,昼夜比为12:12。按此喂养至2014年8月底。
1.3 实验动物训练方案
于2014年9月开始,对F组和V组小鼠分别进行跑台训练和自主跑轮训练;C组小鼠在鼠笼中自由活动;S组小鼠进行中等强度跑台训练,速度0.8 km/h,45 min/d,6 d/周,共8周。具体安排如下:第1周前3天,20 min/d,后3天30 min/d,第2周开始每天训练45 min。V组进行自主跑轮运动,共8周。
1.4 实验动物取材
第8周最后一次训练结束后12~24 h内,断颈椎处死小鼠,分离腓肠肌,在预冷的PBS缓冲液中清洗干净,保存于-80°冰箱中以备RT-PCR检测自噬相关特异性基因和mTOR信号通路中相关细胞因子的mRNA表达。
1.5 腓肠肌中自噬特异性基因和mTOR信号通路相关细胞因子mRNA表达定量检测
将保存于-80°冰箱中的腓肠肌组织取出,利用TRIzol法提取腓肠肌组织中的总RNA,按反转录试剂盒(购自美国Fermentas公司)步骤和说明,将RNA反转录为cDNA。然后利用定量试剂盒(购自美国Fermentas公司)对cDNA中Beclin1、LC3、Atg13和Atg7和PI3K/Akt/mTOR信号通路中相关细胞因子(PI3K、PDK1、Akt、TSC2、mTOR、ATG13、ULK1)mRNA表达进行定量检测。PCR引物由上海生工合成(表1)。

表1 目标基因引物序列
1.5 数据处理
利用2-△△法对原始数据进行分析,各检测结果均以(¯X±S)表示,用SPSS 17.0软件进行单因素方差分析,以P<0.05为显著性差异标准,以P<0.01为非常显著性差异标准。
2 实验结果
2.1 不同方式运动对自然衰老小鼠骨骼肌PI3K/Akt/mTOR信号通路的影响
由图1可知,与C组相比,V组PI3K(P<0.05)和PDK1(P<0.05)mRNA表达均出现显著上调;与C组相比,F组PI3K(P<0.01)、PDK1(P<0.01)、Akt(P<0.05)和mTOR(P<0.05)的mRNA表达均出现显著上调,TSC2(P<0.05)mRNA表达出现显著下调;与V组相比,F组PI3K(P<0.05)、PDK1(P<0.05)和Akt(P<0.05)的mRNA表达均出现显著上调,mTOR(P>0.05)随呈上升趋势但差异不具有显著性,TSC2(P>0.05)mRNA表达呈下调趋势,但差异不具有显著性。

图1 不同方式运动对自然衰老小鼠PI3K/Akt/m TOR信号通路中相关细胞因子表达的影响
2.2 不同方式运动对自然衰老小鼠骨骼肌自噬水平的影响
由图2可知,与C组相比,V组小鼠骨骼肌中Atg3(P<0.05)mRNA表达下调且差异具有显著性,ULK1(P>0.05)、Beclin1(P>0.05)、LC3(P>0.05)和Atg7(P>0.05)mRNA表达虽下调但差异不具有显著性;与C组相比,F组小鼠骨骼肌中Atg3(P<0.01)、ULK1(P<0.05)、Beclin1(P<0.05)、LC3(P<0.05)和Atg7(P<0.05)mRNA表达均出现显著下调;与V组相比,F组小鼠骨骼肌中Atg3(P>0.05)、ULK1(P>0.05)、Beclin1(P>0.05)、LC3(P>0.05)和Atg7(P>0.05)mRNA表达均下调但差异不具有显著性。
3 讨论与分析
3.1 不同方式运动对衰老小鼠骨骼肌中PI3K/Akt/mTOR信号通路的影响
mTOR参与了体内多条信号通路,其中PI3K/Akt/mTOR信号通路在多种生物学过程,如癌症发生、细胞分化、骨骼肌生长、成纤维细胞增殖等发挥着重要的调控作用。PI3K作为该通路的上游因子,分为Ⅰ和Ⅲ两种类型(其中Ⅰ型通过激活PI3KAkt,Ⅲ型可与Beclin1结合[8])。但无论Ⅰ型还是Ⅲ型,最后都是通过作用于mTOR进而发挥其生物学作用。当PI3K被激活后,其促进PDK1在Thr308位点上的磷酸化,PDK1可激活其下游的Akt蛋白,接着磷酸化下游的TSC2,而TSC2具有GTP酶活化蛋白(GAP)活性,所谓GAPs是指能够将GTP酶从GTP结合的活化状态转化为GDP结合的非活化状态的一类酶,也就是说TSC2可以将Rheb(一种小GTP酶)从活化状态转换成非活化状态,从而达到抑制mTOR活性的目的[9]。mTOR被抑制后又可磷酸化自噬基因13(Atg13),其与Atg1分别同ULK1和ULK2相结合,介导ULK1蛋白与FIP200的相互作用。ULK1-Atg13-FIP200复合物是mTOR的直接靶蛋白,也是mTOR通路对某些生物学作用的关键调控者。mTOR磷酸化Atg13,使其不能与Atg1结合从而发挥生物学作用[10]。此外,mTOR活性增强时,通过磷酸化S6K1使其激活,进而磷酸化p70S6来促进mRNA转移[11]。
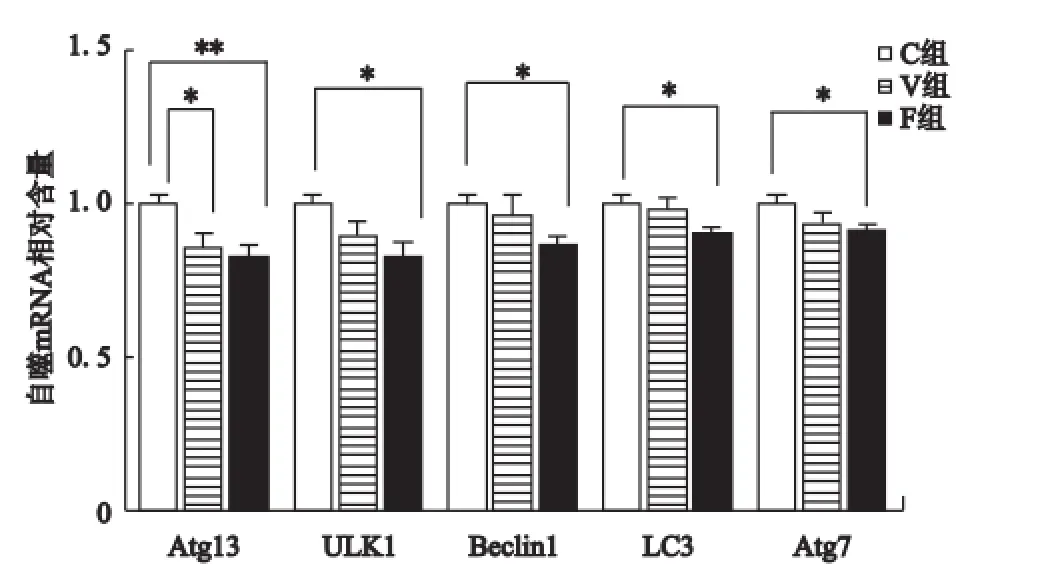
图2 不同方式运动对自然衰老小鼠骨骼肌自噬水平的影响
目前有关PI3K/Akt/mTOR信号通路的研究较多,张雯[12]在其研究中发现,PI3K/Akt/mTOR信号通路在宫颈癌及肝癌细胞的发生及细胞增殖过程中具有重要的作用。吴登艳等[13]在研究黄芩苷对异常增生的瘢痕组织时,发现抑制PI3K/AKT/mTOR信号通路抑制人增生性瘢痕组织成纤维细胞的增殖。Zhang等[14]研究发现,PI3K/AKT/mTOR信号通路在组织蛋白酶S诱导的人恶性胶质瘤细胞自噬中具有重要作用。目前有关PI3K/AKT/mTOR信号通路调控相关生物学作用的相关研究较多,但有关其在衰老骨骼肌中表达的相关研究尚未见报道。并且运动训练作为一种特殊的干预手段,其在激活PI3K/AKT/mTOR信号通路上具有重要的作用。李志刚[15]在其研究中发现,适宜负荷游泳训练能诱导PI3K/Akt/mTOR信号蛋白磷酸化表达,促进骨骼肌蛋白合成及肌肉的生长。Bodine[16]研究发现,PI3K/Akt/mTOR信号通路在抗阻训练调控出生后骨骼肌体积和质量上具有重要作用。然而目前有关不同方式运动调控衰老组织PI3K/AKT/mTOR信号通路研究还未见报道。本研究中,经过8周运动训练结束后,自主跑轮组小鼠骨骼肌中只有PI3K和PDK1的mRNA表达上调而其他细胞因子的mRNA表达没有变化,而跑台组骨骼肌中PI3K/Akt/mTOR信号通路中各细胞因子的mRNA表达均出现显著变化。说明与自主跑轮运动相比,跑台训练可更好的激活衰老小鼠骨骼肌中的PI3K/Akt/mTOR信号通路,这与Hayasaka等[17]的研究结果相一致,他们研究也发现跑台训练要比自主运动更能激活PI3K/Akt/mTOR信号通路。究其原因,这可能与自主跑轮运动相比,跑台运动运动强度较大能更好的激活衰老小鼠骨骼肌中胰岛素样生长因子(IGF-1)和BMPs信号通路中的BMP-6高表达密切相关[18]。IGF-1作为PI3K/AKT/mTOR信号通路的上游启动生长因子,运动训练可通过激活IGF-1进而激活PI3K/AKT/mTOR信号通路[19]。而表达上调的BMP-6可通过磷酸化Smad2/3进而上调其下游的靶基因Talin,而表达上调的Talin可促进FAK蛋白表达进而激活PI3K/AKT/mTOR信号通路[20]。再者,还可能与运动训练可上调人高机动组蛋白A2(HMGA2)有关,因为Yu等[21]在研究细胞衰老时,证实高表达的HMGA2可通过上调cyclin E和CDC25A以及降低蛋白酶抑制因子表达从而激活PI3K/AKT/mTOR信号通路。目前有关运动训练调控衰老骨骼肌中PI3K/AKT/mTOR信号通路相关研究较少,其生物学机制尚不是很清晰。
3.2 不同方式运动对衰老小鼠骨骼肌自噬水平的影响
骨骼肌作为人体的重要组织器官,在衰老过程中伴随着骨骼肌体积减小、机能下降等症状。近来研究发现,自噬引起的自噬性程序性死亡是引起衰老小鼠骨骼肌减少及功能下降的重要原因之一[22]。Cao等[23]在其研究中亦发现,自噬水平的升高与衰老小鼠骨骼肌萎缩、力量下降等存在密切相关。而在调控自噬发生的特异性基因标志物中,Beclin1在自噬发生过程中起着正调控作用,是首个被鉴定可调控哺乳动物自噬水平的关键基因,参与细胞自噬的发生[24]。Atg13、ULK1和LC3(Atg8)参与自噬体形成过程中两大泛素系统,是细胞自噬的通用标志物[25]。Atg7作为肌肉自体吞噬另一个关键的特异性基因,是自噬体伸展扩张过程中的重要标志物,可导致肌肉萎缩和衰老引起的肌肉力量下降[26]。目前有关衰老引起骨骼肌自噬水平升高的研究较多,Wohlgemuth等[27]研究发现,大鼠24个月后骨骼肌出现显著的衰老症状并且骨骼肌中的自噬标志基因Atg13、ULK1、Beclin1、LC3和LAMP-2等基因表达均出现显著上调。Leeuwenburgh等[28]研究也证实,衰老小鼠骨骼肌中调控自噬发生的关键性细胞因子——Beclin1、Atg7和LC3等均显著上调。而运动训练作为一种特殊的调控衰老骨骼肌自噬发生的重要手段,Lira等[5]研究发现,大强度的跑台训练可显著上调衰老小鼠骨骼肌中Atg13、ULK1、LC3等自噬标志基因的表达,促进自噬的发生,而自主跑轮运动可下调衰老小鼠骨骼肌的自噬水平但作用效果不是很显著。Kim等[7]研究也发现,8周的中等强度上坡跑训练可显著下调衰老ICR小鼠骨骼肌中Atg13、Beclin1、Atg7和LC3的基因表达,抑制自噬的发生。Chistiakov等[29]研究发现,8周游泳训练对于下调衰老C57BL/6小鼠股四头肌自噬水平的作用并不是很明显。本研究中,与对照组相比,V组只有Atg13显著下调,而F组的Atg13、ULK1、Beclin1、LC3和Atg7自噬标志基因均显著下调。说明,跑台运动抑制衰老小鼠自噬发生的作用效果优于自主跑轮运动。这与Lira等的研究结果不一致,他们研究发现大强度跑台训练上调衰老小鼠骨骼肌的自噬水平。究其原因,这可能与Lira等[5]的研究中采用的运动强度较大有关。运动强度较大时,肌肉组织受到较大的损伤,导致自噬水平的提高[30]。跑台训练抑制衰老小鼠骨骼肌自噬水平的效果优于自主跑轮运动,这与本研究中跑台训练可激活PI3K/AKT/mTOR信号通路密切相关。因为Zhao等[31]研究证实,激活PI3K/AKT/mTOR信号通路后可抑制自噬的发生,使得Atg13、Beclin1、LC3、Atg7等自噬标志基因表达显著下调。再者可能与跑台训练可激活LKB1-AMPK信号通路有关[32],LKB1激活后可上调AMPK的表达,并进一步磷酸化mTOR从而抑制衰老小鼠骨骼肌的自噬水平,使得LC3、Beclin1等自噬标志基因表达下调,自噬泡数量降低[33]。跑台训练可更好的抑制衰老小鼠骨骼肌自噬的发生,还可能与其可更好的抑制Omi/Hax1信号通路进而抑制自噬发生有关[34]。
4 结论
跑台运动可通过激活PI3K/Akt/mTOR信号通路,从而抑制衰老小鼠骨骼肌的自噬水平。
[1]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451:1069-1075.
[2]Bloemberg D,McDonald E,Dulay D,et al.Autophagy is altered in skeletal and cardiac muscle of spontaneously hypertensive rats[J].Acta physiol,2013,4:Epub ahead of print.
[3]杨湘怡,陶润知,聂亚雄.mTOR依赖的自噬通路与神经变性疾病[J].中南医学科学杂志,2014,42(2):191-197.
[4]Zhang L,Wang H,Zhu J,et al.Mollugin induces tumor cell apoptosis and autophagy via the PI3K/AKT/mTOR/p70S6K and ERK signaling pathways[J].Biochem Biophys Res Commun,2014,10(2):990-995.
[5]Lira VA,Okutsu M,Zhang M,etal.Autophagy is required for exercise training-induced skeletalmuscle adaptation and improvement of physical performance[J].FASEB J,2013,27(10):4184-4193.
[6]Russ DW,Krause J,Wills A.“SR stress”in mixed hindlimb muscles of aging male rats[J].Biogerontology,2012,13(5):547-555.
[7]Kim YA,Kim YS,Oh SL,et al.Autophagic response to exercise training in skeletalmuscle with age[J].J physiol Biochem,2013,69(4):697-705.
[8]Petiot A,Ogier-Denis E,Blommaart EF,et al.Distinct classes of phosphatidylinositol3’-kinases are involved in signaling pathways that control macroautophagy in HT-29 Cells[J].J Biol Chem,2000,275(16):992-998.
[9]赵永军,陈涛,郭艳花.骨骼肌自噬的分子调控机制及运动对其影响[J].辽宁体育科技,2013,35(6):18-21.
[10]Jung CH,et al.ULK-Atg13-FIP200 complexesmediate mTOR signaling to the autophagy machinery[J].Mol Biol Cell,2009,20:1992-2003.
[11]叶青.自噬的分子机制与病理生理意义.国际病理科学与临床杂志,2007,27:358-362;陈洪菊,屈艺,母得志.m T O R信号通路的生物学功能[J].生命的化学,2010,30(4):555-559.
[12]张雯.PGRN促宫颈癌及肝癌细胞增殖对AKt/mTOR信号途径依赖性的研究[D].济南:山东大学,2014:54.
[13]吴登艳,邓娅,郝进,等.PI3K/AKT/mTOR信号通路介导黄芩苷抑制增生性瘢痕组织成纤维细胞的增殖[J].中国生物化学与分子生物学报,2014,30(1):60-67.
[14]Zhang L,Wang H,Xu J,etal.Inhibition of cathepsin S induces autophagy and apoptosis in human glioblastoma cell lines through ROS-mediated PI3K/AKT/mTOR/p70S6K and JNK signaling pathways[J].Toxicol Lett,2014,228(3):248-259.
[15]李志刚.游泳运动对大鼠骨骼肌生长及PI3K/Akt/mTOR信号通路影响[D].上海:上海体育学院,2011:41.
[16]Bodine SC.mTOR signaling and themolecular adaptation to resistance exercise[J].Med Sci Sports Exerc,2006,38(11):1950-1957.
[17]Hayasaka M,Tsunekawa H,Yoshinaga M,et al.Endurance exercise induces REDD1 expression and transiently decreasesmTORC1 signaling in rat skeletalmuscle[J].Physiol Rep,2014,2(12):e12254.
[18]Kackstein K,Teren A,Matsumoto Y,et al.Impact of angiotensin II on skeletalmusclemetabolism and function in mice:contribution of IGF-1,Sirtuin-1 and PGC-1α[J].Acta Histochem,2013,115(4):363-370.
[19]Xie B,Zhou J,Shu G,et al.Restoration of klotho gene expression induces apoptosis and autophagy in gastric cancer cells:tumor suppressive role of klotho in gastric cancer[J].Cancer Cell Int,2013,13(1):18.
[20]Deng Z,Lei X,Zhang X,et al.mTOR signaling promotes stem cell activation via counterbalancing BMP-mediated suppression during hair regeneration[J].JMol Cell Biol,2015:Epub ahead of print.
[21]Yu KR,Park SB,Jung JW,et al.HMGA2 regulates the in vitro aging and proliferation ofhuman umbilical cord blood-derived stromal cells through themTOR/p70S6K signaling pathway[J].Stem Cell Res,2013,10(2):156-165.
[22]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451:1069-1075.
[23]Cao Y,Klionsky DJ.Physiological functions of Atg6/Beclin 1:a unique autophagy-related protein[J].Cell Res,2007,17(10):839-849.
[24]马芹芹,刘立亚,黄秀兰.Beclin1与mTOR对心肌缺血/再灌注损伤中自噬的交互调控机制[J].心脏杂志,2012,24(3):395-401.
[25]Nakatogawa H,Suzuki K,Kamada Y,et al.Dynamics and diversity in autophagymechanisms:lessons from yeast[J].Cell Biol,2009,10(7):458-467.
[26]JounaiN,Takeshit F,Kobiyama K,etal.The Atg5-Atg12 conjugate associates with innate antiviral immune responses[J].Proc Natl Acad Sci USA,2007,104(35):14050-14055.
[27]Wohlgemuth SE,Seo AY,Marzetti E,et al.Skeletalmuscle autophagy and apoptosis during aging:Effects of calorierestriction and lifelong exercise[J].Exp Gerontol,2010,45(2):138-148.
[28]Leeuwenburgh C,Wagner P,Holloszy JO,et al.Caloric restriction attenuates dityrosine cross-linking of cardiac and skeletal muscle proteins in agingmice[J].Arch Biochem Biophys,1997;346:74-80.
[29]Chistiakov DA,Sobenin IA,Revin VV,et al.Mitochondrial aging and age-related dysfunction ofmitochondria[J].Biomed Res Int,2014:Epub 2014 Apr 10.
[30]Williams JM,Miskimen T,Minsky S,et al.Increasing tobacco dependence treatment through continuing education training for behavioral health professionals[J].Psychiatr Serv,2015,66(1):21-26.
[31]Zhao Z,Han F,Yang S,et al.Oxamate-mediated inhibition of lactate dehydrogenase induces protective autophagy in gastric cancer cells:Involvement of the Akt-mTOR signaling pathway[J].Cancer Lett,2015,358(1):17-26.
[32]陈文才.运动干预对糖尿病大鼠骨骼AMPK信号转导的影响[D].辽宁:中国医科大学,2010:31.
[33]李爽.LKB1-AMPK-mTOR通路在oxLp(a)诱导HUVECs自噬中的作用研究[D].湖南:南华大学,2013:46.
[34]雷槟恺,赵晓琴,焦楠,等.自噬调节通路在骨豁肌损伤修复中的意义[C].2013年中国生理学会运动生理学专业委员会年会暨“运动与健康学术研讨会论文摘要汇编,2013:70-71.
责任编辑:郭长寿
Effect of Different Exercise M odes on Autophagy of M uscles in Aging Fem ale M ice Through the PI3K/AKT/m TOR Pathway
FAN Shenyuan1,JIN Erhui2
(1.Physical Education Department,Anhui Science and Technology University,Fengyang 233100,Anhui,China;2.College of Animal Science,Anhui Science and Technology University,Fengyang 233100,Anhui,China)
Objective:Research the influence of different exercisemodes on autophagy ofmuscles in aging femalem ice and the biology mechanism.M ethods:36 8-w eek old female C57BL/6 m ice were random ly divided into three groups:aging control group(C),aging voluntary wheel running group(V)and aging treadmill running group(F).After one week,group V and group F respectively did voluntary wheel training and treadm ill training.A fter 12h of the last training,using themothod of RT-PCR to detect themRNA expression of related gene in the gastrocnemiusmuscles.Results:Compared to group C,themRNA expression of PI3K(P<0.05),PDK1(P<0.05)and Atg3(P<0.05)of group V w ere significantly up-regulated.Compared to group C,themRNA expression of PI3K(P<0.01),PDK1(P<0.01),Akt(P<0.05),m TOR1(P<0.05),TSC2(P<0.05)、Atg13(P<0.05)and ULK1(P<0.05)of group Fwere significantly upregulated and the expression ofmRNA of Beclin1(P<0.05)and Atg7(P<0.05)significantly down-regulated.Compared to group C,the expression of mRNA of PI3K(P<0.01),PDK1(P<0.01),Akt(P<0.05),m TOR1(P<0.05),ATG13(P<0.01),ULK1(P<0.05),Beclin1(P<0.05),LC3(P<0.05)and Atg7(P<0.05)were all significantly changed.Compared to group V,the mRNA expression of PI3K(P<0.05)、PDK1(P<0.05)and Akt(P<0.05)w ere all significantly up-regulated.Conclusion:Treadm ill training can restrain the autophagy level of the agingm ice muscles through activating the PI3K/Akt/m TOR signaling pathway.
exercise of differentmodes;aging;skeletalmuscle;autophagy;PI3K/Akt/mTOR
G804.7
A
1004-0560(2016)01-0082-05
2015-09-23;
2015-11-13
国家自然科学基金(课题编号:31402154)。
樊申元(1980—),男,讲师,硕士,主要研究方向为运动与健康。

