秋季太湖梅梁湾蓝藻的原位增殖与垂直分布
周起超, 赵爽, 彭成荣, 沈伟, 宋立荣,*
秋季太湖梅梁湾蓝藻的原位增殖与垂直分布
周起超1,2, 赵爽3, 彭成荣1, 沈伟4, 宋立荣1,*
1. 中国科学院水生生物研究所/淡水生态与生物技术国家重点实验室, 武汉430072
2. 云南省环境科学研究院(中国昆明高原湖泊国际研究中心)/高原湖泊流域污染过程与管理云南省重点实验室, 昆明650034
3. 钦州市海洋环境监测预报中心, 钦州535000
4. 常州市环境监测中心, 常州213001
通过细胞分裂频率法对秋季太湖梅梁湾蓝藻(微囊藻)原位生长速率进行了测定, 发现微囊藻白天的细胞分裂频率高于夜间, 水柱表层微囊藻的原位生长速率最高; 湖体微囊藻的原位生长速率为0.09—0.16 d-1, 围隔微囊藻的原位生长速率为0.20—0.35 d-1; 蓝藻的原位生长速率受光照、温度、营养盐与生物量等因素的影响。蓝藻生物量、群体粒径组成、捕光色素及其组成等在水柱中均有垂直分布差异, 依赖于混合强度、浮力调节与群体粒径的垂直迁移或是蓝藻为了获取更为合适的光照条件。
微囊藻; 原位增殖; 垂直分布; 群体粒径; 色素组成
周起超, 赵爽, 彭成荣, 等. 秋季太湖梅梁湾蓝藻的原位增殖与垂直分布[J]. 生态科学, 2016, 35(5): 117-125.
ZHOU Qichao, ZHAO Shuang, PENG Chengrong, et al. Thein-situgrowth and vertical distribution of cyanobacteria in autumn in Meiliang Bay, Lake Taihu, China[J]. Ecological Science, 2016, 35(5): 117-125.
1 前言
蓝藻水华已成为危及水生态系统健康的重要环境问题, 直接关系到饮用水安全, 如本研究区域太湖曾发生的水危机事件就与此有关, 蓝藻水华的发生频率与强度升高更是太湖水环境问题的一个重要特征[1–2]。虽然对蓝藻水华的研究已从各层面逐步深入, 但要全面认识蓝藻水华的形成与衰退机制, 有关蓝藻原位增殖的研究是不可或缺的。测定蓝藻的原位生长速率, 是研究水华蓝藻原位增殖的关键内容, 国内外均有相关报道[3–8]。秋季是水华蓝藻持续生长或下沉转为休眠的关键时期[9–11], 而蓝藻在秋季的原位增殖很少受国内学者关注[6–8]。微囊藻是多地水华的优势类群, 自然条件下常以群体形态存在,增殖方式为简单的细胞分裂, 故细胞分裂频率法(frequency of dividing cells, FDC)是测定其原位生长速率的理想方法[5]。与此同时, 当混合强度减弱群体微囊藻会聚集于水体表层[12], 会直接影响景观效果。蓝藻在水柱中的垂直迁移是利于其获取合适的光能和营养物质的重要调节方式, 受光照、风浪及其自身等多种因子的影响[12–16]; 然而, 对浅水湖泊太湖而言, 因蓝藻水华受风浪等的影响较大[17–18],蓝藻的垂直分布特征及其影响因子所受的关注较少,需进一步开展研究。因此, 本文基于原位调查, 研究了秋季太湖梅梁湾蓝藻的原位生长与垂直分布及其影响因子, 并比较了湖体与围隔两个点位的差异,期望为蓝藻水华发生机理的研究提供基础数据。
2 材料与方法
2.1研究区域概况
太湖(图1)是我国第三大淡水湖泊, 面积2338 km2,平均水深1.89 m, 是周边地区饮水、灌溉、渔业、水产与工业用水、航运、观光旅行等的重要水资源;随着经济的快速发展与对水资源利用的加深, 太湖已逐步显现了富营养化与蓝藻水华等问题。位于北部的梅梁湾是太湖蓝藻水华较严重的湖区, 微囊藻(Microcystis)常为优势类群, 每年5—10月占浮游植物总生物量的40—98%[19]。
2.2样品采集与常规指标测定
研究点位为中国科学院太湖湖泊生态系统研究站附近(31°24′N, 120°13′E; 图1)的湖体(Lake, L; 水深2 m)和围隔(Enclosure, E; 5×5×1.9 m3), 二者相距约50 m; 2011年9月25—26日, 分别于8:00、11:00、14:00、17:00、20:00、23:00、2:00、6:30和9:00、11:30、14:30、17:30、21:15、23:30、2:30、7:00分表层(Surface, 0.5 m)、中层(Middle, 1.1 m)、底层(Bottom, 1.7 m)采集水样。
图1 样品采集点(改自文献[19])Fig. 1 Location of study site (Revised from reference[19])
每小时用照度计(Quantitherm Light Meter, Hansatech, UK)测定光合有效辐射(PAR, 400—700 nm),用温度计测定气温, 用便携式风速风向仪测定风速与风向。每次采样时, 以赛氏透明度盘测定水体透明度(SD), 以YSI Professional Plus(Yellow Springs Instruments, USA)测定水温(water temperature, WT)、溶解氧(dissolved oxygen, DO)、电导率(electrical conductivity, EC)与pH; 总氮(total nitrogen, TN)、总磷(total phosphorus, TP)根据《湖泊富营养化调查规范》的方法进行测定[20]; 叶绿素与类胡萝卜素浓度测定采用90%丙酮法[21–22]; 藻蓝蛋白(Phycocyanin, PC)、别藻蓝蛋白(Allophycocyanin, AP)与藻红蛋白(Phycoerythrin, PE)的浓度测定根据Glazer的方法[23]。
2.3细胞分裂频率测定与比生长速率计算
微囊藻增殖中, 有单细胞、分裂期细胞、双细胞三种形态, 细胞分裂频率(f)为分裂期细胞占总细胞数的百分比[5], 本研究采用的分裂期细胞为中部收缢的细胞(constricted cells)而非拉长的细胞(elongated cells)[4]。将样品取回后立即用戊二醛固定,辅以超声(300 W, 3 s)处理若干次以打散微囊藻群体而不破坏细胞, 及时用显微镜拍照后测定微囊藻的细胞分裂频率, 并根据下式计算:

式中: n为f的测定次数; Td为细胞分裂所需时间, 基于24 h内的20:00至次日4:00微囊藻细胞无有效分裂, 故铜绿微囊藻的Td为3.30 h, 惠氏微囊藻的Td为3.07 h[5], 又因观察到两种微囊藻均存在于采样水体中且所占比例不相上下, 故选取二者的均值即Td为3.185 h代表微囊藻的细胞分裂所需时间进行计算; fi为不同采样时间微囊藻的细胞分裂频率, fmin为连续监测过程中微囊藻的最小细胞分裂频率, 20:00至次日4:00时段内的fi视为0。
2.4群体粒径测定
通过显微镜(Olympus BX 51, Japan)观察微囊藻形态并拍照(Olympus DP 71, Japan), 随机选取100个左右的群体, 由自带图像软件Olympus DP-Soft测定微囊藻群体的面积、长与宽, 根据不同形态利用不同的公式计算出微囊藻群体的粒径[16]。
2.5统计分析
Nonparametric Tests-2 Independent Samples (Mann-Whitney U, 昼夜比较)与Nonparametric Tests-K Independent Samples(Kruskal-Wallis H, 分层间比较)均在SPSS 16.0操作完成, P < 0.05表示显著性, P <0.01表示极显著。
3 结果
3.1气象条件与水体理化参数
试验期间, 最高光强出现在首日的11:00, 为 1287 μE·m-2·s-1, 之后基本呈现下降趋势至次日日出(图2); 气温22.5—29.9℃, 平均风速1.8 m·s-1(0—3.9 m·s-1), 东北风为主。
湖体、围隔SD分别为25—40 cm、20—30 cm,二者WT、DO、EC、pH的变化如图3所示, 湖体与围隔表、中、底三层的值均有一定程度的日波动。湖体WT、EC、pH三层均有显著性差异(P < 0.05); 但各层参数在昼夜分布上并无显著性差异, 白天EC在分层上有显著性差异(P < 0.05)。围隔中, 表层WT、DO、pH几乎均高于中层高于底层, EC有交错现象; 围隔各层WT、DO、pH具极显著差异(P <0.01), 白天各层的WT、DO、pH均有显著性差异(P < 0.05), 夜间各层的DO、EC、pH均有显著性差异(P < 0.05)。

图2 光合有效辐射变化Fig. 2 Variation of photosynthetic active radiation (PAR)
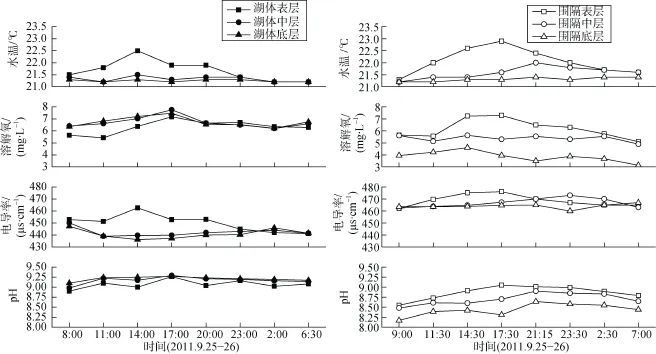
图3 湖体与围隔水体水温(WT)、溶解氧(DO)、电导率(EC)、pH的变化Fig. 3 Variations of water temperature (WT), dissolved oxygen (DO), electrical conductivity (EC) and pH value
试验期间, 湖体与围隔表、中、底三层水柱的营养盐均存在一定的昼夜变化(表1), 但只有围隔水柱的总氮具显著性差异(P < 0.05), 而湖体、围隔中的两种营养盐在三层之间差异不显著。
3.2蓝藻生物量变化
湖体和围隔各层均以微囊藻为优势类群, 如铜绿微囊藻(M. aeruginosa)、惠氏微囊藻(M. wesenbergii)。围隔蓝藻生物量显著高于湖体, 湖体平均叶绿素a浓度为15.35 μg·L-1(8.28—25.65 μg·L-1), 围隔平均叶绿素a浓度为51.89 μg·L-1(24.02— 90.60 μg·L-1); 湖体与围隔蓝藻生物量均是白天显著高于夜间(P <0.05)。随着上午光强(累积量)升高, 湖体蓝藻生物量稍有上升趋势, 此后基本呈下降趋势; 围隔中的上升趋势持续至14:30, 此后逐渐下降。虽然湖体蓝藻生物量会受水平迁移的影响, 但整个试验周期中其三层叶绿素a浓度无显著性差异, 围隔各层叶绿素a浓度亦无显著性差异。湖体中的垂直分布昼夜变化不明显, 围隔中的垂直分布昼夜波动则较明显, 表现为:首日9:00表层浓度高于中层和底层, 11:30则为表中层高于底层, 14:30、17:30表中层高于底层, 21:15表层最高, 之后的夜间以及次日早晨各层浓度接近。
3.3蓝藻色素组成变化
湖体中, 类胡萝卜素平均相对含量为0.496 (0.442—0.575), 首日14:00表层类胡萝卜素相对含量高于中层与底层, 17:00时底层高于中层高于表层, 20:00时表层与中层高于底层, 23:00时中层与底层高于表层, 次日6:30时表层与中层高于底层。围隔中, 类胡萝卜素平均相对含量为0.489(0.444—0.526), 分层及昼夜变化不明显。湖体、围隔蓝藻类胡萝卜素相对含量在昼夜、三层间均无显著性差异(图5)。

表1 试验期间水柱营养盐变化Tab. 1 Variation of nutrients in the water column

图4 叶绿素a浓度变化Fig. 4 Variation of chl.a concentrations

图5 类胡萝卜素相对含量变化Fig. 5 Variation of relative content of carotenoids (Caro./Chl.a)
湖体表、中、底层藻胆蛋白相对含量((PC+AP+ PE)/Chl.a)均值分别为7.20(4.97—9.85)、7.45(3.58—17.83)、12.11(4.83—28.57), 围隔表、中、底层藻胆蛋白相对含量均值分别为4.81(2.08—7.11)、5.76 (2.31—10.28)、8.00(1.78—17.72), 两点位各层间均无显著性差异。蓝藻藻胆蛋白组成变化如图6所示:湖体中, PC的平均百分比为22.89%(12.80—34.41%), AP的平均百分比为37.26%(28.58—45.17%), PE的平均百分比为39.85%(33.85—42.03%); 围隔中, PC的平均百分比为32.05%(23.53—41.07%), AP的平均百分比为41.77%(34.21—51.26%), PE的平均百分比为26.17%(23.85—28.90%)。
3.4微囊藻细胞分裂频率与比生长速率
湖体与围隔微囊藻细胞分裂频率均为白天大于夜间, 但无显著性差异(图7); 湖体微囊藻细胞分裂频率各层无显著性差异, 围隔中底层最高、中层最低(P < 0.01)。各时间点均值而言, 湖体微囊藻细胞分裂频率最大值为次日6:30的9.14%, 最小值为首日17:00的3.77%, 均值为6.39%; 围隔微囊藻细胞分裂频率最大值为首日11:30的8.16%, 最小值为首日17:00的4.68%, 均值为6.15%。经计算, 湖体表、中、底三层微囊藻原位生长速率分别为0.16、0.13、0.09 d-1, 围隔表、中、底三层微囊藻原位生长速率分别为0.35、0.20、0.29 d-1。
3.5微囊藻群体粒径
湖体微囊藻群体的平均粒径为145.39 μm(25.44—474.50 μm), 围隔中微囊藻群体的平均粒径为140.37 μm (43.44—733.41 μm)。湖体: 8:00, 表、中、底层微囊藻群体平均粒径分别为143.11、146.31、140.57 μm; 14:00, 表、中、底层微囊藻群体平均粒径分别为142.85、156.71、141.71 μm; 20:00, 表、中、底层微囊藻群体平均粒径分别为154.46、144.20、139.08 μm。围隔: 9:00, 表、中、底层微囊藻群体平均粒径分别为149.14、137.34、136.75 μm; 14:30, 表、中、底层微囊藻群体平均粒径分别为143.79、135.03、147.31 μm; 21:15, 表、中、底层微囊藻群体平均粒径分别为134.87、143.27、134.89 μm。不同时间点微囊藻群体粒径的垂直分布如图8所示, 湖体与围隔的中等群体(100—200 μm)均占50%以上。湖体中, 从8:00至14:00, 表层水中小群体(< 100 μm)比例由30.28%减小至22.33%, 20:00的小群体比例与14:00的接近;围隔中, 从9:00至14:30, 表层水中中等群体与大群体(> 200 μm)的比例由76.09%增加至81.25%, 21:15的小群体比例又增加至22.31%。
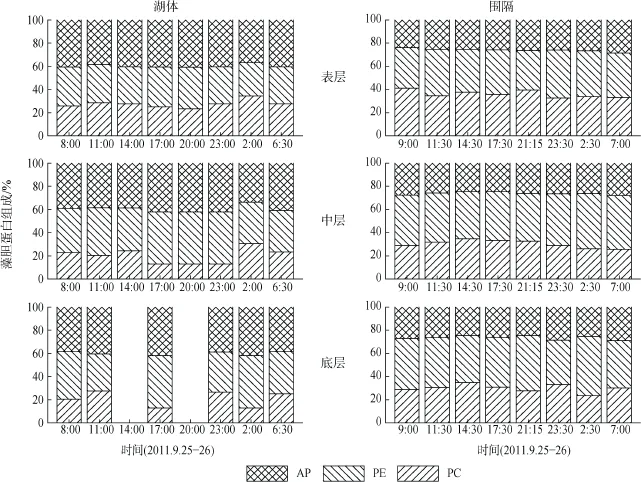
图6 藻胆蛋白组成变化Fig. 6 Variation of phycobiliprotein composition

图7 微囊藻细胞分裂频率变化Fig. 7 Variation of frequency of dividing cells (FDC) of Microcystis
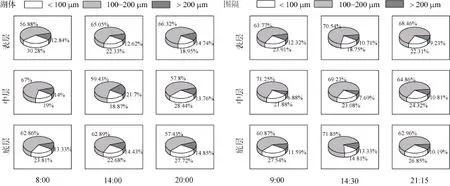
图8 不同时间微囊藻群体粒径的垂直分布Fig. 8 Size-class vertical distribution of Microcystis colonies at different times
4 讨论
4.1原位生长
自然条件下, 蓝藻生物量易受风浪引起的水平漂移、垂直迁移等多种因子的影响而具有空间异质性[5], 使得解释某湖区蓝藻来源问题变得相对困难[7]。本研究未对不同区域进行跟踪采样分析, 因而难以对水平漂移做深入讨论。
湖体与围隔微囊藻细胞分裂频率均是白天略高, 11:00—17:30阶段内微囊藻细胞分裂频率基本呈下降趋势, 说明微囊藻细胞分裂频率随光强的降低而有所降低, 结果与前期报道一致[5,7]。提高类胡萝卜素相对含量是微囊藻抵御高光强胁迫的响应机制[24–25],试验期间天气为晴转多云且最高光强只有1287 μE·m-2·s-1,类胡萝卜素相对含量未表现出显著升高, 故而认为试验期间浮游植物未受到高光强胁迫, 微囊藻细胞分裂频率亦未在高光强及其后一段时间内表现出显著降低。20:00—4:00阶段内, 湖体与围隔的总体细胞分裂频率(表、中、底三层)均无明显变化, 因为本时间段微囊藻的细胞分裂暂停了[5]。湖体与围隔中白天的藻类生物量均高于夜间, 与白天较高的细胞分裂频率有关。
研究表明, 通过细胞分裂频率计算得到的微囊藻原位生长速率与通过生长曲线拟合得出的结果吻合[4]。湖体表、中、底三层的微囊藻原位生长速率低于夏季(其光强、水温、营养盐、叶绿素a浓度均高于本研究)测得的0.2—0.3 d-1[7], 暗示着微囊藻在秋季的增殖能力降低, 进而可进一步转入下沉休眠阶段。围隔表、中、底三层的微囊藻原位生长速率与2005年9月在日本东京的一个富营养化池塘的结果接近[3]。围隔浮游植物生物量、营养盐、各层原位生长速率均高于湖体, 说明蓝藻的原位生长速率与藻类生物量、营养盐有关[7], 或是高原位生长速率导致了高生物量; 同时, 本结果暗示有一定修建时间的围隔因生境条件的改变, 并不能很好地代表湖体本身, 这需在今后的原位围隔试验中予以考虑。此外, 有浮力的微囊藻生长速率高[26], 加之水柱表层的光照强、营养盐充足, 因而湖体与围隔水柱表层微囊藻的原位生长速率均最高。
4.2垂直分布
太湖梅梁湾中, 当风速为2.0 m·s-1时, 浮游植物在水柱各层分布不均匀, 当风速达到3.1 m·s-1时,浮游植物在水柱各层均匀分布[15], 本研究中的平均风速为1.8 m·s-1(0—3.9 m·s-1), 对微囊藻垂直分布无显著影响。蓝藻的垂直分布还与瞬时风速有关,因围隔具一定消浪作用, 其藻类生物量的分层差异更为明显。围隔藻类生物量明显高于湖体, 与其较高的DO、pH有关; 同时, 高浓度的藻类对辐射的衰减作用大, 进而引起围隔更大的层间温度差异。
微囊藻在水柱中的分布依赖于群体大小与浮力调节[14], 群体粒径大被认为迁移速率快[27], 而浮力调节更依赖于光照条件[13], 在夜间由于异化作用导致浮力升高而向水柱表层迁移, 白天高光强下则下沉[14,28]。本研究中, 白天无高光强胁迫, 围隔底层的生物量在白天最低、9:00至14:30表层水柱的中等群体和大群体比例上升, 与蓝藻通过浮力调节作用向上迁移以获取较优的光照进行光合作用有关。夜间蓝藻因光合作用积累物质使密度上升而下沉, 小群体的下沉速率小于中等群体和大群体[27], 且蓝藻浮力调节与光强变化有延迟性[29–30], 故而围隔表层在21:15时的小群体比例增加且生物量最高。夜间风速小, 而其它时间点围隔的生物量分层并不明显,或是因为生物量的同步下降抵消了分层效应。
蓝藻类囊体膜上的叶绿素a与类囊体膜外表面的藻胆蛋白是其捕光系统的主要成分[31], 使蓝藻能有效利用500—600 nm波段的绿光、黄光和橙光, 且藻胆蛋白使蓝藻充分收集昏暗水体中的光[11]。本研究中, 湖体与围隔底层的藻胆蛋白相对含量均高于中层和表层, 或是底层蓝藻可通过增加藻胆蛋白相对含量以有效地利用光能; 然而, 各层间均未表现出显著性差异, 或与水柱混合强度及蓝藻的垂直迁移有关。PE、PC、AP的吸收峰分别为565 nm、620 nm、650 nm, 蓝藻可根据光质改变藻胆蛋白组成, 如集胞藻(Synechocystis)在绿光下培养的PE:PC:AP为2:2:1, 红光下为0.4:2:1[31]。本研究中, 湖体与围隔的藻胆蛋白比例不同, 与两点位生物光学特性的差异有关[32], 湖体与围隔水柱的藻胆蛋白组成与太湖秋季的水下光场有关[33]。需要指出的是, 研究期间并未测定水下光场结构, 故而难以深入讨论藻胆蛋白组成与水下光场的关系。
5 结论
通过细胞分裂频率法对秋季太湖梅梁湾微囊藻的原位生长速率进行了测定, 结果显示白天的细胞分裂频率高于夜间, 水柱表层的原位生长速率最高;湖体与围隔存在差异, 其中湖体的原位生长速率为0.09—0.16 d-1, 围隔的为0.20—0.35 d-1。蓝藻的原位生长速率受光照、温度、营养盐与生物量等的影响。蓝藻生物量、群体粒径、捕光色素及其组成等在水柱中均有垂直分布差异, 蓝藻依赖于混合强度、浮力调节与群体粒径的垂直迁移或是为了获取更为合适的光照条件。
[1] ZHANG Min, DUAN Hongtao, SHI Xiaoli, et al. Contributions of meteorology to the phenology of cyanobacterial blooms: Implications for future climate change[J]. Water Research, 2012, 46(2): 442–452.
[2] DUAN Hongtao, MA Ronghua, XU Xiaofeng, et al. Twodecade reconstruction of algal blooms in China's Lake Taihu[J]. Environmental Science & Technology, 2009, 43(10): 3522–3528.
[3] YAMAMOTO Y, TSUKADA H. Measurement of in situ specific growth rates ofMicrocystis(cyanobacteria) from the frequency of dividing cells[J]. Journal of Phycology, 2009, 45(5): 1003–1009.
[4] YAMAMOTO Y, SHIAH F K. Relationship between cell growth and frequency of dividing cells ofMicrocystis aeruginosa[J]. Plankton & Benthos Research, 2010, 5(4): 131–135.
[5] TSUJIMURA S. Application of the frequency of dividing cells technique to estimate the in situ growth rate ofMicrocystis(Cyanobacteria)[J]. Freshwater Biology, 2003, 48(11): 2009–2024.
[6] 李哲, 谢丹, 郭劲松, 等. 三峡水库澎溪河典型优势藻原位生长速率的初步研究[J]. 湖泊科学, 2012, 24(5): 746–754.
[7] 吴晓东, 孔繁翔. 水华期间太湖梅梁湾微囊藻原位生长速率的测定[J]. 中国环境科学, 2008, 28(6): 552–555.
[8] 冯婧, 李哲, 闫彬, 等. 三峡水库不同运行阶段澎溪河典型优势藻原位生长速率[J]. 湖泊科学, 2014. 26(2): 235–242.
[9] TAKAMURA N, YASUNO M, SUGAHARA K. Overwintering ofMicrocystis aeruginosaKütz. in a shallow lake[J]. Journal of Plankton Research, 1984, 6(6): 1019–1029.
[10] TAKAMURA N, YASUNO M. Sedimentation of phytoplankton populations dominated byMicrocystisin a shallow lake[J]. Journal of Plankton Research, 1988, 10(2): 283–299.
[11] 孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005, 25(3): 589–595.
[12] CHURRO C, FEMANDES A S, ALVERCA E, et al. Effects of tryptamine on growth, ultrastructure, and oxidative stress of cyanobacteria and microalgae cultures[J]. Hydrobiologia, 2010, 649(1): 195–206.
[13] BORMANS M, SHERMAN B S, WEBSTER I T. Is buoyancy regulation in cyanobacteria an adaptation to exploit separation of light and nutrients[J]. Marine and Freshwater Research, 1999, 50(8): 897–906.
[14] WALLACE B B, BAILEY M C, HAMILTON D P. Simulation of vertical position of buoyancy regulatingMicrocystis aeruginosain a shallow eutrophic lake[J]. Aquatic Sciences, 2000, 62(4): 320–333.
[15] CAO Huansheng, KONG Fanxiang, LUO Liancong, et al. Effects of wind and wind-induced waves on vertical phytoplankton distribution and surface blooms ofMicrocystis aeruginosain Lake Taihu[J]. Journal of Freshwater Ecology, 2006, 21(2): 231–238.
[16] XIAO Yan, GAN Nanqin, LIU Jin, et al. Heterogeneity of buoyancy in response to light between two buoyant types of cyanobacteriumMicrocystis[J]. Hydrobiologia, 2012, 679(1): 297–311.
[17] WU Tingfeng, QIN Boqiang, BROOKES J D, et al. The influence of changes in wind patterns on the areal extension of surface cyanobacterial blooms in a large shallow lake in China[J]. Science of the Total Environment, 2015, 518–519: 24–30.
[18] HUANG Changchun, LI Yunmei, YANG Hao, et al. Detection of algal bloom and factors influencing its formation in Taihu Lake from 2000 to 2011 by MODIS[J]. Environmental Earth Sciences, 2014, 71(8): 3705–3714.
[19] CHEN Yuwei, QIN Boqiang, TEUBNER K, et al. Longterm dynamics of phytoplankton assemblages:Microcystisdomination in Lake Taihu, a large shallow lake in China[J]. Journal of Plankton Research, 2003, 25(4): 445–453.
[20] 金相灿, 屠清瑛. 湖泊富营养化调查规范[M]. 北京: 中国环境科学出版社, 1990.
[21] MITCHELL B G, KIEFER D A. Determination of absorption and fluorescence excitation spectra for phytoplankton[M]//HOLM-HANSEN O, BOLIS L, GILLES R. Marine Phytoplankton and Productivity. Berlin: Springer-Verlag, 1984: 157–169.
[22] Починок Ф Н 著. 荆家海, 丁钟荣 译. 植物生物化学分析方法[M]. 北京: 科学出版社, 1981.
[23] GLAZER A N. Phycobiliproteins [M]//LESTER P, GLAZER A N. Methods in Enzymology. New York: Academic Press, 1988: 291–303.
[24] PAERL H W, FULTON R S, MOISANDER P H, et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria[J]. The Scientific World Journal, 2001, 1: 76–113.
[25] XU Kui, JIANG Haibo, JUNEAU P, et al. Comparative studies on the photosynthetic responses of three freshwater phytoplankton species to temperature and light regimes[J]. Journal of Applied Phycology, 2012, 24(5): 1113–1122.
[26] WANG Chong, KONG Hainan, HE Shengbing, et al. The inverse correlation between growth rate and cell carbohydrate content ofMicrocystis aeruginosa[J]. Journal of Applied Phycology, 2010, 22(1): 105–107.
[27] DAIE J. Cytosolic fructose-1,6-bisphosphatase: A key enzyme in the sucrose biosynthetic pathway[J]. Photosynthesis Research, 1993, 38(1): 5–14.
[28] TAMOI M, ISHIKAWA T, TAKEDA T, et al. Molecular characterization and resistance to hydrogen peroxide of two Fructose-1,6-bisphosphatases fromSynechococcusPCC 7942[J]. Archives of Biochemistry and Biophysics, 1996, 334(1): 27–36.
[29] WALLACE B B, HAMILTON D P. The effect of variations in irradiance on buoyancy regulation inMicrocystis aeruginosa[J]. Limnology and Oceanography, 1999, 44(2): 273–281.
[30] KROMKAMP J, KONOPKA J A, MUR L R. Buoyancy regulation in light-limited continuous cultures ofMicrocystis aeruginosa[J]. Journal of Plankton Research, 1988, 10(2): 171–183.
[31] LEE R E. Phycology[M]. New York: Cambridge University Press, 2008.
[32] 张运林. 湖泊光学研究进展及其展望[J]. 湖泊科学, 2011, 23(4): 483–497.
[33] 黄昌春, 李云梅, 孙德勇, 等. 秋季太湖水下光场结构及其对水生态系统的影响[J]. 湖泊科学, 2009, 21(3): 420–428.
The in-situ growth and vertical distribution of cyanobacteria in autumn in Meiliang Bay, Lake Taihu, China
ZHOU Qichao1,2, ZHAO Shuang3, PENG Chengrong1, SHEN Wei4, SONG Lirong1,*
1.State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan430072,China
2.Yunnan Key Laboratory of Pollution Process and Management of Plateau Lake-Watershed,Yunnan Institute of Environmental Science(Kunming China International Research Center for Plateau Lake),Kunming650034,China
3.Qinzhou Marine Environmental Monitoring and Forecasting Center,Qinzhou535000,China
4.Changzhou Environmental Monitoring Center,Changzhou213001,China
Thein-situgrowth rate ofMicrocystisin autumn was determined by cell division frequency method in Meiliang Bay, Lake Taihu, China. The results showed that the frequency of cell division during the daytime was higher than at night, and thein-situgrowth rate ofMicrocystisin the water surface was the highest. Moreover, thein-situgrowth rates ofMicrocystisin open water and in enclosure were 0.09-0.16 d-1and 0.20-0.35 d-1respectively, which were probably influenced by light, nutrients, algae biomass and other factors. Meanwhile, the biomass, colonial size, light-harvesting pigments and their compositions of cyanobacteria varied with the depth. To obtain appropriate light conditions, cyanobacteria may migrate vertically depending on the intensity of mixing, buoyancy regulation and colonial size.
Microcystis;in-situgrowth; vertical distribution; colony size; pigment composition
10.14108/j.cnki.1008-8873.2016.05.017
Q178.1
A
1008-8873(2016)05-117-09
2015-08-03;
2015-09-28
国家重点基础研究发展计划项目(2008CB418000);国家水体污染控制与治理科技重大专项(2009ZX07101-013)
周起超(1985—), 男, 浙江松阳人, 博士, 副研究员, 主要从事湖泊生态学研究, E-mail: qchzhou@gmail.com
*通信作者: 宋立荣, 男, 博士, 研究员, 主要从事藻类学研究, E-mail: lrsong@ihb.ac.cn

