饲粮脂肪水平对冬毛期银狐能量代谢、血清生化指标、肝脏脂肪酸组成及肝脏型脂肪酸结合蛋白基因表达的影响
张 婷 罗 婧 钟 伟 孙伟丽 王 卓 孙皓然
樊燕燕 邢敬亚 李光玉*
(中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建实验室,长春130112)
饲粮脂肪水平对冬毛期银狐能量代谢、血清生化指标、肝脏脂肪酸组成及肝脏型脂肪酸结合蛋白基因表达的影响
张婷罗婧钟伟孙伟丽王卓孙皓然
樊燕燕邢敬亚李光玉*
(中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建实验室,长春130112)
摘要:本试验旨在研究饲粮脂肪水平对冬毛期银狐能量代谢、血清生化指标、肝脏脂肪酸组成及肝脏型脂肪酸结合蛋白(L-FABP)基因表达的影响。选取145日龄、体重相近的健康雄性银狐50只,随机分成5组(每组10个重复,每个重复1只),分别饲喂含10%、12%、16%、20%、24%混合油脂(鸡油∶豆油=1∶1)的试验饲粮,试验饲粮对应的脂肪水平为12.85%(A组)、14.71%(B组)、18.72%(C组)、22.23%(D组)、26.11%(E组)。预试期为15 d,正试期为75 d。结果显示:1)饲粮脂肪水平显著或极显著影响冬毛期银狐干物质日采食量、日采食代谢能、平均日增重和代谢能增重比(P<0.05或P<0.01),而对总能消化率无显著影响(P>0.05)。2)随着饲粮脂肪水平的升高,冬毛期银狐血清甘油三酯(TG)、葡萄糖(GLU)水平呈升高趋势,且E组血清TG水平显著高于A、B组(P<0.05),A组血清GLU水平显著低于其他各组(P<0.05)。饲粮脂肪水平对血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平以及谷丙转氨酶(ALT)和谷草转氨酶(AST)活性无显著影响(P>0.05)。3)饲粮脂肪水平对冬毛期银狐肝脏脂肪酸中多不饱和脂肪酸(PUFA)、单不饱和脂肪酸(MUFA)及饱和脂肪酸(SFA)的比例有显著或极显著影响(P<0.05或P<0.01)。随着饲粮脂肪水平的升高,肝脏中PUFA和MUFA的比例升高,而SFA的比例则下降。4)随着饲粮脂肪水平的升高,冬毛期银狐肝脏中L-FABP mRNA相对表达量基本呈增加趋势,其中E组极显著高于A、B、C组(P<0.01)。由此得出,过高的饲粮脂肪水平不利于冬毛期银狐充分利用饲粮中营养物质;提高饲粮脂肪水平可增加冬毛期银狐血清TG和GLU水平,同时促进肝脏中不饱和脂肪酸的沉积;提高饲粮脂肪水平可上调冬毛期银狐肝脏中L-FABP基因的表达,进而促进脂肪酸的转运,减轻高脂饮食对肝脏造成的损伤。
关键词:银狐;脂肪水平;血清生化指标;肝脏;脂肪酸组成;肝脏型脂肪酸结合蛋白
脂肪是最经济有效的能源物质,饲粮中添加脂肪有利于提高能量浓度,降低饲料成本[1]。大量试验证实,高脂饮食能够促进毛皮动物生长[2-5]。比较Hansen等[6]的报道,NJF(2012)[7]报道的银狐的体重提高了60%,引起体重增大的主要原因之一是体脂肪的增加[8]。但是高脂肪的摄入和大量体脂沉积不利于毛皮动物肝脏的健康[9]。肝脏型脂肪酸结合蛋白(L-FABP)是脂肪酸结合蛋白家族(FABPs)的重要成员,与长链脂肪酸高度亲和,对食入脂肪在体内的吸收转运具有重要意义[10]。毛皮动物对饲粮脂肪水平的要求较其他单胃动物高,这与其特殊的脂肪代谢密不可分。本文旨在研究饲粮脂肪水平对冬毛期银狐能量代谢、血清生化指标、肝脏脂肪酸组成及L-FABP基因表达的影响,为银狐脂肪酸营养及脂肪代谢研究提供参考。
1材料与方法
1.1试验设计与试验动物饲养管理
选取145日龄、体重相近的健康雄性银狐50只,随机分成5组(每组10个重复,每个重复1只),分别饲喂含10%、12%、16%、20%、24%混合油脂(鸡油∶豆油=1∶1)的试验饲粮,试验饲粮对应的脂肪水平为12.85%(A组)、14.71%(B组)、18.72%(C组)、22.23%(D组)、26.11%(E组)。
所有试验银狐于室外自然光照下单笼饲养(笼子尺寸为100 cm×80 cm×80 cm)。每天早、晚各饲喂1次,自由采食并保证充足的饮水。预试期为15 d,正试期为75 d。
1.2试验饲粮
以膨化玉米、豆粕、秘鲁鱼粉、肉骨粉、玉米蛋白粉、干酒糟及其可溶物(DDGS)、鸡油、豆油等为主要原料,同时添加由矿物质、维生素等组成的营养性添加剂制成试验饲粮。试验饲粮组成及营养水平见表1,试验饲粮脂肪酸组成见表2。
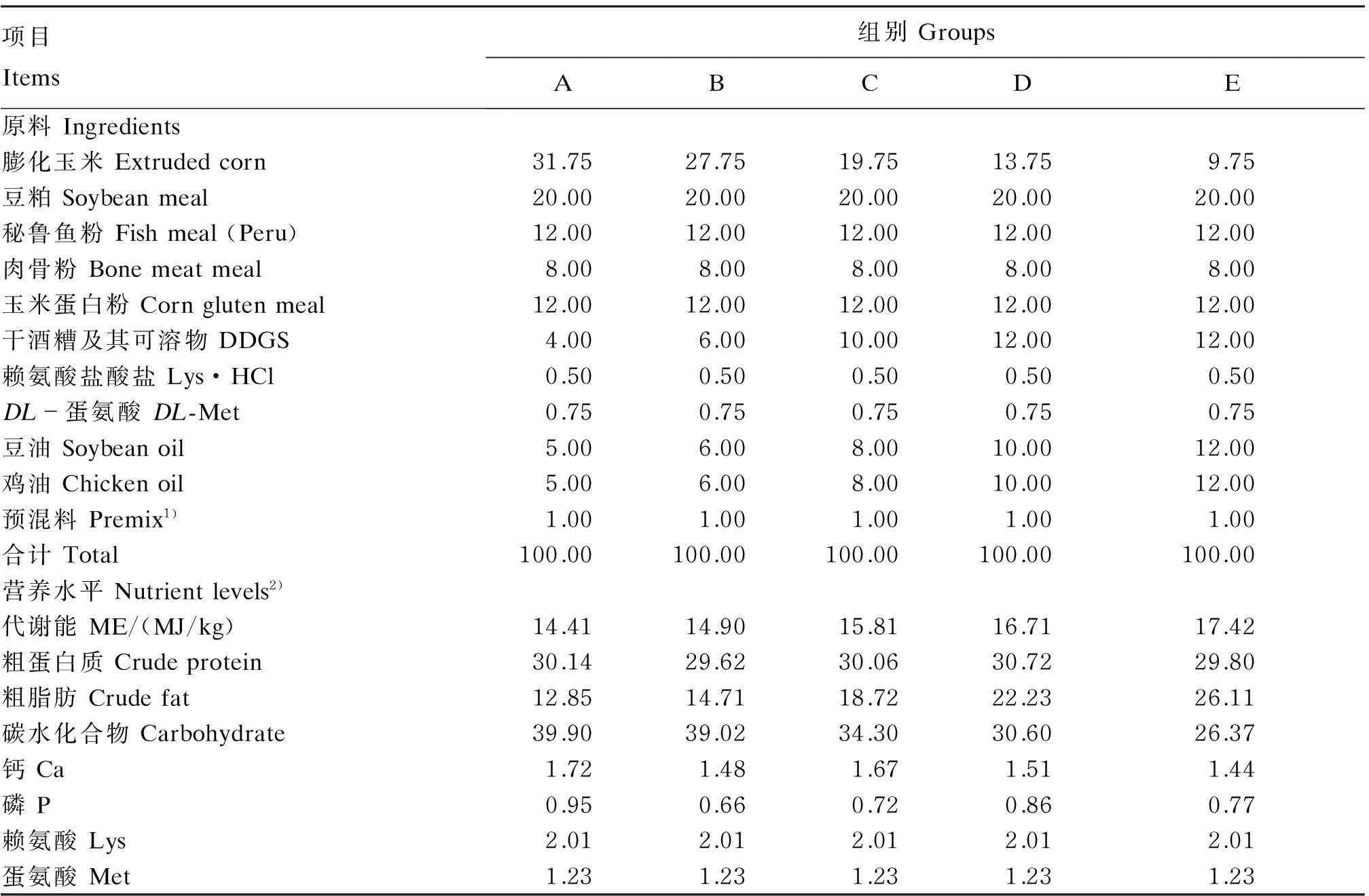
表1 试验饲粮组成及营养水平(风干基础)
1)每千克预混料含有One kilogram of premix contained the following:VA 800 000 IU,VD3200 000 IU,VE 4 000 mg,VK350 mg,VB1400 mg,VB2500 mg,VB6200 mg,VB124.2 mg,叶酸 folic acid 50 mg,泛酸 pantothenic acid 2 200 mg,生物素 biotin 1 600 mg,氯化胆碱 choline chloride 120 mg,VC 12 000 mg,Fe 4 000 mg,Zn 3 200 mg,Mn 1 600 mg,I 80 mg,Se 12 mg,Cu 500 mg。
2)粗蛋白质、粗脂肪、碳水化合物、钙、磷、赖氨酸、蛋氨酸为测定值,代谢能依据NRC(1982)计算。Crude protein, crude fat, carbohydrate, Ca, P, Lys and Met were measured values, while ME was calculated based on NRC (1982).

表2 试验饲粮脂肪酸组成
SFA:饱和脂肪酸 saturated fatty acids;MUFA:单不饱和脂肪酸 monounsaturated fatty acids;PUFA:多不饱和脂肪酸 polyunsaturated fatty acids。表6同 The same as Table 6。
1.3样品采集
试验第65天于晨饲前每组选取8只银狐,用一次性真空促凝采血管在后肢外侧小隐静脉处采血5 mL,采血后立即颠倒混合5~8次,室温静置30 min,然后4 500 r/min离心7 min,取上层血清-80 ℃冷藏备用。试验结束后,每组随机选取8只银狐,心脏注射5 mL的琥珀乙酰胆碱处死;之后迅速解剖,取肝小叶相同部位约2 g,用生理盐水冲洗掉血迹,放入冻存管后立即投入液氮中10 min以上,之后转入-80 ℃冰箱保存。另取肝脏约50 g,用生理盐水冲洗掉血迹,放入自封袋,-20 ℃冰箱冷藏待测脂肪酸组成。
1.4测定方法
1.4.1饲料养分含量测定
试验饲粮粗蛋白质含量采用凯氏定氮法测定,参照GB/T 6432—1994;粗脂肪含量采用索氏提取仪测定,参照GB/T 6433—1994;粗灰分含量采用高温灼烧法测定,参照GB/T 6438—1992;钙含量采用乙二胺四乙酸(EDTA)络合滴定法测定,参照GB/T 6436—1992;磷含量采用钒钼酸铵比色法测定,参照GB/T 6437—1992;氨基酸含量采用全自动氨基酸分析仪(HITACHI,L-8900,日本)进行测定。
1.4.2血清生化指标测定
血清生化指标均采用荷兰威图全自动生化分析仪测定,测定试剂盒均购自中生北控生物科技股份有限公司,具体测定方法参照试剂盒说明书。
1.4.3肝脏脂肪酸组成测定
脂肪酸组成采用气-质-质联用仪(Agilent 7890A-7000B)测定。色谱条件:色谱柱DB-5MS(30 m×250 μm×0.25 μm);柱温初始55 ℃,保持2 min,以5 ℃/min的速率升至200 ℃,保持1 min,再以2 ℃/min的速率升至230 ℃,保持3 min,再以5 ℃/min的速率升至270 ℃,保持10 min;进样口温度250 ℃;载气为氦气(99.999%),1.0 mL/min;进样量1 μL;分流比为10∶1。质谱条件:电子轰击离子(EI)源;离子源温度230 ℃;电子能量70 eV;接口温度250 ℃;扫描质量范围为质荷比(m/z)50~500。
1.4.4肝脏L-FABPmRNA相对表达量的测定
1.4.4.1总RNA提取和cDNA的合成
取肝脏样品于液氮中研磨成粉,收集于1.5 mL无RNA酶Eppendorf管中。总RNA的提取采用RNAiso Reagent试剂盒(TaKaRa公司),提取过程参照试剂盒说明书。提取的总RNA通过凝胶电泳检测其完整性,并测定总RNA在260和280 nm处的吸光度(OD)值,以检测其纯度。反转录依据试剂盒(TaKaRa公司)进行,反转录产物于-20 ℃冻存备用。
1.4.4.2L-FABPmRNA相对表达量的测定
L-FABPmRNA相对表达量的测定采用实时
1.5数据统计与分析
试验结果以平均值±标准差表示,数据用Excel进行整理并用SAS 8.0软件中的GLM程序进行方差分析,平均值之间的多重比较采用Duncan氏法进行,P<0.01为差异极显著,P<0.05为差异显著,P>0.05为差异不显著。

表3 实时荧光PCR引物序列及参数
2结果
2.1饲粮脂肪水平对冬毛期银狐能量代谢的影响
由表4可知,饲粮脂肪水平显著或极显著影响冬毛期银狐的干物质日采食量、日采食代谢能、平均日增重和代谢能增重比(P<0.05或P<0.01)。干物质日采食量随饲粮脂肪水平的升高而降低,C组极显著低于其他各组(P<0.01);B、C组日采食代谢能显著高于A、D、E组(P<0.05);B、C、D组平均日增重极显著高于A、E组(P<0.01),同时A组极显著高于E组(P<0.01);E组代谢能增重比显著高于其他各组(P<0.05)。饲粮脂肪水平对冬毛期银狐总能消化率无显著影响(P>0.05)。
2.2饲粮脂肪水平对冬毛期银狐血清生化指标的影响
由表5可知,随着饲粮脂肪水平的升高,冬毛期银狐血清甘油三酯(TG)水平呈升高趋势,且E组显著高于A、B组(P<0.05)。A组血清葡萄糖(GLU)水平最低,显著低于其他各组(P<0.05)。饲粮脂肪水平对血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平及谷丙转氨酶(ALT)和谷草转氨酶(AST)活性无显著影响(P>0.05)。

表4 饲粮脂肪水平对冬毛期银狐能量代谢的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01), while with no or the same letter superscripts mean no significant difference (P>0.05). The same as below.

表5 饲粮脂肪水平对冬毛期银狐血清生化指标的影响
2.3饲粮脂肪水平对冬毛期银狐肝脏脂肪酸组成的影响
由表6可知,饲粮脂肪水平对冬毛期银狐肝脏脂肪酸中多不饱和脂肪酸(PUFA)(如C18∶2n-6、C18∶3n-3)、单不饱和脂肪酸(MUFA)(如C18∶1n-9)及饱和脂肪酸(SFA)(如C18∶0)的比例有显著或极显著影响(P<0.05或P<0.01)。随着饲粮脂肪水平的升高,肝脏中PUFA和MUFA的比例升高,而SFA的比例下降。
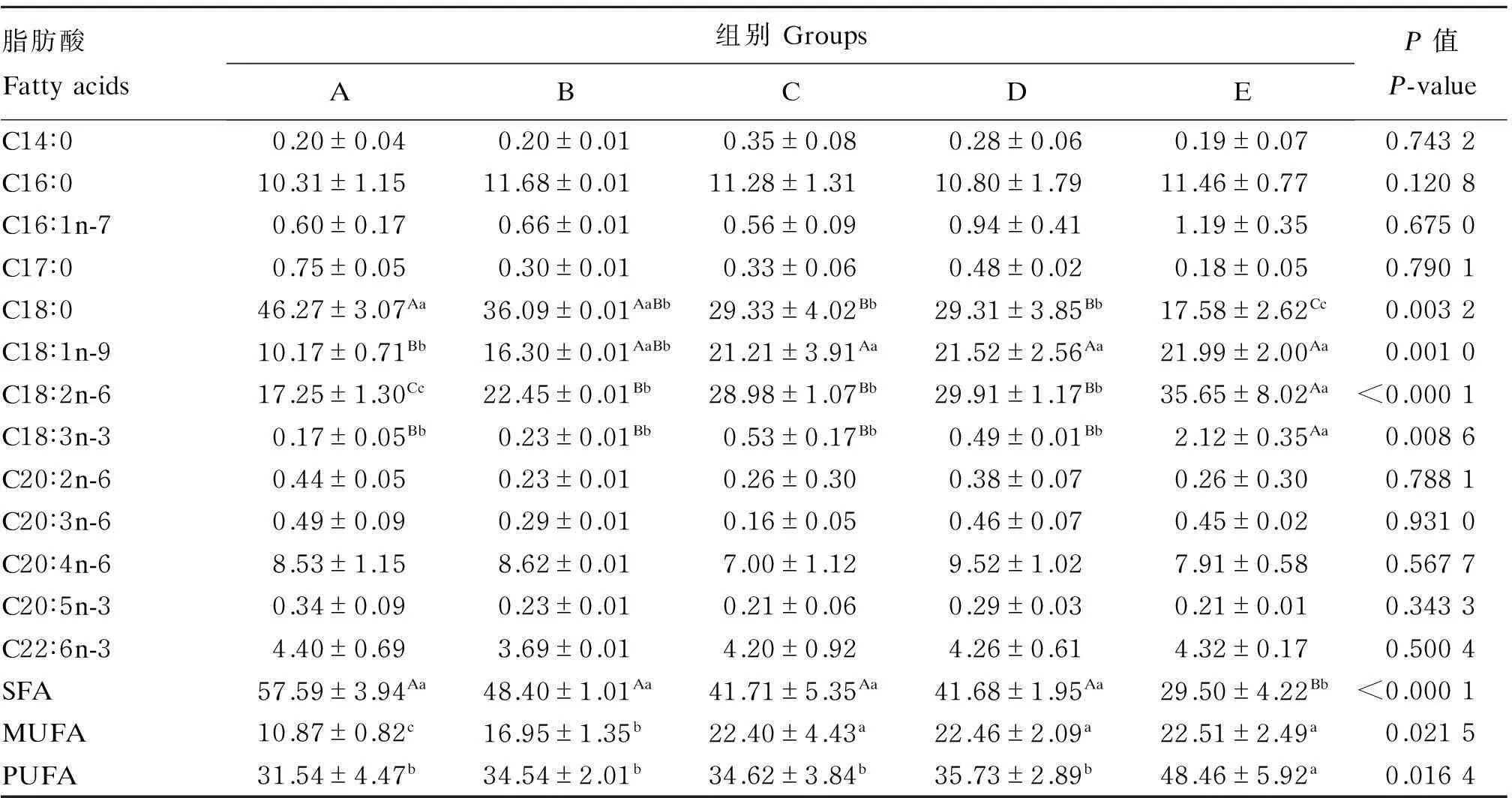
表6 饲粮脂肪水平对冬毛期银狐肝脏脂肪酸组成的影响(占总脂肪酸的百分比)
2.4饲粮脂肪水平对冬毛期银狐肝脏L-FABPmRNA相对表达量的影响
由图1可以看出,随着饲粮脂肪水平的升高,冬毛期银狐肝脏L-FABPmRNA相对表达量基本呈增加趋势,其中E组极显著高于A、B、C组(P<0.01)。
3讨论
3.1饲粮脂肪水平对冬毛期银狐能量代谢的影响
饲粮中的能量蕴藏在营养物质中,脂肪是最有效的能量物质,其添加水平显著影响饲粮能量浓度。本试验结果显示,随着饲粮脂肪水平的升高,冬毛期银狐干物质日采食量逐渐降低,这与在蓝狐上所得结果[3]相一致。杨颖[11]报道,随饲粮能量水平的升高,雄性水貂总能消化率显著增高。本试验发现,提高饲粮脂肪水平并未引起银狐总能消化率产生显著变化。虽然随着饲粮脂肪水平的升高使饲粮的代谢能逐渐增加,但日采食代谢能呈现出先增加后保持平衡的趋势,这可能是由于动物为能而食[12]。含24%混合油脂组(E组)代谢能增重比显著高于其他各组,说明过高脂肪水平不利于银狐更好的利用饲料中营养物质进行体组织合成。
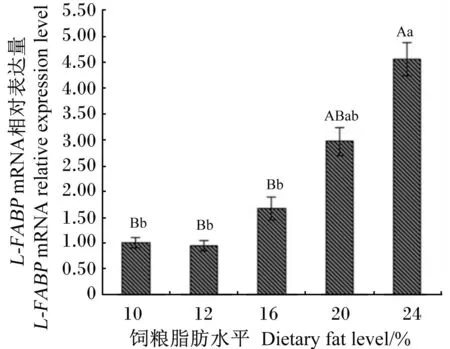
数据柱标注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。
Value columns with different small letters mean significant difference (P<0.05), and with different capital letters mean extremely significant difference (P<0.01), while with no or the same letters mean no significant difference (P>0.05).
图1饲粮脂肪水平对冬毛期银狐
肝脏L-FABPmRNA相对表达量的影响
Fig.1Effects of dietary fat level on relative
expression level ofL-FABPmRNA in liver of silver fox
during the winter fur-growing period
3.2饲粮脂肪水平对冬毛期银狐血清生化指标的影响
血脂是血液内所有脂类物质的总称,主要包括TG、TC、磷脂、游离脂肪酸等[13]。TG是哺乳动物能量贮存的主要形式,有研究表明提高饲粮能量水平可增加犬血清中TG水平[14]。Van de Ligt等[15]报道,生长猪血清GLU水平随饲粮能量水平的升高呈上升趋势。本试验结果与前人研究结果一致,银狐血清TG及GLU水平随饲粮脂肪水平的升高而升高,说明高脂饮食促进银狐机体脂肪合成。此外,银狐血清TC、HDL-C及LDL-C水平随饲粮脂肪水平的升高有增高趋势,但各组间差异不显著。这是由于不同的血脂指标随能量变化规律不同,血清TC水平不易受饲粮组成影响[16]。在人类疾病诊断中,血清ALT和AST活性是评价肝脏健康程度的重要指标。本试验中各组银狐血清ALT和AST活性无显著差异,说明银狐对脂肪有一定的耐受能力。
3.3饲粮脂肪水平对冬毛期银狐肝脏脂肪酸组成的影响
本试验测得的银狐肝脏脂肪酸组成与其他毛皮动物如欧洲熊、蓝狐、水貂等肝脏脂肪酸组成相似[17-18]。组织脂肪酸中PUFA的比例是由多种因素决定的,包括脂肪酸的合成速率、相互转化、氧化分解等[19]。本试验中银狐肝脏C18∶1n-9、C18∶2n-6和C18∶3n-3比例随饲粮脂肪水平的升高而升高,这是由于饲粮脂肪酸中C18∶1n-9和C18∶2n-6的比例高,随饲粮脂肪水平的升高,银狐食入的C18∶1n-9和C18∶2n-6增加,最终导致肝脏中沉积量增加。肝脏内脂肪合成主要由细胞质内脂肪酸合成酶催化,脂肪酸合成酶主要产物为饱和脂肪酸C16∶0和C18∶0。Ahlstrøm等[20]研究发现,随饲粮脂肪水平(脂肪源为鱼油)的升高,蓝狐肝脏C18∶0比例显著下降。本试验获得相似结果,即银狐肝脏C18∶0比例随饲粮脂肪水平的升高显著下降。其可能原因是PUFA食入量的增加抑制了脂肪酸合成酶的表达[21]。前人的研究发现高脂饮食可引起小鼠胰岛素抵抗,进而导致大量脂肪沉积于肝脏[22-24]。高脂饮食是否引起银狐胰岛素抵抗有待进一步研究。
3.4饲粮脂肪水平对冬毛期银狐肝脏L-FABP基因表达的影响
FABPs与长链(>14C)脂肪酸高度亲和[25]。因此L-FABP基因表达量的变化能够在一定程度上反映肝脏脂肪代谢情况。前人研究表明,L-FABP基因表达受饲粮油脂的调控[23,26]。Matzinger等[27]研究表明,脂肪代谢活跃组织如肝脏、小肠脂肪组织等,FABPs基因表达量较高。本试验结果显示,随饲粮脂肪水平的升高,银狐肝脏L-FABPmRNA相对表达量基本呈增加趋势。肝脏中L-FABPmRNA相对表达量的增加主要是由于高脂肪酸的摄入和利用。本试验中,银狐采食高脂肪水平饲粮后,摄入了高水平的长链脂肪酸,脂肪酸经肠道消化吸收被转运至肝脏,促进L-FABP基因表达以加快脂肪酸的转运,进而减少肝脏脂肪沉积。随着对FABPs基因研究的不断深入,其在脂肪代谢疾病诊断方面的潜力受到学者们的关注[28-29]。高脂饮食是否引起银狐脂肪代谢疾病有待进一步研究。
4结论
本试验条件下:
① 提高饲粮脂肪水平可降低冬毛期银狐的干物质日采食量,日采食代谢能表现出先升高后降低的趋势,过高脂肪水平不利于银狐充分利用饲粮中的营养物质。
② 提高饲粮脂肪水平可增加冬毛期银狐血清TG和GLU水平,同时促进肝脏不饱和脂肪酸的沉积。
③ 提高饲粮脂肪水平可上调冬毛期银狐肝脏中L-FABP基因的表达,进而促进脂肪酸的转运,减轻高脂饮食对肝脏造成的损伤。
参考文献:
[1]HANSEN N E.Recent advances in the nutrition of fur animals[J].Norwegian Journal of Agricultural Sciences,1992(9):221-231.
[2]AHLSTRØM Ø,SKREDE A.Feed with divergent fat:carbohydrate ratios for blue foxes (Alopexlagopus) and mink (Mustelavison) in the growing-furring period[J].Norway Journal Agricultural Science,1995,9:115-126.
[3]GENG Y Y,YANG F H,XING X M,et al.Effects of dietary fat levels on nutrient digestibility and production performance of growing-furring blue foxes (Alopexlagopus)[J].Journal of Animal Physiology and animal Nutrition,2012,96(4):610-617.
[4]AHLSTRØM Ø.Effect of different dietary fat:carbohydrate ratio on fur characteristics in mink and silver foxes[M].NJF-seminar No.450.Sweden:Knivsta,2011.
[5]MARX F R,TREVIZAN L,AHLSTRØM Ø,et al.Soybean oil and beef tallow in dry extruded diets for adult dogs[J].Archives of Animal Nutrition,2015,69(4):297-309.
[6]HANSEN N E,FINNE L,SKREDE A,et al.Energiforgiforsyningen hos mink og rv[M].Finland:Nordic Association of Agricultural Research,1991.
[7]NJF.Energy and main nutrients in feed for mink and foxes[R].2nd ed.Finland:Fur Animals Nutrition and Feeding Committee,2012:59-80.
[8]DAHLMAN T,KIISKINEN T,MKELJ,et al.Digestibility and nitrogen utilisation of diets containing protein at different levels and supplemented withDL-methioninine,L-methionine andL-lisine in blue fox (Alopexlagopus)[J]. Animal Feed Science and Technology,2002,98:219-235.
[9]HUNTER B,LEMIEUX N.Mink biology,health and disease[M].Guelph:University of Guelph Graphic and Print Services,1996.
[10]ZIMMERMAN A W,VEERKAMP J H.New insights into the structure and function of fatty acid-binding proteins[J] Cellular and Molecular Life Sciences,2002,59(7):1096-1116.
[11]杨颖.日粮能量水平及来源对水貂生产性能和营养物质消化代谢的影响[D].硕士学位论文.北京:中国农业科学院,2013:16-28.
[12]杨凤.动物营养学[M].3版.北京:中国农业出版社,2003:76-88.
[13]王中平,刘凡,王玲,等.血脂异常与冠心病研究进展[J].四川解剖学杂志,2010,18(3):45-48.
[14]ROMSOS D R,HORNSHUH M J,LEVEILLE G A.Influence of dietary fat and carbohydrate on food intake,body weight and body fat of adult dogs[J].Experimental Biology and Medicine,1978,157:278-281.
[15]VAN DE LIGT C P A,LINDEMANN M D,CROMWELL G L.Assessment of chromium tripicolinate supplementation and dietary protein level on growth,carcass,and blood criteria in growing pigs[J].Journal Animal Science,2002,80(9):2412-2419.
[16]陈金文,杨山,莫棣华,等.日粮能量和蛋白水平对肉鸡腹脂和血脂的影响[J].动物营养学报,1998,10(1):20-28.
[18]ZALEWSKI K,MARTYSIAK-ZUROWSKA D,STOYHWO A,et al.Chemical composition of lipids isolated from selected organs and tissues of the raccoon dog (Nyctereutesprocyonoides)[J].Polish Journal of Environmental Studies,2008,17(4):605-611.
[19]ENSER M,RICHARDSON R I,WOOD J D,et al.Feeding linseed to increase the n-3 PUFA of pork:fatty acid composition of muscle,adipose tissue,liver and sausages[J].Meat Science,2000,55(2):201-212.
[20]AHLSTRØM Ø,SKREDE A.Liver fatty acid composition and peroxisomal fatty acid oxidase activity in blue foxes (Alopexlagopus) and mink (Mustelavison) fed diets containing different levels of fish oil[J].Comparative Biochemistry Physiology Part A:Physiology,1997,177(1):135-140.
[21]CLARKES D,ARMSTRONG M K,JUMP D B.Dietary polyunsaturated fats uniquely suppress rat liver fatty acid synthase and S14 mRNA content[J].The Journal of Nutrition,1990(120):225-231.
[22]LEWIS G F,CARPENTIER A,ADELI K,et al.Disordered fat storage and mobilization in the pathogenesis of insulin resistance and type 2 diabetes[J].Endocrine Reviews,2002,23(2):201-209.
[23]PETIT V,ARNOULD L,MARTIN P,et al.Chronic high-fat diet affects intestinal fat absorption and postprandial triglyceride levels in the mouse[J].Journal of Lipid Research,2007,48(2):278-287.
[24]KIM J K,GAVRILOVA O,CHEN Y,et al.Mechanism of insulin resistance in A-ZIP/F-1 fatless mice[J].The Journal of Biological Chemistry,2000,275(12):8456-8460.
[25]GAJDA A M,STORCH J.Enterocyte fatty acid-binding proteins (FABPs):different functions of liver and intestinal FABPs in the intestine[J].Prostaglandins,Leukotrienes and Essential Fatty Acids,2015,93:9-16.
[26]MALLORDY A,POIRIER H,BESNARD P,et al.Evidence for transcriptional induction of the liver fatty-acid-binding-protein gene by bezafibrate in the small intestine[J].European Journal of Biochemistry,1995,227(3):801-807.
[27]MATZINGER D,DEGEN L,DREWE J,et al.The role of long chain fatty acids in regulating food intake and cholecystokinin release in humans[J].Gut,2000,46(5):688-693.
[28]KIM J S,INGALE S L,LEE S H,et al.Impact of dietary fat sources and feeding level on adipose tissue fatty acids composition and lipid metabolism related gene expression in finisher pigs[J].Animal Feed Science and Technology,2014,196:60-67.
[29]NEWBERRY E P,DAVIDSON N O.Liver fatty acid binding protein (L-FABP) as a target for the prevention of high fat diet induced obesity and hepatic steatosis[J].Immunology,Endocrine & Metabolic Agents in Medicinal Chemistry,2009,9(1):30-37.
(责任编辑菅景颖)
Effects of Dietary Fat Level on Energy Metabolism, Serum Biochemical Indices, Liver Fatty Acid Composition and Liver Type Fatty Acid Binding Protein Gene Expression of Silver Foxes During the Winter Fur-Growing Period
ZHANG TingLUO JingZHONG WeiSUN WeiliWANG ZhuoSUN Haoran FAN YanyanXING JingyaLI Guangyu*
(State Key Laboratory of Special Economic Animal Molecular Biology, Institute of Special Animal and Plant Science, Chinese Academy of Agricultural Science, Changchun 130112, China)
Abstract:This experiment was conducted to study the effects of dietary fat level on energy metabolism, serum biochemical indices, liver fatty acid composition and liver type fatty acid binding protein (L-FABP) gene expression of silver foxes during the winter fur-growing period. Fifty 145-day-old healthy male silver foxes with a similar body weight were randomly divided into 5 groups with 10 replicates per group and 1 fox per replicate, and they were fed experimental diets containing 10%, 12%, 16%, 20% and 24% lipid mixture (soybean oil∶chicken oil=50∶50), respectively. The fat level in those experimental diets was 12.85% (group A), 14.71% (group B), 18.72% (group C), 22.23% (group D) and 26.11% (group E), respectively. The experiment was 15 days for adaptation and 75 days for trial period. The results showed as follows: 1) dietary fat level significantly or extremely significantly affected the daily dry matter intake, daily metabolizable energy (ME) intake, average daily gain and ME/gain of silver foxes during the winter fur-growing period (P<0.05 or P<0.01), but there was no significant effect on gross energy digestibility (P>0.05). 2) Serum triglyceride (TG) and glucose (GLU) levels showed increasing trends with dietary fat level increasing, and the serum TG level in group E was significantly higher than that in groups A and B (P<0.05), while the serum GLU level in group A was significantly lower than that in other groups (P<0.05). There were no significant differences in serum total cholesterol (TC), high density lipoprotein-cholesterol (HDL-C), low density lipoprotein-cholesterol (LDL-C) contents, and alanine transarninase (ALT) and alanine transarninase (AST) activities among groups (P>0.05). 3) Dietary fat level significantly or extremely significantly affected the proportions of liver polyunsaturated fatty acids (PUFA), monounsaturated fatty acids (MUFA) and satisfied fatty acids (SFA) of silver foxes during the winter fur-growing period (P<0.05 or P<0.01). With the dietary fat level increasing, the proportions of liver PUFA and MUFA were increased, while the proportion of liver SFA was decreased. 4) The relative expression level of L-FABP mRNA in liver was up-regulated with dietary fat level increasing, and that in group E was extremely significantly higher than that in groups A, B and C (P<0.01). These results indicate that the high level of fat in the diet does not conducive to the utilization of dietary nutrients for silver foxes during the winter fur-growing period. Increasing dietary fat level can increase the levels of serum TG and GLU, and promote the unsaturated fatty acid deposition in liver of silver foxes during the winter fur-growing period. Increasing dietary fat level can also up-regulate the liver L-FABP mRNA expression of silver foxes during the winter fur-growing period,which lead to promote the transportation of fat, and then reduce the damage to the liver caused by high fat diet.[Chinese Journal of Animal Nutrition, 2016, 28(2):618-626]
Key words:silver foxes; fat level; serum biochemical indices; liver; fatty acid composition; liver type fatty acid binding protein
*Corresponding author, professor, E-mail: tcslgy@126.com
中图分类号:S816
文献标识码:A
文章编号:1006-267X(2016)02-0618-09
作者简介:张婷(1988—),女,吉林长春人,硕士研究生,研究方向为野生动植物保护与利用。E-mail: zhangting542118@163.com*通信作者:李光玉,研究员,博士生导师,E-mail: tcslgy@126.com
基金项目:吉林省自然科学基金项目(20140101033JC);中国农业科学院科技创新工程项目
收稿日期:2015-08-31
doi:10.3969/j.issn.1006-267x.2016.02.038

