标记引物数量对白桦遗传多样性的影响
赵双菁,刘莹莹,魏敏静,杨传平,魏志刚
〔林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040〕
标记引物数量对白桦遗传多样性的影响
赵双菁,刘莹莹,魏敏静,杨传平,魏志刚
〔林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040〕
摘要以帽儿山实验林场15个种源的白桦种源试验林300个样本为试验材料,通过不同数量的SRAP引物对白桦遗传多样性研究结果的影响做出分析,并提出标记引物确定的计算公式。结果表明,SRAP引物数量不影响白桦各种源间遗传参数的变化趋势,但随着引物数量的增加,区分不同种源间遗传差异的能力随之提高,当SRAP引物数量为15对时,可探测到的多态位点百分率达98.5%以上。
关键词白桦;标记引物数量;遗传多样性
遗传多样性是生物多样性的基础和核心,是生态系统多样性和物种多样性的基础方面,保护生物多样性最终是要保护其遗传多样性[1]。林木遗传多样性的研究开始于形态学为基础的种源试验,如杉木(Cunninghamialanceolata)、桉树(Eucalyptusrobusta)、红松(Pinuskoraiensis)、樟子松(Pinussylvestrisvar.mongolica)和长白落叶松(Larixolgensis)等树种的种源试验研究[2,3]。同工酶标记发明后,被先后运用到欧洲赤松(Pinussylvestris)、云杉(Piceaasperata)、红松、颤杨(Populustremuloide)、花旗松(Pseudotsugamenziesii)和欧洲山毛榉(Fagussylvatica)等重要林木遗传多样性研究中[4-6]。随后,DNA标记的出现及其技术自身的优点,被迅速运用到林木遗传多样性研究中并极大地推动了该领域的研究进程,如欧洲赤松、栲树(Castanopsisfargesii)、挪威云杉(Piceaabies)、山毛榉、欧洲刺槐(Robiniapseudoacacia)、云杉、海岸松(Pinuspinaster)、雪松(Cedrusdeodara)、红松、木荷(Schimasuperba)、长叶榧(Torreyajackii)和白皮松(Pinusbungeana)等一些主要用材和珍稀濒危树种均采用DNA标记进行了研究,是林木遗传多样性研究中应用最广泛的技术[7]。目前为止,虽然大规模测序技术的不断发展和完善,相继有杨树、桉树和欧洲赤松等少数几个树种完成了全基因测序,这为基于SNP技术为基础的林木遗传多样性及辅助选择育种提供了可能,然而对于多数植物与树木而言仍然缺乏全基因组序列,因此,目前基于基因组非编码区变异变为基础的DNA标记技术仍是多数植物遗传多样性研究中的主要方法与技术。
群体遗传学的研究基础是DNA序列变异。同源DNA序列的遗传分化程度是衡量群体遗传结构的主要指标,其分化式样则是理解群体遗传结构产生和维持的进化内在驱动力诸如遗传突变、重组、基因转换的前提[8]。因此,在遗传多样性研究中,要尽可能地揭示出该物种全基因组区域的DNA序列的变异,这样才能全面反映出其遗传多样性和群体遗传结构,为后期资源的保存和利用奠定基础。DNA分子标记,不同的标记及引物反映的基因组区域的不同DNA序列变异,因此如果标记数量较少时,可能无法全部覆盖基因组上产生变异的所有区域,因此不可能揭示该变异的全部信息[9],而数量过多,不能增加信息量还会造成额外的实验成本。因此,对于遗传多样性研究中,究竟采用多少标记足以揭示其群体的遗传结构是一个值得重视的问题。如Julio等在研究蔷薇的遗传多样性时发现,对于杂合度的估算,必须有10个以上的个体和20个以上的标记[10]。而Reyazu等在黄麻(Corchorusspecies)遗传多样性研究中发现,15对与41对SSRs引物揭示的信息量相同[11]。白桦(Betulaplatyphylla)是一种分布范围广、适用性强、用途广泛的阔叶速生树种,然而,有关白桦遗传多样性研究报道中 ,同样也没有重视到标记数量对遗传参数结果与遗传结果影响的问题。
SRAP ( Sequence-related amplified polymorphism,序列相关扩增多态性) 标记建立以来,由于其操作简便快速、成本低、可信度高、易于测序等特点备受分子生物学家的青睐[9],被迅速应用到莲藕(Nelumbonucif)[10]、桃(Amygdaluspersica)[11]花生(Arachishypogaea)[12]、油菜(Brassicanapus)[13]、黄瓜(Cucumissativus)[14]、甘薯(Dioscoreaesculenta)[15]和西瓜(Citrulluslanatus)[16]等植物的种质资源鉴定评价、遗传图谱构建(包括转录图谱)、重要性状标记乃至基因分离克隆等方面得到了应用。本文通过对不同SRAP引物对白桦遗传多样性研究结果的影响的研究,提出SRAP标记研究白桦遗传多样性引物数量的标记,在此基础上提出标记引物确定的计算公式。
1材料与方法
1.1试验材料来源
试验材料来自东北林业大学帽儿山实验林场白桦种源试验林,共15个种源,分别为:新疆、凉水、汪清、露水河、小北湖、辉南、桓仁、草河口、绰尔、宁夏、莫尔道嘎、清源、东方红、帽儿山、乌伊岭。每个种源随机选取20个个体,共计300个样本。2012年6月采取当年生嫩叶,用密封袋封好,做好标记,放在冰盒中带回实验室,置于-80 ℃冰箱中保存。
1.2试验方法
1.2.1白桦叶片基因组DNA提取白桦叶片基因组DNA提取方法见参考文献[12]。
1.2.2反应体系及反应程序SRAP该反应体系为20 μL:0.21×106μgL-1DNA,1.5 μL;25 mmolL-1Mg2+,1.4 μL;5 UμL-1Taq酶,0.25 μL;2.5 mmolL-1dNTPs,2 μL;10 μmL-1引物,0.35 μL。PCR反应程序为:94 ℃预变性5 min,94 ℃变性1 min,35 ℃复性1 min,72 ℃延伸1 min,5个循环;94 ℃变性1 min,50 ℃复性1 min,72 ℃延伸1 min,30个循环,72 ℃延伸7 min[13,14]。
1.2.3引物筛选本研究中所用SRAP引物根据文献[15]中的引物序列,在上海生工合成。从15个种源中选取地理位置最近的2个种源(莫尔道嘎和桓仁),每个种源选5个个体用于引物的筛选。以条带清晰并且群体与个体间至少有一条差异条带的引物为选择标准,从合成的30对引物中,筛选出17对条带清晰、多态性高的引物用于实验分析。引物序列如表1所示。
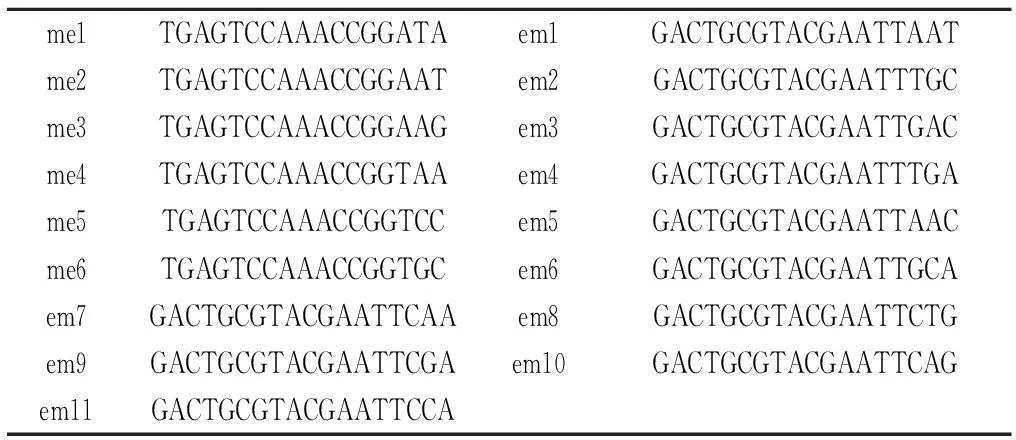
表1 SRAP引物序列
1.2.4SRAP引物数量按5、7、9、11、13、15、17对SRAP引物对15个白桦种源进行扩增和分析。
1.3数据统计及分析
电泳图谱中的每一条带均代表了引物与模板DNA互补的一对结合位点,可记为一个分子标记,根据分子量标准对照反应产物在胶上的对应位置,估计扩增产物的分子量大小,有带的记为“1”,无带的记为“0”[16]。所得结果为一二元数据矩阵,利用Popgene32软件计算各项遗传参数。
2结果与分析
2.1不同标记引物数量的白桦群体遗传多样性
按5、7、9、11、13、15、17对SRAP引物对15个白桦种源、300个个体进行SRAP扩增并对各遗传参数统计分析,结果见表2。表2表明,引物数量不同时,得到的白桦群体遗传多样性各项参数的大小也不同。如5对特异性引物(me2em3、me2em4、me2em5、me2em6、me2em8)共检测到46个位点,其中多态位点有45,多态位点百分率达97.83%,多态位点数量为21~33、多态位点百分率在45.65%~71.74%,平均等位基因数在1.456 5~1.717 4,有效等位基因数在1.200 8~1.333 9,Nei’s指数在0.123 1~0.202 6,Shannon指数在0.192 6~0.314 1,各种源上述遗传参数的变化趋势基本一致,最大均为凉水种源,最小为草河口种源。白桦种源总基因多样性为0.234 3,种群内基因多样性为0.168 2,种群间的遗传多样性为0.066 1,种源间分化系数为0.283 0,说明71.70%的遗传变异存在于种源内,28.30%存在于种源间,基因流Nm为 1.272 8。
7对SRAP引物(me2em3、me2em4、me2em5、me2em6、me2em8、me2em11、me3em3)共检测到62个位点,其中多态位点有61,多态位点百分率为98.38%,多态位点数量在26~61之间、多态位点百分率在41.94%~98.38%,平均等位基因数在1.419 4~1.709 7,有效等位基因数在1.205 8~1.295 3、Nei’s指数在0.125 2~0.214 1、Shannon指数在0.193 1~0.320 6,各种源上述遗传参数的变化趋势基本一致,最大与最小种源分别为凉水和淖尔种源。白桦种源总基因多样性为0.243 7,种群内和种群间基因多样性为0.166 1和0.077 6,种源间分化系数为0.318 3,说明68.16%的遗传变异存在于种源内,31.84%存在于种源间,基因流Nm为1.070 6。
9对SRAP引物(me2em3、me2em4、me2em5、me2em6、me2em8、me2em11、me3em3、me3em4、me4em9)检测到白桦各种源平均等位基因数为1.369 9~1.726 0,有效等位基因数1.176 3~1.373 9,Nei’s指数在0.107 6~0.216 4,Shannon指数在0.166 8~0.325 3,多态位点数量为27~72、多态位点百分率达36.99%~98.63%,各种源上述遗传参数的变化趋势基本一致,最大均为凉水种源,而最小为淖尔种源。白桦种源总基因多样性为0.248 8,种群内基因多样性Hs为0.163 8,种群间的遗传多样性为0.077 6,种源间分化系数为0.341 9,说明65.84%的遗传变异存在于种源内,34.16%存在于种源间,基因流Nm为0.962 5。
11对特异性引物(me2em3、me2em4、me2em5、me2em6、me2em8、me2em11、me3em3、me3em4、me4em9、me4em11、me5em4)检测到白桦各种源平均等位基因数为1.348 3~1.752 8,有效等位基因数为1.165 8~1.367 2,Nei’s指数为0.101 3~0.223 4,Shannon指数为0.157 1~0.344 2,多态位点数量为31~87,多态位点百分率为34.8%~75.68%,各种源上述遗传参数的变化趋势基本一致,最大均为凉水种源,而最小为淖尔种源。白桦种源总基因多样性为0.248 1,种群内基因多样性为0.162 9,种群间的遗传多样性为0.085 2,种源间分化系数为0.343 5,说明65.66%的遗传变异存在于种源内,34.34%存在于种源间,基因流Nm为0.955 7。
13对特异性引物(me2em3、me2em4、me2em5、me2em6、me2em8、me2em11、me3em3、me3em4、me4em9、me4em11、me5em4、me5em11、me6em12) 检测到白桦各种源平均等位基因数为1.403 8~1.769 2,有效等位基因数1.191 3~1.379 0,Nei’s指数在0.118 5~0.229 1,Shannon指数0.184 0~0.352 0,多态位点数量为42~80,多态位点百分率达40.38%~76.92%,各种源上述遗传参数的变化趋势基本一致,最大均为凉水种源,而最小为淖尔种源。白桦种源总基因多样性为0.255 6,种群内基因多样性为0.168 4,种群间的遗传多样性为0.087 2,种源间分化系数为0.341 1,说明65.88%的遗传变异存在于种源内,34.12%存在于种源间,但基因流Nm为0.966 0。
15对特异性引物(me2em3、me2em4、me2em5、me2em6、me2em8、me2em11、me3em3、me3em4、me4em9、me4em11、me5em4、me5em11、me6em12)检测到白桦各种源平均等位基因数为1.408 3~1.791 7,有效等位基因数为1.211 6~1.396 4,Nei’s指数为0.125 3~0.239 3,Shannon指数为0.190 9~0.367 0,多态位点数量为42~80,多态位点百分率为40.38%~76.92%,各种源上述遗传参数的变化趋势基本一致,最大均为凉水种源,而最小为淖尔种源。白桦种源总基因多样性为0.262 3,种群内基因多样性Hs为0.173 0,种群间的遗传多样性为0.089 3,种源间分化系数为0.340 6,说明65.96%的遗传变异存在于种源内,34.05%存在于种源间,但基因流Nm为0.967 9。
利用筛选出的17对特异性SRAP引物检测到白桦各种源平均等位基因数为1.363 0~1.829 6,有效等位基因数为1.188 1~1.415 3,Nei’s指数为0.111 4~0.248 3,Shannon指数为0.169 7~0.379 9,多态位点数量为49~112,多态位点百分率为36.3%~82.96%,各种源上述遗传参数的变化趋势基本一致,最大均为凉水种源,最小为清源种源。白桦种源总基因多样性为0.2591,种群内基因多样性为0.170 7,种群间的遗传多样性为0.088 4,种源间分化系数为0.340 9,说明65.88%的遗传变异存在于种源内,34.12%存在于种源间,基因流Nm为0.966 5。

表2 不同引物数量遗传参数比较
注:a为引物数量为5对时白桦种源的聚类结果,b为引物数量7对时白桦种源的聚类结果,c为引物数量9对时白桦种源的聚类结果,d为引物数量11对时白桦种源的聚类结果,e为引物数量13对时白桦种源的聚类结果,f为引物数量15对时白桦种源的聚类结果,g为引物数量17对时白桦种源的聚类结果
2.2白桦种源不同样本数量时群体间亲缘关系
为了进一步分析引物数量对于群体遗传结构的分析结果的影响,对不同标记数量分析了白桦15个种源间的遗传距离并进行了聚类分析。结果表明,引物数量不同,不仅对不同种源间的遗传距离的估算结果产生影响,而且得到的白桦种源间进化关系存在一定的差异(图1)。不同引物数量,反映出遗传距离最近与最远的种源也存在差异,如当引物数为7、13、15和17对时,遗传距离最小的2个种源均为莫尔道嘎和桓仁;而引物数为5、9和11对时,遗传距离最小的2个种源为清源和宁夏。引物数量为9、11、13、15和17对时,遗传距离最大的2个种源均为凉水和草河口,而引物数量为7对时,凉水和东方红种源的遗传距离最大;引物数量为5对时,凉水和乌伊岭种源的遗传距离最大。从上述不同引物数量白桦种源聚类结果来看,在相同的遗传距离处(如0.11处),不同引物数量导致白桦种源聚类类群数量各不相同,如当引物数量为5对时,15个种源聚成3类;当引物数量为5对时,15个种源聚成3大类群;引物数量为7和9对时,聚成4类。同时,上述不同聚类结果中,包含的种源也各不相同,总体来说,随着引物数的增多,聚类数量与每个类别中包括的种源趋于相同。如当引物数量为5对时, 15个种源可聚成3个类群:凉水种源聚为一类,乌伊岭聚为一类,其余种源聚成一大类(图1 a)。当引物数量为7对时,可聚成4个类群:凉水种源聚为一类,辉南聚为一类,汪清、新疆、露水河聚成一类,其余种源聚成一大类(图1 b)。当引物数量为9对时,可聚成4个类群:凉水种源聚为一类,辉南聚为一类,汪清、新疆、露水河聚成一类,其余种源聚成一大类(图1 c)。当引物数量为11对时,可聚成5个类群:凉水种源单独聚为一类;汪清、新疆、露水河种源聚为一类;小北湖、桓仁、莫尔道嘎、辉南聚为一类;草河口、淖尔、宁夏、清源种源聚为一类,东方红、乌伊岭、帽儿山种源聚为一类(图1d)。当引物数量为13对时,可聚成5个类群:凉水、汪清种源聚为一类,新疆、露水河种源聚为一类,小北湖、辉南、莫尔道嘎和桓仁种源聚为一类,草河口、淖尔、宁夏、清源种源聚为一类(图1 e)。当引物数量为15对时,可聚成6个类群:凉水、汪清种源聚为一类;新疆、露水河种源聚为一类,桓仁为一类、东方红、乌伊岭、帽儿山聚为一类,小北湖、辉南、莫尔道嘎种源聚为一类,草河口、淖尔、宁夏、清源种源聚为一类(图1 f)。当引物数量为17对时,可聚成5个类群:凉水、汪清种源聚为一类;新疆、露水河种源聚为一类;小北湖、辉南、桓仁、莫尔道嘎种源聚为一类;草河口、淖尔、宁夏、清源种源聚为一类;东方红、乌伊岭、帽儿山聚为一类(图1 g)。
2.3引物数量和白桦遗传参数的相关分析
为了进一步弄清SRAP引物数量对白桦主要遗传参数影响的大小,对引物数量和各遗传参数进行了相关性分析(表3),结果表明,引物数量白桦群体的有效等位基因数量Ne、Nei’s基因多样性指数H、Shannon’s信息多样性指数I、多态位点、多态位点百分率和群体基因多样性间呈极显著相关,而群体间分化系数与基因流与引物数量之间显著相关,而与其他遗传参数之间无显著相关。

表3 SRAP引物数量与主要遗传参数的相关性
注:表格内上面数字为相关系数,下面为显著性水平
2.4白桦遗传多样性引物数量的确定
在群体遗传多样性研究中,检测多态位点数越高越有利于分析和研究群体遗传多样性和遗传结构,因此对白桦种源不同样本数量与多态位点百分率进行拟合分析(图2),在95%的置信区间内,两者之间极显著线性回归,其决定系数为93.9%,表明两者之间存在较好的相关性。
我们在白桦遗传多样性研究时,可在综合考虑成本、技术难度等基础上,根据所需多态位点百分率大小,计算出所需样本的数量。如当白桦遗传多样性研究时,以最低所需多态位点百分率98.5%为标准,则每个种源所需引物数量为14、16对时,实际操作中可设为15对标记。
3结论
3.1SRAP引物数量对白桦种源遗传参数影响不同。其中,引物数量与白桦群体的有效等位基因数量、Nei’s基因多样性指数、Shannon’s信息多样性指数I、多态位点、多态位点百分率和群体基因多样性间呈极显著相关,而群体间分化系数与基因流与引物数量之间显著相关,而与其他遗传参数之间无显著相关。不同标记数量与存在显著差异的遗传参数之间均呈正相关,然而,除5个SARP标记数时,15个白桦种源内多态位百分率最低为草河口种源,而7个标记以上时,分析发现多态位百分率最低均为淖尔种源。
除此之外,不同标记数量反映出的白桦不同种源间各遗传参数的变化趋势基本相似,表明不同引物数量并不影响白桦各种源间遗传参数的变化趋势。
3.2SRAP不同引物数量对白桦15个种源间进化关系的分析结果有较大影响。当引物数量分别为5和7时,反映出的遗传距离最小与最大的种源均不同,当引物数量为9和11对时,反映出的遗传距离最小种源不同,但遗传距离最大的2个种源相同,均为凉水和草河口;引物数量超过13对时,种源间遗传距离最小与最大的2对种源分别为莫尔道嘎和桓仁、凉水和草河口。而且,随着SRAP引物数量增加,在遗传距离为0.11处,分别可将15个种源聚类成3、4、4、5、6、5和5个类别,表明随着引物数量的增加,区分不同种源间遗传差异的能力总体上也随之提高。
3.3SRAP引物数量与其多态位点百分率呈线性相关,且决定系数达93.9%。并以此为公式计算出开展白桦遗传多样性研究时,如设定要探测到的多态位点百分率达98.5%以上时,白桦遗传多样性研究中SRAP引物数量设定为15个。
参考文献:
[1] 顾万春,李文英.我国林木种质资源共享现状及建议[J].世界林业研究,2007,20:66-69
[2] 杨书文,杨传平,王秋玉,等.东北内蒙主要用材树种的种源选择[J].东北林业大学学报,1993(4):1-7
[3] 沈熙环.林木育种成果亟待巩固发展[J].中国林业,2002(6):29-30
[4] J.Buiteveld et al.Genetic diversity and differentiation in European beech (Fagus sylvatica L.) stands varying in management history[J].Forest Ecology and Management,2007,247: 98-106
[5] 罗建勋,顾万春,陈少瑜.云杉天然群体遗传多样性的等位酶变异[J].植物生态学报,2006(1):165-173
[6] 张春晓,李悦,沈熙环.林木同工酶遗传多样性研究进展[J].北京林业大学学报,1998(3):61-69
[7] A Roy, A Bandyopadhyay, A K Mahapatra, et al. Evaluation of genetic diversity in jute (Corc-horus species) using STMS, ISSR and RAPD markers[J]. Plant Breeding, 2006, 125(3): 292- 297.
[8] 王云生,黄宏文,王瑛.植物分子群体遗传学研究动态[J].遗传,2007(10):1191-1198
[9] Navinder Sainil, Neelu Jainl, Sunita Jain, et a1. Assessment of genetic diversity within and among Basmati and non-Basmati rice varieties using AFLP, ISSR and SSR markers[J].Euphytica, 2004,140(1):133-146
[10] Norma Julio, Ana Sobral, Juan Rondan Duen, et a1. RAPD and ISSR markers indicate diminished gene flow due to recent fragmentation of Polylepis australis woodlands in central Arge-ntina[J]. Biochemical Systematics and Ecology,2008,36(5-6),329-335
[11] Reyazul R, Mir.Sachin Rustgi, Shailendra Sharma,et a1.A preliminary genetic analysis of fibre traits and the use of new genomic SSRs for genetic diversity in jute[J]. Euphytica, 2008,161(3):413-427
[12] 魏志刚,杨传平,张力杰,等. 一种白桦叶片基因组DNA提取方法[P].黑龙江:CN103013985A,2013-04-03
[13] 杨传平,潘华,魏志刚.白桦ISSR~PCR反应体系的优化[J].东北林业大报,2003,3(6):1-3
[14] 连莲.白桦ISSR、AFLP遗传图谱构建[D].哈尔滨:东北林业大学,2008:26
[15] Lie G F. Quiros Sequence-related amplified polymorphism(SRAP), a new marker system base on a simple PCR reaction:its application to mapping and gene tagging in Brassiea[J]. Theoretical and Applied Genetics, 2001,103(8):455-461
[16] 李雪峰.兴安落叶松种群、无性系遗传多样性的研究[D].哈尔滨:东北林业大学,2009:22-23
Effects of Number of Labeling Primers on Genetic Diversity ofBetulaplatyphylla
Zhao Shuangjing, Liu Yingying, Wei Minjing, Yang Chuanping, Wei Zhigang
〔State Key Laboratory of Forest Genetics and Breeding (Northeast Forestry University), Harbin 150040,China〕
AbstractTaking 300 samples from 15 provenance in experimental forest farm for Betula platyphylla in Maoershan Experimental Forest Farm as experimental materials,the effects of different number of SRAP on primers genetic diversity of Betula platyphylla were analyzed. The formula for labeling primers was proposed. Result shows that the number of SRAP primer does not affect the trends for genetic parameters among provenances of Betula platyphylla. The ability of distinguishing genetic differences among different provenances increase with the increase of the number for labeling primers. While SRAP primer number being 15 pairs,polymorphic percentage which can be detected reach above 98.5%.
Key wordsBetula platyphylla;number of labeling primers;genetic diversity
中图分类号:S792.153
文献标识码:A
doi:10.13601/j.issn.1005-5215.2016.04.002
作者简介:赵双菁,硕士,Email:zshuangjing2006@163.com通讯作者:魏志刚,教授,博士,Email:zhigangwei1973@163.com
基金项目:863课题白桦、桉树等分子育种与品质创制(2011AA100202)
收稿日期:2016-03-21
文章编号:1005-5215(2016)04-0006-05

