铝胁迫下胡枝子根尖胼胝质形成规律及影响因素
孙清斌,沈仁芳,尹春芹,赵学强中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京 0008湖北理工学院环境科学与工程学院,黄石 435003
铝胁迫下胡枝子根尖胼胝质形成规律及影响因素
孙清斌1,2,沈仁芳1,*,尹春芹2,赵学强1
1中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京210008
2湖北理工学院环境科学与工程学院,黄石435003
摘要:采用水培试验,研究了铝胁迫下两个胡枝子品种根尖产生胼胝质的变化规律及影响因素。结果表明,两个品种的根尖铝吸收量与胼胝质形成量呈正比例关系。品种间差异主要是在根尖0—0.5 cm处。敏感品种胼胝质形成量同铝吸收量的变化趋势相一致,而耐性品种则在铝处理6 h时出现一个高峰值后下降。去除铝胁迫后,耐性品种胼胝质形成量并不显著减少。与单独铝处理相比,阴离子通道抑制剂苯甲酰甲醛加铝处理对两个品种胼胝质形成无影响;尼氟灭酸加铝处理抑制敏感品种胼胝质的形成,对耐性品种无影响;蒽-9-羧酸加铝处理显著抑制两个品种的胼胝质形成。另外,抑制剂2-去氧-D-葡萄糖加铝共同处理与单独铝处理相比,敏感品种的胼胝质形成量显著降低,耐性品种无影响。甘露醇对两个品种胼胝质形成的影响无显著差别。镧处理下胼胝质的形成量是耐性品种显著高于敏感品种,铝、镧同时处理胼胝质的形成量最高。敏感品种胼胝质形成处理间无差别。总之,耐性品种在铝胁迫下胼胝质形成与有机酸分泌可能存在一定的协调关系;铝胁迫下胼胝质形成是敏感指标;在一定条件下,特别是有机酸分泌前胼胝质的形成可能具有一定抗性意义;铝诱导胼胝质的形成受多种外界因素(浓度、时间、有机酸分泌,渗透压等)的影响。
关键词:胡枝子;铝胁迫;胼胝质;有机酸
孙清斌,沈仁芳,尹春芹,赵学强.铝胁迫下胡枝子根尖胼胝质形成规律及影响因素.生态学报,2016,36(4):1073-1082.
Sun Q B,Shen R F,Yin C Q,Zhao X Q.Analysis of variations in and factors affecting callose formation in response to al stress in Lespedeza Root Tips.Acta Ecologica Sinica,2016,36(4):1073-1082.
酸性土壤中铝毒害是限制作物生长和产量的最主要影响因子之一[1]。到目前为止,铝胁迫下对质外体和共质体所造成的毒害被认为是澄清铝毒害机制中至关重要的环节[2]。尽管共质体的作用不容忽视,但质外体的保护作用却是植物具备耐铝性的前提条件[1]。这是因为尽管质外体在地上器官和根皮层的组织体积中仅占5%或更少[3],但其结构和运输特性决定了其在水分、养分和生长物质(激素)运输上起着重要作用[4]。多位专家认为,植物的质外体具备调控植物铝毒害的能力[5-7]。因此,研究铝胁迫下质外体反应,探索其与铝胁迫之间的关系有着一定的理论意义。
铝毒害下植物最快的反应之一是胼胝质迅速在质外体部位合成和沉淀,这一生理反应可以在数分钟内检测到[2,8]。高等植物原生质膜上包含葡聚糖合酶,用于纤维素和胼胝质的合成[9],其中纤维素合酶和胼胝质合酶复合体构成了原生质膜上的第二大蛋白家族,这一聚合体存在于原生质膜的外表面,致力于调控纤维素和胼胝质的合成[10]。植物在遇到机械伤害、生理逆境或病菌感染时胼胝质合酶会大量合成胼胝质[11-13]。近年来,研究发现拟南芥胼胝质合酶(GSL)家族包含12个成员(GSL1-GSL12)[14],根据其在植物体内的功能可分两组[15]:较大组(包括GSL1,GSL2,GSL6,GSL8,GSL10)的作用是在花粉形成和细胞分裂过程中合成胼胝质;较小组(包括GSL5,GSL7,GSL12)的作用是逆境条件下形成胼胝质,以加强细胞结构的抗逆性,其中GSL5对于胼胝质形成起至关重要的作用[16];其它基因片段功能尚不清楚。另外,这些基因片段具体的生物反应过程和定位至今尚未鉴定出来。到目前为止,支持植物合成胼胝质起到调节作用的直接有力证据主要集中在花粉壁形成[15]和病害诱导[13,17]胼胝质形成方面。而对于除拟南芥之外植物以及其它生物逆境条件下胼胝质产生的生物化学机制、与信号传导之间的关系等研究尚且不足。
另一方面,铝胁迫诱导胼胝质合成是植物铝敏感性指标,可作为区分不同植物或品种间耐铝性差别的可靠参数[18-22]。同时,胼胝质形成可能在调节铝毒害上有一定的积极意义。铝胁迫下高等植物胼胝质的聚集被认为是阻碍或减少铝进一步贯穿质外体的屏障[23]。Sivaguru等证明,铝胁迫下在胞间连丝上形成胼胝质可以有效地阻碍细胞间物质转运和信息传递,从而最大可能地降低铝胁迫造成的影响[24]。Eticha等也认为,铝诱导胼胝质形成量提高是不同玉米品种更好地适应酸性土壤上生长的一种有效方式,纤维素和胼胝质空间结构上的差异可能是调节它们功能的关键所在[21]。Buchanan等指出,不同于纤维素(1,4-β-D-葡聚糖)彼此之间平行排列的结构,胼胝质(1,3-β-D-葡聚糖)可以形成二级或三级螺旋的空间结构[10]。然而铝胁迫下诱导胼胝质形成是否具有抗性意义至今尚无明确定论。
胡枝子作为酸性土壤上的先锋植物,其耐铝能力毋庸置疑。目前已知其耐性品种主要通过分泌有机酸、高效利用磷以应对铝胁迫[25-26]。鉴于胼胝质形成是植物受到铝胁迫后最为迅速的反应之一,其形成也是植物对铝胁迫产生抗性反应的先端。同时,细胞壁组分变化可能是对铝毒害的一种适应机制,那么胡枝子在铝胁迫下诱导胼胝质形成和有机酸分泌之间是否存在对应关系、胼胝质形成是否可能具有一定的抗性作用、具体形成的受控因素,这些内容的研究对于了解铝胁迫下胡枝子响应机制都是十分必要的。因此,本研究选取耐铝性存在显著差异的两个胡枝子品种作为研究对象,探索铝调控处理下,浓度、时间以及外加试剂(阴离子通道抑制剂、DDG、甘露醇等)对胼胝质形成的作用机制,初步明确胼胝质的形成变化规律,分析其在胡枝子耐铝方面的生理作用以及与有机酸分泌之间的关系,为进一步开展铝胁迫下,植物反应和伤害机理提供一定理论参考依据。
1 材料与方法
1.1植物材料和生长条件
二色胡枝子和截叶胡枝子的种子预处理和催芽方法参见[27]。当幼芽长至2—3 cm时,移至盛有0.5 mmol/L CaCl2(pH 4.5)溶液的盆子中培养5—7 d后,两个胡枝子品种都分别选取较为一致的幼苗进行铝处理。所有试验在光照培养室中进行,温度为(25±2)℃,相对湿度为(65±5)%,光强为300 μmol光子m-2s-1,昼夜循环为光14 h/黑暗10 h。
1.2试验设计
1.2.1不同浓度铝处理下对胼胝质形成的影响
试验共设4个铝处理浓度(pH 4.5),分别为:含0、50、100和200 μmol/L AlCl3的0.5 mmol/L CaCl2溶液。幼苗经不同浓度铝处理24 h后,分别切取根尖(0—1.0 cm)10条待测。前期对铝胁迫下两个胡枝子品种相对根伸长、根尖铝含量进行了测定并已发表[26,28],此处仅测定根尖胼胝质含量。
1.2.2铝处理下不同根段胼胝质的变化
幼苗用含50 μmol/L AlCl3的0.5 mmol/L CaCl2溶液(pH 4.5)处理24 h后,切取0—0.5,0.5—1.0,1.0—1.5,1.5—2.0 cm长的根段各20条。分别测定根段内铝含量和胼胝质含量。
1.2.3胼胝质形成随时间的动态变化
用0.5 mmol/L CaCl2溶液配制成50 μmol/L铝处理溶液(pH 4.5),分别处理幼苗1、2、3、6、9、12、18、24 h后,切取根尖(0—1.0 cm)各20条待测。铝处理24 h后,改用不含铝的0.5 mmol/L CaCl2(pH 4.5)溶液继续处理,不同时间点每个处理共切取3次。测定项目包括胼胝质含量和根尖铝含量。
1.2.4不同阴离子通道抑制剂对胼胝质形成的影响
为了研究铝胁迫下不同阴离子通道抑制剂对胼胝质形成的影响。幼苗用含0或50 μmol/L AlCl3的0.5 mmol/L CaCl2溶液处理,试验设加或不加10 μmol/L阴离子通道抑制剂[尼氟灭酸(niflumic acid,NIF)、苯甲酰甲醛(phenylglyoxal,PG)和蒽-9-羧酸(anthracene-9-carboxylic acid,A-9-C)]的不同处理。处理24 h后切取根尖(0—1.0 cm)10条,测定胼胝质含量。
1.2.52-去氧-D-葡萄糖(DDG)和甘露醇(Mannitol,简写为Man.)对胼胝质形成的影响
幼苗先用100 μmol/L DDG处理1 h,冲洗干净,再用含0或50 μmol/L AlCl3的0.5 mmol/L CaCl2溶液(pH 4.5)处理24 h。50 mmol/L Man.则是直接和含0或50 μmol/L AlCl3的0.5 mmol/L CaCl2溶液(pH 4.5)混合后处理24 h。各处理结束后,切取根尖(0—1.0 cm)10条,测定胼胝质含量。
1.2.6La对胼胝质形成影响
为了验证胼胝质形成是否为铝胁迫下的专性反应,幼苗分别用含0、50 μmol/L AlCl3、50 μmol/L LaCl3和50 μmol/L AlCl3+LaCl3的0.5 mmol/L CaCl2溶液(pH 4.5)处理24 h。然后切取根尖(0—1.0 cm)10条,测定胼胝质含量。
1.3测定项目与方法
1.3.1根尖Al含量测定
Al处理24 h后切取根尖(0—1.0 cm),进行根尖总Al含量测定,测定方法参见[28]。每个处理重复3次。
1.3.2胼胝质含量测定
胼胝质含量测定方法参考Kohle等[29],具体过程参见孙清斌等[27]。每个处理重复3次。
2 结果与分析
2.1两个品种的相对根伸长率、根尖铝含量和胼胝质的形成
前期实验表明,随铝处理浓度增加,两个胡枝子品种的相对根伸长率均呈下降趋势,根尖铝含量则呈上升趋势[26,28]。与之相对应,根尖胼胝质形成的量也是表现出较为明显的增加趋势(图1)。说明植物吸收的铝越多,根伸长受到抑制程度越大,根尖所形成的胼胝质也增多。另外,不同浓度铝处理下相对根伸长率都是二色胡枝子(耐性品种)高于截叶胡枝子(敏感品种),根尖铝含量则是耐性品种显著小于敏感品种[26,28],而胼胝质形成量也有同样的规律(图1),说明胼胝质形成量与根尖铝含量相对应。

图1 铝处理对胡枝子根尖胼胝质含量的影响Fig.1Effect of Al on callose content in root apices of Lespedeza plants,L.bicolor and L.cuneataSignificant differences between mean values are indicated by different letters at the P<0.05 level(Tukey test);Data are means±SD
2.2不同根段胼胝质形成和根尖铝含量变化
图2是铝处理下两个品种不同根段胼胝质形成量和根尖铝含量的结果。由图可知,不同根段胼胝质的形成量与根尖铝含量是正相关的;敏感品种根尖铝和胼胝质的含量是0—0.5 cm段显著高于其它根段,耐性品种也有较明显的降低趋势,说明此段是铝作用的主要部位;对比品种间差别,发现根段0.5—2.0 cm内品种间无显著差别,差别主要在于0—0.5 cm处,说明品种间耐铝的差别主?要体现在根尖0—0.5 cm处,其它部位差别不大。

图2 不同根段下胼胝质形成和根尖铝分布规律Fig.2Callose content and Al content in apical root segments of two Lespedeza speciesSignificant differences between mean values are indicated by different letters at the P<0.05 level(Tukey test);Error bars represent±SD(n=3)
2.3根尖铝含量和胼胝质形成动态变化
为了探索胼胝质形成随时间的动态变化规律,做了50 μmol/L铝处理24 h内和之后12 h不加铝处理下,两个品种根尖铝含量和胼胝质形成的变化规律(图3)。结果表明,50 μmol/L铝处理下,随时间变化两个品种根尖铝含量都是逐渐增加的,但前12 h内,品种间无统计上的差异,之后敏感品种显著高于耐性品种(图3)。说明两个品种对铝的吸附或吸收能力存在一定的差异。铝处理24 h后再用0.5 mmol/L CaCl2处理,发现随时间推移,两个品种根尖铝含量都在逐渐降低,耐性品种缓慢下降,敏感品种则是迅速下降后保持不变(图3)。说明仍有相当一部分铝依然牢固的吸附于根部组织上。与之相对应胼胝质的形成变化规律是:铝胁迫下,敏感品种胼胝质形成同铝吸收趋势比较吻合,耐性品种则在铝处理6 h时出现一个峰值随后下降。鉴于以往结果,铝胁迫下敏感品种不分泌任何有机酸,耐性品种大量分泌柠檬酸和苹果酸,铝处理3 h后开始分泌,9 h时达最大值[25],说明胼胝质的形成可能与有机酸的分泌存在一定的协调关系。24 h后去除铝胁迫耐性品种胼胝质的形成量并不显著减少(图3),则印证了仍有相当一部分铝存在于细胞壁上的结果,从而使得根尖继续产生胼胝质。
2.4阴离子通道抑制剂对胼胝质形成的影响
铝胁迫下有机酸是通过阴离子通道分泌出来,因此我们也探索了铝与阴离子通道抑制剂胁迫下胼胝质的形成状况。结果显示,铝与阴离子通道抑制剂同时作用下,诱导胼胝质形成的影响与仅用铝胁迫相比存在差别(图4),说明存在于原生质膜上的阴离子通道可能参与了胼胝质的形成。同单独加铝处理相比PG+Al处理对两个品种胼胝质形成的无影响;NIF+Al处理抑制敏感品种胼胝质的形成,对耐性无影响;A-9-C+Al处理显著抑制两个品种胼胝质的形成。说明不同阴离子通道抑制剂对有机酸分泌的抑制机制存在差别,从而直接影响胼胝质的形成。

图4 不同阴离子通道抑制剂处理下胡枝子根尖胼胝质含量Fig.4Effects of anion-hannel inhibitors on callose content in the root apices of two Lespedeza speciesSignificant differences between mean values are indicated by different letters at the P<0.05 level(Tukey test);Error bars represent±SD (n=3)
2.5DDG与甘露醇对两个胡枝子品种胼胝质形成的影响
DDG被认为是胼胝质合成酶的抑制剂,用DDG处理之后,胼胝质的形成应该减少。本试验结果显示,DDG+Al处理与单独铝处理相比,敏感品种的胼胝质形成量显著降低,耐性品种尽管也有降低趋势,但无统计差别(图5)。说明在外加干扰剂(DDG)作用下,面对逆境耐性品种表现出较强的稳定性。另外,甘露醇是一种维持渗透压平衡的化学试剂。有研究表明,铝胁迫可改变细胞的渗透压[4]。结果显示,它对两个品种胼胝质形成的影响无显著差别(图5)。对比品种间差别发现,两种试剂(DDG和甘露醇)加铝对耐性品种胼胝质形成的影响同单独加铝处理无差异,说明面对铝胁迫所造成的逆境,耐性品种表现出的稳定性强于敏感品种。

图3 不同铝处理下胡枝子根尖铝含量和胼胝质含量动态变化Fig.3Kinetic course of Al content and callose content in apical root segments of two Lespedeza species Error bars represent±SD(n=3)
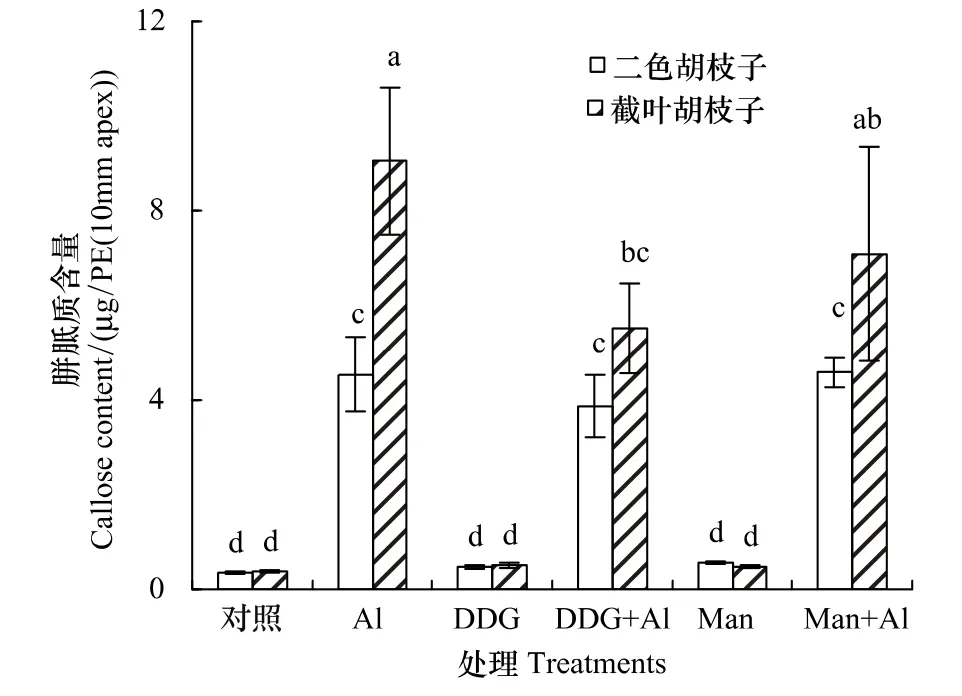
图5 DDG与甘露醇对胡枝子根尖胼胝质含量的影响(DDG:2-去氧-D-葡萄糖;Man:甘露醇)Fig.5 Effects of Al(50 μmol/L),DDG(100μmol/L)and mannitol(50 mmol/L)application on callose content in the root apice of two Lespedeza speciesSignificant differences between mean values are indicated by different letters at the P<0.05 level(Tukey test);Error bars represent±SD(n =3)
2.6镧对胼胝质形成影响
镧通常被用来鉴定某些生理反应是否为铝胁迫下的专性反应,如镧可阻塞Ca2+通道,抑制有机酸释放,从而被认为铝胁迫下的专性反应[25]。本试验结果显示,镧单独处理也能大量诱导胼胝质的形成(图6),说明植物合成胼胝质并非铝胁迫下的专性反应;诱导胼胝质形成过程中除了Ca2+信号通道参与之外,还应该可能有其他信号传导物质参与其中。另外,单独镧处理下胼胝质的形成是耐性品种显著高于敏感品种,Al+La处理更是显著高于其它处理,说明在铝毒害下镧抑制有机酸释放时,镧、铝同时处理,其毒害效应有叠加趋势。结合敏感品种各处理结果,除单独加铝处理之外,相比耐性品种+La处理(单独或混合)胼胝质形成均显著降低,说明胼胝质的形成可能有一定的抗性意义。

图6 铝、镧对胡枝子根尖胼胝质含量的影响Fig.6Effects of Al and La treatments on callose content in the root apex of two Lespedeza speciesSignificant differences between mean values are indicated by different letters at the P<0.05 level(Tukey test);Error bars represent±SD (n=3)
3 讨论
3.1铝胁迫下胼胝质形成和有机酸分泌的关系
铝胁迫下不同植物都会有相应的应对机制。耐铝机制以外排为主的植物中,分泌有机酸是其最主要的途径之一。根据铝胁迫与有机酸分泌的响应时间差,有机酸分泌分两种模式,Ⅰ类模式:植物可迅速对铝胁迫做出反应,在数十分钟内即可大量释放出有机酸;Ⅱ类模式:植物存在明显的滞后效应,一般需数小时后才有明显的有机酸分泌[30]。本课题组以往研究表明,耐性胡枝子品种铝处理3 h后才开始分泌有机酸,9 h达到最大值[25],存在明显的滞后效应,其分泌模式应属于II类模式。通常认为,Ⅰ类有机酸分泌模式可能与质膜阴离子通道被激活有关,Ⅱ类分泌模式则可能与耐性基因的诱导有关[31]。杨建立进一步认为,诱导的基因可能与有机酸的代谢,细胞膜或液泡膜上离子通道的开闭,线粒体膜上的有机酸的运输等过程相关联[32]。因此,铝胁迫下胡枝子分泌有机酸过程应该与基因诱导有关,其分泌过程也是较为复杂的。
通过分析两个品种根尖胼胝质形成的动态结果发现:耐性品种根尖铝吸收同胼胝质形成之间具有非同步性,铝胁迫下6 h时胼胝质形成出现一个峰值(图3),此时恰处于有机酸分泌量逐渐增加过程。二者结合起来分析,可推断为由于有机酸的分泌,降低了铝毒害效应,从而可能减少了胼胝质的形成。将铝胁迫下阴离子通道抑制剂对胡枝子有机酸分泌[25]和胼胝质形成(图4)的结果结合起来分析发现,PG对有机酸分泌无影响,也不影响Al胁迫下胼胝质的形成;NIF可以刺激柠檬酸分泌(达7倍之多),对苹果酸无影响(但有机酸分泌总量增加),从而减少胼胝质形成(敏感差异显著,耐性差异有降低趋势);A-9-C在完全抑制有机酸分泌的同时也显著抑制了胼胝质形成。PG与NIF对两者间的作用结果比较容易理解,A-9-C的结果可解释为由于对植物伤害较大,直接破坏了细胞的正常调节作用[25]。因此,铝胁迫下诱导有机酸释放和胼胝质形成之间可能有着共同的调控因子。
另外,胼胝质形成的专性鉴定结果也进一步说明了胼胝质形成过程可能受到有机酸释放的影响。镧作为一种金属阳离子,通常被认为是Ca通道抑制剂,在微摩尔浓度下也会限制植物根系生长[33]。单独La处理耐性胡枝子品种不分泌任何有机酸(柠檬酸和苹果酸)[25],但胼胝质形成量高于敏感品种,这就说明了无有机酸释放,耐性品种受到伤害时,形成的胼胝质更多。Al+La处理显著降低了耐性品种有机酸(苹果酸)释放[25],从而形成胼胝质的量高于敏感品种。此结果从另一方面也说明有机酸释放与胼胝质形成可能存在共同的调控机制。
因此,胼胝质形成和有机酸分泌可能存在相互协调的关系。关于胼胝质形成[34]和有机酸分泌[32]的生理调节过程都有相应报道。Ma等认为,铝胁迫下有机酸分泌的滞后现象与诱导基因表达和蛋白质合成有关[35]。杨建立推测:铝首先激活某些基因,然后这些基因编码有机酸载体和阴离子通道蛋白合成,由此开始有机酸的分泌[32]。信号传导是基因诱导的前提,Ca2+浓度的瞬间变化在植物信号传导系统中被认为占主导因素[36]。因此,诱导有机酸的分泌过程也可能有Ca2+的参与调节。现在认为胼胝质合成可能是由于铝毒害作用,引起膜内外电压发生变化,诱导膜的超极化,通过Ca通道形成一个瞬间Ca流[37],诱导细胞质内Ca2+浓度提高,使得蛋白酶激活胼胝质合成酶,增加胼胝质在细胞壁形成的量[38]。因而可以认为,两个生理反应过程可能同时是因为铝诱导细胞内[Ca2+]变化,一方面蛋白激酶激活,诱导胼胝质迅速合成,同时激活调控有机酸分泌的基因,一旦此过程完成,即刻开始大量分泌有机酸,相应的蛋白激酶进一步调控减少耐性品种胼胝质的形成。当然调控两个过程中某些步骤的蛋白也可能是由细胞核内又重新合成的。同时,镧处理阻塞Ca通道,抑制耐性胡枝子有机酸分泌[25],不影响其形成胼胝质(图6),表明逆境条件下原生质体内[Ca2+]变化与调控有机酸分泌生理过程关系更加密切,原生质体内[Ca2+]降低(波动)也可能是诱导胼胝质形成的另一信号因子。当然,其信号传导也可能不只是由于[Ca2+]简单变化引起的,还可能是由其它信号传导物质参与其中的(如IP3等)。另外,质膜上面也可能存在直接诱导蛋白激酶启动的膜受体[10]。此外,Bhuja等认为,胼胝质的形成并不是简单地由Ca2+的变化所引起的,应该还包含其它调节因素[2]。由此可见,由蛋白激酶和Ca2+参与的信号传导途径是一个极为复杂的网络,铝胁迫下细胞如何调控两个生理过程尚有待于进一步的实验证据支撑。
3.2胼胝质的形成仅仅是铝胁迫下的毒害指标
细胞壁作为植物与外界环境的第一道屏障,参与体内外一系列代谢活动,在抵抗逆境方面有着独特的作用。细胞壁是植物细胞区域划分中质外体的主要组成部分,铝存在具有改变质外体结构和功能的潜力[34]。铝胁迫下将会使得正常代谢的纤维素合成酶受阻,胼胝质合成酶启动,诱导胼胝质形成[34]。胡枝子的耐铝机制以外排为主[25],根尖所积聚的铝越少,则说明该品种耐铝性越强。前期实验结果与本文数据也印证了此观点,即耐性品种根尖铝含量[26]、胼胝质形成量都较低,且随铝浓度的增加,胼胝质形成量也随之增加(图1,图2)。这些数据表明,将胼胝质形成定义为铝胁迫下的毒害指标应该是正确的。
根尖通常被认为是铝作用的主要部位,有机酸也主要在这一段分泌[39-40]。本实验结果也同样支持该观点,不同品种根段只有根尖0—0.5 cm处存在显著差别(图2)。Zheng和Yang认为,根尖部细胞活性越强,铝所产生的毒害越强[41],那么毒害越强的部位是不是更加需要有相应的抵抗机制?因此,铝胁迫下胼胝质形成除了说明其是毒害指标之外,是否还具有抵抗铝毒害的作用?这似乎也是一个很让人产生兴趣的课题,本试验镧处理结果也直接支持这样的观点。镧也是一种毒害元素,也能诱导大量胼胝质形成。由于镧抑制耐性品种有机酸的释放,所形成胼胝质的量显著高于敏感品种相应的处理(图6),表明胼胝质形成可能也是面对胁迫环境的一种抗性反应。另外,铝处理下加入DDG,同敏感品种相比耐性品种依然表现出较强稳定性(胼胝质形成量不减)(图5)。结合上面3.1讨论内容,铝胁迫下有机酸分泌和胼胝质形成可能存在共同调节机制,有机酸分泌前期有大量胼胝质形成且耐性品种高于敏感品种的事实,也再次表明铝胁迫下胼胝质形成可能并不仅仅是简单的毒害指标。以往也有报道认为,铝胁迫下胼胝质的聚集被认为是对植物抵抗逆境胁迫有着积极的作用[21,23-24]。Hossain等指出,胼胝质合成的增加,诱导半纤维素合成的增加,从而提高细胞壁的刚性,达到抵抗逆境的作用,从而认为,合成半纤维素的前体物质主要是胼胝质[42]。同时,近年来有多篇文献报道了胼胝质在植物抵御病害方面有着重要意义[13-17]。尽管如此,对于胼胝质在抵抗铝胁迫作用方面的研究还是很欠缺的。Zheng和Yang认为,铝胁迫下胼胝质的形成是一种保护反应、还是一种简单的伤害作用、甚至是一种无害的反应都是尚无定论的[41]。因此,进一步深入研究以确定胼胝质的真正生理作用是很有必要的。
3.3铝胁迫下胼胝质形成的可能受控因素
由于铝毒害的产生实际上是一系列的伤害,植物对其抗性反应也是多重的。胼胝质形成被认为铝胁迫下是一个快速而又敏感的生理反应,数分钟内纤维素合成酶完全失活,胼胝质大量形成[12]。由于该反应经历时间极短,其形成应该是铝处理浓度的高低,持续时间的长短都会影响。本试验数据印证了胼胝质的形成受铝毒害浓度高低(图1)、时间长短(图3)的影响。另外,通过上面讨论La对胼胝质形成的影响发现胼胝质形成可能受控于信号传导物质[Ca2+]参与。结合阴离子通道抑制剂结果分析证明,胼胝质形成的调控过程可能也有阴离子通道的参与。以往对耐性品种分泌有机酸的研究表明,A-9-C抑制两种有机酸分泌[25]。本试验结果显示,A-9-C完全抑制有机酸分泌的同时也显著降低了胼胝质形成(图4),这A-9-C可能是对植物伤害较大,直接破坏了细胞的正常调节作用[25],从而说明胼胝质的形成可能受有机酸释放的调控。
除此之外,胼胝质形成也受到细胞膨压所调控。甘露醇预处理可以降低铝胁迫下的膨压,增加细胞间空隙,从而便于可溶性物质在质外体的运输[4]。本试验结果显示,甘露醇的加入有降低敏感品种胼胝质形成的趋势(图5)。因此,尽管甘露醇的加入并不一定能够缓解铝对共质体的毒害,但是由于其可以维持质外体正常空间结构,从而可以减少胼胝质的形成。由于胼胝质合成是由胼胝质合成酶来完成的,那么底物多少将直接决定胼胝质的合成量。DDG被认为是参与UDPG和GDPG的代谢过程,可以限制寡糖脂键的生物合成,从而限制蛋白糖基化,最终限制胼胝质的形成[43]。本试验结果也显示,DDG处理显著降低敏感品种胼胝质的合成(图6)。因此,DDG和甘露醇处理胼胝质的合成表观效果类似,但实际上并不一定降低铝产生的毒害,原因在于它们的作用机制确实有着本质上的差异。当然,除了上述几种因素之外,胼胝质的形成还可能受到其它多种因素的调节作用。
4 结论
耐性品种在铝胁迫下胼胝质形成与有机酸分泌可能存在一定的协调关系;胼胝质形成是植物铝胁迫下敏感指标;在一定条件下,特别是有机酸分泌前可能会发挥一定的抗性作用;铝诱导胼胝质的形成受多种外界因素(浓度、时间、有机酸分泌,渗透压平衡等)影响。
参考文献(References):
[1]Horst W J,Kollmeier M,Schmohl N,Sivaguru M,Wang Y,Felle H H,Hedrich R,Schröder W,StaA.Significance of the root apoplast for aluminium toxicity and resistance of maize//Sattelmacher B,Horst W J,eds.The Apoplast of Higher Plants:Compartment of Storage,Transport and Reactions.Heidelberg:Springer,2007:49-66.
[2]Bhuja P,McLachlan K,Stephens J,Taylor G.Accumulation of 1,3--D-glucans,in response to aluminum and cytosolic calcium in Triticum aestivum.Plant&Cell Physiology,2004,45(5):543-549.
[3]Grignon C,Sentenac H.pH and ionic conditions in the apoplast.Annual Review of Plant Physiology and Plant Molecular Biology,1991,42:103-128.
[4]Sivaguru M,Eticha D,Horst WJ,Matsumoto H.Aluminum inhibits apoplastic flow of high-molecular weight solutes in root apices of Zea mays L.Journal of Plant Nutrition and Soil Science,2006,169(5):679-690.
[5]Horst W J.The role of the apoplast in aluminium toxicity and resistance of higher plants:a review.Zeitschrift für Pflanzenernährung und Bodenkunde,1995,158(5):419-428.
[6]Kochian L V.Cellular mechanisms of aluminum toxicity and resistance in plants.Annual Review of Plant Physiology and Plant Molecular Biology,1995,46:237-260.
[7]Taylor G J.Overcoming barriers to understanding the cellular basis of aluminium resistance.Plant and Soil,1995,171(1):89-103.
[8]Wissemeier A H,Klotz F,Horst W J.Aluminium induced callose synthesis in roots of soybean(Glycine max L.).Journal of Plant Physiology,1987,129(5):487-492.
[9]Kudlicka K,Brown R M.Cellulose and callose biosynthesis in higher plants I.Solubilization and separation of(1→3)-and(1→4)-β-glucan synthase activities from mung bean.Plant Physiology,1997,115(2):643-656.
[10]Buchana B B,Gruissem W,Jones R L.Biochemistry&Molecular Biology of Plants.Rockville,MD:American Society of Plant Physiologists,2000.
[11]Delmer D P.Cellulose biosynthesis.Annual Review of Plant Physiology,1987,38:259-290.
[12]Nakashima J,Laosinchai W,Cui X J,Brown R M.New insight into the mechanism of cellulose and callose biosynthesis:proteases may regulate callose biosynthesis upon wounding.Cellulose,2003,10(4):369-389.
[13]Voigt C A.Callose-mediated resistance to pathogenic intruders in plant defense-related papillae.Frontier in Plant Science,2014,5(168):1-5.
[14]Chen X Y,Kim J Y.Callose synthesis in higher plants.Plant Signaling and Behavior,2009,4(6):489-492.
[15]Ellinger D,Voigt C A.Callose biosynthesis in arabidopsis with a focus on pathogen response:what we have learned within the last decade.Annals of Botany,2014,114(6):1349-1358.
[16]Maeda H,Song W,Sage T,Penna D D.Role of callose synthases in transfer cell wall development in tocopherol deficient Arabidopsis mutants.Frontier in Plant Science,2014,5(46):1-15.
[17]Ellinger D,Naumann M,Falter C,Zwikowics C,Jamrow T,Manisseri C,Somerville S C,Voigt C A.Elevated early callose deposition results in complete penetration resistance to powdery mildew in Arabidopsis.Plant Physiology,2013,161(3):1433-1444.
[18]Wissemeier A H,Diening A,Hergenroder A,Horst W J,Mix-Wagner G.Callose formation as parameter for assessing genotypical plant tolerance of aluminium and manganese.Plant and Soil,1992,146(1/2):67-75.
[19]Horst W J,Püschel A K,Schmohl N.Induction of callose formation is a sensitive marker for genotypic aluminium sensitivity in maize.Plant and Soil,1997,192(1):23-30.
[20]Massot N,Llugany M,Poschenrieder C,Barcelo J.Callose production as indicator of aluminum toxicity in bean cultivars.Journal of Plant Nutrition,1999,22(1):1-10.
[21]Eticha D,Thé C,Welcker C,Narro L,StaA,Horst W J.Aluminium-induced callose formation in root apices:Inheritance and selection trait for adaptation of tropical maize to acid soils.Field Crops Research,2005,93(2/3):252-263.
[22]Rangel A F,Mobin M,Rao I M,Horst W J.Proton toxicity interferes with the screening of common bean(Phaseolus.vulgaris L.)genotypes for aluminium resistance in nutrient solution.Journal of Plant Nutrition and Soil Science,2005,168(4):607-616.
[23]Marschner H.Mechanisms of adaptation of plants to acid soils.Plant and Soil,1991,134(1):1-20.
[24]Sivaguru M,Fujiwara T,Šamaj J,Baluška F,Yang Z M,Osawa H,Maeda T,Mori T,Volkmann D,Matsumoto H.Aluminum induced 1,3→β-D-glucan inhibits cell-to-cell trafficking of molecules through plasmodesmata.A new mechanism of aluminum toxicity in plants.Plant Physiology,2000,124(3):991-1005.
[25]Dong X Y,Shen R F,Chen R F,Zhu Z L,Ma J F.Secretion of malate and citrate from roots is related to high Al-resistance in Lespedeza bicolor.Plant and Soil,2008,306(1-2):139-147.
[26]Sun Q B,Shen R F,Zhao X Q,Chen R F.Phosphorus enhances Al resistance in Al-resistant Lespedeza bicolor but not in Al-sensitive L.cuneata under relatively high Al stress.Annals of Botany,2008,102(5):795-804.
[27]孙清斌,沈仁芳,赵学强.不同参数评价植物耐铝性的研究.植物营养与肥料学报,2008,14(5):1017-1022.
[28]孙清斌,沈仁芳,赵学强.显微技术在植物Al毒研究中的应用.土壤学报,2009,46(6):1026-1032.
[29]Köhle H,JeblickW,Poten F,Blaschek W,Kauss H.Chitosan-elicited callose synthesis in soybean cells as a Ca2+-dependent process.Plant Physiology,1985,77(3):544-551.
[30]Ma J F.Role of organic acids in detoxification of aluminum in higher plants.Plant&Cell Physiology,2000,44(4):383-390.
[31]沈仁芳.铝在土壤-植物中的行为及植物的适应机制.北京:科学出版社.2008.
[32]杨建立.植物耐铝的分子生理机理[D].杭州:浙江大学,2007.
[33]Ryan P R,DiTomaso J M,Kochian L V.Aluminium toxicity in roots:an investigation of spatial sensitivity and the role of the root cap.Journal of Experimental Botany,1993,44(2):437-446.
[34]孙清斌,沈仁芳,尹春芹,赵学强.铝毒胁迫下植物的响应机制.土壤,2008,40(5):691-697.
[35]Ma J F,Ryan P R,Delhaize E.Aluminium tolerance in plants and the complexing role of organic acids.Trends in Plant Science,2001,6(1): 273-278.
[36]Sivaguru M,Pike S,Gassmann W,Baskin T I.Aluminum rapidly depolymerizes cortical microtubules and depolarizes the plasma membrane: evidence that these responses are mediated by a glutamate receptor.Plant&Cell Physiology,2003,44(7):667-675.
[37]Rengel Z,Zhang W H.Role of dynamics of intracellular calcium in aluminium-toxicity syndrome.New Phytologist,2003,159(2):295-314.
[38]Fox T C,Guerinot M L.Molecular biology of cation transport in plants.Annual Review of Plant Physiology and Plant Molecular Biology,1998,49: 669-696.
[39]Delhaize E,Ryan P R.Aluminum toxicity and tolerance in plants.Plant Physiology,1995,107(2):315-321.
[40]Sivaguru M,Horst W J.The distal part of the transition zone is the most aluminum-sensitive apical root zone of maize.Plant Physiology,1998,116 (1):155-163.
[41]Zheng S J,Yang J L.Target sites of aluminum phytotoxicity.Biologia Plantarum,2005,49(3):321-331.
[42]Hossain A K M Z.Hossain M A,Asgar M A,Tosaki T,Koyama H,Hara T.Changes in cell wall polysaccharides and hydroxycinnamates in wheat roots by aluminum stress at higher calcium supply.Journal of Plant Nutrition,2006,29(4):601-613.
[43]Datema R,Schwarz R T,Rivas L A,Lezica R P.Inhibition of β-1,4-glucan biosynthesis by deoxyglucose.Plant Physiology,1983,71(1): 76-81.
Analysis of variations in and factors affecting callose formation in response to al stress in Lespedeza Root Tips
SUN Qingbin1,2,SHEN Renfang1,*,YIN Chunqin2,ZHAO Xueqiang1
1 State Key Laboratory of Soil and Sustainable Agriculture,Institute of Soil Science,Chinese Academy of Sciences,Nanjing 210008,China
2 College of Environmental Science and Engineering,Hubei Institute of Technology,Huangshi 435003,China
Abstract:Lespedeza speices can grow very well in infertile acidic soils as native pioneer plants.The reasons why such plants are well adapted to these soils might be due to a combination of mechanisms.Al toxicity is the primary factor limiting plant growth in acidic soils.Our previous results indicated that secretion of malate and citrate from roots was related to the high Al-resistance of Lespedeza.The objective of this study was to investigate the formation of callose under Al stress and its regulating factors in two Lespedeza species with different Al resistance,and attempted to explore the relative role of callose formation and organic acid exudation in Al toxicity or resistance of Lespedeza.The results showed that increased Al uptake was associated with increased callose formation in both Lespedeza species.The differences in Al tolerance between the two species were mainly expressed at the root apical 0—0.5 cm.Moreover,the callose formation was similar to root Al uptake for Al-sensitive species,but not for Al-tolerant species,of which callose formation peaked at 6 h of Al treatment and thenbook=1074,ebook=186decreased.Callose formation of the tolerant species was not obviously reduced following removal of Al from the culture.Furthermore,no obvious differences in callose formation were observed under treatment with PG(phenylglyoxal,anionchannel inhibitor)plus Al as compared to Al treatment alone in both species.NIF(niflumic acid,anion-channel inhibitor) plus Al treatment inhibited callose formation in the Al-sensitive species,but not in the Al-tolerant species.Callose formation was inhibited by A-9-C(9-anthracene carboxylic acid,anion-channel inhibitor)plus Al treatment in both species.Compared with Al treatment alone,DDG plus Al treatment caused a significant reduction in callose formation in the Alsensitive species but not in the Al-tolerant species.No differences in callose formation were observed for both species following mannitol treatment.Callose formation in response to La treatment was significantly higher in the Al-tolerant species than in the Al-sensitive species and was still higher following treatment with both Al and La.However,no differences in callose formation in Al-sensitive species were detected among treatments.In summary,callose synthesis may be regulated in conjunction with organic acid exudation.Callose formation may be a sensitive indicator of Al stress and may also function in Al tolerance before organic acids are secreted from roots.Finally,callose formation may be dependent on many factors,including Al concentration,treatment time,organic acid exudation,and osmotic pressure.Further studies are required to examine these additional factors to determine the complex mechanisms mediating callose formation.
Key Words:Lespedeza;Al stress;callose;organic acids
*通讯作者
Corresponding author.E-mail:rfshen@issas.ac.cn
收稿日期:2014-06-09;网络出版日期:2015-07-09
基金项目:土壤与农业可持续发展国家重点实验室开放基金课题(0812201225);湖北省自然基金面上项目(2014CFC1089);湖北省矿区环境污染控制与修复重点实验室开放基金(2013104);湖北理工学院引进人才项目(10yjz04R);国家重点基础研究发展计划项目(973项目) (2014CB441000)
DOI:10.5846/stxb201406091185

