烟草疫霉菌游动孢子接种剑麻方法研究
赵艳龙,詹儒林,张燕梅,何衍彪,常金梅,柳凤,杨玉梅,周文钊(中国热带农业科学院南亚热带作物研究所,广东湛江524091)
烟草疫霉菌游动孢子接种剑麻方法研究
赵艳龙,詹儒林,张燕梅,何衍彪,常金梅,柳凤,杨玉梅,周文钊*
(中国热带农业科学院南亚热带作物研究所,广东湛江524091)
摘要:为更准确鉴定剑麻对斑马纹病的抗病性,以不同的培养方法对剑麻斑马纹病病原菌-烟草疫霉菌产孢的效果进行了比较,并研究了游动孢子接种剑麻斑马纹病的方法。试验结果表明:菌丝块-水培法产生孢子囊及游动孢子,速度最快,数量最多,且方法简单,是最佳的培养方法;刺伤-棉花保湿法接种剑麻叶片,操作简单方便,接种成功率高,是利用游动孢子接种剑麻斑马纹病的最好方法。
关键词:烟草疫霉菌;游动孢子;接种;剑麻
剑麻斑马纹病是上世纪70年代开始在我国剑麻园发现,给剑麻生产造成严重损失[1],其病原菌主要是烟草疫霉菌( Phytophthora nicotianae van Breda de Haan),该菌通过产生厚垣孢子及卵孢子,可以土壤中存活多年,因此,斑马纹病一直以来都是影响剑麻生产最严重的病害之一[2-4]。目前剑麻品种的斑马纹病抗性鉴定常采用菌块接种[5],该方法操作虽然比较简单,但准确性不够高。游动孢子可以测定浓度,因而利用游动孢子接种,可明显提高抗病性鉴定的精确性,本文对烟草疫霉菌游动孢子的产生和接种方法进行了系统的研究,为剑麻抗病性及生理小种精准鉴定提供依据。
1 材料与方法
1.1材料
1.1.1供试菌种
2014年9月从广东湛江农垦东方红农场农科所剑麻园里采集剑麻斑马纹病典型病斑的叶片,分离的病原菌经柯赫氏法则证实并经鉴定为烟草疫霉菌后,纯化并保存。该菌种编号为DFHJB1 -2014。
1.1.2培养基制备
10% V8培养基: 10 mL V8汁加去离子水90 mL,CaCO30.02 g,琼脂2 g。
1.1.3培养液制备
①土壤浸出液:取肥沃菜园表土500 g,加入去离子水500 mL,充分搅匀后静置数小时。土壤上清液用普通滤纸过滤后,再经孔径0.22 μm的滤膜过滤2次除菌。置于4℃冰箱中保存备用;
②土壤溶液:取肥沃菜园土50 g加自来水200 mL,搅拌均匀,静置数小时。上清液用普通滤纸过滤,滤过液即为土壤溶液;
③10% V8培养液: 100 mL V8汁加入CaCO31 g,在1500转/分下离心10分钟。上清液与去离子水按1: 9比例稀释;
④皮氏液配方: Ca( NO3)20.4 g,KH2PO40.15 g,Mg( NO3)20.15 g,CaCl20.06 g,蒸馏水1000 mL。在121℃高压蒸汽灭菌20分钟。
1.2试验方法
1.2.1产生游动孢子试验
将DFHJB1-2014接种于10% V8培养基平板,置于28℃半光照(即12 h光照和12 h黑暗交替)培养,4 d后用4 mm打孔器在菌丝边缘打下菌饼,参照郑小波[6]的方法,略作改动,分别按如下方法进行处理:
1)菌丝丛-水培法
将10% V8培养液倒入6 cm的培养皿中,每皿5 mL,取菌饼4块移入培养皿,在28℃、黑暗条件下培养1 d,倾去培养液,加入5 mL灭菌水重新悬浮菌丝丛,每皿滴加经过滤除菌的土壤浸出液3滴,置于28℃、黑暗条件下培养,24 h后换一次水并滴加土壤浸出液。
2)菌丝块-水培法
在直径为6 cm的培养皿中加入5 mL灭菌水,取菌饼4块置于灭菌水中,菌丝面朝上,让灭菌水刚刚淹过菌丝面。置日光灯下连续光照培养,培养温度28℃。
3)皮氏培养液法
将菌饼4块移入装有5 mL皮氏溶液的培养皿中,在28℃黑暗条件下培养3~4 d,倾去皮氏溶液,换上灭菌水,置于28℃培养。
4)菌丝块-土壤溶液法
在直径为6 cm的培养皿中加入5 mL土壤溶液,取菌饼4块置于土壤溶液中,菌丝面朝上,使土壤溶液刚刚漫过菌丝块。置光照下28℃培养。
以上各处理1 d、2 d、3 d和6 d后分别观察孢子囊和游动孢子的产生情况,每处理重复3次,每重复2个培养皿。孢子囊和游动孢子的观察测定分别按照陈方新[7]的方法,并使用血球计数板对游动孢子进行计数。
1.2.2接种方法试验
1.2.2.1接种材料准备
以盆栽法培育剑麻苗至20片叶片时,割取下部无病虫害、无损伤的叶片,每株3片,共割取42片作接种材料。
1.2.2.2接种体准备
用菌丝块水培法培养,在倒置显微镜下观察,产生大量游动孢子后,吸取孢子悬浮液,用血球计数板计数并配制成浓度为1×104个/mL的孢子悬浮液,作接种体。
1.2.2.3接种方法
1)刺伤-棉花保湿法: 75%酒精消毒后,6根大头针刺伤叶片表面,用移液枪滴50 μL游动孢子悬浮液于伤口上,棉花保湿,置于28℃条件下培养。
2)刺伤-磁盘保湿法: 75%酒精消毒后,6根大头针刺伤叶片表面,用移液枪滴50 μL游动孢子悬浮液于伤口上,小心放入磁盘中密封保湿,置于28℃条件下培养。
3)刺伤接种法: 75%酒精消毒后,6根大头针刺伤叶片表面,用移液枪滴50 μL游动孢子悬浮液于伤口上,小心放入磁盘中密封,置于28℃条件下培养。
4)注射-棉花保湿法: 75%酒精消毒后,用微量进样器注射10 μL游动孢子悬浮液,棉花保湿,置于28℃条件下培养。
5)注射-磁盘保湿法: 75%酒精消毒后,用微量进样器注射10 μL游动孢子悬浮液,小心放入磁盘中密封保湿,置于28℃条件下培养。
6)注射接种法: 75%酒精消毒后,用微量进样器注射10 μL游动孢子悬浮液,小心放入磁盘中密封,置于28℃条件下培养。
每片叶片在上、中、下各接一个点。每方法接种2张叶片,3次重复。
7)喷雾法: 75%酒精消毒后,将游动孢子悬浮液喷雾至整个叶片表面上,小心放入磁盘中密封保湿,置于28℃条件下培养。该方法接种2片叶片,3次重复。
1.2.2.4发病情况观察
接种后6 d,观察、记录各接种方法接种点是否发病,并计算发病率。
2 结果与分析
2.1游动孢子产生试验结果
通过镜检,烟草疫霉菌产生的孢子囊成熟以后,即逐渐释放游动孢子(图1)。

图1 烟草疫霉菌游动孢子及其释放Fig.1 Zoosproes of phytophthora nicotianae and its realease
不同培养方法产生的孢子囊及游动孢子结果见表1:

表1 不同培养方法对产孢的影响Tab.1 The influence of different cultivation methods on the spore production
从表1可见:菌丝块水培法产孢最快最多,1 d后孢子囊浓度即达到2.28×103个/mL,且孢子囊释放产生大量游动孢子(浓度为26.08×103个/mL),2 d后孢子囊浓度1.75×103个/mL,伴随着较多的游动孢子(浓度为8.87×103个/mL),说明其一边继续产生孢子囊,一边释放游动孢子,3 d后孢子囊还有0.60×103个/mL,游动孢子浓度为3.05×103个/mL,6 d后既没有孢子囊,也没有游动孢子,说明前几天产生的孢子囊已全部释放完;其次是菌丝块-土壤溶液法,1 d后孢子囊浓度达到1.27×103个/mL,2 d后为0.82×103个/mL,3 d后为0.85×103个/mL,1 d后产生大量游动孢子(浓度为16.17×103个/mL),2 d、3 d后还有较多的游动孢子,说明该培养方法产孢和释放游动孢子速度都要慢些,但6 d后也已释放完毕;皮氏培养液法1 d后孢子囊浓度达0.58×103个/ mL,释放的游动孢子较前2种方法少(浓度为3.23×103个/mL),3 d后孢子囊比较少,为0.34× 103个/mL,但6 d后又产生大量孢子囊(浓度达2.61×103个/mL)和游动孢子(浓度20.12×103个/mL),说明该培养方法在经过一段速度较慢的产孢过程后,其营养供应时间长,致6 d后仍能产生孢子囊及游动孢子;菌丝丛水培法最慢,到6 d后才产生孢子囊和少量游动孢子,是因为前几天一直在长菌丝,孢子囊刚刚开始释放。
综合上述结果,用菌丝块水培法产生孢子囊及游动孢子,速度最快,数量最多,且方法简单,它不需要其它培养液,也不需要复杂的操作;菌丝块土壤溶液法,产孢子囊速度快,数量也较多,游动孢子释放多,持续时间长,但需要加其它培养液,且操作较复杂;皮氏培养液法,产生孢子囊速度快,但数量较少,游动孢子数少;而菌丝丛水培法,可以产生孢子囊及游动孢子,但速度太慢,因此,菌丝块水培法是最佳的培养方法。
2.2接种方法试验结果
各接种方法的发病情况及发病率见表2:
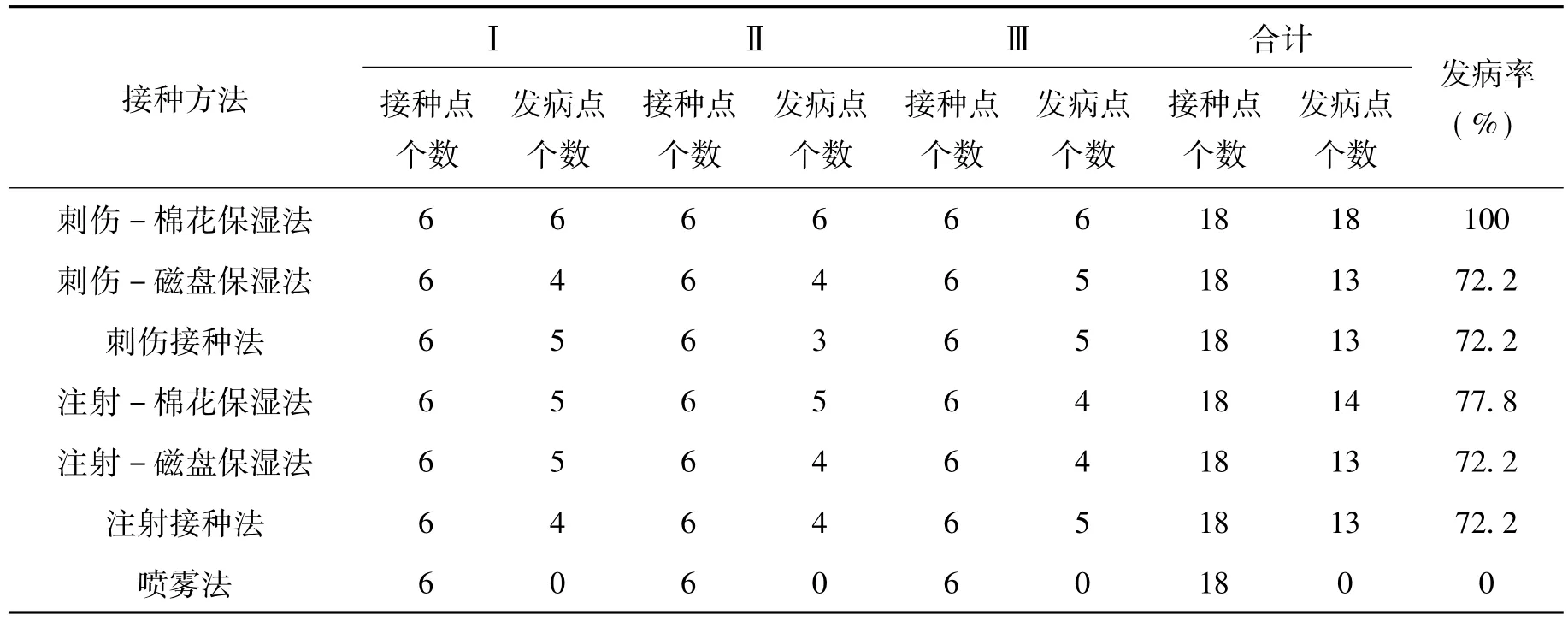
表2 不同接种方法对剑麻叶片发病情况的影响Tab.2 Effects of different inoculation methods on disease development of sisal leaves
从表2可见:刺伤-棉花保湿法接种的成功率最高,发病率为100%,注射-棉花保湿法成功率次之,其发病率为77.8%,刺伤-磁盘保湿法、刺伤接种法、注射-磁盘保湿法和注射接种法成功率稍低,其发病率为72.2%,而喷雾法接种不成功,发病率为0。因此刺伤-棉花保湿法是最好的接种方法。
3 讨论和结论
3.1关于孢子囊的产生和游动孢子的释放
国内外对于产孢方法有不少研究[6-14],王万能[8]挑取菌丝在0.1% KNO3培养,6 d后产生孢子囊和游动孢子;徐敬友[9]挑取菌丝块于皮氏液培养,诱发产生孢子囊;郑小波[6]、沈会芳[10]、杨建卿[11]、朱贤朝[12]、王智发[13]等将产生大量成熟的孢子囊利用低温刺激,孢子囊即释放游动孢子,但都要培养较长时间,使其产生成熟的孢子囊才能产生游动孢子,本试验筛选出菌丝块水培法,即将该菌在10% V8平板培养4 d,再以灭菌水浸泡从平板挑取的菌块,光照培养1 d即可产生大量游动孢子囊并释放大量游动孢子。本方法操作简单,不需要低温刺激,从培养到产孢所需时间短,游动孢子产生快而多,是一种较为简便快捷的方法。
3.2关于游动孢子接种剑麻的方法
不同的接种方法,接种效果有明显差别,分析其原因是:首先,斑马纹病菌无法通过蜡质层进入气孔,自然孔口无法发病,只有对叶片造成伤口,才可能使其直接进入叶片组织导致发病,因此,喷雾法接种不成功,而刺伤和注射接种可以成功;但造成伤口后也不一定就能发病,还必须具备一定的环境条件,温度和湿度,斑马纹病要求的湿度更高,因此,虽然都是刺伤接种,但棉花保湿接种法比磁盘保湿和刺伤接种法的发病率都高;另外,注射后进行接种,由于注射的深度不一致,假如造成的伤口太大,损坏了叶片组织,也有可能造成病菌无法感染,因此,尽管都用棉花保湿,刺伤接种的成功率比注射接种的成功率也要高。
利用游动孢子接种,前人以烟草和菠萝为对象做过许多研究[8,10,12-13],对于剑麻斑马纹病的接种,前人都是用菌丝块作为接种体[5,15],而利用游动孢子作为接种体接种剑麻却未见报道,本试验尝试多种方法,最后确定刺伤接种棉花保湿法为最佳的方法。此方法可以更加准确的接种斑马纹病,为生理小种鉴定和抗性鉴定提供依据。
本文利用剑麻离体叶片进行游动孢子接种,存在一定局限性,下一步将继续试验,进一步补充和完善剑麻活体叶片组织接种方法。
参考文献:
[1]李道和.剑麻栽培[M].北京:中国农业出版社,1998.
[2]裴超群,陶玉兰.剑麻斑马纹病重病区补植的新品种—杂种76416号[J].广西热作科技,1992( 1) : 29-33.
[3]李莲英.五星农场更新剑麻园斑马纹病调查分析[J].广西农业科学,2003( 5) : 47-48.
[4]谢红辉,黄兑武,韦艳明,等.广西剑麻病虫害发生现状及防治对策[J].中国热带农业,2012( 5) : 47-49.
[5]NY/T 1942-2010,龙舌兰麻抗病性鉴定技术规程[S].2010.
[6]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997: 86.
[7]陈方新,齐永霞,高智谋,等.诱导疫霉菌产生游动孢子囊液体培养基的研制[J].植物保护,2005,31( 2) : 34-37.
[8]王万能,全学军,肖崇刚.烟草疫霉菌的产孢和接种方法研究[J].植物保护学报,2005,32( 1) : 18-21.
[9]徐敬友,陆家云,方中达.洋槐上疫霉种的研究[J].南京农业大学学报,1990,13( 4) : 17-23.
[10]沈会芳,林壁润,蒲小明,等.应用离体叶片法鉴定菠萝资源心腐病抗性[J].广东农业科学,2014( 7) : 80-82,87.
[11]杨建卿,江彤,陈学平.烟草疫霉菌的培养及大量产生游动孢子囊及游动孢子方法研究[J].植物保护学报,2001,27( 4) : 12-14.
[12]朱贤朝,郭振业,刘保安,等.我国烟草黑胫病菌生理小种研究初报[J].中国烟草科学,1987( 4) : 1-4.
[13]王智发,刘延荣,谢成颂,等.我国烟草黑胫病菌生理小种鉴定[J].山东农业大学学报(自然科学版),1987,18( 1) : 1-8.
[14]Shen H D.Response of Phytophthora parasitica var.nicotianae to metalaxyl exposure[J].Plant Digest,1984( 4) : 559-562.
[15]陈河龙,郭朝铭,刘巧莲,等.龙舌兰麻种质资源抗斑马纹病鉴定研究[J].植物遗传资源学报,2011,12( 4) : 546-550.
Study on Inoculation Methods with Zoospore of Phytophthora nicotianae Breda on Sisal
ZHAO Yanlong,ZHAN Rulin,ZHANG Yanmei,HE Yanbiao,CHANG Jinmei,LIU Feng,YANG Yumei,ZHOU Wenzhao*
( South Subtropical Crops Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang 524091,Guangdong,China)
Abstract:In order to identify accurately the resistance to zebra disease of sisal,the effects of sporulation for Phytophthora nicotianae Breda by different culture method were compared,and the inoculation methods with zoospore were studied.Results showed that the method of Mycelia-hydroponics was the best culture method for the simplest operation,together with the most production of sporangium and zoospore and the fastest sporulation rate.And wound inoculation-cotton mistrue retention was the best method of inoculation with zoospore of Phytophthora nicotianae Breda for the simple and convenient operation,and the highest successful rate of inoculation
Key words:Phytophthora nicotianae Breda;zoospore;inoculation;sisal
*通讯作者:周文钊( 1965-),男,研究员,主要从事剑麻育种研究。E-mail: zwenzhao@163.com。
作者简介:赵艳龙( 1968-),男,高级农艺师,主要从事热带作物病虫害综合防治。E-mail: zylyym@163.com。
基金项目:现代农业产业技术体系( CARS-19-E03) ;国家自然科学基金( No:31401427)
收稿日期:2015-11-19
文章编号:1671-3532( 2016) 01-0019-05
中图分类号:S563.8
文献标识码:A

