3,4,5-三硝基吡唑及其衍生物的研究进展
吴军鹏, 曹端林, 王建龙, 刘 洋, 李永祥
(中北大学化工与环境学院, 山西 太原 030051)
1 引 言
随着武器装备的革新和军事技术的发展,高能量、低感度、低成本、环境友好、综合性能好的含能材料已成为全世界各含能领域研发的热点[1-2]。吡唑环结构中环张力较大,含有高能的N—N键、C—N键,且结构中存在π电子体系,易于进行硝化、磺化、卤化等亲电取代反应[3-4]。环上硝基基团的引入,使其密度和氮含量增加,氧平衡更接近于理想值,从而改善化合物的爆轰性能。其中3,4,5-三硝基吡唑作为重要的硝基吡唑类化合物之一,具有高密度、高能量、低感度的优点,在含能材料领域具有广阔的应用前景。
3,4,5-三硝基吡唑(3,4,5-trinitro-1H-pyrazole,TNP,1)是唯一全碳硝化的吡唑类化合物,其分子结构式见图1。TNP为一种白色固体,不吸湿,易溶于水及乙醚、乙酸乙酯等有机溶剂。TNP的熔点为187.8 ℃,密度1.87 g·cm-3,爆速9.0 km·s-1,爆压37.09 GPa,热分解范围为260~350 ℃,具有良好的热稳定性和化学稳定性[5]。TNP的晶体结构为单斜晶系,空间群为Pc2/c, 晶胞参数为a=22.5218(9) Å,b=8.2885(3) Å,c=15.1944(6) Å,V=2167.68(14) Å3,Z=12。
3,4,5-三硝基吡唑结构(图1)中含有3个硝基,其强吸电子作用使得1号位上N原子电负性增大,N—H键可以与C、N或O去质子化的阴离子发生中和反应或复分解反应,从而形成N质子化的阳离子例如铵、肼、胍、唑、嗪鎓等,以及其他K+、Ag+、Ba2+、Sr2+等含能盐,也可通过氢键诱导引入唑类骨架的多样官能团或富氮杂环,形成高能量密度材料。3,4,5-三硝基吡唑及其衍生物可广泛应用于农药、医药、染料、含能材料等领域[6],具有深远的研究意义和广阔的发展前景。
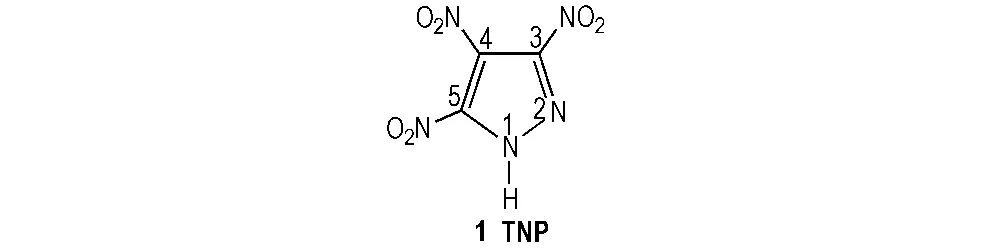
图1 3,4,5-三硝基吡唑分子结构
Fig.1 The molecular structure of 3,4,5-trinitro-1H-pyrazole[5]
2009年,Herve等[7]在12届NTREM会议上首次报道了TNP以及其三种合成方法,使得TNP及其衍生物的合成研究成为热点。国外已对此类含能化合物进行了大量的研究,但目前国内外尚未有较全面的综述。因此,本文系统综述了TNP及其相关衍生物(包括共价型衍生物和含能离子盐)的合成方法、理化性能及其应用,讨论了以TNP为骨架的新型含能化合物的分子设计,以期为今后的研究提供一定理论基础。
2 3,4,5-三硝基吡唑的合成
2.1 直接硝化法
直接硝化是指利用硝化剂直接将硝基引入有机化合物分子中,而不经过其他氧化、加成等其他基团转换方式合成硝基化合物的反应[8],此方法合成路线见Scheme 1。

Scheme 1 The possible synthesis routes of TNP by nitrating pyrazole directly[9,12]
Herve等[5]以3,5-二硝基吡唑(2)采用硝酸/20%发烟硫酸硝化体系,温度控制在100 ℃,1H NMR监测反应过程,合成了TNP,得率为94%。Dalinger等[9]采用硝化能力稍弱的硝硫混酸体系,在90~100 ℃下反应10 h得到TNP,得率为87%。
Ravi等[10-11]提出了金属硝酸盐硝化体系,并对硝化合成TNP的工艺进行了大量的研究。Ravi分别采用硝酸鉍/二氧化硅、硝酸鉍/硫酸/二氧化硅、蒙脱石K10/硝酸鉍三种硝化体系,将2与各硝化剂溶在四氢呋喃溶液中,室温下分别搅拌3,3,2.5 h后,过滤并旋蒸除去溶剂制得TNP,得率分别为93%、98%和95%。此法比前面提及的方法得率高,且有效避免了废酸的处理,方法中提到的硝酸鉍廉价易得,性质优良,可适用于芳香杂环化合物的硝化。
除硝酸鉍/二氧化硅外,Ravi还提出硝酸银/三氟化硼、硝酸铜/黏土、硝酸铁/黏土等硝化体系。常用的传统硝化剂有硝酸/硫酸,硝酸/发烟硫酸,硝酸/醋酸酐,硝酸/三氟乙酸酐等体系,但这些硝化剂在操作时间、介质酸性、硝化能力、热重排、安全问题等方面都存在一定的局限性。相比传统的硝化体系,金属硝酸盐硝化体系避免了反应介质的酸性问题,条件温和,操作简化,时间明显缩短,得率提高,符合绿色化学的研究方向。
由吡唑直接硝化合成TNP,理论[12]上可能的合成方法有以下五种: 分别由吡唑(3)、3-硝基吡唑(4)、4-硝基吡唑(5)、化合物2、3,4-二硝基吡唑(6)合成TNP,见Scheme 1,但是目前已报道文献中除方法Ⅰ成功合成出TNP外,其他方法均未见报道。
2.2 间接硝化法
2.2.1 氨基氧化法
此法主要是以5-氨基-3,4-二硝基吡唑(7)[13]和4-氨基-3,5-二硝基吡唑(8)[14]为原料,氧化合成TNP,合成路线见Scheme 2。由于化合物7和8吡唑环上两个硝基的强吸电子作用,使得其氨基高度失活,需要强氧化剂才能对其氧化。氧化剂主要有硫酸/过氧化氢,过二硫酸,过硫酸氢钾等。
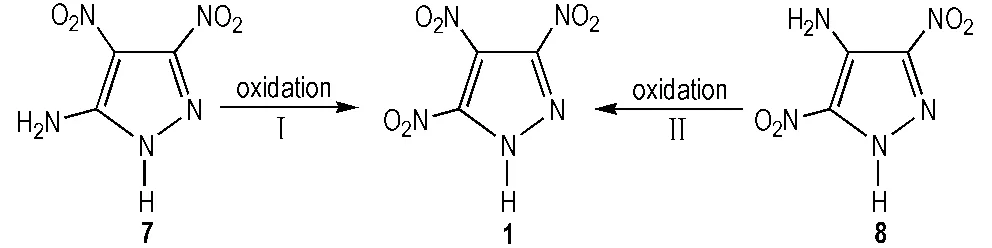
Scheme 2 Oxidation of aminodinitropyrazoles to obtain TNP[5]
Herve等[5]以7为原料,N2保护下,浓硫酸和90%过氧化氢为氧化剂,二氯甲烷作为溶剂,合成了TNP,得率仅为37%。Dalinger等[15]将7溶在92%硫酸中,然后在0~5 ℃逐滴加入84.5%过氧化氢溶液,20~30 ℃下加热8 h,反应结束后,将反应液倒入冰中,乙醚多次萃取,硫酸镁干燥,真空浓缩得到TNP,得率同样很低,仅为42%。两种方法均需要高浓度过氧化氢溶液,危险系数较高,还需N2保护,操作繁琐,不宜采用。
Herve等[5]以8为原料,和上述氧化7的合成方法相同,合成了TNP,得率明显提高,为93%,但不足之处仍为危险系数高的90%过氧化氢。Shreeve等[16]将8溶到浓硫酸中,冰浴下缓慢滴加30%过氧化氢,反应24 h,反应结束后,冰水稀释,乙醚反复萃取,硫酸镁干燥,真空除去溶剂,得率93%。此法采用30%过氧化氢,反应条件温和,在高产率合成TNP的同时,显著提升操作的安全性。赵秀秀等[17]仍以8为原料,舍弃了传统的浓硫酸/过氧化氢氧化体系,采用过硫酸氢钾为氧化剂,40 ℃下在水中反应18 h制得TNP,得率85%,此法氧化剂绿色环保,反应时间缩短,且保证了收率。
传统的氧化方法存在以下缺陷: 反应条件苛刻、选择性差、副产物较多、尤其是高浓度过氧化氢/硫酸体系、危险系数极高、金属催化剂昂贵、毒性有机溶剂等。而上述方法中过硫酸氢钾,原料廉价易得,绿色环保,条件温和,可作为绿色氧化剂使用,有着更好的应用前景。
从Scheme 2中看,相比7中5号位的氨基,8中4号位氨基电子云密度和空间位阻较大,能够促使分子间氧化反应的进行,同时有效避免分子间副反应的发生,氧化选择性强,路线Ⅱ比路线Ⅰ得率较高。此外,化合物8中“NO2--NH2--NO2”框架使得其比7更加稳定,而且容易合成。综合考虑,路线Ⅱ为TNP典型的合成方法。
2.2.2 氨基重氮化法
带氨基侧链的唑类化合物,可在强酸介质和亚硝酸的作用下发生重氮化反应,从而引入硝基,得到相应的硝基衍生物。重氮化试剂为亚硝酸,通常由盐酸或硫酸与亚硝酸钠反应制得。由于亚硝酸不稳定,容易分解,反应时需临时配样,及时反应,且在酸性介质下进行,通常伯胺与酸的摩尔比为1∶2.5。氨基吡唑类化合物重氮化合成TNP的机理见Scheme 3[18]:

Scheme 3 Diazotization mechanism of aminodinitropyrazole[18]
Herve等[8]以7为原料,通过重氮化法成功制得TNP,合成路线见Scheme 4。具体做法如下: 将7溶于20%硫酸中,在0~10 ℃下将部分亚硝酸钠滴入其中,搅拌1 h。然后在20 ℃下将另一部分10%亚硝酸钠水溶液加入上述溶液中,加热30 min直至氮气放出。浓硫酸中和,乙酸乙酯萃取,硫酸镁干燥,真空浓缩得到TNP,收率80%。然而,Herve以8为原料,用类似的方法并未合成出TNP,Herve认为4-重氮基-3,5-二硝基吡唑的4号位不能发生亲核取代致使方法Ⅱ无法进行。

Scheme 4 Diazotization of aminodinitropyrazoles to obtain TNP[5]
2.2.3 碘代硝化法


Scheme 5 Nitration mechanism of iodopyrazole[19]
2012年,Ravi等[20]经硝酸硝化3,4,5-三碘吡唑(9),采用碘代硝化法制得TNP,合成路线见Scheme 6。该法是以吡唑为原料,碘/碘化钾为碘化剂,在25% 氨水中搅拌24 h,硫酸氢钠脱色,过滤,乙酸酸化,得到中间产物9,然后将9用浓硝酸在100 ℃下回流加热40 min,反应结束后,倒入冰中,碳酸氢钠中和,调PH至0.5,乙醚反复萃取,硫酸镁干燥,得到TNP,收率86%
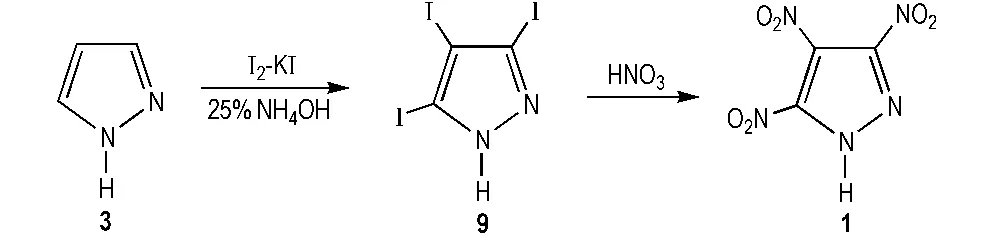
Scheme 6 Nitrodeiodination of polyiodopyrazoles to obtain TNP[20]
此法提出了吡唑环上的全碳卤代,使得由吡唑环先卤代再硝化合成TNP的方法成为了可能,为TNP的合成开辟了新的途径。然而此方法提到的碘代得率非常低,仅为42%,且碘化剂I2,KI价格昂贵,反应过程中有废酸产生,此方法合成TNP存在局限性。其他卤素原子如Cl,Br,都未曾见报道用此类方法成功合成出TNP。
2.3 微波重排法
相比前面提及的三种合成方法,微波重排法是一种全新且简易的加热合成方法。微波独特的内加热方式,使反应具有时间短、副反应少、得率高、操作方便、环境友好等优点,克服了传统加热方法时间冗长,操作麻烦的缺点,对有机合成的发展具有重大的推动作用[21]。
Ravi等[22]运用微波法分别以1,3,4-三硝基吡唑(10)和1,3,5-三硝基吡唑(11)为原料,无溶剂加热重排合成了TNP,合成路线见Scheme 7。微波反应条件为: 反应温度120~190 ℃,功率400 W,反应时间仅为5 min,得率分别为43%和45%。
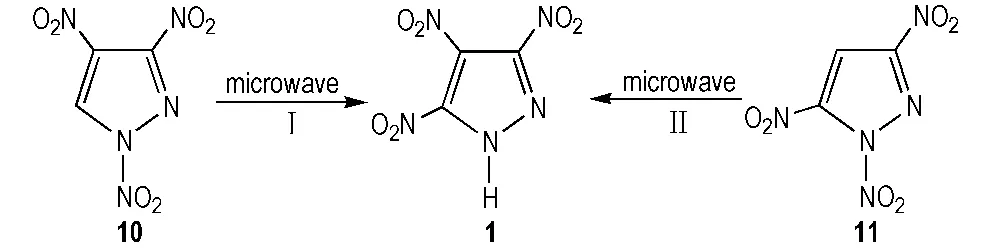
Scheme 7 Microwave methods for synthesis of TNP[22]
化合物10,11和TNP,三者互为同分异构体。化合物10由5经TFAA(二氯甲烷为溶剂)或NO2BF4(乙腈为溶剂)硝化合成制得[13,23]。重排加热过程中,N原子上的硝基基团发生异构化。在适宜的溶剂和温度下,N—NO2重排形成更稳定的C—NO2。Ravi仅指出了路线Ⅰ的微波重排机理,见Scheme 8,但并未指出11的合成方法以及路线Ⅱ的重排机理。
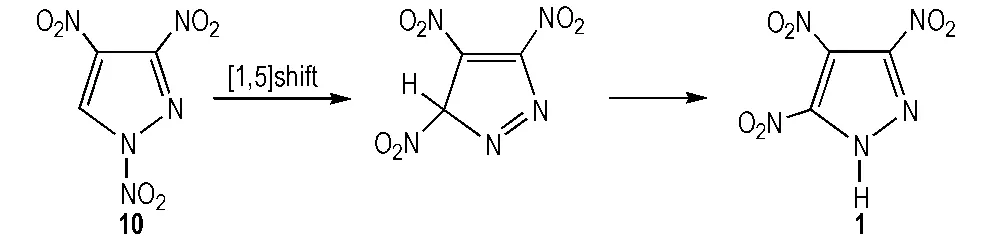
Scheme 8 Rearrangement mechanism of 1,3,4-TNP to obtain TNP[22]
重排反应是有机合成重要的一类反应。重排反应的效果极易受溶剂、时间、温度的影响。硝基吡唑类化合物常用的重排溶剂为氯苯、硝基苯、苯甲醚、二甲苯、均三甲苯、正癸烷、N-甲基甲酰胺、丙二醇或苄腈等[22]。相比溶剂加热重排法,无溶剂微波重排法明显缩短反应时间,避免以往重排反应溶剂的减少、处理、循环等问题,但仅限用于实验室研究,无法放大工艺满足工业化生产。
在上述7种合成TNP的方法中,2的直接硝化法和8的氨基氧化法,是目前研究最多,最为典型的两种合成TNP的方法,但2和8的合成步骤较为繁琐,因此需要继续探索TNP新的合成及优化工艺。而金属硝酸盐硝化体系,以及文章未提到的N2O5体系[24]、过硫酸氢钾氧化体系等都有很大的发展前景。
3 TNP共价型衍生物的合成、性能及应用
3.1 1-氨基-3,4,5-三硝基吡唑
1-氨基-3,4,5-三硝基吡唑(ATNP,12)为白色固体,熔点130.5 ℃,分解温度范围为176~272 ℃。王军等[25]运用Brinkley-Wilson法则,Rothstein和Kamlet方法等对该炸药的爆炸特性参数进行了计算,结果如下: 密度1.917 g·cm-3、爆速9.17 km·s-1、爆压40.94 GPa。
Herve等[5]在氮气保护下,冰水浴下将氢化钠加入溶有TNP的无水乙腈中,温度控制在室温,向其加入2,4,6-三硝基苯基羟胺(Pic-O-NH2)并搅拌3天,反应结束后过滤,蒸干滤液,二氧化硅纯化,得到粗产品ATNP,得率仅为26%,合成路线见Scheme 9。
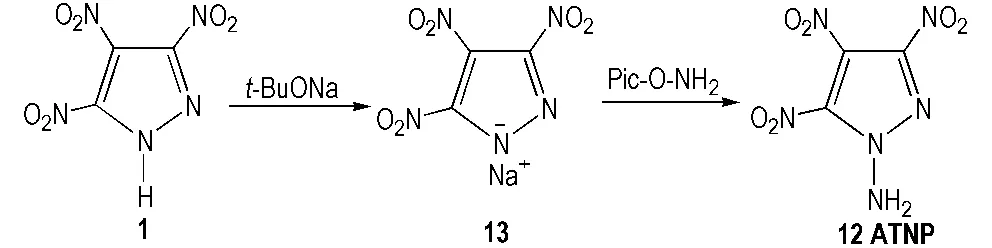
Scheme 9 Synthetic route of ATNP[5]
3.2 1-甲基-3,4,5-三硝基吡唑
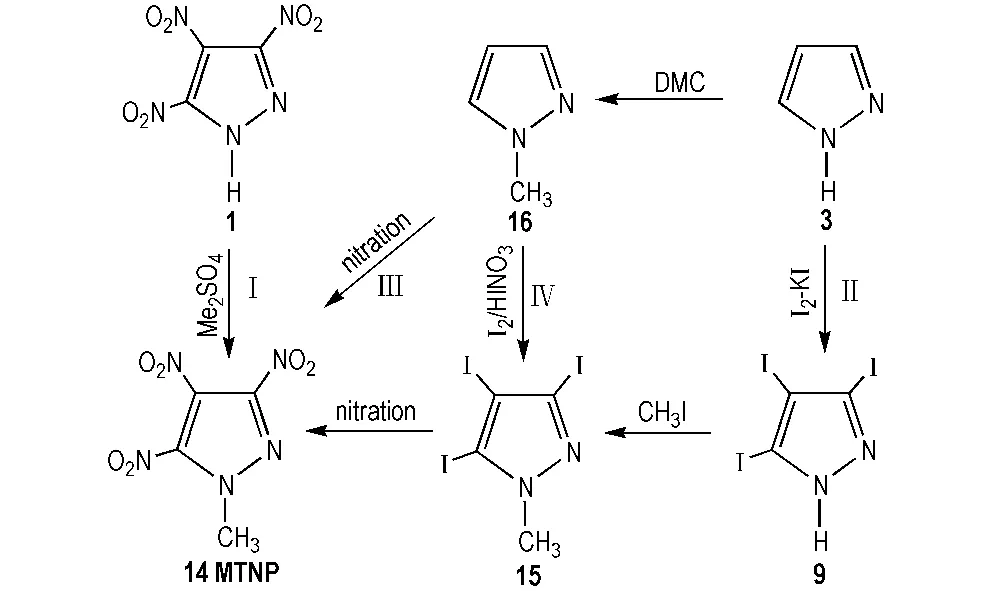
1-甲基-3,4,5-三硝基吡唑(MTNP,14)为淡黄色固体,微溶于水,易溶于有机溶剂。其熔点91.5 ℃、密度1.81 g·cm-3、爆速8.65 km·s-1、爆压33.7 GPa、分解温度范围为248~280 ℃,可作为熔铸炸药。Dalinger等[26]研究了其单晶结构,空间结构为: MTNP属斜方晶系,空间群为Pn2(1)/c; 晶胞参数为a=11.919(5) Å,b=8.352(3) Å,c=8.477(3) Å,V=843.9(6) Å3,Z=4。MTNP相关合成路线见Scheme 10。
Scheme 10 Synthetic routes of MTNP[26-31]
Dalinger等[26]将TNP溶在碳酸氢钠溶液中,硫酸二甲酯为甲基化试剂,20 ℃下反应7 h,首次得到粗产品MTNP,收率为95%(路线Ⅰ)。
Ravi等[20]以吡唑为原料,碘/碘酸/乙酸为碘化剂,先合成中间体9,然后用碘甲烷甲基化9合成1-甲基-3,4,5-三碘基吡唑(15),再硝酸硝化获得目标产物MTNP(路线Ⅱ)。
Ravi等[27-28]又直接以1-甲基吡唑(16)为原料,分别以硝硫混酸、蒙脱石K10/硝酸鉍为硝化剂,一步法直接硝化合成MTNP(路线Ⅲ)。郭俊玲等[29]同样以16为原料,超酸体系(发烟硫酸/硝酸钾)一步法合成MTNP,得率15%(路线Ⅲ)。李雅津等[30]借鉴路线Ⅱ,仍以16为原料,通过改变碘、碘酸、乙酸的加料顺序,先合成中间体15,最终经硝酸硝化制得MTNP,产率为10%(路线Ⅳ)。
对比上述4种合成MTNP的方法,路线Ⅰ需要以TNP为原料,如前所述合成TNP的步骤繁多,制约着下一步甲基化,且甲基化试剂为毒性的硫酸二甲酯。路线Ⅱ中9的合成产率较低,影响着后续步骤产物的合成。路线Ⅲ原料易得,工艺简单,但产率较低。路线Ⅳ碘代过程中有废酸生成,污染严重,且产率较低。此外,Ⅱ和Ⅳ中碘化剂价格昂贵,成本太高。综合考虑,积极寻求路线Ⅲ的优化工艺是合成MTNP的较佳选择。
3.3 1,3,4,5-四硝基吡唑
若将TNP的1号位转化为硝基,可获得新型的含能化合物1,3,4,5-四硝基吡唑(17),结构式见图2,Ravi等[31]通过Gaussian 03量子化学软件对化合物17各参数进行了计算和分析。其中密度2.06 g·cm-3、爆速9.24 km·s-1、爆压41.27 GPa、生成热5.60 kJ·kg-1。17与TNP、RDX和HMX相比,其密度、爆速和爆压明显增加,爆轰性能出色,可作为潜在的含能化合物,但目前尚未有文献报道其合成方法。
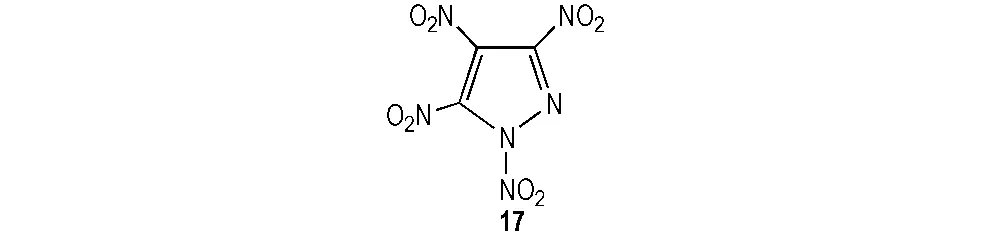
图2 1,3,4,5-四硝基吡唑分子结构[31]
Fig.2 The molecular structure of 1,3,4,5-tetranitropyrazole[31]
部分TNP共价型衍生物与常见炸药的性能比较如表1所示。从表1中看,TNP以及其共价衍生化合物均具有较高的密度,均在1.80 g·cm-3以上,其爆速均高于6.85 km·s-1,爆压均高于21.0 GPa,爆轰性能明显优于TNT。化合物14的爆轰性能与RDX相当,且熔点更低,是一种良好的熔铸类炸药载体。TNP与HMX爆轰性能基本相当,而化合物12和17的密度均大于1.90 g·cm-3、爆速高于9.10 km·s-1、爆压超过40.0 GPa,三项指标明显优于HMX,三者均可替代HMX作为潜在的高能单质炸药。国外对TNP和化合物14的合成、热稳定性和化学稳定性进行了大量的探索和研究,而对更高性能的化合物12和17的合成鲜有报道,国内仅对化合物14的合成以及基本物性参数进行了研究。因此,加大对TNP及相关共价衍生物的探索与研究有一定的现实意义。
表1 部分TNP共价型衍生物与常见炸药的性能比较[25,31-32]
Table 1 Comparison of the performances of several covalent derivative compounds and common explosives[25,31-32]
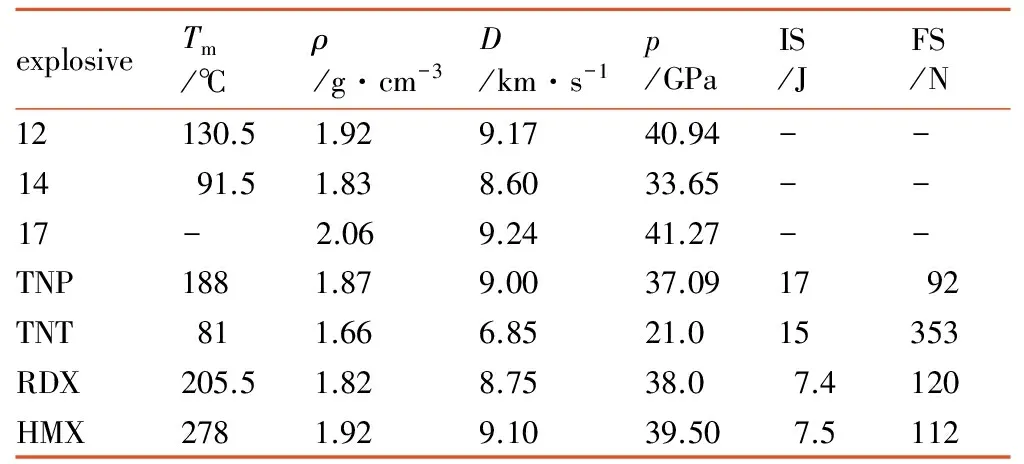
explosiveTm/℃ρ/g·cm-3D/km·s-1p/GPaIS/JFS/N12130.51.929.1740.94--1491.51.838.6033.65--17-2.069.2441.27--TNP1881.879.0037.091792TNT811.666.8521.015353RDX205.51.828.7538.07.4120HMX2781.929.1039.507.5112
Note: 1)Tmis the melt point; 2)ρis the density; 3)Dis the detonation velocity; 4)pis the detonation pressure; 5) IS is the impact sensitivity; 6) FS is the friction sensitivity.
4 TNP含能离子盐的合成、性能及应用
4.1 TNP含能金属盐
基于唑类环独特的立体结构和空间效应,大多数硝基唑类化合物都呈酸性[5]。TNP 1号位N—H键容易与碱发生中和反应,或与某些金属盐发生复分解反应,进而引入金属离子,形成TNP含能金属盐。Drukenmuller等[33]报道并合成了部分以TNP为母体的金属盐,合成路线见Scheme 11。这些金属盐的合成方法基本相似,具体方法为: 将TNP溶解在溶剂中(常用乙醇),按化学反应计量逐批加入相应的碱或金属碳酸盐,室温下搅拌12 h,反应结束后除去溶剂,得到相应的TNP金属盐。

Scheme 11 Synthesis of metal 3,4,5-trinitro-1H-pyrazole salts[33]
Drukenmuller等通过DSC测试记录部分TNP金属盐的热性能数据,也通过BAM感度测试仪器列出相关感度数据,如表2所示。从表中可以看出除20为193 ℃外,其他三种TNP金属盐的分解温度均在200 ℃以上,稳定性较好。金属盐18和21撞击感度为5 J,属于敏感性,而金属盐19和20撞击感度为40 J,属于低感型,而这四种金属盐的摩擦感度在80~360 N范围内,属于敏感型。
表2 四种TNP金属盐的特性[33]
Table 2 The properties of four metal TNP salts[33]

saltTm/℃Tdeh/℃Tdec/℃FS/NIS/JESD/J18--2548050.219-10427496400.220-12119380400.22115811530214450.1
Note: 1)Tmis the melting temperature; 2)Tdehis the dehydration temperature; 3)Tdecis decomposition temperature; 4) FS is friction sensitivity; 5) IS is the impact sensitivity; 6) ESD is the electrostatic discharge sensitivity.
烟火技术作为含能材料的重要分支[34],广泛应用于军事照明和民用烟花材料研究中。新型烟火技术的重点在于无烟、微烟及低污染药剂的研发。不同唑类金属盐燃烧发生不同的焰色反应,燃烧过程中无烟或低烟,可以提升颜色的色彩。TNP金属盐的燃烧物主要是无毒无害的N2,无毒害气体释放,符合环境环保友好的要求。TNP金属盐作为唑类金属盐的一类,可作为理想的着色剂候选化合物,在烟火技术应用方面有重大的潜能。
4.2 TNP含能非金属盐
吡唑环上的1号位N原子易被质子化作用形成其对应的阴离子,再与氨、肼、胍、唑、嗪鎓等作用形成非金属含能离子盐。Shreeve等[16]报道了由TNP唑环阴离子和富氮阳离子组成的含能非金属盐的合成,这些非金属盐包括铵盐,胍盐,氨基胍盐,二氨基胍盐、三氨基胍盐等,具体路线见Scheme 12。具体操作方法: 按照化学反应计量,将相应的反应物加入到溶有TNP水溶液中,室温下搅拌,直至变成透明溶液,否则继续添加水,结束后蒸掉多余水分,得到相应的TNP非金属盐23~30; 将含有富氮阳离子的卤素盐溶液逐滴加入到TNPAg悬浮液中,室温搅拌6 h,然后过滤AgX(X为Cl或I)沉淀并水洗,可得到相应的TNP非金属盐31~35。所有合成的TNP非金属盐23~35,均不吸湿,能够在空气中稳定存在。

Scheme 12 Synthesis of nonmetal TNP salts[16]
Shreeve等[16]对TNP非金属盐的物理性能进行计算及测试,相关物性参数见表3。其中熔点、分解温度、由TG-DSC综合分析仪测出; 密度由气体比重瓶测出; 其他重要参数如生成焓、氧平衡、爆压、爆速、比冲量由Gaussian 03量子化学软件计算得出; 撞击感度用10 kg落锤BAM打桩锤装置测得。
从表3可以看出,TNP非金属盐具有较高的密度(1.6~1.8 g·cm-3),除盐23,30无熔点,盐33熔点为206 ℃外,其他大部分盐熔点范围都在122~188 ℃,分解温度范围为167~243 ℃,稳定性良好。除盐23,24,25外,其他盐生成焓在200 kJ·mol-1之上,盐31甚至达到769 kJ·mol-1。在爆轰性能方面,这些TNP非金属盐的爆速范围为7.59~8.54 km·s-1,均超过6.85 km·s-1,爆压范围为24.3~31.9 GPa,均超过21.0 GPa,爆轰性能明显优于TNT,但爆速均低于8.75 km·s-1,爆压低于33.8 GPa,仍逊色于RDX,HMX,此类盐可作为潜在的TNT替代品。盐27爆速为8.54 km·s-1,爆压为31.9 GPa,撞击感度高于40 J,爆轰性能和感度接近于TATB; 在感度方面,这些盐的撞击感度高于40 J(除35为35 J外),均低于TNT(IS为15 J),属于不敏感型含能盐,可作为低感型含能材料; 这些TNP非金属盐的比冲量范围为228~269.6 s,其中23和27的比冲值均大于250 s,也可以作为潜在的火箭推进剂材料。
表3 TNP非金属盐与常见炸药的性能比较[16,32]
Table 3 Comparison of the properties of nonmetal 3,4,5-trinitro-1H-pyrazole salts and common explosives[16,32]
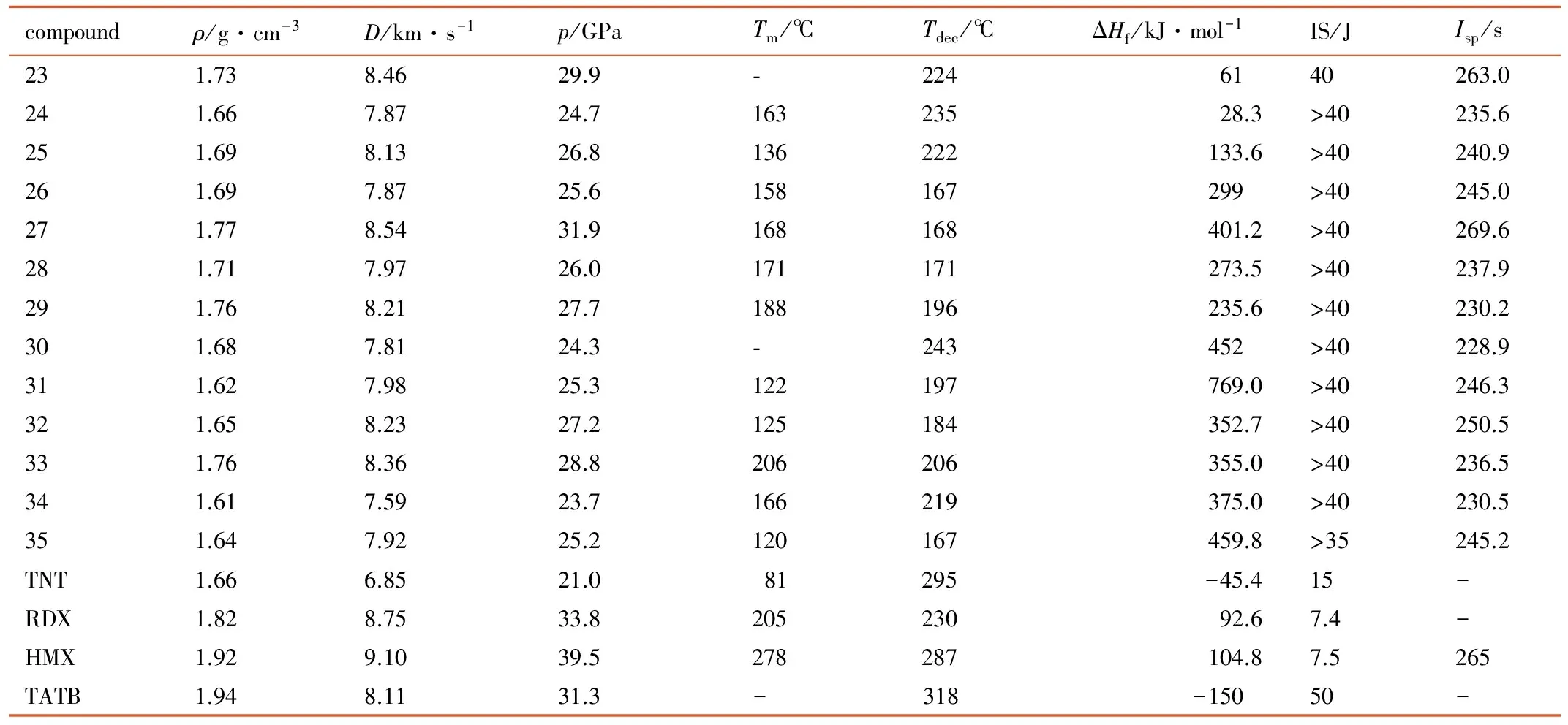
compoundρ/g·cm-3D/km·s-1p/GPaTm/℃Tdec/℃ΔHf/kJ·mol-1IS/JIsp/s231.738.4629.9⁃2246140263.0241.667.8724.716323528.3>40235.6251.698.1326.8136222133.6>40240.9261.697.8725.6158167299>40245.0271.778.5431.9168168401.2>40269.6281.717.9726.0171171273.5>40237.9291.768.2127.7188196235.6>40230.2301.687.8124.3⁃243452>40228.9311.627.9825.3122197769.0>40246.3321.658.2327.2125184352.7>40250.5331.768.3628.8206206355.0>40236.5341.617.5923.7166219375.0>40230.5351.647.9225.2120167459.8>35245.2TNT1.666.8521.081295-45.415-RDX1.828.7533.820523092.67.4-HMX1.929.1039.5278287104.87.5265TATB1.948.1131.3-318-15050-
Note: 1)ρis the density; 2)Dis the detonation velocity; 3)pis the detonation pressure; 4)Tmis the melting temperature; 5)Tdecis the decomposition temperature; 6) ΔHfis the heat of formation; 7) IS is the impact sensitivity; 8)Ispis the specific impulse.
传统的富氮含能化合物中高氮低碳氢含量的元素含量特性,既增加化合物密度,又易趋于氧平衡。但这类高爆压、高爆速、高爆热的炸药,除存在着许多单质炸药固有的熔点高、机械感度高、粘接性差、压装困难的问题外,同时在生产、储存、运输过程中的安全可靠性较差[35]。TNP非金属含能盐作为富氮含能化合物,不仅具有较高的密度和优良的爆轰性能,而且熔点和感度较低,将有效的改善单质炸药存在的上述缺陷,而且该类化合物燃烧或爆炸后分解产物主要是氮气,具有低信号和环境友好的特征,有望广泛应用在高能炸药、推进剂、气体发生剂、烟火剂等领域。
5 TNP为骨架的含能化合物的分子设计
5.1 新型含能化合物的设计理念
含能材料作为武器装备系统实现高效毁伤的最终能量载体,是决定武器先进性的关键因素之一。新型含能材料的研发主要分为分子、晶体、配方三个层面,尤其是高能单质含能分子的研发占核心地位[36]。新型含能化合物的分子设计,无论是共价型还是离子型,都要考虑化合物结构与物理性能、热力学性质、及能量性质等之间的关系[37]。新型含能化合物的关键特性包括C/H/N比,密度、生成热、氧平衡、感度(撞击、摩擦、静电火花)、爆轰性能、热和水解安定性、环境相容性。其中密度和生成热都是衡量化合物能量高低的关键指标。理想的含能化合物的特性: 爆速>8.5 km·s-1、分解温度>200 ℃、撞击感度>7 J、摩擦感度>120 N、与粘合剂和增塑剂相容、在水中溶解度低、能够长期贮存至少15年、分解产物符合环保要求、合成得率高、成本低[38]。
5.2 TNP为骨架的含能化合物的分子设计
3,4,5-三硝基吡唑作为全碳硝化的唑类化合物,是合成许多HEDMs的理想中间体[39],但是其强酸性严重限制其在实际中的应用。随着含能材料技术的不断深入,人们通过对化合物母体进行修饰和改性,形成能量高,稳定性良好的新型含能化合物。这样在增加TNP母体爆炸能量的同时,也降低其酸性,更容易拓宽其应用范围。主要途径有两种:
一是以TNP唑环为骨架,用苦基、硝氨基,偶氮基,氧化偶氮基、唑环等含能基团取代1号位上的H,尽可能构建高氮含量的桥连骨架或共轭平面,形成共价型含能化合物。这些化合物还可通过修饰引入更多的C—N键、N—N键、NN键以及—NO2、—CN、—N3、—NH2等基团,从而增加化合物的密度和生成热,降低碳氢含量,更容易趋于氧平衡。还可通过N-硝胺化、N→O化定向调控,在改进分子能量和感度的同时,提高分子设计的多样性和可靠性。这样既增加TNP母体的爆炸能量,也降低其酸性并拓宽其应用范围。
王军等[25]设计出一系列TNP为骨架的含能化合物分子,其结构见图 3,性能计算结果见表4。从表4看出,除36密度为1.85 g·cm-3,37~40密度均在1.9 g·cm-3之上; 爆轰性能方面,36性能略低于RDX,40与RDX相当,37优于RDX,而38和39爆速均高于9.10 km·s-1,爆压均高于41 GPa,尤其38高达46 GPa,二者均可替代HMX,成为新型高能单质炸药。
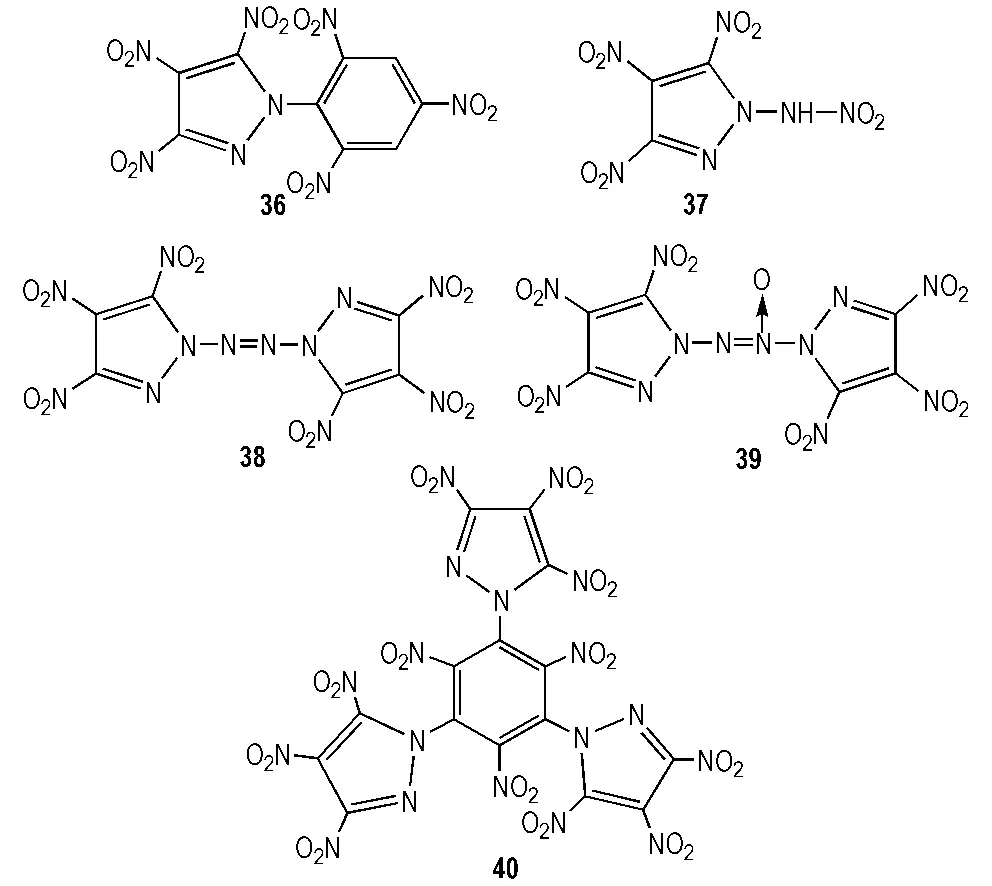
图3 TNP为骨架的含能化合物分子结构
Fig.3 The molecular structure of energy compounds based on TNP[25]
表4 以TNP为骨架的含能化合物分子的性能[25]
Table 4 The properties of energetic compounds of TNP as skeleton[25]
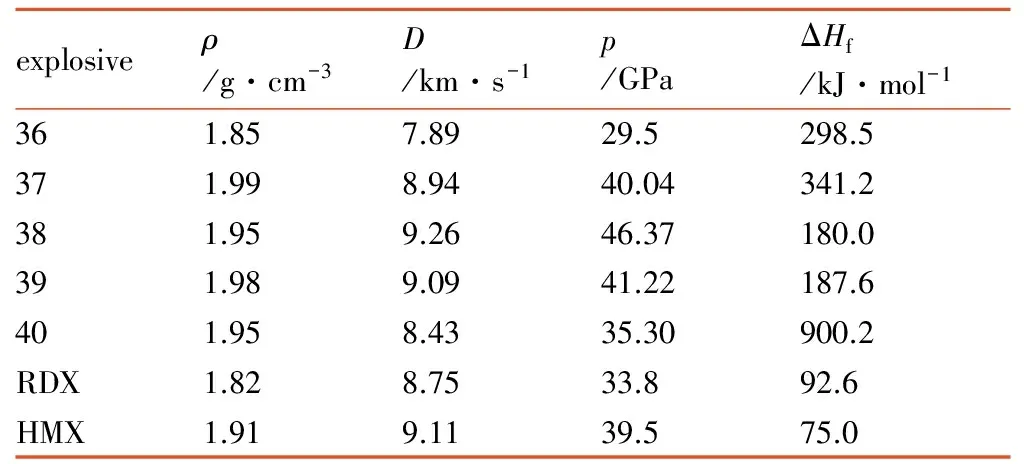
explosiveρ/g·cm-3D/km·s-1p/GPaΔHf/kJ·mol-1361.857.8929.5298.5371.998.9440.04341.2381.959.2646.37180.0391.989.0941.22187.6401.958.4335.30900.2RDX1.828.7533.892.6HMX1.919.1139.575.0
Note: 1)ρis the density; 2)Dis the detonation velocity; 3)pis the detonation pressure; 4) ΔHfis the heat of formation.
二是以TNP唑环为阴离子骨架,引入富氮阳离子基团,形成离子型含能化合物。Yin等[40]将TNP唑环阴离子与三唑环阳离子结合,设计并合成了含能离子盐41,其结构式见图4。该化合物密度1.87 g·cm-3、爆速8.36 km·s-1、爆压28.3 GPa、摩擦感度为360 N、撞击感度为40 J。41爆轰性能与RDX相当,感度很低,可作为潜在的钝感炸药。
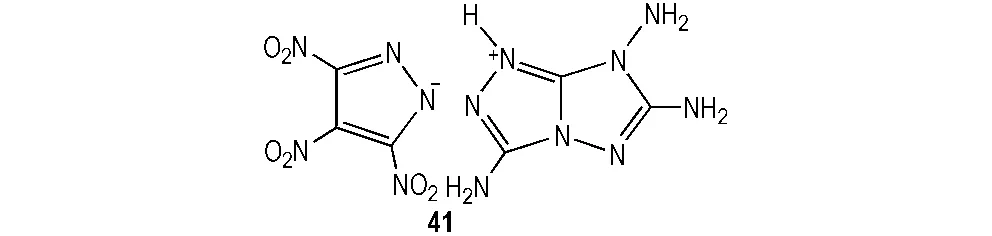
图4 TNP为骨架的含能离子盐分子结构[40]
Fig.4 The molecular structure of energetic salt of TNP as skeleton[40]
6 结论与展望
综述了TNP及其衍生物(共价型衍生物、金属盐、非金属盐)的合成方法,相关性能及应用情况。基于低的撞击感度,良好的稳定性,高的爆轰性能,TNP及其衍生物可作为潜在的候选含能材料。目前TNP及其衍生物的研究已经取得一定的成果,但仍留有许多方向需要继续开拓、探索和研究。笔者认为今后应当注重以下几个方面的研究: (1)TNP新的合成工艺及优化; (2)TNP共价型衍生物,如1,3,4,5-四硝基吡唑(ATNP)的合成及性能研究; (3)以TNP为骨架,与其他富氮基团构建的新型含能化合物的分子设计及合成研究; (4)TNP及其衍生物的实际应用研究。
参考文献:
[1] Yu Z, Bernstein E R. Sensitivity and performance of azole-based energetic materials[J].TheJournalofPhysicalChemistryA, 2013, 117(42): 10889-10902.
[2] 黄辉, 王泽山, 黄亨建, 等. 新型含能材料的研究进展[J]. 火炸药学报, 2005, 28(4): 9-13.
HUANG Hui, WANG Ze-shan, HAUNG Heng-jian, et al. Rsearches and progresses of novel energetic materials[J].ChineseJournalofExplosives&Propellants, 2005, 28(4): 9-13.
[3] 赵廷兴, 李磊, 董战, 等. 硝基唑类含能化合物的合成研究进展[J]. 有机化学, 2013, 34(2): 304-315.
ZHAO Ting-xing, LI Lei, DONG Zhan, et al. Research progress on the synthesis of energetic nitroazoles[J].ChineseJournalofOrganicChemistry. 2013, 34(2): 304-315.
[4] 郭俊玲, 曹端林, 王建龙, 等. 硝基吡唑类化合物的合成研究进展[J]. 含能材料, 2014, 22(6): 872-879.
GUO Jun-ling, CAO Duan-lin, WANG Jian-long, et al. Review on synthesis of nitropyrazoles[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(6): 872-879.
[5] Herve G, Roussel C, Graindorge H. Selective preparation of 3, 4, 5-trinitro-1H-pyrazole: a stable all-carbon-nitrated arene[J].AngewandteChemIntEd, 2010, 122(18): 3245-3249.
[6] Gao H, Shreeve J M. Azole-based energetic salts[J].ChemicalReviews, 2011, 111(11): 7377-7436.
[7] Ek S, Latypov N, Herve G, et al. Synthesis of di- and trinitropyrazoles[C]∥12th Seminar on New Trends in Research of Energetic Materials. Pardubice, April 1-3, Pardubice: Czech Republic, 2009: 494.
[8] 覃光明, 葛忠学. 含能化合物合成反应与过程[M]. 北京: 化学工业出版社, 2011: 10-12.
QIN Guang-ming, GE Zhong-xue. Synthesis reactions and processes of energetic compound[M]. Beijing: Chemical Industry Press, 2011: 10-12.
[9] Dalinger I L, Vatsadze I A, Shkineva T K, et al. The specific reactivity of 3, 4, 5-trinitro-1H-pyrazole[J].MendeleevCommunications, 2010, 20(5): 253-254.
[10] Ravi P, Tewari S P. Facile and environmentally friendly synthesis of nitropyrazoles using montmorillonite K-10 impregnated with bismuth nitrate[J].CatalysisCommunications, 2012, 19: 37-41.
[11] Ravi P, Gore G M, Tewari S P, et al. A simple and environmentally benign nitration of pyrazoles by impregnated bismuth nitrate[J].JournalofHeterocyclicChemistry, 2013, 50(6): 1322-1327.
[12] 吕春绪. 硝酰阳离子理论[M]. 北京: 兵器工业出版社, 2006: 16-38.
LÜ Chun-xu. Nitroxyl cation theory[M]. Beijing: Weapon Industry Press, 2006, 16-38.
[13] Herve G. Dinitropyrazole derivatives, their preparation, and energetic compositions comprising them: US, 2009/0186931[P]. 2009.
[14] Ek S, Latypov N V. Four Syntheses of 4-amino-3, 5-dinitropyrazole[J].JournalofHeterocyclicChemistry, 2014, 51(6): 1621-1627.
[15] Dalinger I L, Popova G P, Vatsadze I A, et al. Synthesis of 3, 4, 5-trinitropyrazole[J].RussianChemicalBulletin, 2009, 58(10): 2185-2185.
[16] Zhang Yan-qiang, Guo Yong, Joo Y H, et al. 3, 4, 5-trinitropyrazole-based energetic salts[J].Chemistry-aEuropeanJournal, 2010, 16(35): 10778-10784.
[17] Zhao X, Zhang J C, Li S H, et al. A green and facile approach for synthesis of nitro heteroaromatics in water[J].OrganicProcessResearch&Development, 2014, 18(7): 886-890.
[18] 孙昌俊, 曹晓冉, 王秀菊. 药物合成反应—理论与实践[M]. 北京: 化学工业出版社, 2007: 300-301.
SUN Chang-jun, CAO Xiao-ran, WANG Xiu-ju. Drug synthetic reactions: theory and practice[M]. Beijing: Chemical Industry Press, 2007: 300-301.
[19] Smith M B, March J. March′s advanced organic chemistry: reactions, mechanisms, and structure[M]. John Wiley & Sons, 2007.
[20] Ravi P, Koti Reddy C K, Saikia A, et al. Nitrodeiodination of polyiodopyrazoles[J].Propellants,Explosives,Pyrotechnics, 2012, 37(2): 167-171.
[21] 罗军, 蔡春, 吕春绪. 微波有机合成化学最新进展[J]. 合成化学, 2002, 10(1): 17-24.
LUO Jun, CAI Cun, LÜ Chun-xu. Recent development of microwave-induced organic reaction chemistry[J].ChineseJournalofSyntheticChemistry, 2002, 10(1): 17-24.
[22] Ravi P, Tewari S P. Solvent free microwave assisted isomerization of N-nitropyrazoles[J].Propellants,Explosives,Pyrotechnics, 2013, 38(1): 147-151.
[23] Dalinger I L, Cherkasova T I, Popova G P, et al. Nitropyrazoles 14. Synthesis of 1, 3, 4-trinitropyrazole and its behavior in the nucleophilic substitution reactions. General method of synthesis of 5-substituted 3, 4-dinitropyrazoles[J].RussianChemicalBulletin, 2009, 58(2): 410-413.
[24] 吕春绪. N2O5绿色硝化研究及其新进展[J]. 含能材料, 2010, 18(6): 611-617.
LÜ Chun-xu. Clean nitrating agent dinitrogen pentoxide and its application in nitration[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2010, 18(6): 611-617.
[25] 王军, 景梅, 张晓玉, 等. 硝基二唑炸药爆炸参数的经验计算(Ⅱ)[J]. 含能材料, 2013, 21(5): 609-611.
WANG Jun, JING Mei, ZHANG Xiao-yu, et al. Empirical calculation of the explosive prameters of nitrodiazole explosives(Ⅱ)[J].ChineseJournalofEnergeticMaterials(HannengCailiao). 2013, 21(5): 609-611.
[26] Dalinger I L, Vatsadze I A, Shkineva T K, et al. Synthesis and comparison of the reactivity of 3, 4, 5-1H-Trinitropyrazole and ItsN-methyl derivative[J].JournalofHeterocyclicChemistry, 2013, 50(4): 911-924.
[27] Ravi P, Tewari S P. Faujasite catalyzed nitrodeiodination of iodopyrazoles[J].CatalysisCommunications, 2013, 42: 35-39.
[28] Ravi P, Gore G M, Sikder A K, et al. Silica-sulfuric acid catalyzed nitrodeiodination of iodopyrazoles[J].SyntheticCommunications, 2012, 42(23): 3463-3471.
[29] 郭俊玲, 李永祥, 王建龙, 等. 1-甲基-3, 4, 5-三硝基吡唑的一步法合成及热性能[J]. 含能材料, 2015, 23(3): 304-306.
GUO Jun-ling, LI Yong-xiang, WANG Jian-long, et al. One-step synthesis and thermal behavior of 1-methy-3, 4, 5-trinitropyrazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2015, 23(3): 304-306.
[30] 李雅津, 曹端林, 李永祥, 等. 1-甲基-3, 4, 5-三硝基吡唑的合成与表征[J]. 火炸药学报, 2013, 36(3): 28-30.
LI Ya-jin, CAO Duan-lin, LI Yong-xiang, et al. Synthesis and Characterization of 1-methy-3, 4, 5-trinitropyrazole[J].ChineseJournalofExplosives&Propellants, 2013, 36(3): 28-30.
[31] Ravi P, Gore G M, Tewari S P, et al. Quantum chemical studies on the structure and performance properties of 1, 3, 4, 5-tetranitropyrazole: a stable new high energy density molecule[J].Propellants,Explosives,Pyrotechnics, 2012, 37(1): 52-58.
[32] 欧育湘. 炸药学[M]. 北京: 北京理工大学出版社, 2006: 222-243.
OU Yu-xiang. Explosive[M]. Beijing: Beijing University of Science & Technology Press, 2006: 222-243.
[33] Drukenmuller I E, Klapotke T M, Morgenstern Y, et al. Metal salts of dinitro-, trinitropyrazole, and trinitroimidazole[J].ZeitschriftfuranorganischeundallgemeineChemie, 2014, 640(11): 2139-2148.
[34] 潘功配. 烟火药的创新与发展[J].含能材料, 2011, 19(5): 483-490.
PAN Gong-pei. Innovation and development of pyrotechnic composition[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2011,19(5): 483-490.
[35] 黄海丰, 孟子晖, 周智明, 等. 含能盐和含能离子液体[J]. 化学进展, 2009, 21(1): 152-163.
HUANG Hai-feng, MENG Zi-hui, ZHOU Zhi-ming, et al. Energetic salts and energetic ionic liquids[J].ProgressinChemistry, 2009, 21(1): 152-163.
[36] 田均均, 张庆华, 李金山. 含能分子合成最新进展[J]. 含能材料, 2016, 24(1): 1-9.
TIAN Jun-jun, ZHANG Qing-hua, LI Jin-shan. Recent advances in energetic molecule synthesis[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2016, 24(1): 1-9.
[37] 李娜, 柴春鹏, 甘志勇, 等. 含能离子化合物的分子设计与性能研究进展[J]. 含能材料, 2010, 18(4): 467-475.
LI Na, CHAI Chun-peng, GAN Zhi-yong, et al. Review on molecular design and performance of energetic ionic compounds[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2010, 18(4): 467-475.
[38] Klapötke T M, Sabate C M. Bistetrazoles: nitrogen-rich, high-performing, insensitive energetic compounds[J].ChemistryofMaterials, 2008, 20(11): 3629-3637.
[39] Yin P, Parrish D A, Shreeve J M. Energetic multifunctionalized nitraminopyrazoles and their ionic derivatives: ternary hydrogen-bond induced high energy density materials[J].JournaloftheAmericanChemicalSociety, 2015, 137(14): 4778-4786.
[40] Yin P, Zhang J, Parrish D A, et al. Energetic fused triazoles-a promising C—N fused heterocyclic cation[J].JournalofMaterialsChemistryA, 2015, 3(16): 8606-8612.

