水培法收集甜椒根系分泌物化学成分鉴定
韩旭,杜公福,牛玉,曹振木(中国热带农业科学院热带作物品种资源研究所,海南儋州,571737)
水培法收集甜椒根系分泌物化学成分鉴定
韩旭,杜公福,牛玉,曹振木
(中国热带农业科学院热带作物品种资源研究所,海南儋州,571737)
摘要:采用水培法收集甜椒的根系分泌物,硅胶柱层析法分离根系分泌物,用气质联用仪(GC-MS)鉴定各组分的化学成分。研究结果表明,甜椒根系分泌物石油醚组分GC-MS鉴定图谱共出现49个物质峰,相似度大于85%的化学物质共35个;乙酸乙酯组分GC-MS鉴定图谱共出现62个物质峰,相似度大于85%的化学物质共35个;氯仿组分GC-MS鉴定图谱共出现68个物质峰,相似度大于85%的化学物质共28个;甲醇组分GC-MS鉴定图谱共出现51个物质峰,相似度大于85%的化学物质共35个。甜椒根系分泌物中含有烷烃类、酯类、醇类、酚类、醛类、噻唑类、喹啉类、脲类、醋酸盐类、胺类化合物。
关键词:甜椒;根系分泌物;化学成分;鉴定;水培法
科研院所基本科研业务费专项资金(1630032014020)韩旭(1983-),女,博士,助理研究员,主要从事蔬菜栽培生理生态研究,电话:0898-23301285,
E-mail:hanxu_0216@126.com
曹振木(1972-),男,通信作者,研究员,本科,硕士生导师,主要从事蔬菜作物遗传育种研究,
电话:0898-23300308,E-mail:caozhenmu2007@163.com
根系分泌物是复杂的非均一体系,通常指在特定的环境下,活体植物根系的不同部位释放到根际环境中有机化合物的总称[1]。根系分泌物所含的有机化合物一般在200种以上,分为3类,一类是大分子化合物,主要包括糖、蛋白质、酶和凝胶等;一类是小分子化合物,主要包括酸、酚、酮等;一类是生长激素、黄酮、甾类等[2]。植物根系分泌物在土壤结构组成、养分活化、植物养分吸收和缓解环境胁迫等方面具有重要作用[3~5],所以对根系分泌物的研究越来越引起重视。水培收集法应用广泛,操作简单,在一定程度上反映某些特定根系分泌物的变化,并排除土壤微生物的干扰[6]。气相质谱联用仪是鉴定植物根系分泌物化学成分的常用方法,具有需样量小、灵敏度高、健全数据库比对等特点。因此,采用水培法和气质联用法分离鉴定植物根系分泌物的化学成分是切实可行的,对于解决连作障碍问题具有重要意义。
甜椒(Capsicum fructescens L.),俗称灯笼椒、柿子椒,是茄科辣椒属辣椒的一个变种,广泛种植于我国南北各地,营养丰富,特别是VC含量位居各类蔬菜之首,深受广大消费者喜爱[7,8]。但栽培管理制度的不合理及生产环境的局限性等因素导致甜椒连作障碍日益加剧,严重影响辣椒生长发育、果实品质和产量形成,根系分泌物的逐年累积是导致连作障碍的重要因素。因此,本研究通过水培法收集甜椒的根系分泌物,采用硅胶柱层析法分离和GCMS鉴定根系分泌物的化学成分,为甜椒根系分泌物的深入研究提供理论基础,对减缓甜椒的连作障碍具有重要指导意义。
1 材料与方法
1.1试验材料
供试甜椒品种为热甜5号,由中国热带农业科学院热带作物品种资源研究所瓜菜研究室提供。
1.2试验方法
①甜椒根系分泌物的收集采用水培法收集甜椒的根系分泌物。将石英砂高温高压灭菌,70℃烘干备用,然后将催芽后的热甜5号种子播于含有石英砂的培养箱中,待第1片真叶展开,向培养箱中注入过量蒸馏水,慢慢拔出辣椒幼苗,尽量不伤根系,留待种植于水培装置的培养箱中。用培养箱、泡沫板和通气泵自制辣椒水培装置,将Hoagland营养液置于培养箱中,用量是培养箱容积的2/3。在泡沫板上均匀打小孔,然后将辣椒幼苗定植于小孔中,悬浮于培养箱中。室内人工光照培养,适时通气。每5 d收集1次含根系分泌物的营养液并补充新的营养液,共收集7次,混合各收集液并通过双层定性滤纸过滤和0.45 μm的水系微孔滤膜抽滤,即得到根系分泌物粗提物。用滤纸拭干甜椒根系并称质量,减压浓缩到30.0 g/L,即得到辣椒根系分泌物粗提物的原液。
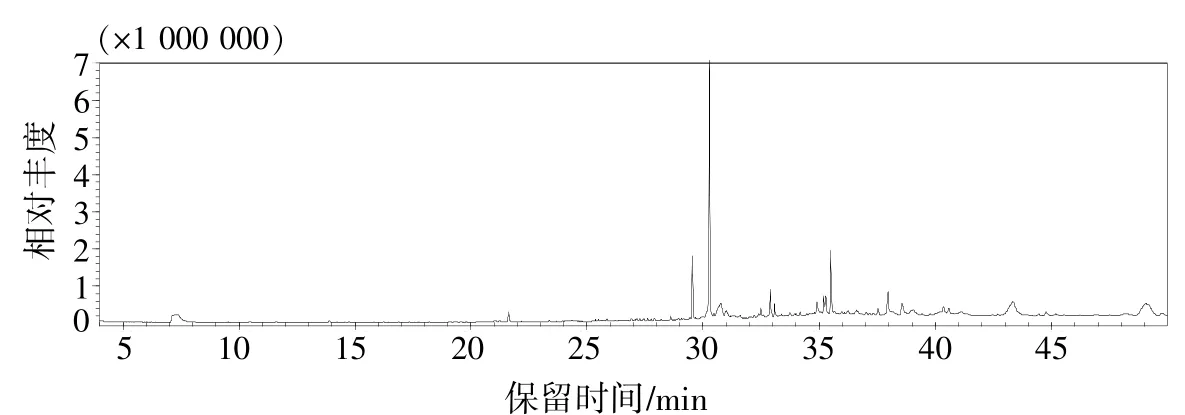
图1 甜椒根系分泌物石油醚组分GC-MS鉴定结果
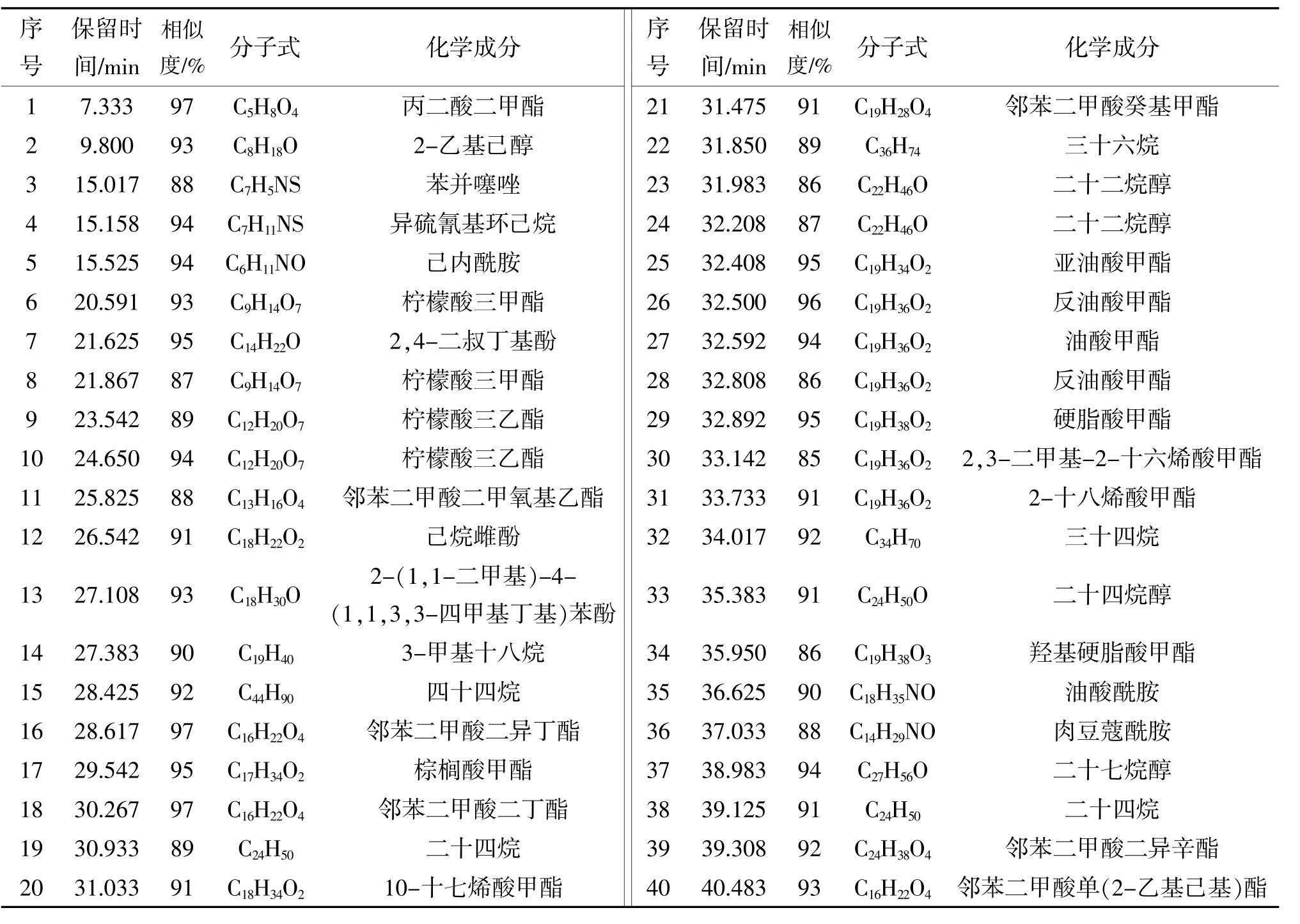
表1 甜椒根系分泌物石油醚组分化学成分分析
②甜椒根系分泌物化学成分的分离将50 mL甜椒根系分泌物粗提物原液与5 g硅胶(BDH 200~300目)混匀,40℃水浴蒸干,作为提取物。用石油醚(60~90℃)和100 g硅胶(BDH 200~300目)填充色谱柱(200 mm×30 mm),静置过夜。将提取物置于色谱柱顶端,根据有机溶剂极性按照从小到大的顺序,分别用500 mL石油醚、乙酸乙酯、氯仿和甲醇逐级洗脱,流速控制在1~2 s/滴。分别收集各洗脱液,40℃减压浓缩至干,并溶于10 mL甲醇(色谱纯),-20℃冰箱保存,进一步鉴定化学成分。
③甜椒根系分泌物化学成分的鉴定采用气相质谱联用仪(ThermoFisher GC-MS,Trace GC ultra-DSQ-AI3000,USA)鉴定甜椒根系分泌物的化学成分。GC-MS分析条件如下。
a.色谱条件。毛细管柱DB5-MS(30m×0.25mm,膜厚度0.25μm);载气He(流速1.0mL/min);进样口温度250℃;程序升温:柱温50℃(保持2 min),以6℃/ min程序升温至250℃(保持15 min)。
b.质谱条件,离子源温度200℃;EI源(电子轰击源);轰击电压70 eV;扫描范围m/z 30~600 amu;1 μL进样,不分流。
c.化学成分的筛选。根据数据库筛选的结果,选择相似度≥85%的化合物为中椒105根系分泌物的有效化学成分。
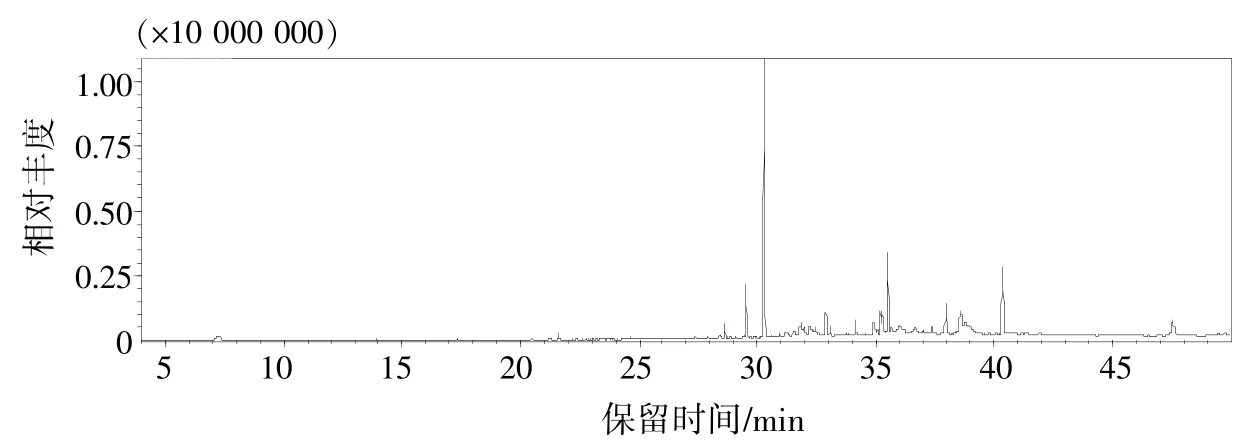
图2 甜椒根系分泌物乙酸乙酯组分GC-MS鉴定结果

表2 甜椒根系分泌物乙酸乙酯组分化学成分分析
2 结果与分析
2.1石油醚组分GC-MS鉴定结果
由图1可见,共出现49个物质峰,第一个出峰时间为6.589 min,最后一个出峰时间为49.074 min,主要出峰时间集中在27~36 min,最大峰面积出现在30.272 min。
如表1所示,热甜5号根系分泌物石油醚组分中相似度大于85%的化合物共有35个,其中烷烃类化合物6个、酯类化合物18个、醇类化合物4个,酚类化合物3个、噻唑类化合物1个、酰胺类化合物3个。
2.2乙酸乙酯组分GC-MS鉴定结果
由图2可见。共出现62个物质峰,第一个出峰时间为7.244 min,最后一个出峰时间为47.553 min,主要出峰时间集中在28~39 min,最大峰面积出现在30.291 min。
如表2所示,热甜5号根系分泌物乙酸乙酯组分中相似度大于85%的化合物共有35个,其中烷烃类化合物13个、酯类化合物11个、酚类化合物1个、醇类化合物3个、胺类化合物5个、醋酸盐类化合物2个。

图3 甜椒根系分泌物氯仿组分GC-MS鉴定结果
2.3氯仿组分GC-MS鉴定结果
由图3可知,共出现68个物质峰,第一个出峰时间为7.305 min,最后一个出峰时间为46.784 min,主要出峰时间集中在30~41 min,最大峰面积出现在40.659 min。
热甜5号根系分泌物氯仿组分相似度大于85%的化合物共有28个(表3),其中酯类化合物10个、醛类化合物1个、酚类化合物3个、喹啉类化合物1个、烷烃类化合物7个、醇类化合物2个、胺类化合物2个、脲类化合物1个、醋酸盐类化合物1个。
2.4甲醇组分GC-MS鉴定结果
由图4可知,共出现51个物质峰,第一个出峰时间为6.050 min,最后一个出峰时间为46.767 min,主要出峰时间集中在27~41 min,最大峰面积出现在40.485 min。
热甜5号根系分泌物甲醇组分相似度大于85%的化合物共有35个(表4),其中酯类化合物18个、噻唑类化合物1个、酚类化合物3个、烷烃类化合物6个、醇类化合物4个、酰胺类化合物3个。
3 讨论与结论
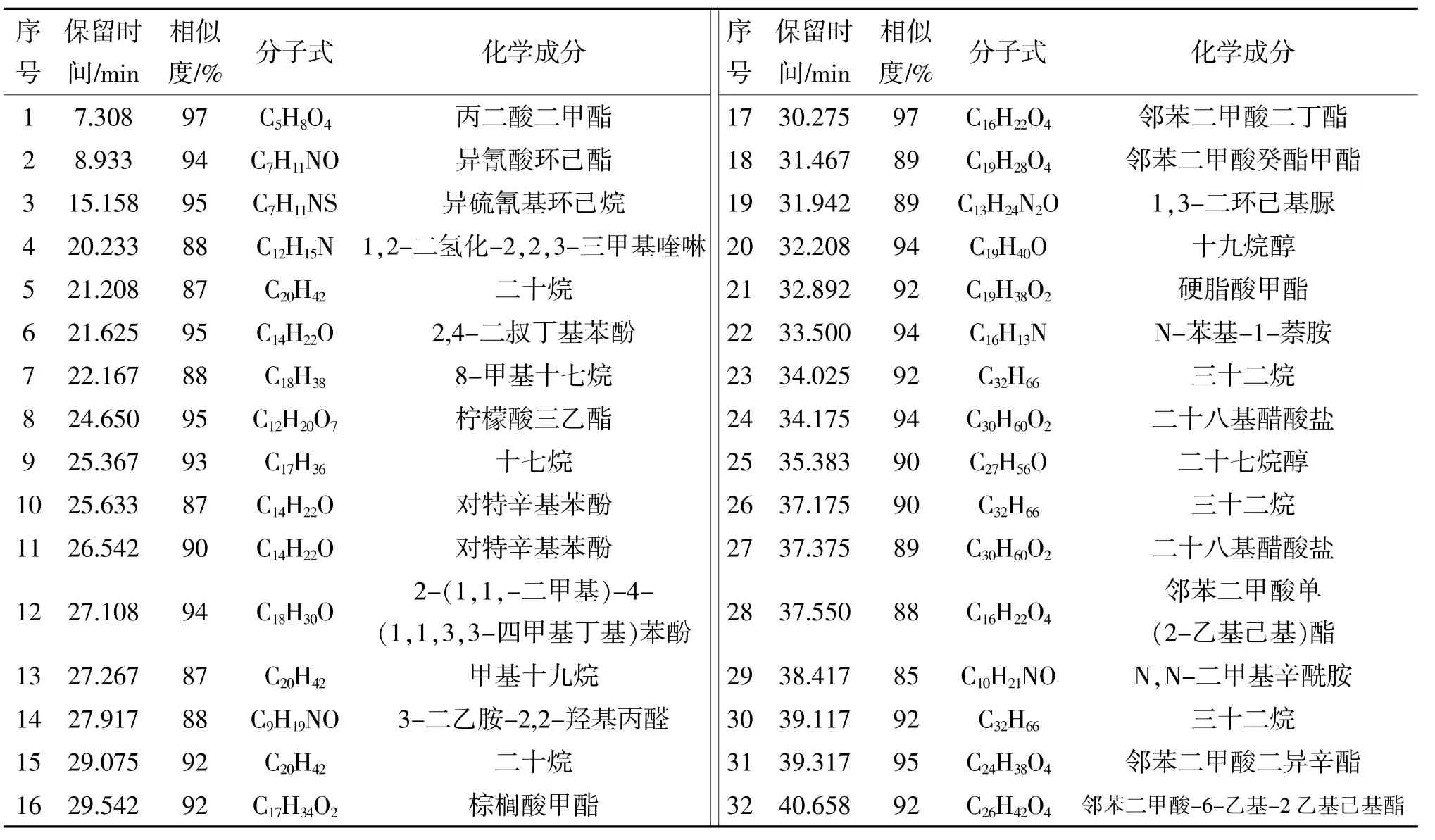
表3 甜椒根系分泌物氯仿组分化学成分分析
对辣椒根系分泌物的收集通常采用水培的方法[9,10],虽然水培植物的根毛发育较少,缺乏土壤的机械阻力,与植物在土壤中生长分泌的物质略有不同,但也能反映根系分泌物中的化学成分,能够排除土壤微生物对其的干扰。因此,本研究采用水培法对甜椒的根系分泌物进行收集,既保证了甜椒的正常生长,又很好地消除了其他植物或土壤微生物对根系生长的干扰。
本试验结果表明,水培法收集的甜椒根系分泌物中主要含有烷烃类、酯类、醇类、酚类、醛类、噻唑类、喹啉类、脲类、醋酸盐类、胺类化合物。前人研究结果表明,线椒根系分泌物中主要含有酸类、酮类、胺类、酯类、醇类、酚类、烃类、苯及其他杂环类物质[9];大白菜根系分泌物中主要含有烷烃类、酸类、酯类物质[11];油菜根系分泌物中主要含有烷烃类、醇类、酯类、酸类物质[12];大豆根系分泌物中含有烷烃类、醇类、酸类、酚类、醛类、酯类化合物[13,14];花生根系分泌物中含有有机酸、醇类、醛类、酮类、烃类、酯类物质[15];人参根系分泌物中主要含有烷烃类、酯类、酸类物质[16];丹参根系分泌物中主要含有烷烃类、醇类、酸类、酯类、醛类物质[17];低效刺槐根系分泌物中主要含有酸类、酯类、醇类物质[18]。本研究结果与其基本一致,不同作物根系分泌物含有不同种类的化学成分。

图4 甜椒根系分泌物甲醇组分GC-MS鉴定结果

表4 甜椒根系分泌物甲醇组分化学成分分析
已有研究表明,植物释放到环境中的化感物质可分为14大类,包括有机酸、脂肪族醛和酮、直链醇、长链脂肪酸和多炔、简单不饱和内酯、苯甲酸及其衍生物、萘醌、蒽醌和复合醌、肉桂酸及其衍生物、简单酚、香豆素类、类萜和甾类化合物、类黄酮、单宁、生物碱和氰醇、硫化物和芥子油苷、氨基酸和多肽、嘌呤和核苷[19~22]。本研究中水培甜椒根系分泌物中也可能含有化感物质,逐年累积产生化感自毒作用,导致连作障碍的发生,但哪些化学成分是化感物质,起到化感自毒作用,还有待进一步研究。
参考文献
[1]吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报,2014,38(3):298-310.
[2]陈龙池,廖利平,汪思龙,等.根系分泌物生态学研究[J].生态学杂志,2002,21(6):57-62.
[3]Guo T R,Zhang G P,Zhou M X,et al.Influence of aluminum and cadumium stresses on mineral nutrition and root exudates in two barley cultivars[J].Pedosphere,2007,17(4):505-512.
[4]Xie MJ,Yan C L,Ye J.Effect of phenanthrene on the secretion oflowmolecule weight organic compounds by rye grass root[J].EcologyandEnvironment,2008,17(2):576-579.
[5]Zeng F,Chen S,Miao Y,et al.Changes of organic acid exudation and rhizosphere pH in rice plants under chromium stress[J].Environmental Pollution,2008,155(2):284-289.
[6]涂书新,吴佳.植物根系分泌物的研究方法评述[J].生态环境学报,2010,19(9):2 493-2 500.
[7]刘凯歌,宋云鹏,龚繁荣,等.高温胁迫对甜椒幼苗生长和生理生化指标的影响[J].上海农业学报,2015,31(3):63-67.
[8]孙克香,杨莎,郭峰,等.高温强光胁迫下外源钙对甜椒(Capsicum fructescens L.)幼苗光合生理特性的影响[J].植物生理学报,2015,51(3):280-286.
[9]谢振华,赵尊练,武国平,等.线辣椒不同生育阶段根系分泌物的组分分析[J].西北农业学报,2012,21(8):175-181,206.
[10]张婷玉,林多,杨延杰.辣椒根系分泌物的收集方法研究[J].北方园艺,2014(12):14-17.
[11]张照然,范黎明,吴毅歆,等.大白菜根系分泌物的GCMS分析[J].江西农业学报,2013,25(9):75-77.
[12]张红,高亚军,安蓉.油菜根系分泌物的GC-MS检测方法研究[J].农业资源与环境学报,2014,31(3):290-295.
[13]马凤鸣,王安娜,吴蕾,等.大豆根系分泌物的鉴定及PAL1,PAL2,C4H的克隆[J].作物杂志,2011(2):65-71.
[14]吴泉.分析大豆根系分泌物并检测其化感作用[J].河南科技,2013(5X):213-221.
[15]李忠,江立庚,唐荣华,等.花生根系分泌物的鉴定和化感作用研究[J].华南农业大学学报,2015,36(5):48-53.
[16]张爱华,彭洪利,雷锋杰,等.人参根系分泌物的提取与鉴定[J].西北农林科技大学学报,2014,42(7):1-6.
[17]杨先国,刘塔斯,陈斌,等.丹参根际土壤浸提物的GCMS分析[J].中国农学通报,2013,29(10):173-177.
[18]石鑫,魏天兴,陈珏,等.低效刺槐林根系分泌物的GCMS分析[J].湖南农业科学,2011(8):135-137.
[19]Kong C H,Wang P,Xu X H.Allelopathic interference of Ambrosia trifida with wheat(Triticum aestivum)[J].Agr Ecosyst Environ,2007,119(3-4):416-420.
[20]Wang P,Liang W J,Kong C H.Allelopathic potentials of volatile allelochemicals ofAmbrosia trifida L.on other plants[J].Allelopathy J,2005,15(1):131-136.
[21]Tamura Y,Hattori M,Konno K,et al.Triterpenoid and caffeic acid derivatives in the leaves of ragweed,Ambrosia artemisiifolia L.(Asterales:Asteraceae),as feeding stimulants of Ophraella communaLeSage(Coleoptera:Chrysomelidae)[J].Chemoecology,2004,14(2):113-118.
[22]Blmu U.Allelopathic interactions involving phenolic acids[J].J Nematol,1996,28(3):259-267.
Chemical Components Identification on Root Exudates of Capsicum fructescens L.by Nutrient Solution Culture
HAN Xu,DU Gongfu,NIU Yu,CAO Zhenmu
(Tropical Crops Genetic Resources Institute,Chinese Academy of Tropical Agricultural Sciences,Danzhou,Hainan 571737)
Abstract:In the paper,we collected root exudates of Capsicum fruclescens L.by nutrient solution culture,and isolated root exudates by column chromatography,then identified the chemical components of root exudates by GC-MS.The results showed that,there were 49,62,68 and 51 peaks in GC-MS chromatograms of petroleum ether,ethyl acetate,chloroform and methanol extractions of root exudates of C.fructescens L.separately,and there were 35,35,28 and 35 chemical substances with similarity over 85% correspondingly.The root exudates ofC.fructescens L.were composed of alkane,esters,alcohols,phenols,aldehydes,thiazoles,chinolines,ureas,acetate and amine compounds.
Key words:Capsicum fructescens L.;Root exudates;Chemical component;Identification;Nutrient solution culture
收稿日期:2015-10-20
基金项目:海南省自然科学基金(20153119);中央级公益性
DOI:10.3865/j.issn.1001-3547.2016.04.020
中图分类号:Q945
文献标识码:A
文章编号:1001-3547(2016)04-0047-06

