葛根素及黄豆苷元分离纯化工艺研究
杨紫薇+王舒雅+高俊+冯迟+陈怡露+雍晓雨+周俊+刘晓宁+谢欣欣+郑涛
摘要: 采用HPD800大孔吸附树脂富集葛根中的葛根素及黄豆苷元,并通过溶剂萃取以及重结晶技术分离纯化葛根素及黄豆苷元。试验结果表明:经过大孔吸附树脂富集后,葛根素的纯度从8.62%增加到35.26%、黄豆苷元的纯度从0.276%增加到10.17%;以水饱和的正丁醇作为葛根素萃取溶剂,萃取2次萃取率可达92.32%;选取乙酸乙酯作为黄豆苷元的萃取溶剂,萃取1次萃取率达到94.75%;选取90%乙酸作为葛根素结晶的溶剂,经过1次结晶,葛根素的纯度可达91.32%,收率为12.5%,黄豆苷元的纯度可达93.81%,收率为15.77%。
关键词: 葛根素;黄豆苷元;大孔树脂;富集;分离;纯化
中图分类号: R284.2 文献标志码: A 文章编号:1002-1302(2016)03-0297-03
葛根是豆科植物葛的根,是一种在我国常见的中药材,素有“亚洲人参”的美誉,具有解肌退热、透疹、生津止渴、升阳止泻的功效[1]。我国的葛根种类有10多种,较为常见的有粉葛和野葛2种,其中粉葛的淀粉含量较高,常用于淀粉食品的加工;野葛主要以野生为主,异黄酮含量较高,主要用于提取有效药用成分[2-3]。葛根中的有效药用成分是异黄酮类物质,主要包括葛根素和黄豆苷元[4]。葛根素具有降低血糖、改善心脑循环、抗氧化、延缓动脉硬化、延缓衰老、抗肿瘤等作用,国内临床上主要用于治疗心绞痛、高血压等心脑血管疾病,有资料表明葛根素对于心脑血管疾病的治愈率可以达到 97.6%[5-7]。黄豆苷元则对于治疗更年期妇女综合征、乳腺癌、预防骨质疏松有显著的疗效[8-9]。近年来中国的老龄化趋势明显,患心脑血管的患者增多,对葛根异黄酮类药物原料的需求越来越大。因此,设计高效分离纯化葛根素和黄豆苷元的工艺方法成为当下研究热点。
大孔树脂是一类以吸附作用对有机物进行浓缩、分离作用的高分子聚合物[10-11]。近年来大量文献报道采用大孔树脂分离纯化葛根素,但是葛根素的纯度均不高。刘慧敏等用HPD-200A型大孔树脂纯化葛根素,得到的粗提取物的纯度可以达到27.23%[12]。而且,近年来文献中从葛根素异黄酮中分离纯化葛根素的很多,忽略了黄豆苷元的价值。本试验采用HPD800大孔树脂富集葛根素和黄豆苷元,并采用溶剂萃取法,研究萃取次数对于萃取率的影响,再通过合适的溶剂结晶得到高纯度葛根素和黄豆苷元。
1 材料与方法
1.1 材料
葛根[Pueraria lobata (Willd.) Ohwi]购自江苏句容药材市场,阴干,粉碎。对照品葛根素(纯度≥99%)、黄豆苷元(纯度≥98%),Sigma公司产品;测定含量用乙腈,J&K Chemical Ltd产品;乙酸,Sigma公司产品,色谱纯;去离子水自制;大孔吸附树脂HPD800,郑州勤实科技有限公司产品;其他试剂均为国产分析纯。
1.2 试验仪器
Agilent 1260LC高效液相色谱仪配G1311-B自动进样器、G1311-B四元泵、G1316-A柱温箱、G1314-F紫外检测器,美国Agilent公司;Milli-Q纯水仪,美国Millipore公司;ZWY-110X50恒温水浴振荡器,上海智城分析仪器制造有限公司;玻璃层析柱(1.5 cm×30 cm),天津玻璃仪器厂;RE-52A 旋转蒸发仪,上海亚荣生化仪器厂。
1.3 分析方法
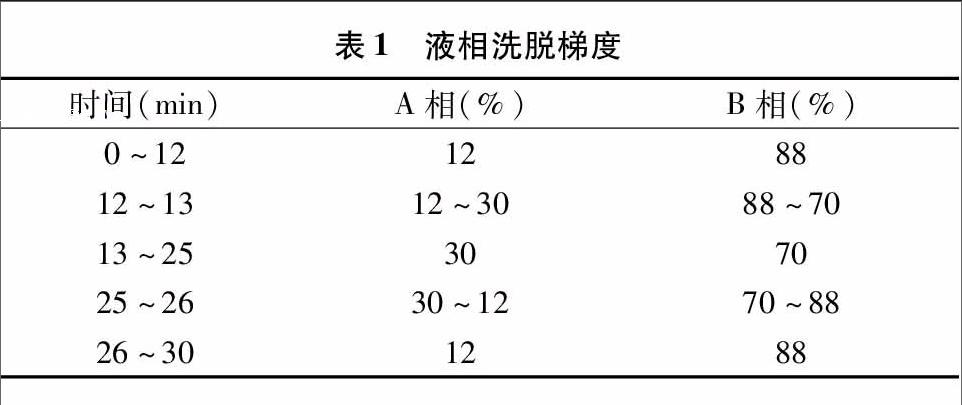
采用高效液相色谱法检测样品液中葛根素及黄豆苷元含量[13]。采用以下色谱条件: Agilent ODS-C18色谱柱(5 μm,250 mm×4.6 mm);流动相:A相为含0.1%乙酸的乙腈溶液,B相为含0.1%乙酸的水溶液(流动相配比见表1);流速为1 mL/min;柱温为25 ℃;检测波长250 nm;进样量5 μL。
1.4 葛根素及黄豆苷元标准曲线的建立
精确称取干燥至恒质量的葛根素标准品5.00 mg、黄豆苷元标准品3.00 mg于10 mL容量瓶中,用甲醇定容,作为标准品贮备液(葛根素:500 μg/mL,黄豆苷元:300 μg/mL)。用甲醇稀释标准品储备液配制成以下浓度:葛根素:250、125、62.5、31.25、15.625 μg/mL;黄豆苷元:150、75、37.5、18.75、9.375 μg/mL。分别用0.22 μm滤膜过滤后按“1.3”节中的色谱条件重复进样3次进行检测,得到液相结果后,以葛根素和黄豆苷元浓度为横坐标,以峰面积积分值为纵坐标绘制标准曲线,得葛根素和黄豆苷元回归方程:y=23 932x-22.81(r2=0.999 6)和y=33 927x-50.60(r2=0.999 6)。葛根素和黄豆苷元的浓度分别在10~300 μg/mL和5~250 μg/mL范围内时葛根素和黄豆苷元的浓度与峰面积线性关系良好。
1.5 葛根提取液的制备
准确称取5 g葛根粉末(过60~80目筛),按照葛根粉末 ∶ 乙醇=1 g ∶ 8 mL加入体积分数为70%的乙醇浸泡2 h,再以90℃水浴回流提取2 h后趁热滤去葛根渣,并收集滤液。利用旋转蒸发仪将滤液蒸成浸膏,并将浸膏烘干得葛根黄酮粉末,用去离子水配置成葛根素和黄豆苷元的含量分别为1.527、0.140 mg/mL的溶液备用。
1.6 葛根素及黄豆苷元富集液的制备
1.6.1 葛根素和黄豆苷元的上样吸附 选用大孔树脂HPD800富集葛根提取液中的葛根素及黄豆苷元,具体操作如下:称取10.0 g预处理好的树脂,采用湿法装柱,测得柱体积(1 BV)为14 mL;将提取液pH值调至6,在25℃条件下进行吸附,流速为1 BV/h。
1.6.2 葛根素及黄豆苷元富集液的制备 当树脂吸附饱和后,用1 BV去离子水洗涤树脂除去杂质,在25℃条件下用70%乙醇解吸,流速为1 BV/h,得葛根素和黄豆苷元富集液。按式(1)计算葛根素及黄豆苷元的纯度:
P=CpVp Mp×100%。
(1)
式中:P为葛根素或黄豆苷元样品纯度,%;Cp为葛根素或黄豆苷元样品浓度,mg/mL;Vp为样品溶液的体积,mL;Mp为葛根黄酮粉末质量,mg。
1.7 葛根素及黄豆苷元的分离纯化
1.7.1 葛根素和黄豆苷元的分离 将富集液减压浓缩至无醇味,取10 mL分别加入10 mL乙酸乙酯、乙醚、三氯甲烷进行萃取[14-15],HPLC检测其有机溶剂中的葛根素和黄豆苷元的含量,选择合适的萃取溶剂,按式(2)计算葛根素及黄豆苷元的萃取率:
G=CgVg Mg×100%。
(2)
式中:G为葛根素及黄豆苷元的萃取率,%;Cg为萃取剂中葛根素和黄豆苷元的浓度,mg/mL;Vg为萃取溶液的体积,mL;Mg为富集液中葛根素及黄豆苷元的质量,mg。
1.7.2 黄豆苷元结晶 选取合适的有机溶剂作为黄豆苷元的萃取溶剂,并考察萃取次数对于黄豆苷元萃取率的影响。然后将黄豆苷元萃取液减压蒸干得黄豆苷元粗品,称取黄豆苷元粗品1.0 g,加入40 mL 50%乙醇溶液进行结晶。
1.7.3 葛根素结晶 将“1.7.1”节中萃余相减压浓缩,除去其中少量的有机溶剂,以水饱和的正丁醇为萃取溶剂萃取其中的葛根素,并考察萃取次数对于葛根素萃取率的影响。然后将葛根素萃取液减压蒸干得葛根素粗品,称取葛根素粗品1.0 g,加入40 mL 90%乙酸溶液进行结晶。
2 结果与分析
2.1 葛根素及黄豆苷元富集液的制备
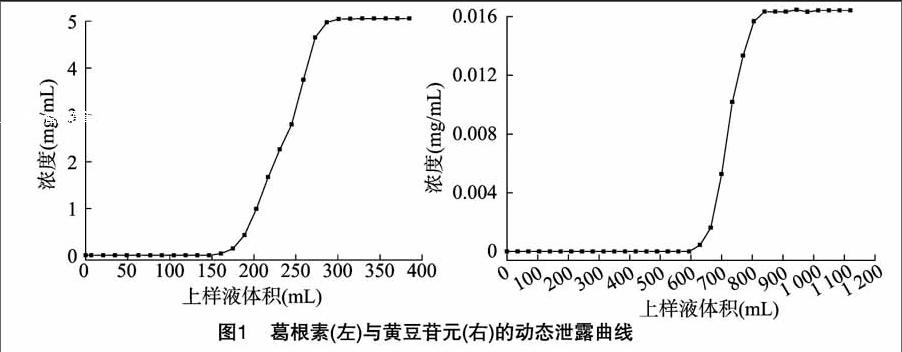
2.1.1 提取液的上样吸附 本试验采用大孔树脂HPD800对葛根素和黄豆苷元进行吸附,试验结果如图1所示:当上样液中葛根素及黄豆苷元的含量分别为1.527 mg/mL和0.140 mg/mL,上样流速为1 BV/h时,上样液用量为840 mL(60 BV),此时树脂对葛根素及黄豆苷元的吸附均已达饱和,其饱和吸附量分别为(71.78±0.75) mg/g和(21.77±0.01)mg/g。
2.1.2 葛根素及黄豆苷元富集液的制备 以70%的乙醇溶液为解析液对树脂上吸附的葛根素及黄豆苷元进行解析。试验结果如图2所示:在解析流速为1 BV/h时,解析液用量为140 mL(10 BV),此时葛根素及黄豆苷元的吸附均可解析完全。经过大孔树脂分离纯化后,葛根素的纯度从8.62%增加到35.26%、黄豆苷元的纯度从0.276%增加到10.17%,且葛根素和黄豆苷元的回收率分别为81.71%和79.59%。
2.2 葛根素及黄豆苷元的分离纯化
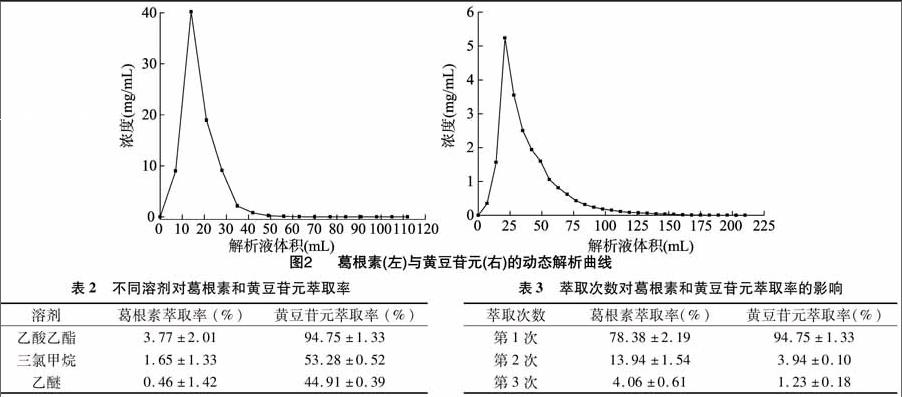
2.2.1 葛根素和黄豆苷元的分离 葛根素和黄豆苷元的极性相差较大,且在同种溶剂中的溶解度相差较大,因此本试验拟通过溶剂萃取技术,达到富集液中葛根素和黄豆苷元分离的效果。本试验考察了不同有机溶剂对葛根素和黄豆苷元萃取率的影响,结果见表2。可以看出,用乙酸乙酯可以对葛根素和黄豆苷元达到很好的分离效果,对黄豆苷元的萃取率高达(96.75±1.33)%。且乙酸乙酯较三氯甲烷和乙醚安全性更高,故而选择乙酸乙酯作为葛根素和黄豆苷元的分离溶剂。
2.2.2 萃取次数对葛根素和黄豆苷元萃取率的影响 选择乙酸乙酯作为黄豆苷元的萃取溶剂,并考察了萃取次数对黄豆苷元萃取率的影响,结果(表3)表明,等体积乙酸乙酯萃取1次就能将溶液中大部分的黄豆苷元萃取出来, 因此选择黄豆苷元的萃取次数为1次。选择水饱和的正丁醇作为葛根素的萃取溶剂,并考察了萃取次数对葛根素萃取率的影响,结果(表3)表明,等体积水饱和的正丁醇萃取2次能将溶液中大部分黄豆苷元萃取出来,因此选择葛根素萃取次数为2次。
2.2.3 葛根素结晶 将葛根素及黄豆苷元粗品分别用10%乙酸和50%乙醇结晶1次,得到葛根素和黄豆苷元产品,其纯度分别为91.32%和93.81%,回收率分别为12.5%和15.77%。图3给出了葛根素(A)及黄豆苷元(B)结晶后的HPLC色谱图,可以看出,经过不同的溶剂结晶后,葛根素及黄豆苷元样品中的杂质含量显著减少。
3 结论
经过HPD800型大孔吸附树脂富集后,葛根素的纯度从8.62%增加到35.26%、黄豆苷元的纯度从0.276%增加到10.17%,用乙酸乙酯可以对葛根素和黄豆苷元达到很好的分离效果并且同时萃取黄豆苷元,萃取的次数对于萃取率来说也有很大的影响。以水饱和的正丁醇作为葛根素萃取溶剂,萃取2次萃取率可达92.32%。黄豆苷元用乙酸乙酯萃取1次的萃取率就可以达到94.75%。
选取90%乙酸作为葛根素重结晶的溶剂,经过1次重结晶,葛根素的纯度可达91.32%,收率为12.5%,黄豆苷元的纯度可达93.81%,收率为15.77%。
本研究所提出的方法可以快速有效地分离、纯化葛根素和黄豆苷元,适合用于葛根素和黄豆苷元的工业化生产。
参考文献:
[1]郑 皓.葛根的研究与开发现状[J]. 氨基酸和生物资源,2006,28(2):24-26,31.
[2]冯瑞芝,陈碧珠,连文琰,等. 葛根的资源调查[J]. 中国药学杂志,1993,28(5):273-275,318.
[3]Mitich L W. Kudzu [Pueraria lobata (Willd. ) Ohwi][J]. Weed Technology,2000,14(1):231-235.
[4]文颖娟,邓中甲. 葛根功效的理论探讨[J]. 北京中医药,2008,27(2):136-138.
[5]张 雁,张孝祺. 葛根的营养保健功能及开发利用[J]. 食品研究与开发,2000(2):37-39.
[6]范树国,赵朝英,邱 璐,等. 不同提取方法对葛根总黄酮得率的影响[J]. 江苏农业科学,2012,40(1):233-235.
[7]Cherdshewasart W,Sutjit W. Correlation of antioxidant activity and major isoflavonoid contents of the phytoestrogen-rich Pueraria mirifica and Pueraria lobata tubers[J]. Phytomedicine,2008,15(1/2): 38-43.
[8]丁 鼎,颜继忠. 大豆异黄酮纯化研究现状[J]. 化工时刊,2011(4):35-38.
[9]张 蕊,姜义宝,杨玉荣,等. 大豆异黄酮的特性及其应用研究进展[J]. 动物营养学报,2011,23(11):1884-1890.
[10]崔九成,蒙跃龙,杨 钧. 大孔树脂分离葛根总黄酮研究[J]. 西北药学杂志,1999,14(4):154-155.
[11]米靖宇,宋纯清. 大孔吸附树脂在中草药研究中的应用进展[J]. 中成药,2001,23(12):914-917.
[12]刘慧敏,杜守颖,陆 洋,等. 大孔树脂纯化葛根的使用次数和再生方法[J]. 天津中医药,2014(3):177-180.
[13]Wang S Y,Gao J,Chen Y L,et al. Optimisation of the ethanol-based heat reflux extraction of isoflavones from Pueraria lobata (Willd. ) Ohwi root[J]. Advanced Materials Research,2014,955: 180-186.
[14]杨红红,符悦冠,肖 烽,等. 中药茜草根乙酸乙酯萃取物的分离及抗氧化活性研究[J]. 武汉工程大学学报,2010,32(12):1-5.
[15]王利亚,万惠杰,陈连喜,等. 茯苓乙醚萃取物化学成分研究[J]. 中国中药杂志,1993,18(10):613-614,639.

