2种药用植物在喀斯特生境下的光合特征及适生性
王瑞+吴沿友+邢德科+杭红涛
摘要: 为筛选喀斯特生态修复植物,探讨植物配置方案,利用Li-6400便携式光合测定系统分别测定了莽草、长刺楤木2种药用植物叶片的光合作用日变化特征,并结合植物叶片各生理生态因子对净光合速率(Pn)影响的通径分析、叶绿素含量、碳酸酐酶活力和稳定碳δ13C同位素组成对比了2种植物在喀斯特生境下的适生能力。结果表明:长刺楤木的大多数光合作用指标(Pn、LUE、Cond、Ci、Tr)均高于莽草,且具有较高的抗胁迫能力和碳酸酐酶活力;2种药用植物在相同喀斯特生境下表现出不同的适应机制,长刺楤木的喀斯特适生性高于莽草,但莽草的抗干旱能力强于长刺楤木。
关键词: 喀斯特;莽草;长刺楤木;适生性;光合生理特征
中图分类号: S567.901 文献标志码: A 文章编号:1002-1302(2016)03-0216-04
生态修复是治理喀斯特石漠化地区的有效途径[1-2],而合理的植物种群、群落构建是该领域的共性关键技术[3],因此喀斯特地区适生植物的选择就显得至关重要。喀斯特地貌因存在石漠化、干旱溶岩、土地瘠薄、高pH值、高钙、高重碳酸盐及高钙镁浓度等限制因素而被认定为一种特殊的脆弱生境,严重影响植物的生长发育[4]。但有研究表明,部分植物可借助体内的碳酸酐酶调节控制每一个与气孔开闭有关的保卫细胞,且可在碳酸酐酶作用下利用无机碳源进行光合作用[5]。近年来研究表明,喀斯特适生植物可交替使用大气中的CO2和土壤中的重碳酸盐,经碳酸酐酶的催化作用进行光合作用而正常生长,且碳酸酐酶活力可作为植物喀斯特适生性的有力判据[6-9]。高适生性喀斯特先锋植物的合理配置不仅可有效发挥喀斯特生态修复效用,还在低成本固碳增汇方面具有相当优势[10]。在选择、配置喀斯特生态修复作物的同时,若能兼顾经济价值和碳汇效应,可有效激发种植者的积极性和环保效益,对修复和改善喀斯特生态系统具有促进意义。
长刺楤木(Aralia spinifolia Merr)、莽草(Illicium lanceolatum A.C.Smith)在贵州喀斯特山区广泛分布,且资源丰富[11-12],具有一定药用价值。长刺楤木根、根皮主要含皂苷类化合物,可供药用,具有驳骨、拔毒之功效,具有治头昏、头痛、风湿痹痛、跌打损伤、蛇伤,以及强壮、免疫促进、抗肿瘤、抗溃疡和保肝等作用[13]。莽草因含有seco-prezizaane类型的倍半菇类化合物而具有杀虫、抗氧化、抗菌、镇痛、抗肿瘤等多种药理活性,有研究者正尝试从莽草中寻找高效、安全、依赖性小的抗炎、镇痛新药先导化合物[12]。
笔者所在课题组在喀斯特生态修复植物筛选、配置的野外试验中发现,长刺楤木、莽草在贵州喀斯特山区长势良好,资源丰富。本研究考察野生长刺楤木、莽草在喀斯特生境下的光合作用特征参数,并通过稳定性碳同位素技术、碳酸酐酶活力对这2种药用植物的喀斯特适生性进行比较,以期为喀斯特生态修复的适生植物筛选和配置提供科学依据。
1 材料与方法
1.1 研究区域概况、材料与处理
研究区域为贵州省六盘水市玉舍国家森林公园(喀斯特原始森林),地理位置为104°47′813″~104°50′385″E、26°27′508″~26°27′881″N,总面积为3 342.27 hm2,海拔 1 700~2 503 m,属于典型的亚热带季风气候,立体气候较为明显。土壤类型主要为由玄武岩、石灰岩等发育的山地黄壤土,相关指标为铵态氮含量(11.01±2.2) mg/L,有效钾含量(29.67±5.64) mg/L,速效钾含量(31.53±5.64) mg/L,pH值5.24±0.19,含盐量(0.03±0.26)%,有机质含量(6.43±2.41)%。年平均温度为12 ℃左右,最低温度为1月份的 3 ℃,最高温度为7月份的22 ℃,年平均降水量为 1 380 mm;雨热同季,湿度大,降水主要集中在4—10月;植被丰富,具有近700种药用种子植物,是目前六盘水市保护较好的原始喀斯特天然森林植被[14-15]。本试验测定该区域内具有代表性的植株叶片光合作用日变化特征参数;采集相应叶片封存于液氮中,带回实验室测定相应植物叶片的碳酸酐酶活力、叶绿素含量和稳定碳同位素δ13C值。
1.2 光合作用日变化特征参数测定
光合作用日变化特征参数于2012年5月13日(晴朗)测定,分别从试验植株的第4张叶(从展开心叶向下数)开始,选取健康、完全展开叶进行测定(测定时用缓冲瓶使CO2浓度相对稳定,每张叶测3次,取平均值)。每隔2 h用Li-6400光合仪连续测定光合作用日变化特征参数,具体包括净光合速率[Pn,μmol/(m2·s)]、蒸腾速率[Tr,mmol /(m2·s)]、气孔导度[Cond,mmol/(m2·s)]、胞间CO2浓度(Ci,μmol/mol)、大气CO2浓度(Ca,μmol/mol)、光合有效辐射[Par,μmol/(m2·s)]、大气温度(Ta, ℃)、大气相对湿度(RH,%)等特征参数,并计算出叶片光能利用率(LUE,即Pn/Par,%)、瞬时水分利用效率(WUE,即Pn/Tr,以CO2计,μmol/mmol)。
1.3 叶绿素荧光参数测定
当日光合有效辐射达到并保持0 μmol/(m2·s) 1 h后,用美国Li-6400-40便携式荧光仪及配套的Li-6400-40荧光叶室进行叶绿素荧光测定。按van Kooten等方法[16]测定相应荧光参数指标:初始荧光(Fo)、最大荧光(Fm),并计算出PSⅡ最大光化学效率(Fv/Fm)=(Fm-Fo)/Fm及PSⅡ潜在活性(Fm-Fo)/Fo。
1.4 碳酸酐酶活力测定
碳酸酐酶活力采用锑微电极法进行测定[17-18],选择长势一致用于光合作用日变化特征参数测定的叶片,立即封存于液氮中带回试验室。取0.3~1.0 g植物叶片,放入预冷的研钵中,迅速加入液氮,再加入3mL巴比妥缓冲液(10 mmol/L,含巯基乙醇50 mmol/L,pH值8.3)进行研磨,取研磨液倒入5 mL离心管中,将离心管冰浴20 min后,在 13 000 r/min 下离心5 min,取上清液,冷藏待测。样品检测过程中保持反应系统温度在0~2 ℃,取待测上清液50~1 000 μL,加入15 mL 巴比妥缓冲液中,然后迅速加入10 mL预冷的(0~2 ℃)的饱和CO2蒸馏水,用pH电极监测反应体系pH值变化,记下pH值下降1个单位(如pH值从8.2~7.2)所需的时间,记为t;同时记录在酶失活条件下pH值下降1个单位所需的时间,记为t0;酶的活力用WA-unit表示(WA=t/t0-1)。
1.5 叶绿素含量的测定
植物叶片(液氮保存)叶绿素含量采用分光光度法测定[19]。
1.6 稳定碳同位素比值(δ13C)的测定
将采回的植物叶片经108 ℃杀青,再于80 ℃下烘48 h,粉碎均匀并过筛,称取3~5 mg样品装入石英管中,再装入经高温处理的氧化铜丝、铂丝(催化剂),将石英管在高温下煅烧(850 ℃保温3~4 h),确保样品中的碳全部转化成气态的CO2。称取一定量转化成供质谱仪分析的二氧化碳气体,在MAT-252质谱仪上进行测定(中国科学院地球化学研究所),测量精度范围为±0.1%,分析结果以PDB(Pee Dee Belemnite)表示,即δ13CPDB=[(13C/12C)样本-(13C/12C)标准]/(13C/12C)标准×1 000‰。
1.7 数据处理
试验数据采用Microsoft Excel 2007和SPSS 13.0统计软件进行统计分析。
2 结果与分析
2.1 2种植物的光合参数日变化
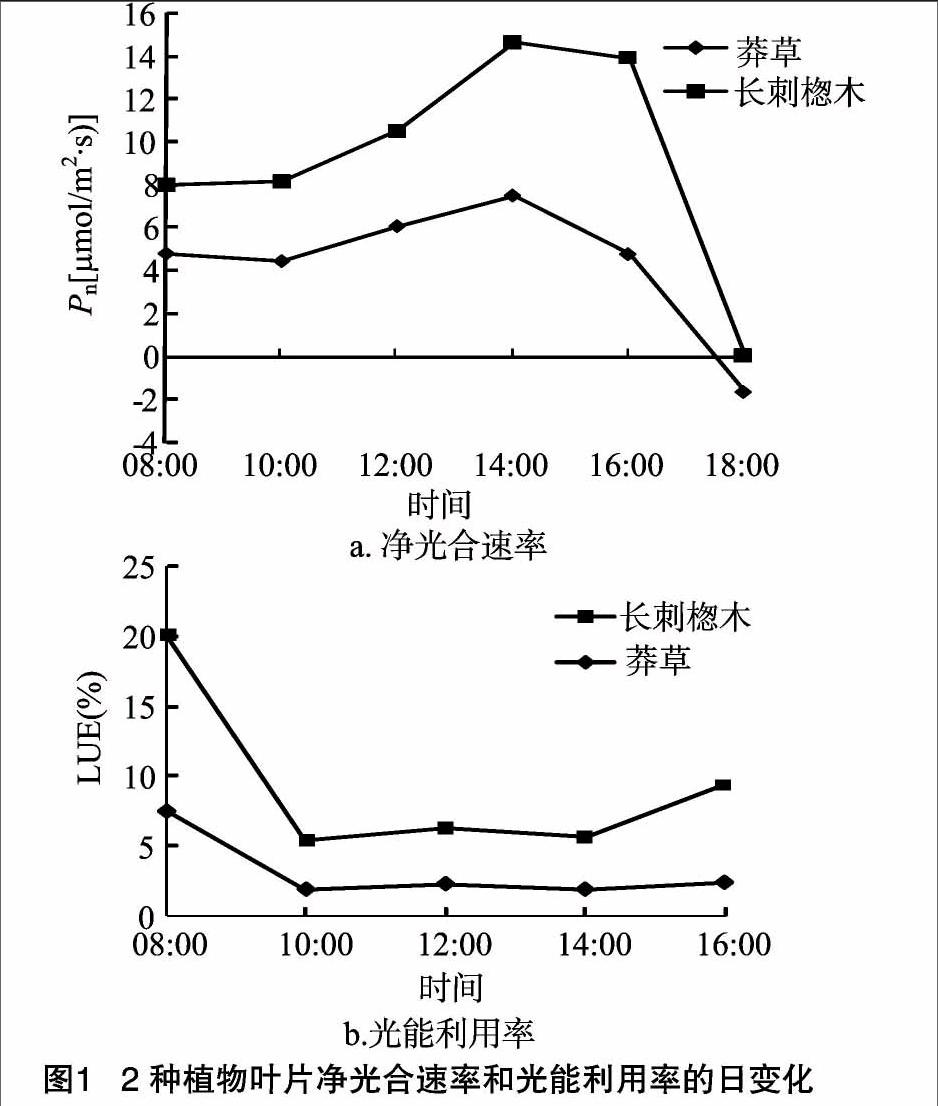
2.1.1 净光合速率和光能利用率日变化特征 由图1可见,莽草、长刺楤木叶片的净光合速率变化趋势大致相似,呈单峰趋势。2种植物叶片的Pn值都是从08:00至10:00呈下降趋势,而10:00后开始上升,14:00达到峰值[莽草:7.48 μmol/(m2·s)、长刺楤木:14.71 μmol/(m2·s)];2种植物的Pn值均在18:00达到最低值,分别为-1.65、0.03 μmol/(m2·s)。莽草、长刺楤木的日均Pn值表现为长刺楤木[(9.21±1.21) μmol/(m2·s)]>莽草[(4.31±0.69) μmol/(m2·s)],可见莽草的光合生产力高于长刺楤木。在光能利用效率方面,2种植物均表现出早晚高、中午低的变化趋势,2种药用植物光能利用效率峰值均在08:00达到最高值,10:00达到最低值;由2种植物叶片的日均LUE值[长刺楤木(6.15%)、莽草(3.19%)]可以推断出长刺楤木对于光照的利用能力高于莽草。
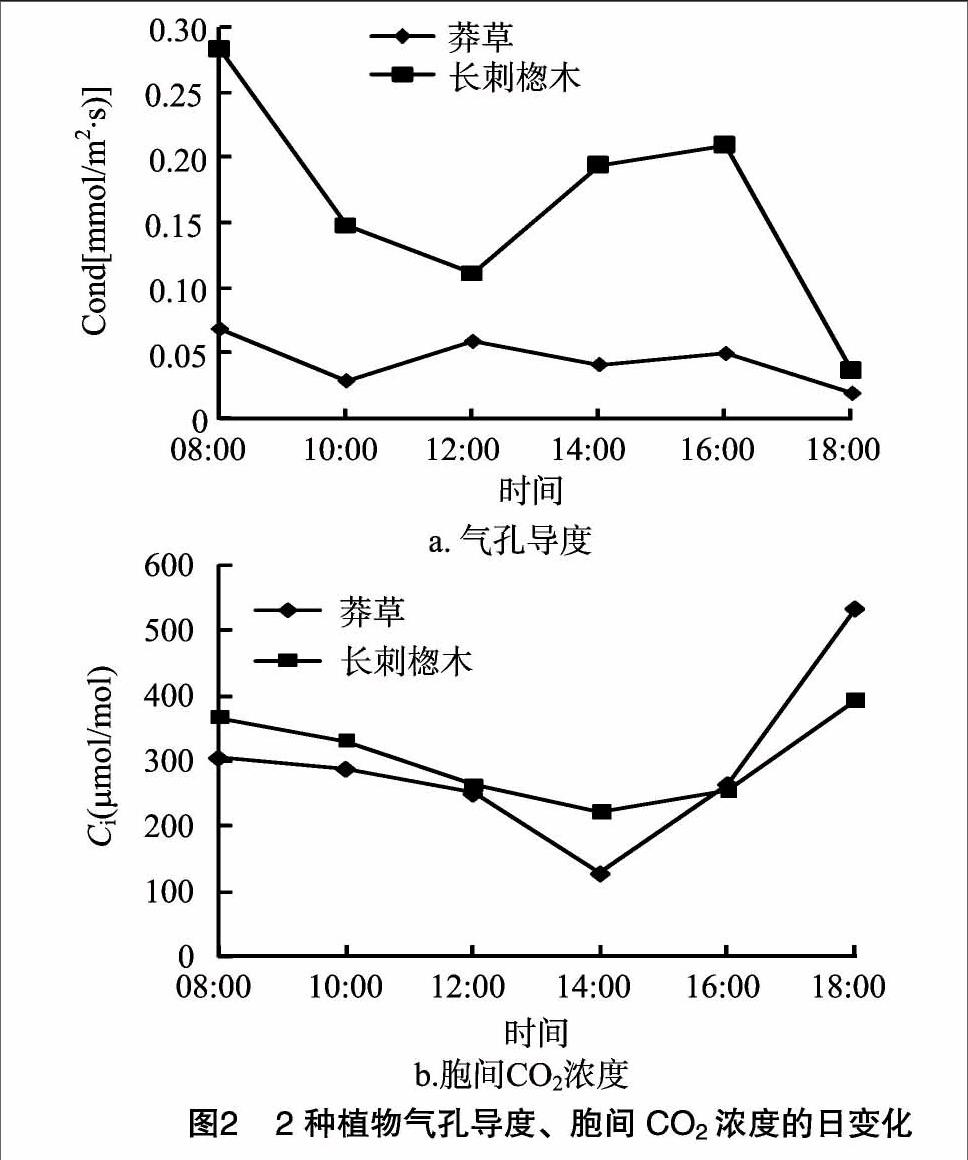
2.1.2 气孔导度和胞间CO2浓度的日变化特征 叶面上的气孔在控制CO2吸收和水分损失的平衡中起着关键作用[20]。由图2可见,08:00时2种植物叶片Cond值最高[长刺楤木:0.28 mmol/(m2·s),莽草:0.07 mmol/(m2·s)];为适应光照度增强和温度升高,2种植物的气孔导度发生不同的变化:莽草呈现以4 h为周期的波动,且受外界影响较小,而长刺楤木没有表现出明显规律;另外,长刺楤木变化曲线的波动明显强于莽草,说明长刺楤木的气孔导度更易受环境因子影响。2种植物叶片Ci值均表现出早晚高、中午低的变化趋势。08:00—14:00,Ci值呈现出与净光合速率相反的变化趋势,说明该时间段内随着2种植物叶片光合作用的增强,CO2消耗量逐渐增大,Ci降低,14:00达到峰底(长刺楤木:220.19 μmol/mol,莽草:126.91 μmol/mol),而后随着Pn的下降而回升。
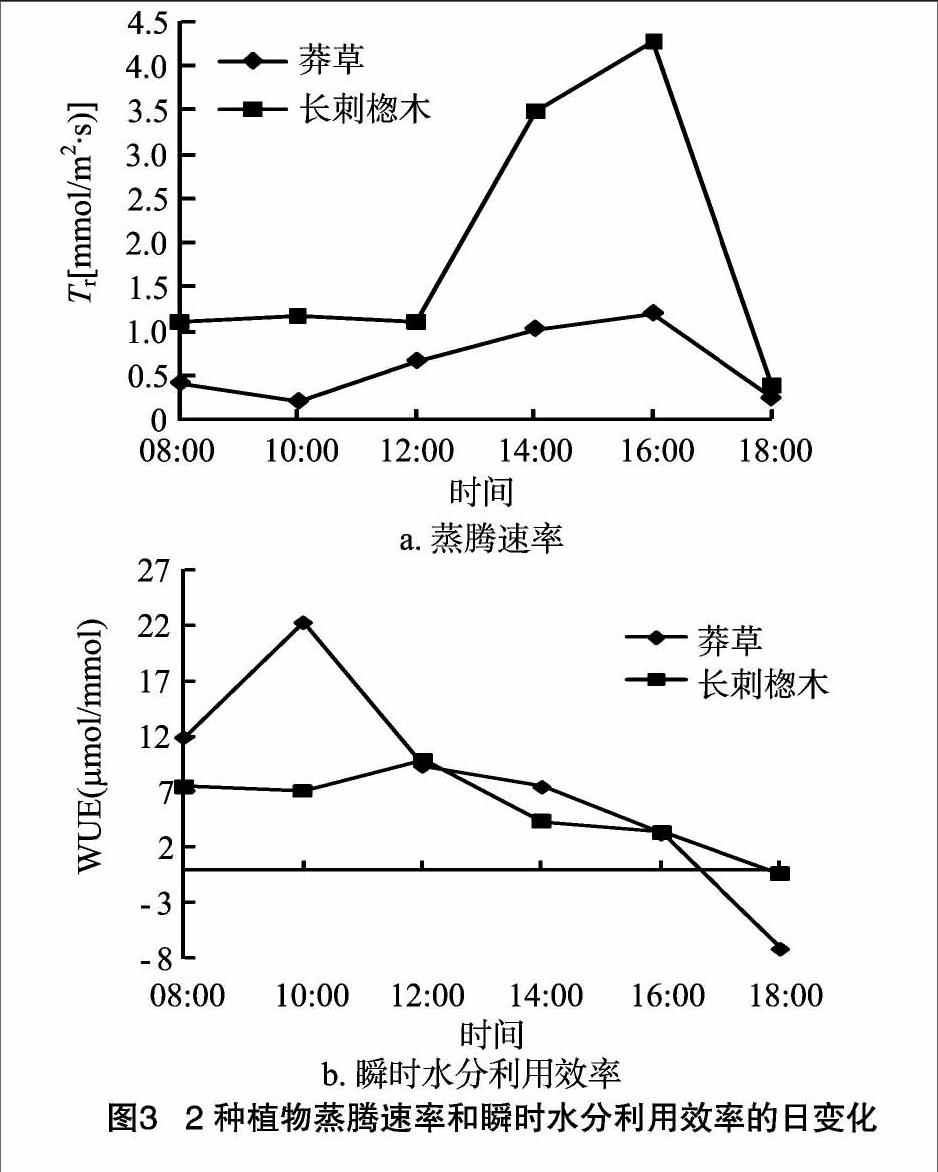
2.1.3 蒸腾速率和瞬时水分利用效率的日变化特征 由图3可见,莽草与长刺楤木的Tr日变化大致呈先上升后下降的趋势(与Pn变化趋势一致), 测定时间内2种植物Tr峰值均出现在16:00[莽草:1.19 mmol/(m2·s),长刺楤木:4.27 mmol/(m2·s)];从图3还可看出,莽草的Tr日变化较为平缓。2种植物的WUE平均值大小为莽草[(7.80±2.28) μmol/mmol]>长刺楤木[(5.21±0.86)μmol/mmol],说明莽草的瞬时水分利用效率高于长刺楤木。
2.1.4 2种植物叶片Pn与各项生理生态因子的关系 由表1、表2莽草、长刺楤木2种植物叶片的净光合速率与生理生态因子的通径分析和相关分析可以看出,在生态因子中,莽草、长刺楤木的Ca、Ta与Pn均无显著相关,其中Ca与Pn呈负相关;在2种植物的各生理因子中,莽草叶片的Ci与Pn呈极显著负相关。通径分析结果(总效应绝对值)表明,各生态因子对Pn直接作用大小为Par>RH>Ca>Ta。Par对莽草叶片Pn的最大直接效应除源于自身作用外,主要通过Ci的间接作用影响Pn,且对Pn呈最大总效应。在生理因子中,对莽草叶片Pn影响大小为Ci>Cond>Tr。对于长刺楤木而言,各生态因子对其Pn影响大小为Par>RH>Ca>Ta,而各生理因子对其Pn影响排序为Tr>Cond>Ci。
通过分析可见,对莽草Pn生态因子的决策系数(R2)大小为Par>Ta>RH>Ca,而对长刺楤木的大小也为Par>RH>Ca>Ta。不同的是对莽草Pn日变化规律的决定生态因子为Par,而长刺楤木为Par、RH,其余为限制因子。在生理因子方面,对莽草Pn生态因子的决策系数(R2)大小为Ci>Cond>Tr,而对长刺楤木大小为Tr>Ci>Cond。由表1可见,影响莽草Pn日变化规律的决定生理因子为Ci、Cond,限制因子为Tr;而对长刺楤木的决定生理因子为Tr,限制因子为Cond、Ci。
2.2 植物叶片叶绿素含量与叶绿素荧光参数
研究表明,叶绿素含量的高低能在一定程度上反映叶片的光合能力,直接影响植物的生长;而叶绿素荧光可与光合特性、水分代谢特性互补,用于揭示植物对环境生态适应性机制[21]。本研究根据相关文献报道方法[19],测得莽草、长刺楤木2种植物叶片的叶绿素含量。由表3可见,2种植物叶片叶绿素含量大小为长刺楤木>莽草,结合上述Pn、LUE检测结果可说明,长刺楤木对光能利用的能力高于莽草。
叶绿素荧光技术作为一种无损光合作用研究的探针,几乎可以反映植物叶片所有的光合作用过程。近年来,该技术在光合作用、植物胁迫生理学、水生生物学、海洋学和遥感等方面得到了广泛的应用[22]。由表3可见,长刺楤木的PSⅡ最大光化学效率(Fv/Fm)大于莽草,结合PSⅡ潜在活性(Fv/Fo)说明,长刺楤木相对于莽草表现出较高的潜在光合能力,由此可推测,在喀斯特生境下长刺楤木相对莽草具有较高的抗胁迫能力。
2.3 植物叶片的碳酸酐酶活力与δ13C 值
研究证明,具有高碳酸酐酶活力的喀斯特适生植物在遭受胁迫时,可利用碳酸酐酶的催化作用将细胞内的碳酸氢根离子转化成CO2、H2O,以弥补水分、CO2 的不足;可交替使用大气中的CO2和土壤中的无机碳进行光合作用而起到固碳增汇的目的[6,10];此外,植物根系分泌的高浓度碳酸酐酶可催化土壤中CO2、H2O转换成HCO3-、H+,以加速石灰岩溶解、提高成土速率[23]。根据文献[17]报道方法测得2种植物叶片的碳酸酐酶活力,两者大小为长刺楤木[(11 161.51±1 159.2) WAU/g]>莽草[(876.58±62.87) WAU/g]。由此可推断,在喀斯特生境下,长刺楤木的固碳增汇能力高于莽草,且具有更好的喀斯特生态修复效用。
基于稳定碳同位素的强烈分馏特征,稳定碳同位素技术被作为一种衡量植物长期水分利用效率的有效工具,即植物的δ13C值与其长期水分利用效率呈正相关[24]。研究表明,2种植物叶片的δ13C大小为莽草的(-26.931±0.015)‰>长刺楤木的(-28.82±0.004)‰,即莽草的长期水分利用效率高于长刺楤木,与上述WUE结果一致。通过对上述各指标的综合分析,可以将长刺楤木的低水分利用效率归属于该植物叶片的高Pn、Tr、Cond。因此,莽草较长刺楤木更能适应干旱环境。
3 讨论与结论
本研究通过光合作用日变化特征参数、碳酸酐酶活力和稳定性碳同位素组成的分析对莽草、长刺楤木的喀斯特适生性进行比较和讨论。在光合日变化特性方面,长刺楤木叶片的Pn、LUE、叶绿素含量均高于莽草,说明长刺楤木的作物生产力较高。经通径分析和相关分析可以看出,对莽草Pn日变化规律的决定生态因子为Par,而长刺楤木为Par、RH;莽草Pn日变化规律的决定生理因子为Ci、Cond,而长刺楤木决定生理因子为Tr。这说明不同植物即使在相同的环境条件下,也会表现出不同的适应机制。通过对比发现,长刺楤木叶绿素含量、叶绿素荧光和PSⅡ最大光化学效率均高于莽草,结合碳酸酐酶活力比较,长刺楤木[(11 161.51±1 159.2) WAU/g]>莽草[(876.58±62.87) WAU/g]可以推测,长刺楤木的喀斯特适生性高于莽草,且固碳增汇能力高于莽草,具有更好的喀斯特生态修复效用。但是莽草具有高于长刺楤木的WUE,结合稳定碳同位素分析结果可知,莽草较长刺楤木更能适应干旱环境。
参考文献:
[1]Wei Y,Yu L F,Zhang J C,et al. Relationship between vegetation restoration and soil microbial characteristics in degraded karst regions:a case study[J]. Pedosphere,2011,21(1):132-138.
[2]Zhu H H,He X Y,Wang K L,et al. Interactions of vegetation succession,soil bio-chemical properties and microbial communities in a Karst ecosystem[J]. European Journal of Soil Biology,2012,51(5):1-7.
[3]郭 柯,刘长成,董 鸣. 我国西南喀斯特植物生态适应性与石漠化治理[J]. 植物生态学报,2011,35(10):991-999.
[4]Yan J,Li J,Ye Q,et al. Concentrations and exports of solutes from surface runoff in Houzhai Karst Basin,southwest China[J]. Chemical Geology,2012,304/305(3):1-9.
[5]Hu H H,Boisson-Dernier A,Israelsson-Nordstroem M,et al. Carbonic anhydrases are upstream regulators of CO2-controlled stomatal movements in guard cells[J]. Nature Cell Biology,2010,12(1):87-U234.
[6]吴沿友,邢德科,刘 莹. 植物利用碳酸氢根离子的特征分析[J]. 地球与环境,2011,39(2):273-277.
[7]吴沿友,刘从强,李萍萍,周文美,王宝利. 利用碳酸酐酶活力鉴定喀斯特适生植物的方法:中国,CN101067148[P]. 2011-05-20.
[8]Xing D,Wu Y. Photosynthetic response of three climber plant species to osmotic stress induced by polyethylene glycol(PEG)6000[J]. Acta Physiologiae Plantarum,2012,34(5):1659-1668.
[9]Wu Y Y,Liu C Q,Li P P,et al. Photosynthetic characteristics involved in adaptability to Karst soil and alien invasion of paper mulberry (Broussonetia papyrifera L. Vent) in comparison with mulberry (Morus alba L.)[J]. Photosynthetica,2009,47(1):155-160.
[10]吴沿友. 喀斯特适生植物固碳增汇策略[J]. 中国岩溶,2011,30(4):461-465.
[11]杨碧仙. 贵州省五加科药用植物的生境和地理分布研究[J]. 时珍国医国药,2010,21(6):1505-1506.
[12]梁 婕. 莽草的化学成分和生物活性研究[D]. 福州:福建中医药大学,2011.
[13]刘军民,丁 平,徐鸿华,等. 长刺楤木的生药学研究[J]. 广州中医药大学学报,2000,17(2):173-175,194.
[14]左经会,林长松,田应洲.贵州玉舍国家森林公园种子植物区系研究[J]. 广西植物,2006,26(4):434-440.
[15]向 红,左经会,林长松,等. 贵州玉舍国家森林公园药用种子植物资源调查[J]. 北方园艺,2010(17):79-82.
[16]Van Kooten O,Snel J F. The use of chlorophyll fluorescence nomenclature in plant stress physiology[J]. Photosynthesis Research,1990,25(3):147-150.
[17]吴沿友 施,王 坤,李萍萍,等. 一种利用锑微电极测定植物碳酸酐酶活力的电化学方法:中国,CN101793860A[P]. 2010-08-15.
[18]Wu Y Y,Shi Q Q,Wang K,et al. An electrochemical approach coupled with Sb microelectrode to determine the activities of carbonic anhydrase in the plant leaves[J]. Lecture Notes in Electrical Engineering,2011,86(1):87-94.
[19]李合生,孙 群,赵世杰,等. 植物生理生化实验技术原理[M]. 北京:高等教育出版社,2000:248-250.
[20]Sun C X,Qi H,Hao J J,et al. Single leaves photosynthetic characteristics of two insect-resistant transgenic cotton (Gossypium hirsutum L.) varieties in response to light[J]. Photosynthetica,2009,47(3):399-408.
[21]Li X G,Meng Q W,Zhao S J. Photoinhibition and photoprotection mechanisms in Ginkgo biloba leaves under strong light stress[J]. Scientia Silvae Sinicae,2004,40(3):56-59.
[22]Gorbe E,Calatayud A. Applications of chlorophyll fluorescence imaging technique in horticultural research:a review[J]. Scientia Horticulturae,2012,138(1):24-35.
[23]李 强,何媛媛,曹建华,等. 植物碳酸酐酶对岩溶作用的影响及其生态效应[J]. 生态环境学报,2011,20(12):1867-1871.
[24]Scartazza A,Lauteri M,Guido M C,et al. Carbon isotope discrimination in leaf and stem sugars,water-use efficiency and mesophyll conductance during different developmental stages in rice subjected to drought[J]. Australian Journal of Plant Physiology,1998,25(4):489-498.
————水溶蚀岩石的奇观

