运动下调左心室β2-AR/β1-AR对MI大鼠心脏的保护效应
陈婷,田振军
(1.西藏民族大学 体育学院,陕西 咸阳 712082;2.陕西师范大学 运动生物学研究所 运动与心血管研究室,陕西 西安 710062)
运动下调左心室β2-AR/β1-AR对MI大鼠心脏的保护效应
陈婷1,2,田振军224
(1.西藏民族大学 体育学院,陕西 咸阳 712082;2.陕西师范大学 运动生物学研究所 运动与心血管研究室,陕西 西安 710062)
摘 要:探讨心脏β2-AR/β1-AR变化在运动减轻心梗后心肌纤维化中的作用。将雄性SD大鼠36只,随机分为假手术组(S)、心肌梗死组(MI)、心梗后有氧运动组(ME),每组12只。MI组采用结扎心脏左冠状动脉前降支(LAD)法,建立MI模型。S组仅穿线而不结扎LAD,ME组在MI后1周进行4周跑台运动。第1周适应性训练(速度10 m/min,坡度0),第2周运动速度15 m/min,坡度3%,第3周速度20 m/min,坡度3%,第4周速度25 m/min,坡度5%。运动总时间均为60 min,每周训练5 d,连续4周。训练结束后开胸摘取心脏,免疫组化法检测左心室β2-AR蛋白表达;荧光免疫组化法检测左心室Nox4蛋白表达;Western Blot法检测β1-AR,β2-AR及Nox4蛋白水平;DHE法检测心肌超氧阴离子水平;Masson染色测定心肌胶原容积百分比(CVF)。结果:与S组比较,MI后可见心肌β2-AR、Nox4阳性染色,大面积超氧阴离子红色荧光及蓝色心肌胶原纤维。MI后LV中β2-AR/β1-AR比例显著上调(P<0.01),心肌Nox4蛋白表达、超氧阴离子水平、CVF值显著增加(P<0.05、P<0.01、P<0.01)。与MI组比较,ME组可见心肌β2-AR、Nox4阳性染色,而超氧阴离子红色荧光及蓝色胶原纤维明显减少。运动后LV中β2-AR/β1-AR比例显著下调(P<0.01),心肌Nox4蛋白表达、超氧阴离子水平及CVF显著降低(P<0.05、P<0.05、P<0.01)。且LV中β2-AR/β1-AR与心肌CVF呈显著正相关(r=0.419,P<0.05)。结果表明:有氧运动可下调左心室β2-AR/β1-AR比例,抑制Nox4-ROS通路,减轻心梗大鼠心肌纤维化程度。运动对心梗后心肌纤维化的抑制和β2-AR/β1-AR比例降低有关。
关 键 词:运动生理学;心脏β肾上腺素能受体;心肌纤维化;心肌超氧阴离子水平;有氧运动;心肌梗死;大鼠
心脏β肾上腺素能受体(β-AR)调节紊乱在心肌梗死(MI)后心功能恶化中发挥关键作用。MI后交感神经系统持续激活,导致心肌β1-AR表达下调[1],相应β2-AR 在β-AR中所占比例增高,且β1-AR和β2-AR脱敏、脱偶联[2],使得β1-AR和β2-AR的正性肌力作用受损。其中β2-AR比例的增高与激活[3],与恶性心律失常风险性的增加呈正相关[2,4]。文献梳理发现,在病理心脏中,β2-AR参与心肌纤维化[5]、心脏氧化应激[5]、病理性左心室(LV)重塑过程[4,6]。心脏β2-AR过表达(100倍和350倍)可导致心肌纤维化[7]。而其机制与心肌NADPH氧化酶Nox2、Nox4上调,ROS水平增加,P38MAPK信号通路激活关系密切[5]。β2-AR激活可造成病理性心室重塑的恶性循环[7,8]。基于此,研究假设采用手段下调β2-AR比例的激活,可能对MI后心肌纤维化有着改善效果。
近年来运动干预改善MI疾病的研究备受关注[9-10]。运动锻炼可减轻心肌纤维化程度,提升MI心脏功能[11-12],此观点已被广泛证实[13]。而在运动减轻MI后心肌纤维化中,β2-AR激活是否发挥作用,其研究报道少见。以往研究表明,运动训练可增加病理心脏β1-AR蛋白表达(48%)及mRNA水平[11],降低β2-AR应答性[4,14]。本研究前期成果发现,有氧运动可恢复MI后心脏β2-AR/β1-AR均衡性[15]。而运动后β2-AR的变化,而对梗死心脏形态及功能上的影响并未深入探讨。因此本研究采用4周有氧运动干预方式,探讨其对MI后LV中β2-AR/β1-AR、Nox4-ROS通路,及对MI大鼠心肌纤维化的影响,旨在阐明心脏β2-AR/β1-AR变化在运动减轻MI后胶原过度增生中的作用,为运动改善MI疾病,探索安全有效治疗预防MI的运动康复方案提供依据。
1 材料与方法
1.1 主要仪器和试剂
主要仪器:奥林巴斯光学显微镜、尼康荧光显微镜、凝胶成像仪等。主要试剂DHE超氧化物荧光探针购于碧云天公司,兔抗大鼠多克隆抗体β2-AR、Nox4购于GeneTex公司;抗体β1-AR购于Cell Signaling Technology公司。
1.2 实验动物与分组
3月龄雄性Sprague Dawley大鼠36只,体重185~215 g,购于由西安交通大学实验动物中心(动物质量合格证号:陕医动证字08-004号)。大鼠随机分为假手术组(S)、心肌梗死组(MI)、心梗+有氧运动组(ME),每组12只。大鼠采用国家标准啮齿类动物干燥饲料喂养,自由饮食,动物室内温度18~25 ℃,湿度50%~60%。MI组采用左冠状动脉前降支(LAD)结扎法,建立MI模型;S组大鼠实施假手术;ME组进行4周的小动物跑台运动。
1.3 心梗模型制备
大鼠采用质量分数5%戊巴比妥钠腹腔麻醉(30 mg/kg),用小动物呼吸机连接自制面罩辅助呼吸,参数调至呼吸频率为65次/min,吸呼比为2∶1,潮气量为10 mL。开胸暴露心脏,于肺动脉圆锥左缘和左心耳根部交界下2 mm处结扎左冠状动脉前降支(LAD),结扎后肉眼可见结扎远端心肌颜色逐渐变浅或变白,主要局限在LV,靠近心尖部最为明显。多道生理信号采集处理系统记录大鼠心电图,监测评价MI模型,大鼠MI后心电图出现S-T段抬高或T波倒置现象,可断定MI造模成功。之后逐层缝合关胸。S组大鼠仅穿线而不结扎LAD。ME组大鼠在MI模型成功后1周开始训练。
1.4 大鼠运动方案
有氧运动方案参照Patel KP等的研究进行[16-17]。ME组大鼠在MI手术后1周进行4周有氧递增跑台运动。第1周适应性训练,运动速度10 m/min,坡度0;第2周运动速度15 m/min,坡度3%;第3周运动速度20 m/min,坡度3%;第4周运动速度25 m/min,坡度5%。ME组运动时间均为60 min(运动强度为50%~80% VO2max),每周训练5 d,连续训练4周。4周运动结束后次日,采用多导生理记录仪记录心电图,数据采集完毕后,迅速开胸摘取心脏,进行后续实验。
1.5 心脏样品处理
随机选取大鼠腹腔麻醉后,经左心室-升主动脉实施心脏灌流术(先灌注PBS,然后灌注质量分数为4%多聚甲醛),取心脏置于多聚甲醛后固定,然后转移到30%蔗糖溶液中浸泡脱水至组织沉底,之后用OCT包埋,制冰冻切片(厚15 μm)。另随机取大鼠心脏,放于质量分数为10%中性甲醛溶液固定后,经乙醇脱水,二甲苯透明,石蜡包埋,常规石蜡切片(厚5 um)用于HE,Masson染色,免疫组化和免疫荧光实验。另取大鼠心脏置于液氮冷冻后,移至-80 ℃低温冰箱保存,用于Western Blot实验。
1.6 免疫组化实验
实验按照SABC免疫组化染色试剂盒说明书进行。石蜡切片脱蜡至水,抗原修复后用山羊血清在湿盒中37 ℃封闭60 min。滴加一抗(兔抗大鼠多克隆抗体β2-AR,1∶60),4 ℃过夜。之后滴加二抗(1∶250)。37 ℃湿盒中孵育60 min。之后孵育SABC复合物(37℃,40 min),PBS清洗,DAB显色,纯水洗涤终止反应,苏木精复染、封片。设置阴性对照(PBS代替一抗)。
1.7 免疫荧光实验
石蜡切片58 ℃预热,脱蜡至水。抗原修复后用山羊血清在湿盒中37 ℃封闭60 min。滴加一抗(兔抗大鼠多克隆抗体Nox4,1∶100),4 ℃过夜。室温复温30 min。之后滴加TRITC标记二抗(1∶250)。37 ℃湿盒中孵育60 min。滴加DAPI避光孵育5 min,PBS冲洗,封片。设置阴性对照(PBS取代一抗)。采用荧光显微镜观察,400倍镜下拍照。
1.8 Western Blot实验
采用RIPA提取总蛋白,Bradford法测定蛋白质含量。等量蛋白质采用12%SDS聚丙烯酰胺凝胶垂直电泳进行分离,转至NC膜上,丽春红染膜,室温封闭(3% BSA)50 min后,分别加入兔抗β1-AR(1∶1 000)、β2-AR(1∶500)、Nox4(1∶800)多克隆抗体,4 ℃过夜,之后加入二抗(Jackson,1∶8 000)孵育50 min,洗膜后用ECL进行发光显迹。计算目的蛋白与内参蛋白条带的积分光密度(Integral Optical Density,IOD),内参为GAPDH。
1.9 DHE染色
DHE染色用于检测心肌超氧阴离子水平。取冰冻切片,将超氧化物荧光探针DHE负载于切片上,避光孵育20 min,荧光探针DHE在超氧化物生成处被氧化为溴化乙锭,与DNA结合后,激发出红色荧光。用荧光显微镜观察结果。
1.10 数据采集与统计学处理
Western Blot实验结果胶片用Image Quant TLv2005软件分析处理,组织切片经光镜观察,用Image Pro-plus 6.0软件进行测量分析。所得数据用GraghPad Prism 5.0软件转换作图。所有数据均运用SPSS 17.0软件包进行处理,结果以平均数±标准差(±s)表示。采用单因素方差分析进行显著性差异分析。P<0.01为差异极显著,P<0.05为差异显著。
2 实验结果及分析
2.1 左心室β1-AR及β2-AR表达的观察结果
β2-AR免疫组化结果显示,S、MI、ME组LV中均可见β2-AR阳性染色,呈棕黄色,主要位于心肌细胞膜。Western Blot结果显示,LV中β2-AR蛋白表达在S、MI、ME组均无显著差异(见图1、图2)。

图1 大鼠心肌β2-AR免疫荧光染色结果(×400)
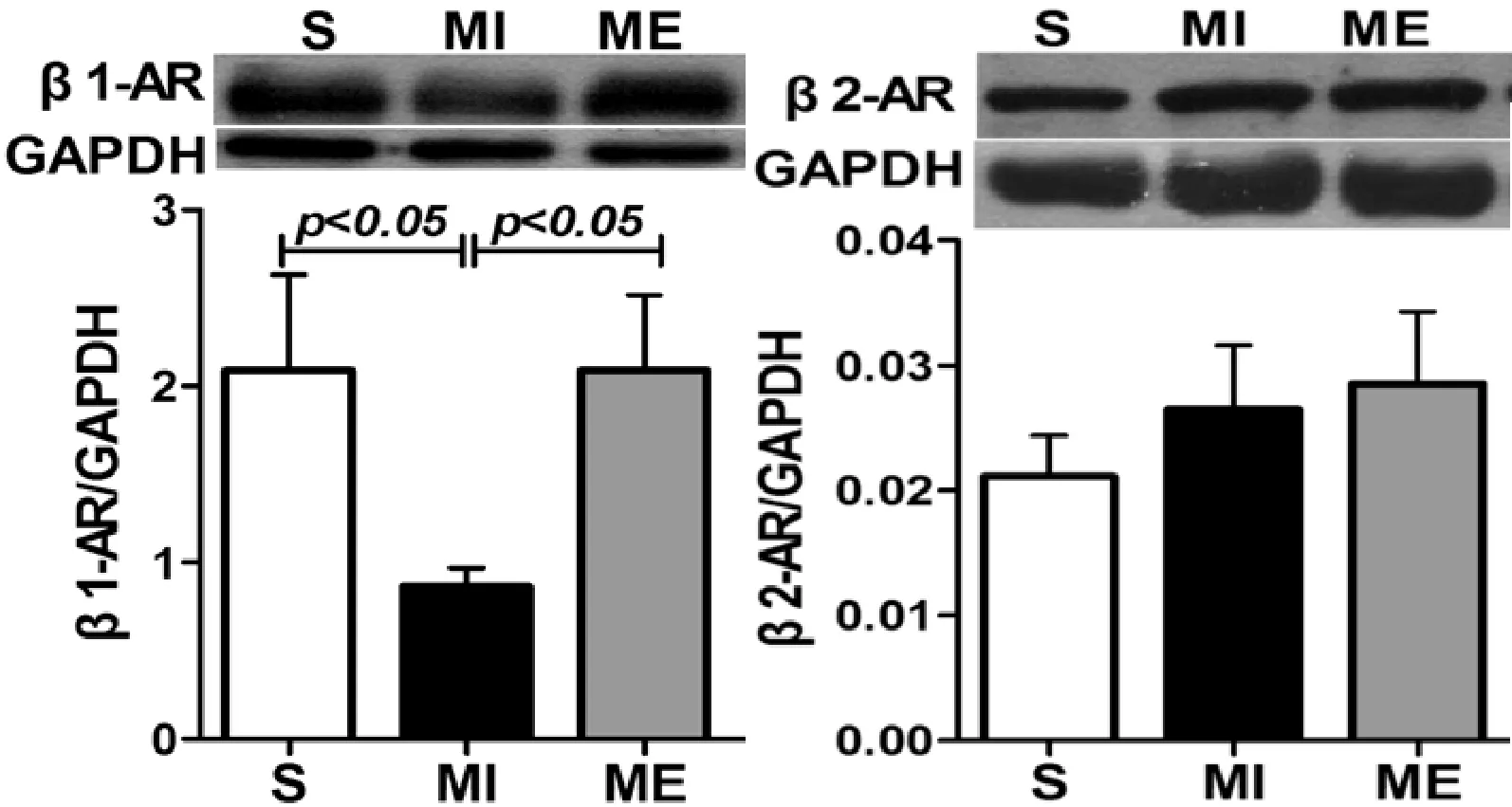
图2 大鼠心肌β1-AR及β2-AR Western Blot结果
β1-AR的Western Blot结果显示,与S组相比,MI组LV中β1-AR蛋白表达显著减少(P<0.05)。与MI组相比,ME组β1-AR蛋白表达显著增高(P<0.05)(见图2)。而MI后LV中β2-AR/β1-AR比例较S组显著上调(均P<0.01)。ME组β2-AR/β1-AR比例较MI组显著下调(P<0.01)。
2.2 左心室Nox4表达的观察结果
Nox4免疫荧光结果显示,S组LV中Nox4阳性染色较少。MI组、ME组均可见Nox4阳性染色,呈亮红色,分布于纵行心肌纤维胞浆,位于蓝色细胞核周围(见图3)。

图3 大鼠心肌Nox4免疫荧光染色结果(×400)
Western Blot结果显示,与S组相比,MI组LV中Nox4蛋白表达显著增加(P<0.05);与MI组相比,ME组Nox4蛋白表达显著降低(P<0.05)(见图4)。
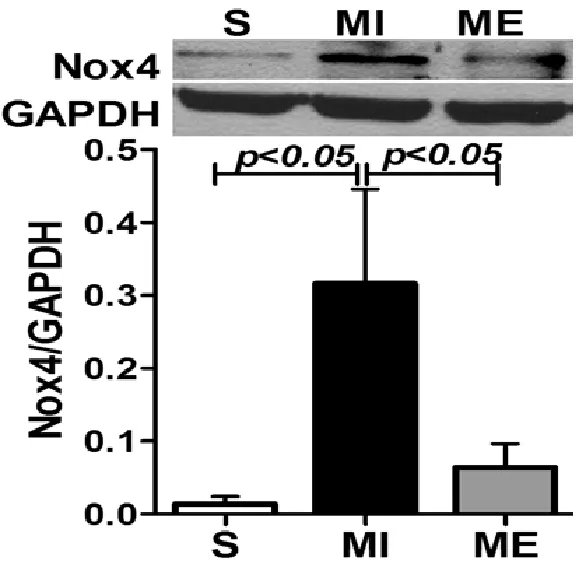
图4 大鼠心肌Nox4的Western Blot结果
2.3 左心室冰冻切片DHE染色结果
DHE染色结果显示,LV中超氧阴离子呈红色荧光,在细胞核表达。S组红色荧光颗粒较少。与S组相比,MI组梗死区可见大量红色荧光颗粒,密集分布(见图5)。
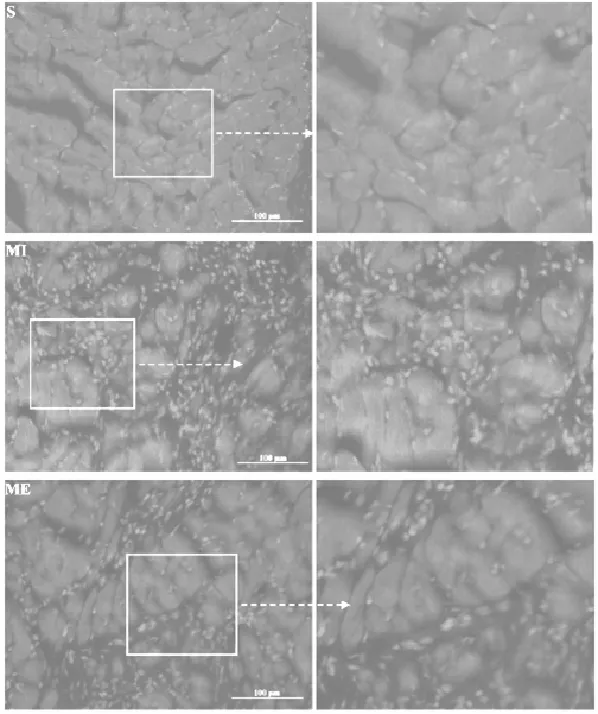
图5 大鼠心肌DHE染色图(×200)
数据显示MI组大鼠LV中超氧阴离子水平较S组显著增加(P<0.01)。而ME组梗死区红色荧光颗粒较少,超氧阴离子水平较MI组显著下降(P<0.05)(见图6)。
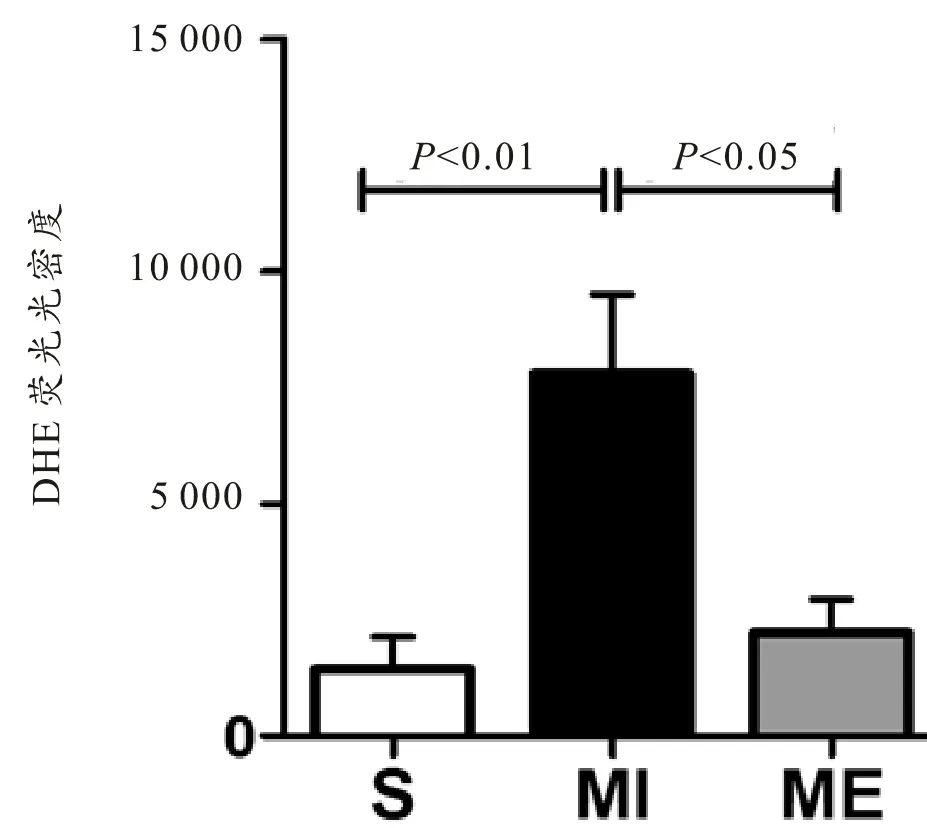
图6 大鼠心肌DHE染色荧光光密度结果
2.4 HE染色观察结果
HE染色结果显示,S组大鼠心肌细胞排列紧密,结构整齐。MI组大鼠梗死区心肌细胞大量坏死,心肌纤维排列紊乱,出现替代性纤维化,形成瘢痕组织。ME组大鼠梗死区部分心肌细胞断裂,瘢痕组织中出现红色心肌,纤维化程度降低(见图7)。
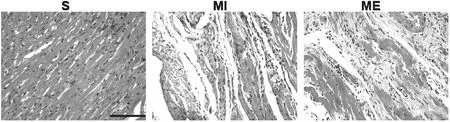
图7 大鼠心肌组织HE染色(×400)
2.5 Masson染色观察结果
Masson染色结果显示,S组大鼠红色心肌纤维排列整齐,蓝色胶原纤维少见。MI后心肌细胞坏死,心肌组织结构紊乱,梗死区可见大面积蓝色胶原纤维。ME组大鼠心肌组织结构有一定程度改善,梗死区红色心肌细胞与蓝色胶原交互分布,胶原纤维明显减少(见图8)。
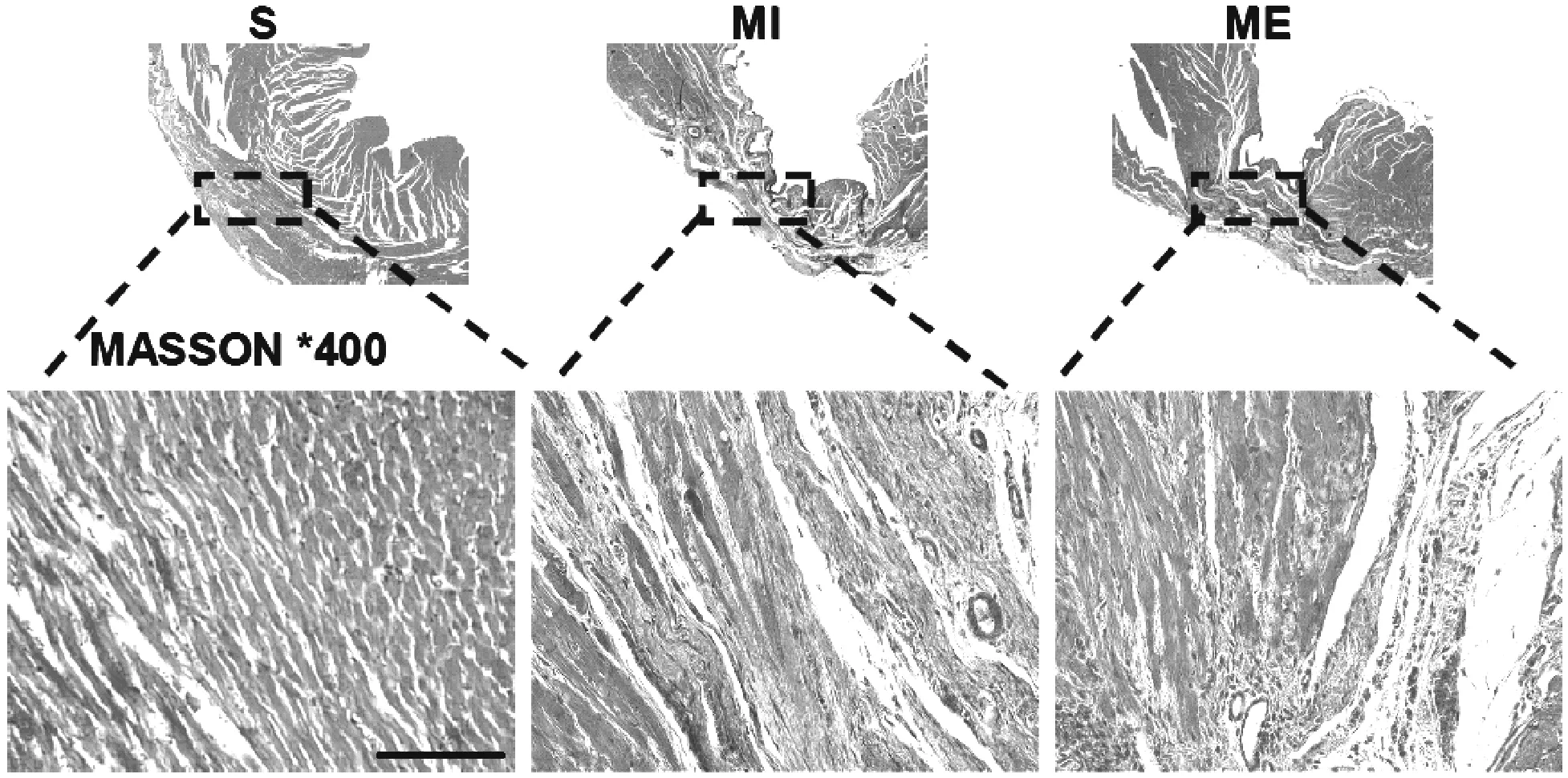
图8 大鼠心肌组织Masson染色(×400)
胶原容积百分比(CVF)用于反映心肌间质纤维化。数据显示,与S组比较,MI后CVF((55.35±6.99)%,P<0.01)较S组((5.71±3.88)%)显著增加。与MI组比较,ME组CVF((32.7±3.55)%,P<0.01)显著降低(见图9),表明4周有氧运动可减轻MI后心肌纤维化程度。

图9 大鼠心肌组织CVF结果
2.6 相关性分析
相关性分析结果显示,LV中β2-AR/β1-AR与心肌CVF具有中等程度相关(r=0.419),有显著性(P=0.047),表明心脏β2-AR/β1-AR比例与心肌纤维化关系有关,有氧运动对MI后心肌纤维化的减轻可能与β2-AR/β1-AR比例降低有关。
3 讨论
3.1 心梗后运动干预可下调左心室β2-AR/β1-AR比例
β-AR是调节心脏功能强有力的生物靶标。人类心脏中β1-AR/β2-AR比例为7:3[18],其作为G蛋白偶联受体超家族的一员,心脏β1-AR通过Gs-AC-cAMP-PKA通路引起心率加快、心肌收缩力增强及传导速度加快。β2-AR可同时与Gs和Gi形成双偶联,发挥正性肌力和细胞保护两方面的作用[19]。β-AR调节紊乱在MI后心功能恶化中发挥重要作用,研究发现MI后交感神经系统持续激活,心肌β1-AR密度下调,导致cAMP产生减少,造成心脏收缩功能降低[1]。而β2-AR密度虽无明显变化,但β2-AR所占比例相应由17%升高到38%,使得MI后交感神经激动对β2-AR的依赖程度明显升高[20]。而β2-AR比例的增加与激活[2],与MI后恶性心律失常发生关系密切[3]。
长期运动训练可提高MI后心脏交感神经和迷走神经均衡性,加强自主神经系统调节功能[21],并对心脏β-AR表型产生有益影响。以往研究表明运动训练可增加病理心脏β1-AR蛋白表达(48%)及mRNA水平[11],增加cAMP水平(36%)[11],降低β2-AR应答性[4,14]。BILLMAN等研究表明运动训练可恢复易患猝死犬β1-AR/β2-AR均衡性[4],但该研究中并未检测β1-AR和β2-AR蛋白表达及密度。本实验结果显示,MI后LV中β1-AR蛋白表达减少,β2-AR虽无显著变化,但心肌β2-AR/β1-AR比例显著上调,β2-AR所占比例的研究意义更大。而4周运动干预后,心肌β1-AR表达增高,β2-AR无明显变化,相应ME组β2-AR/β1-AR比例降低,表明有氧运动可下调LV中β2-AR/β1-AR比例,恢复β-AR均衡性。这与本实验组前期研究结果一致[15]。而运动恢复受体均衡性的机制,以及MI后运动下调β2-AR/β1-AR,其对心脏形态及功能上的影响并未深入研究。而本研究重点从β2-AR与心肌纤维化的角度,探讨运动对MI大鼠心脏的保护效应。
3.2 运动后β2-AR/β1-AR降低与心梗后Nox4-ROS通路下调,心肌纤维化程度减轻有关
MI后心脏发生心室结构和功能改变,表现为心肌细胞坏死和凋亡、间质纤维化、心肌细胞代偿性肥大、心脏收缩功能下降等。研究发现MI后大量产生的ROS可促进心肌间质纤维化[22]。心肌NADPH氧化酶族(Nox)是心血管系统中ROS的主要来源之一,且Nox产生的ROS可激发其他来源ROS的生成[23]。研究发现,Nox敲除小鼠在MI后梗死面积减小,心肌纤维化得到改善[22]。而位于心肌细胞线粒体的Nox4是衰竭心脏氧化应激产生的主要来源,Nox4敲除小鼠氧化应激水平降低,心肌纤维化,细胞凋亡水平均显著降低,心功能得到改善[24]。而心脏β-AR,作为G-蛋白偶联受体,是MI后激活Nox的因素之一[25]。在病理心脏中,β2-AR激活参与心肌纤维化,心脏氧化应激[5],细胞凋亡[6],病理性心脏重塑[4],心律失常过程[2]。其中β2-AR与心肌纤维化关系密切。研究表明β2-AR过表达(60倍)可增强心脏收缩功能,不会恶化为心力衰竭。而β2-AR过表达(100倍和350倍)可造成心肌纤维化[7,26]。其机制与心肌Nox2,Nox4上调,ROS水平增加,P38MAPK信号通路有关激活[5]。β2-AR激活可导致病理性心室重塑的恶性循环[8]。因此本研究假设采用手段下调β2-AR比例的激活,可能对MI后心肌纤维化起到改善效果。
近年来运动干预改善MI疾病的研究备受关注。规律的运动锻炼对于心室重构改善,MI患者心功能提高、MI发病率降低均具有积极意义[27]。运动可减轻心肌纤维化程度,提升MI心脏功能,此观点已得到广泛证实[9-12]。本文主要关注心脏β2-AR在运动减轻MI后心肌纤维化中的作用。本实验结果显示,MI后LV中Nox4蛋白表达,超氧阴离子水平,心肌胶原纤维显著增加。而四周运动干预后,LV中Nox4蛋白表达,超氧阴离子水平及心肌胶原纤维明显减少。且心脏β2-AR/β1-AR比例与CVF呈显著正相关。提示有氧运动可抑制心肌Nox4-ROS通路,减轻MI大鼠心肌纤维化程度。且运动对MI后心肌纤维化的抑制与β2-AR/β1-AR比例降低有关。但目前关于心脏β2-AR的研究存在争议,β2-AR过度激活除发挥心脏毒性外,另有研究认为其具备心肌保护作用[26]。在心肌细胞凋亡方面,β2-AR可偶联Gi通过PI3K/Akt通路发挥抗凋亡作用[28]。而选择性刺激β2-AR可激活cAMP/PKA/Akt/eNOS通路,增加NO生物利用率,降低心肌细胞死亡[6]。通过文献梳理,笔者认为心肌β2-AR的正性肌力及心脏毒性作用主要是通过偶联Gs发挥的[29],而β2-AR的抗心肌细胞凋亡及细胞保护作用主要是与Gi偶联所介导[28]。但运动后病理心脏中这两方面作用之间的关系,平衡及机制研究还需要进一步深入探讨。
综上所述,心梗后进行4周有氧运动干预可下调左心室β2-AR/β1-AR比例,抑制Nox4-ROS通路,减轻心梗大鼠心肌纤维化程度。运动对心梗后胶原过度增生的抑制与β2-AR/β1-AR比例降低有关。
参考文献:
[1]LEOSCO D,RENGO G,IACCARINO G,et al.Exercise promotes angiogenesis and improves beta-adrenergic receptor signalling in the post-ischaemic failing rat heart[J].Cardiovasc Res,2008,78(2),385-394.
[2]BILLMAN G E,CASTILLO L C,HENSLEY J,et al.Beta2-adrenergic receptor antagonists protect against ventricular fibrillation:in vivo and in vitro evidence for enhanced sensitivity to beta2-adrenergic stimulation in animals susceptible to sudden death[J].Circulation,1997,96(6),1914-1922.
[3]HOULE M S,ALTSCHULD R A,BILLMAN G E.Enhanced in vivo and in vitro contractile responses to beta(2)-adrenergic receptor stimulation in dogs susceptible to lethal arrhythmias[J].J Appl Physiol,2001,91(4):1627-1637.
[4]BILLMAN G E,KUKIELKA M,KELLEY R,et al.Endurance exercise training attenuates cardiac beta2-adrenoceptor responsiveness and prevents ventricular fibrillation in animals susceptible to sudden death[J].Am J Physiol Heart Circ Physiol,2006,290(6):H2590-2599.
[5]DI LISA F,KALUDERCIC N,PAOLOCCI N.Beta(2)-Adrenoceptors,NADPH oxidase,ROS and p38 MAPK:another ‘radical’ road to heart failure?[J].Br J Pharmacol,2011,162(5):1009-1011.
[6]BHUSHAN S,KONDO K,PREDMORE B L,et al.Selective beta2-adrenoreceptor stimulation attenuates myocardial cell death and preserves cardiac function after ischemia-reperfusion injury[J].Arterioscler Thromb Vasc Biol,2012,32(8):1865-1874.
[7]LIGGETT S B,TEPE N M,LORENZ J N,et al.Early and delayed consequences of beta(2)-adrenergic receptor overexpression in mouse hearts: critical role for expression level[J].Circulation,2000,101(14):1707-1714.
[8]XU Q,DALIC A,FANG L,et al.Myocardial oxidative stress contributes to transgenic beta(2)-adrenoceptor activation-induced cardiomyopathy and heart failure[J].Br J Pharmacol,2011,162(5):1012-1028.
[9]BARBOSA V A,LUCIANO T F,VITTO M F,et al.Exercise training plays cardioprotection through the oxidative stress reduction in obese rats submitted to myocardial infarction[J].Int J Cardiol,2012,157(3):422-424.
[10]BITO V,DE WAARD M C,BIESMANS L,et al.Early exercise training after myocardial infarction prevents contractile but not electrical remodelling or hypertrophy[J].Cardiovasc Res,2010,86(1):72-81.
[11]DE WAARD M C,VAN DER VELDEN J,BITO V,et al.Early exercise training normalizes myofilament function and attenuates left ventricular pump dysfunction in mice with a large myocardial infarction[J].Circ Res,2007,100(7):1079-1088.
[12]GIALLAURIA F,ACAMPA W,RICCI F,et al.Exercise training early after acute myocardial infarction reduces stress-induced hypoperfusion and improves left ventricular function[J].Eur J Nucl Med Mol Imaging,2013,40(3):315-324.
[13]MANN N,ROSENZWEIG A.Can exercise teach us how to treat heart disease?[J].Circulation,2012,126(22):2625-2635.
[14]HOLYCROSS B J,KUKIELKA M.Exercise training normalizes beta-adrenoceptor expression in dogs susceptible to ventricular fibrillation[J].Am J Physiol Heart Circ Physiol,2007,293(5):H2702-2709.
[15]CHEN T,CAI M X,LI Y Y,et al.Aerobic exercise inhibits sympathetic nerve sprouting and restores beta-adrenergic receptor balance in rats with myocardial infarction[J].PLoS One,2014,9(5):e97810.
[16]ZHENG H,SHARMA N M,LIU X,et al.Exercise training normalizes enhanced sympathetic activation from the paraventricular nucleus in chronic heart failure:role of angiotensin II[J].Am J Physiol Regul Integr Comp Physiol,2012,303(4):R387-394.
[17]ZHENG H,LI Y F,ZUCKER I H,et al.Exercise training improves renal excretory responses to acute volume expansion in rats with heart failure[J].Am J Physiol Renal Physiol 2006,291(6):F1148-1156.
[18]LOHSE M J,ENGELHARDT S,ESCHENHAGEN T.What is the role of beta-adrenergic signaling in heart failure?[J].Circ Res,2003,93(10):896-906.
[19]WRIGHT P T,NIKOLAEV V O,O'HARA T,et al.Caveolin-3 regulates compartmentation of cardiomyocyte beta2-adrenergic receptor-mediated cAMP signaling[J].J Mol Cell Cardiol,2014,67:38-48.
[20]BARTELS L A,CLIFTON G D,SZABO T S.Influence of myocardial ischemia and reperfusion on beta-adrenoceptor subtype expression[J].J Cardiovasc Pharmacol,1998,31(4):484-487.
[21]RIBEIRO F,ALVES A J,TEIXEIRA M,et al.Exercise training enhances autonomic function after acute myocardial infarction: a randomized controlled study[J].Rev Port Cardiol,2012,31(2):135-141.
[22]LOOI Y H,GRIEVE D J,SIVA A,et al.Involvement of Nox2 NADPH oxidase in adverse cardiac remodeling after myocardial infarction[J].Hypertension,2008,51(2):319-325.
[23]TAKIMOTO E,KASS D A.Role of oxidative stress in cardiac hypertrophy and remodeling[J].Hypertension,2007,49(2):241-248.
[24]KURODA J,AGO T,MATSUSHIMA S,et al.NADPH oxidase 4(Nox4)is a major source of oxidative stress in the failing heart[J].Proc Natl Acad Sci USA,2010,107(35):15565-15570.
[25]HEYMES C,BENDALL J K,RATAJCZAK P,et al.Increased myocardial NADPH oxidase activity in human heart failure[J].J Am Coll Cardiol,2003,41(12):2164-2171.
[26]ZHAO M,FAJARDO G,URASHIMA T,et al.Cardiac pressure overload hypertrophy is differentially regulated by beta-adrenergic receptor subtypes[J].Am J Physiol Heart Circ Physiol,2011,301(4):H1461-1470.
[27]KRALJEVIC J,MARINOVIC J,PRAVDIC D,et al.Aerobic interval training attenuates remodelling and mitochondrial dysfunction in the post-infarction failing rat heart[J].Cardiovasc Res,2013,99(1):55-64.
[28]CHESLEY A,LUNDBERG M S,ASAI T,et al.The beta(2)-adrenergic receptor delivers an antiapoptotic signal to cardiac myocytes through G(i)-dependent coupling to phosphatidylinositol 3’-kinase[J].Circ Res,2000,87(12):1172-1179.
[29]STOCKIGT F,BRIXIUS K,LICKFETT L,et al.Total beta-adrenoceptor knockout slows conduction and reduces inducible arrhythmias in the mouse heart[J].PLoS One,2012,7(11):e49203.
Effects of exercise down-regulating left ventricular β2-AR/β1-AR on protecting the hearts of MI rats
CHEN Ting1,2,TIAN Zhen-jun2
(1.School of Physical Education,Xizang Minzu University,Xianyang 712082,China;2.Exercise&Cardiovascular Lab,Institute of Sports and Exercise Biology,Shaanxi Normal University,Xi’an 710062,China)
Abstract:In order to probe into the roles of the changing of cardiac β2-AR/β1-AR in exercise alleviating myocardial fibrosis after myocardial infarction,the authors divided 36 male SD rats randomly into a sham surgery group(S),a myocardial infarction group(MI),and an aerobic exercise after myocardial infarction group(ME),each of which consisted of 12 rats,established a MI mode on the rats in group MI by means of ligation of the left anterior descending(LAD)coronary artery,stitched but not ligated the LAD of the rats in group S,let the rats in group ME exercise on a treadmill for 4 weeks,1 week after MI,according to the following plan: week 1: adaptive training(speed: 10m/min,gradient: 0%); week 2: speed: 15mmin,gradient: 3%; week 3: speed: 20m/min,gradient: 3%; week 4: speed: 25m/min,gradient: 5%; total exercise time: 60min,training: 5 days a week,4 weeks consecutively.After the training was finished,the authors opened thebook=119,ebook=124rats’ chest and took out their hearts,measured left ventricular β2-AR protein expression by means of immunohistochemistry,measured left ventricular Nox4 expression by means of fluorescent immunohistochemistry,measured β1-AR,β2-AR and Nox4 protein levels by means of Western Blot,measured myocardial superoxide anion level by means of DHE,measured myocardial collagen volume fraction(CVF)by means of Masson staining,and revealed the following findings: as compared with the rats in group S,the rats after MI could be seen having myocardial β2-AR and Nox4 positive staining,large areas of superoxide anion red fluorescence and blue myocardial collagen fibers; in LV after MI,the radio of β2-AR/β1-AR increased significantly(P<0.01),myocardial Nox4 protein expression,superoxide anion level and CVF value increased significantly(P<0.05,P<0.01,P<0.01); as compared with the rats in group MI,the rats in group ME could be seen having myocardial β2-AR and Nox4 positive staining,but significantly decreased superoxide anion red fluorescence and blue collagen fibers; in LV after exercise,the radio of β2-AR/β1-AR was down-regulated significantly(P<0.01),myocardial Nox4 protein expression,superoxide anion level and CVF value decreased significantly(P<0.05,P<0.05,P<0.01); and in LV,β2-AR/β1-AR was significantly positive correlative with myocardial CVF(r=0.419,P<0.05).The said findings indicate the followings: aerobic exercise can down-regulate the ratio of left ventricular β2-AR/β1-AR,restrain the pathway of Nox4-ROS,and alleviate the degree of myocardial fibrosis of rats with myocardial infarction; exercise is related to the restraint of myocardial fibrosis and the decrease of the ratio of β2-AR/β1-AR after myocardial infarction.
Key words:sports physiology;β2-AR/β1-AR;myocardial fibrosis;myocardial superoxide anion;aerobic exercise;myocardial infarction;rats
作者简介:陈婷(1984-),女,讲师,博士研究生,研究方向:运动生理学。E-mail:ctgw84@163.com 通讯作者:田振军教授。
基金项目:国家自然科学基金项目(81360297,31371199, 31171141); 陕西师范大学“211工程”运动生物学重点建设学科项目(2012-11)。
收稿日期:2015-05-20
中图分类号:G804.2
文献标志码:A
文章编号:1006-7116(2016)02-0118-08

