水溶性茯苓多糖PWP-Y提取工艺优化及其分子量测定的研究
赵小龙,杨 涛,汤 进, 陈 平
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023 )
水溶性茯苓多糖PWP-Y提取工艺优化及其分子量测定的研究
赵小龙,杨涛,汤进, 陈平
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023 )
摘要:优化水溶性茯苓多糖PWP-Y的提取工艺条件,纯化并测定其分子量。采用正交试验设计,考察超声时间、料液比、提取温度和提取时间等条件对多糖得率的影响,得出最优工艺参数;采用Sevage法脱蛋白、H2O2脱色素、TSKgel PW-M两柱串联色谱柱分离纯化得到均一的茯苓多糖PWP-Y;利用Waters 2414示差检测器联用Wyatt HELEOS-Ⅱ多角度激光光散射检测器,对多糖的绝对分子量和表征进行测定。 结果表明:提取多糖的最佳工艺组合为A1B3C3D3,即超声时间为30 min,料液比为1∶50,提取温度为100 °C,提取时间为4 h,提取效率为5.62%;茯苓多糖PWP-Y由小分子和大分子2个组分构成,Mw分别为39.3×103、54.3×105,其空间构象为团状。
关键词:茯苓多糖;提取优化;分子量测定;多糖构象
1引言
茯苓(Wolfiporiacocos)隶属于担子菌门,多孔菌科,茯苓属[1],是一种高等担子菌,多以菌核入药。其味甘、淡、平,归肺、胃、肾经,具有利水渗湿,健脾宁心的功效。用于水肿尿少,痰饮眩悸,脾虚食少,便溏泄泻,心神不安,惊悸失眠[2],是一种珍贵的食药兼用药材。茯苓多糖(Pachymose)作为茯苓的主要活性成分,具有提高人体免疫机能、抗炎、防止肿瘤等功效[3-4],能够广泛用于食品、医疗保健等领域。
为提高茯苓多糖的提取效率,本实验在以超声时间、料液比、提取温度、提取时间4个单因素为考察指标的基础上,利用正交试验设计优化了茯苓多糖的最佳提取工艺条件;采用Waters 2414示差检测器联用Wyatt HELEOS-Ⅱ多角度激光光散射检测器对茯苓多糖PWP-Y的绝对分子量和其空间构象进行了测定与表征。
2材料与方法
2.1材料与试剂
茯苓采自湖北英山,为多孔菌科真菌茯苓(PoriacocosF.A.Wolf)的干燥菌核,干燥、粉碎后备用。
葡萄糖标准品制备:精密称取经105 ℃干燥至恒重的无水葡萄糖1 g,加适量水溶解,定量转移至1 000 mL容量瓶中,加水至刻度,摇匀,备用。
6 %苯酚:取6 g苯酚加热溶解,定容至100 mL容量瓶中,4 ℃下避光保存。
2.2方法
2.2.1茯苓多糖的提取与分离纯化
粉碎的茯苓粉磨过60目筛,加入80%乙醇,70 ℃回流提取2 h,重复2次后用60 ℃水再提取3次。在提取的茯苓多糖液体中加入三氯甲烷∶正丁醇(5∶1)60 mL,振摇30 min,静置过夜,弃去有机层,收集水层,3 000 r/min离心10 min;取上清液浓缩至约15 mL左右,加入 95 %乙醇至乙醇浓度达到 85 %,4 ℃过夜,弃去上清液,挥去乙醇,残渣在 60 ℃下恒温干燥,即得茯苓水溶性多糖样品。
2.2.2供试品溶液的制备
精密称取各样品粉末约0.012 5 g,加适量水溶解,定量转移至25 mL容量瓶中,摇匀备用。
2.2.3标准曲线的绘制
分别量取0 mL,2.0 mL,4.0 mL,6.0 mL,8.0 mL,10.0 mL葡萄糖标准溶液(1 g/L)到100 mL容量瓶中,加蒸馏水定容,各取1 mL加入试管中,依次加入0.5 mL 6% 苯酚溶液和2.5 mL浓硫酸,摇匀,冷却至室温后于490 nm处测吸光值。以吸光度A为纵坐标,标准液浓度C(mg/mL)为横坐标,得到葡萄糖溶液标准曲线回归方程为A=14.5250C+0.0599(R2=0.9996)。结果如表1,图1所示。
表1葡萄糖标准曲线数据
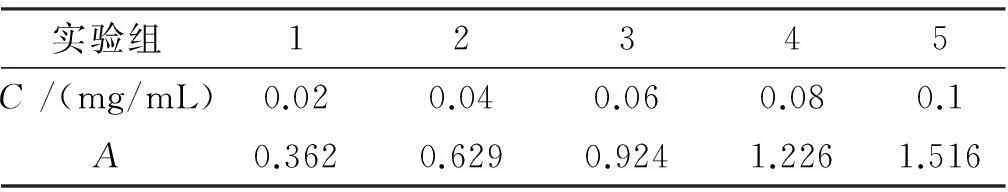
实验组12345C/(mg/mL)0.020.040.060.080.1A0.3620.6290.9241.2261.516
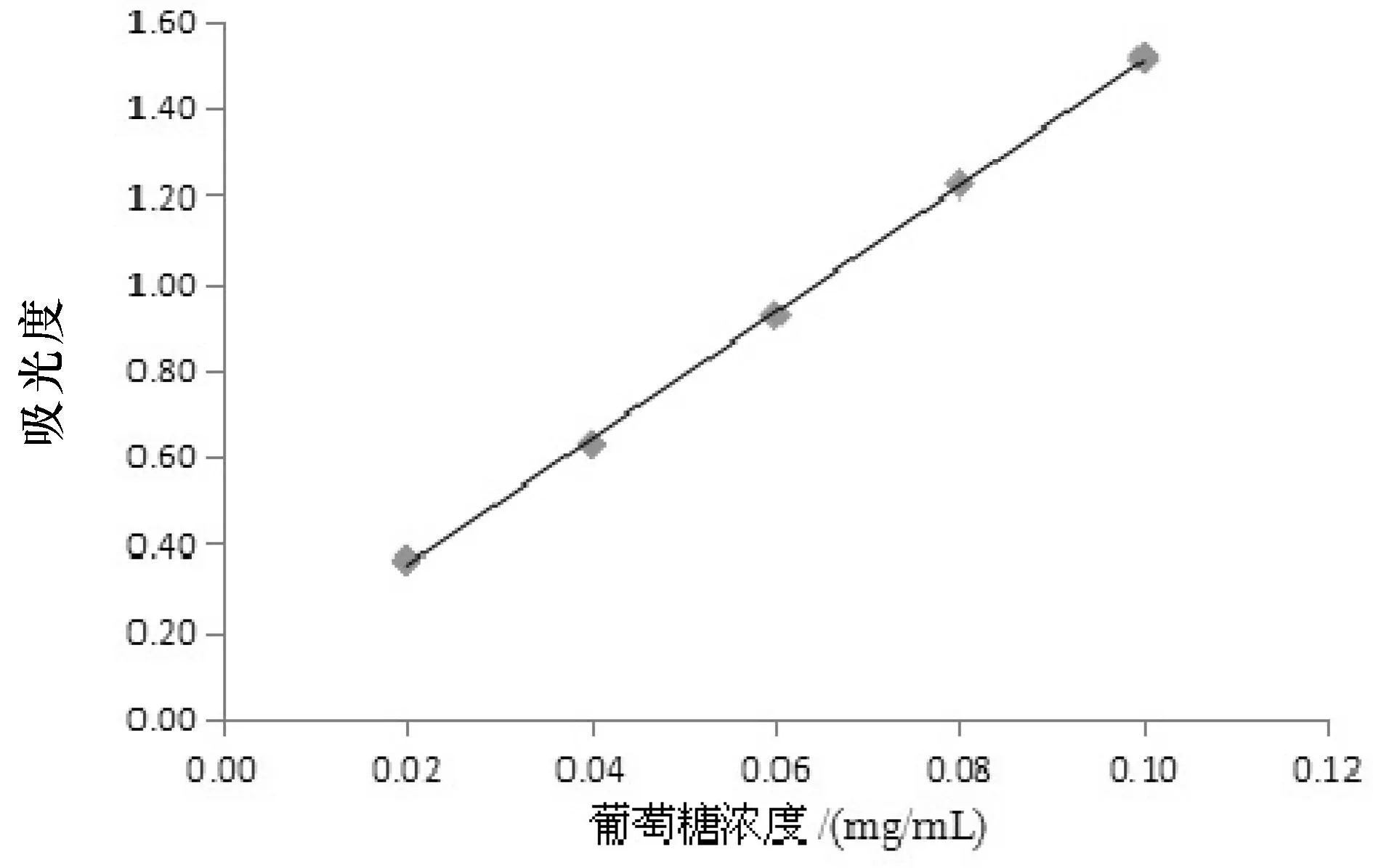
图1 葡萄糖标准曲线
2.2.4茯苓多糖含量的测定[5-6]
配制一定浓度的多糖样品溶液,取各样品溶液100 uL于具塞试管中,依次加入0.9 mL蒸馏水,0.5 mL 6%苯酚,2.5 mL浓硫酸,摇匀。将试管于沸水浴中加热15 min,取出冷却5 min后放入冷水浴中15 min,在490 nm处测定各样品溶液的吸光度值。将吸光度值代入标准曲线回归方程为A=14.5250C+0.0599(R2=0.9996)中,即可算出所配置多糖样品溶液的浓度。
多糖含量(%)=(多糖溶液×稀释倍数×
多糖溶液体积/样品质量)×100% .
2.2.5单因素实验
在大量实验过程中发现,水溶性茯苓多糖的提取受到很多因素的影响,比如超声时间、提取时间、提取温度及料液比等,故对这些影响因素进行了具体研究。
2.2.6正交试验方案
在单因素实验基础上,选择超声时间、料液比、提取时间、提取温度4个因素[7-8],通过比较多糖提取率来确定最佳提取工艺。以考察多糖含量为指标,选择 L9(34)正交表进行实验。
多糖提取率(%)=(多糖含量/药材质量)×100%.
2.2.7多糖PWP-Y平均分子量的测定及空间构象表征
以优化的提取工艺为基础,提取与分离纯化得到多糖PWP-Y。选用TSKgelPW-M两柱串联作为色谱柱,0.7%硫酸钠作为流动相,采用Waters 2414示差检测器联用Wyatt HELEOS-Ⅱ多角度激光光散射检测器对茯苓多糖PWP-Y的绝对分子量和其空间构象进行测定与表征。
3结果与分析
3.1单因素实验
3.1.1提取时间对水溶性多糖提取率的影响
称取5.0 g茯苓粉5份分别置于5个250 mL的圆底烧瓶中,按照料液比1∶20分别加入100 mL蒸馏水,摇匀,超声20 min后放入90 ℃的恒温水浴中分别反应1 h,2 h,3 h,4 h,5 h。冷却至室温后过滤,收集滤液,4 ℃避光保存。
分别取滤液0.5 mL,用蒸馏水补至1.0 mL,各加入0.5 mL苯酚和2.5 mL浓硫酸,摇匀,冷却15 min后,用紫外可见分光光度计于490 nm波长下,测得五组吸光值,根据公式求出多糖提取率,对提取时间做图,结果如图1所示。
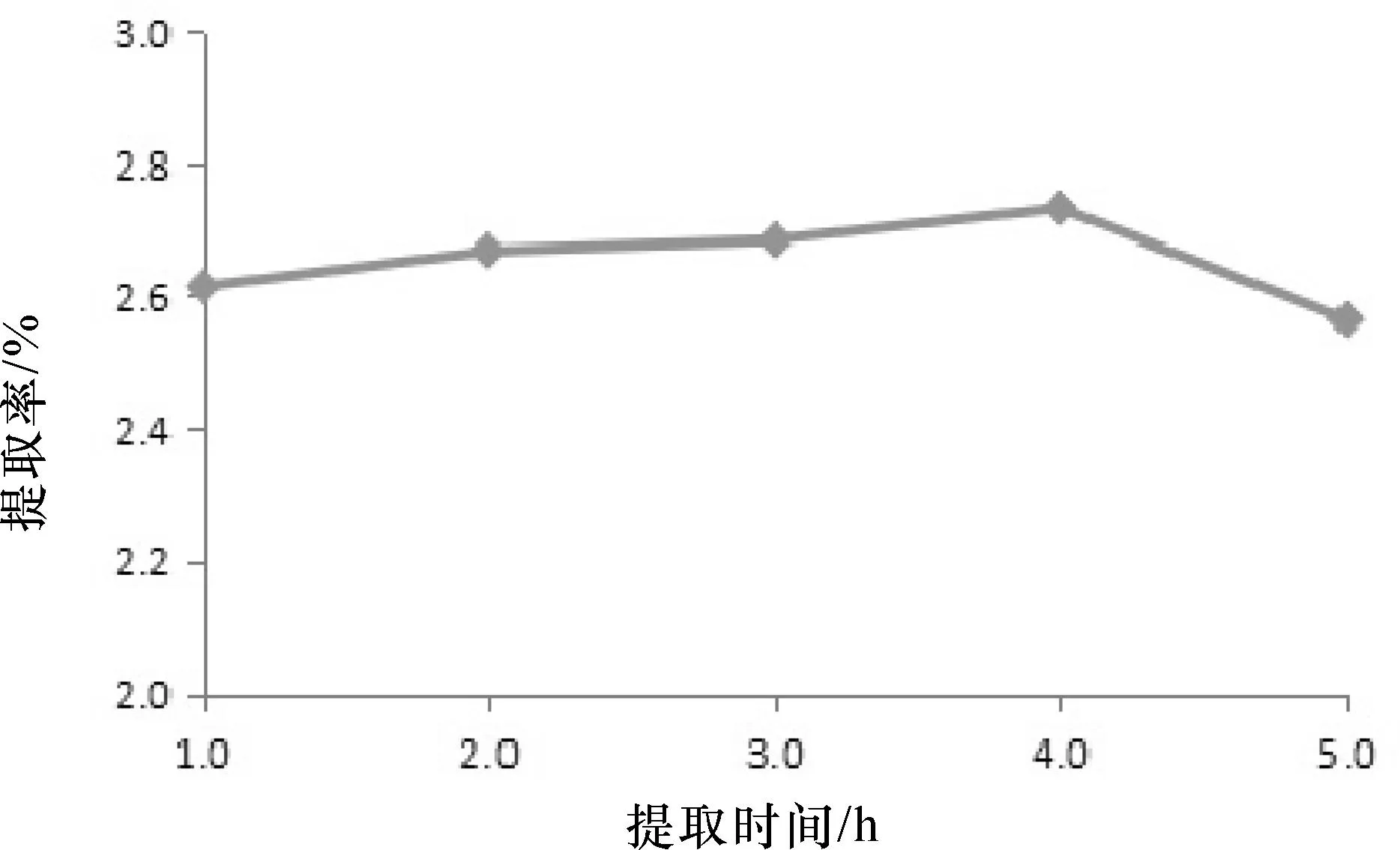
图1 提取时间对水溶性多糖提取率的影响
由图1可知,反应时间在4 h时提取出的茯苓水溶性多糖量最多,选择3 h,4 h,5 h为提取时间因素的三水平。
3.1.2提取温度对水溶性多糖提取率的影响
称取5.0 g茯苓粉5份分别置于5个250 mL的圆底烧瓶中,按照料液比1∶20分别加入100 mL蒸馏水,摇匀,超声20 min后分别放入60 ℃,70 ℃,80 ℃,90 ℃,100 ℃ 的恒温水浴中分别反应4 h。冷却至室温后过滤,收集滤液,4 ℃避光保存。
分别取滤液0.5 mL,用蒸馏水补至1.0 mL,各加入0.5 mL苯酚和2.5 mL浓硫酸,摇匀,冷却15 min后,用紫外可见分光光度计于490 nm波长下,测得五组吸光值,根据公式求出多糖提取率,对提取温度做图,结果如图2所示。

图2 提取温度对水溶性多糖提取率的影响
由图2可知,提取温度在100 °C提取出的茯苓水溶性多糖量最多,选择80 ℃,90 ℃,100 ℃为提取温度因素的三水平。
3.1.3料液比对水溶性多糖提取率的影响
称取5.0 g茯苓粉5份分别置于5个圆底烧瓶中,分别按照料液比1∶10、1∶20、1∶30、1∶40、1∶50加入蒸馏水,摇匀,超声20 min后分别放入100 ℃ 的恒温水浴中分别反应4 h。冷却至室温后过滤,收集滤液,4 ℃避光保存。
分别取滤液0.5 mL,用蒸馏水补至1.0 mL,各加入0.5 mL苯酚和2.5 mL浓硫酸,摇匀,冷却15 min后,用紫外可见分光光度计于490 nm波长下,测得五组吸光值,根据公式求出多糖提取率,对料液比做图,结果如图3所示。
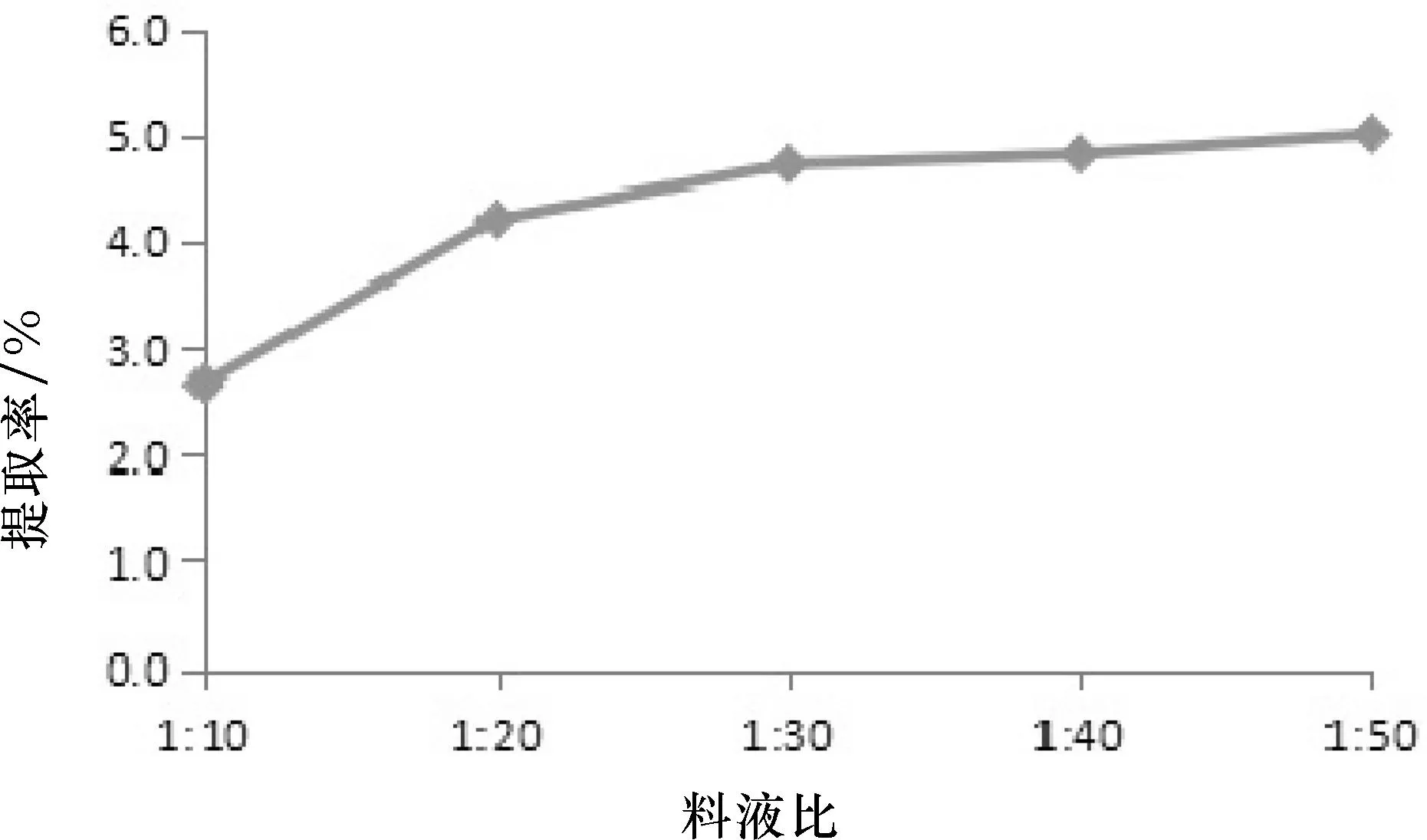
图3 料液比对水溶性多糖提取率的影响
由图3 可知,在料液比1∶20之后,多糖提取率随料液比增大而变化不明显,为了节约资源,选取1∶20、1∶30、1∶40为料液比因素的三水平。
3.1.4超声时间对水溶性多糖提取率的影响
称取5.0 g茯苓粉5份分别置于5个250 mL圆底烧瓶中,按照料液比1∶30加入蒸馏水,摇匀,分别超声10 min,20 min,30 min,40 min,50 min后放入100 ℃ 的恒温水浴中分别反应4 h。冷却至室温后过滤,收集滤液,4 ℃避光保存。
分别取滤液0.5 mL,用蒸馏水补至1.0 mL,各加入0.5 mL苯酚和2.5 mL浓硫酸,摇匀,冷却15 min后,用紫外可见分光光度计于490 nm波长下,测得五组吸光值,根据公式求出多糖提取率,对超声时间做图,结果如图4所示。

图4 超声时间对水溶性多糖提取率的影响
由图4 可知,超声时间在30 min时,茯苓多糖提取率最大,因此选择20 min,30 min,40 min为超声时间因素的三水平。
3.2提取条件工艺优化
根据以上单因素实验,选择超声时间、料液比、提取时间、提取温度4个因素,以考察多糖含量为指标,选择 L9(34)正交表进行实验,见表2。正交试验结果见表3。
表2正交试验的因素水平表

水平因素(A)超声时间/min(B)料液比(C)提取温度/℃(D)提取时间/h1301∶308022401∶409033501∶501004
表3正交试验结果

试验号超声时间(A)料液比(B)提取温度(C)提取时间(D)提取率/%111114.28212224.29313335.62421234.02522314.97623124.32731324.71832133.84933214.57K114.1913.0112.4413.82K213.3113.1012.8813.32K313.1214.5115.3013.48k14.734.344.154.61k24.444.374.294.44k34.374.845.104.49R0.360.500.950.17主次顺序C>B>A>D优水平A1B3C3D1优组合A1B3C3D1
表3显示 ,由K值可以确定各因素的最优水平是A1, B3, C3, D1,由极差R值可知,各因素对多糖提取率的影响次序为:提取温度>料液比>超声时间>提取时间,由此可见反应温度对水溶性多糖提取率影响最大。由正交结果分析茯苓水溶性多糖的最佳提取条件为:A1B3C3D1,即:超声时间30 min,料液比1∶50,提取温度100 ℃,提取时间2 h。
3.3PWP-Y分子量的测定及空间构象[9-10]
由于多角度激光光散射法不需要分子量系列标准品就可以测出多糖的绝对分子量,可以免去分子量对照品与待测物质物理、化学性质不同的误差,为测量多糖的分子量带来了极大的便利,分子量大小如表4、图5所示。采用Waters 2414示差检测器联用Wyatt HELEOS-Ⅱ多角度激光光散射检测器测定样品的绝对分子量和R.M.S值,即样品的均方旋转半径,我们以样品的重均分子量和R.M.S做一条直线,其斜率可以对样品的空间构象进行表征。结果见图6、表5。
表4茯苓多糖PWP-Y重均分子量结果表

组分1(kD)组分2(kD)Mw10%小分子10%大分子Mw10%小分子10%大分子5425.91338.315992.239.315.775.2
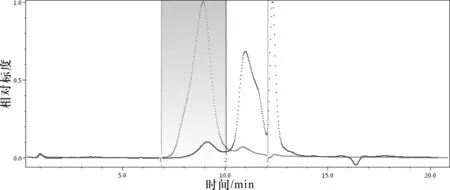
图5 茯苓多糖PWP-Y色谱图
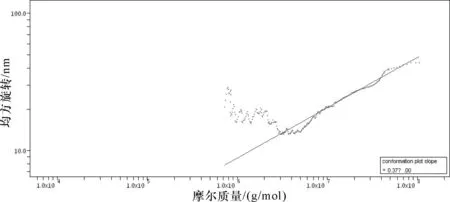
图6 茯苓多糖PWP-Y构象图
表5茯苓多糖PWP-Y构象结果表

提取方式斜率构象水提0.37团状
由表4和图5可知,茯苓多糖PWP-Y由2个组分构成,经过仪器分别对各组分分子量进行测定统计后发现小分子部分(组分2)占到茯苓多糖总含量的80%以上;由表5和图6可知,茯苓多糖PWP-Y的空间构象显示为团状,多糖空间构象也与其来源及提取工艺息息相关。
4结论与讨论
由以上实验结果可知,茯苓多糖最佳的提取工艺条件为超声时间30 min,料液比1∶50,提取温度100℃,提取时间4 h。本实验是在超声辅助的基础上采用热水提取法,通过正交试验对水溶性茯苓多糖的提取工艺进行了优化,获取了最佳提取工艺。但是经过优化后的工艺提取率仍然很低,经查阅的文献上报道运用微波、酶法等方法提取水溶性茯苓多糖的得率也不高,制约了茯苓水溶性多糖的进一步研究、应用和工业化生产,因此考虑利用其他提取方法来获得更高的提取率。
Wyatt HELEOS-Ⅱ多角度激光光散射检测器除了可测定高聚物的绝对分子量和分子大小,对其结构进行研究和表征外,更重要的是也可以进行实时监测:通过检测聚合物溶液的稳定过程,可进行降解、聚集及相分离过程的动力学和机械性能研究;通过检测聚合反应过程,可感知产品经加热、辐射、酸处理,或添加其他助剂以后,体系如何达到稳定,从而进行质量控制。
由Waters 2414示差检测器联用Wyatt HELEOS-Ⅱ多角度激光光散射检测器测定的茯苓多糖PWP-Y由小分子跟大分子2个组分构成,空间构象显示为致密团状,这可能导致该多糖作为保健品进入人体后很难被吸收,为以后该多糖的开发利用奠定了理论基础。
参考文献:
[1]国家药典委员会.中国药典一部[M].北京:中国医药科技出版社,2010:224.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010.
[3]Jin Yong,Zhang Lina,Zhang Mei,et a1.Antitumor activities of heteropolysaccharides of Poria cocos mycelia from different strains and culture media[J].Carbohydrate Research.2003,338(14):1517-1521.
[4]吕苏成,曹巧俐,张力,等.茯苓多糖对正常及荷瘤小鼠免疫功能的影响[J].第一军医大学学报,1990(3):45-46.
[5]胡明华,梁永威,彭川丛,等.不同产地不同规格的茯苓水溶性多糖含量比较[J].中国药业,2012,21(7):10-12.
[6]卫华,赵声兰,赵荣华,等.云南不同产地茯苓中多糖的含量测定[J].云南中医学院学报,2009,32(4):25-27,36.
[7]霍文,孙广利,刘鹏.正交试验法优选茯苓多糖提取工艺[J].西北药学杂志,2006,2(1):18-19.
[8]王秀文,王颖莉,裴晓丽,等.均匀设计法优选党参茯苓水溶性多糖的微波提取工艺[J].中国实验方剂学杂志,2012,18(4):24-27.
[9]颜军,陶涛,孙晓春,等.茯苓多糖的纯化及分子量测定[J].化学与生物工程,2011,28(3):88-90,94.
[10]韩凤兰,胡建英.高效液相色谱法测定宁夏黄芪多糖的分子量及其分布[J].宁夏医学院学报,2006,28(2):172-174.
Optimization of extraction process and molecular weight determination of pachymose from poria cocos
ZHAOXiao-long,YANGTao,TANGJin,CHENPing
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Abstract:To optimize polysaccharide extraction technology of water soluble poria cocos, purification and determination of the molecular weight. Orthogonal experimental design was used to study the optimum polysaccharides extraction condition. Ultrasonic time, solid-liquid ratio, extraction temperature and extraction time were selected to conduct single factor test; The Sevage method was used for deproteinization, H2O2 was used for depigmentation. The polysaccharide PWP-Y was purified by TSKgel PW-M chromatographic column; Waters 2414 differential detector combination Wyatt HELEOS-Ⅱmulti-angle laser light scattering were both applied in the determination of the relative molecular weight(Mw) and characterization of polysaccharides. Results show that the optimum conditions of polysaccharide extraction was A1B3C3D3, when the ultrasonic time, material liquid ratio, extraction temperature and extracting time were 30min, 1∶50, 100 ℃ and 4 h,the extraction efficiency would reach 5.62%; Polysaccharide PWP-Y was made up of micromolecule and macromolecular two components, which Mw was 39.3×103 and 54.3×105, respectively. The spatial conformation of PWP-Y shows clumps.
Key words:pachymaran;optimization of extraction;determination of molecularweight;polysaccharide conformation
中图分类号:TQ 464
文献标识码:A
DOI:10.3969/j.issn.2095-7386.2016.01.008
文章编号:2095-7386(2016)01-0034-05
基金项目:国家中医药管理局中医药行业科研专项(201107009).
作者简介:赵小龙(1990-),男,硕士研究生,E-mail:a87635263@qq.com.通信作者:陈平(1958-),女,教授,E-mail:chenpingvip24@163.com.
收稿日期:2015-11-04.

