SIRT1信号通路介导紫檀芪抗内皮细胞抗缺血再灌注损伤的机制研究
冯 笑,杨 阳,熊红燕,范崇熙,狄守印,胡 伟,段维勋,梁洪亮,金振晓,俞世强
SIRT1信号通路介导紫檀芪抗内皮细胞抗缺血再灌注损伤的机制研究
冯 笑,杨 阳,熊红燕,范崇熙,狄守印,胡 伟,段维勋,梁洪亮,金振晓,俞世强
[摘要]:目的 研究不同浓度紫檀芪(PTE)对人脐静脉内皮细胞(HUVECs)缺血再灌注损伤的保护作用及其可能的机制。方法 HUVECs经1 μM/L和2 μM/L的PTE处理后,接受模拟缺氧复氧(SIR)损伤(缺氧70 min,复氧4 h),采用CCK-8法检测细胞活力,使用酶活性测定法检测细胞培养液中丙二醛(MDA)的释放量和超氧化物歧化酶(SOD)的水平,使用western blot法检测SIRT1、Ac-FOXO1、Bax和Bcl-2的表达情况,使用SIRT1阻断剂EX527观察SIRT信号通路在这一过程中发挥的作用。结果 SIR处理可以抑制HUVECs活性,抑制SIRT1表达,上调Ac-FOXO1表达,下调Bcl-2/Bax比例(与Control组比较,P<0.05)。细胞培养基中MDA含量上升,SOD水平下降(与Control组比较,P<0.05)。1 μM/L和2 μM/L的PTE处理均可以发挥细胞保护作用,提高细胞活力,降低了MDA水平,提高了SOD水平(与SIR组比较,P<0.05)。此外,PTE处理上调了SIRT1表达,抑制了Ac-FOXO1表达,并且提高Bcl-2/Bax比例(与SIR组比较,P<0.05)。EX527处理后细胞活力下降,凋亡增加(与SIR+PTE组比较,P<0.05)。结论 PTE可以保护HUVECs抵抗缺血再灌注损伤,其机制是激活SIRT1/FOXO1保护性信号通路,抑制HUVECs凋亡。
[关键词]:紫檀芪;人脐静脉内皮细胞;缺血再灌注损伤;沉默信息调控因子1
Pterostilbene alleviates HUVECs ischemia reperfusion injury via activating SIRT1 and suppressing cell apoptosis
Feng Xiao,Yang-Yang,Xiong Hong-yan,Fan Chong-xi,Di Shou-yin,Hu Wei,Duan Wei-xun,Liang Hong-liang,Jin Zhen-xiao,Yu Shi-qiang
Department of Cardiovascular Surgery,Xijing Hospital,Fourth Military Medical University,Shaan'xi Xi'an 710032,China
Corresponding author:Jin Zhen-xiao,Email:13571921011@ 163.com
[Abstract]:Objective To explore the effect of pterostilbene on simulated ischemia reperfusion(SIR) injury of HUVECs and the roles of SIRT1 in this process.Methods The cultured HUVECs,pretreated with PTE(1 or 2 μM/L) for 2h,were subjected to SIR.Then cell counting kit-8 was used to detect cell viability,and specialized kits were used to detect the concentration of malondialdehyde(MDA) and superoxide dismutase(SOD) in the cell culture medium.The expression of Silent information regulator 1(SIRT1),Acetylated fork head transcription factor 1(Ac-FOXO1),Bcl-2 and Bax were quantified using western blotting.The specific inhibitor of SIRT1 EX527 was used to investigate the roles of SIRT1 in this process.Results SIR treatment reduced cell viability significantly(from 1.219±0.021 to 0.593±0.036),down-regulated SIRT1 expression,up-regulated Ac-FOXO1 expression and reduced the Bcl-2/Bax ratio(vs the control group,P<0.05).Both 1μM/Land 2 μM/L PTE increased the cell viability(to 0.762±0.029和0.860±0.019),down-regulated the MDA level(to 14.16±1.62 and 11.23±1.35) and up-regulated the SOD level(to 64.16±3.97 and 86.06±5.48 )(vs the SIR group,P<0.05).Western blot analysis showed that SIRT1 expression increased and Ac-FOXO1 expression decreased.The Bcl-2/Bax ratio was increased(vs the SIR group,P<0.05).EX527 treatment reduced the cell viability(from 0.743±0.031 to 0.6140±0.025)(vs the SIR+PTE group,P<0.05).Conclusion PTE treatment may activate SIR injury through activating SIRT1-Ac-FOXO1 pathway and suppressing cell apoptosis.
[Key words]: Pterostilbene;HUVECs;Ischemia reperfusion injury;Silent information regulation 1
心血管疾病是当今社会危害人类生命健康的首要杀手,心肌缺血再灌注损伤是重要的损伤类型,内皮细胞损伤在这个病理过程中发挥着重要的作用[1-3]。内皮细胞构成了血管和周围组织的屏障,心肌缺血再灌注损伤可以促使内皮细胞发生凋亡,最终损伤向心肌重构和心衰的方向发展[3-4]。因而,如何保护血管内皮细胞成为减弱心肌缺血再灌注损伤的重要着眼点。
紫檀芪( pterostilbene,PTE)是广泛存在于蓝莓、黑莓等浆果中非黄酮类多酚化合物,同白藜芦醇互为同系衍生物,但其生物活性要较白藜芦醇强[5]。紫檀芪可以通过抗氧化应激、抗炎、抗增殖等多种机制[1,5-8],对多种疾病具有治疗或预防作用,包括神经系统疾病、代谢性疾病、退行性疾病以及肿瘤等[5-7]。值得注意的是它在心血管系统发挥保护作用[7],并且抵抗缺血再灌注过程中发生的氧化应激损伤[6]。以往的研究表明紫檀芪可以调节内皮细胞的凋亡和自噬,发挥一定的保护作用[9-11],但是它是否可以保护内皮细胞抵抗心肌缺血再灌注损伤尚未报道。
1 材料与方法
1.1 试剂 模拟缺氧复氧(simulated ischemia reperfusion,SIR)T1特异性阻断剂EX527、脱氧葡萄糖、乳酸钠、氯化钠、氯化钾、氯化镁、氯化钙、羟乙基哌嗪乙硫磺酸、连二亚硫酸钠均购自Sigma公司。PTE购自aladdin公司。胎牛血清购自杭州四季青公司。DMEM培养液、胰蛋白酶购自Hyclone公司。CCK-8细胞毒性检测试剂盒购自七海生物公司。超氧化物岐化酶( SOD)检测试剂盒和丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所。抗SIRT1抗体购自CST公司,抗Ac-FOXO1抗体购自Santa Cruz公司,抗Bcl-2和抗Bax抗体购自CST公司。抗β-肌动蛋白(β-actin)抗体购自CMCTAG公司,辣根过氧化物酶标记的IgG二抗购自北京中杉金桥生物技术有限公司。
1.2 仪器 超净工作台购自苏州净化设备仪器厂。CO2细胞培养箱购自Thermo公司。倒置显微镜购自Olympus公司。细胞用低速离心机购自Saitexiangyi公司。细胞培养瓶、96孔板购自Corning公司。Western blot电泳、转膜及发光成像设备均购自Bio-Rad公司。酶标仪购自SpectraMax公司。
1.3 方法
1.3.1 人脐静脉内皮细胞(HUVEC)的培养及SIR模型的建立 常规HUVEC细胞,脐静脉内皮SIR损伤通过模拟缺血液及氮气环境实现。缺血液配方为NaCl 137 mM/L、KCl 12 mM/L、MgCl20.49 mM/L、CaCl2·2H2O 0.9 mM/L、HEPES 4 mM/L、脱氧葡萄糖10 mM/L、连二亚硫酸钠0.75 mM/L、乳酸钠20 mM/L,pH值调至6.5。加入缺血液的细胞培养板或培养瓶置于含95%N2和5%CO2的密闭容器中缺氧70 min(该容器密闭且持续通气),更换正常DMEM后在含95%O2和5%CO2的细胞培养箱中复氧孵育4 h。
1.3.2 实验分组及CCK-8法细检测各组HUVEC细胞活力 首先,本实验分为4组,分别为对照组、SIR组、PTE 1 μM/L+SIR组、PTE 2 μM/L+SIR 组,每组10个复孔,PTE预处理时间为4 h。随后,PTE(2 μM/L)处理前用SIRT1阻断剂EX527预处理2 h阻断SIRT1,EX527浓度为10 μM/L(已证实该浓度本身对SIR后细胞活力无影响),将细胞分组为SIR组、PTE+SIR组、PTE+EX527+SIR组、EX527+SIR组,观察EX527对PTE抗HUVEC细胞SIR损伤的影响。各组处理后将培养液弃掉,磷酸盐缓冲液(PBS)清洗细胞培养板3次,再加入100 μl DMEM培养液和10 μl CCK-8检测液,置于37℃细胞培养箱孵育2 h,用酶标仪检测各孔OD值(450 nm波长下吸光度值),本实验重复3次。
1.3.3 细胞培养液中MDA含量及SOD活力含量检测 各组处理结束后,取培养瓶中的细胞培养液,严格按照试剂盒说明书检测细胞培养液中MDA及SOD含量。每组重复3次。
1.3.4 Western blot法检测细胞SIRT1通路及凋亡指标水平变化 各组细胞处理结束后,用PBS清洗后置于冰上,用细胞刮刮下并收集细胞,用添加蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液于冰上裂解20min,随后以12000r/min离心20min。收集细胞裂解产物,采用二辛可宁酸BCA法测定蛋白浓度并调整其至一致。取30 μg总蛋白,加入相应体积的5×上样缓冲液,煮沸7 min。将该样品用于十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)并用湿转转膜仪转到硝酸纤维素膜(NC膜)上。NC膜用含5%脱脂奶粉的TBST室温封闭4 h后分别孵育在SIRT1(1∶5 000)、Ac-FOXO1(1∶500)、Bax、Bcl-2和β-actin(1∶1 000)中,4℃孵育过夜。然后用TBST洗涤并于常温用1∶5 000的辣根过氧化物酶标记的羊抗兔或鼠IgG孵育2 h。然后用TBST洗涤,最后在Bio-Rad照相系统采集照片,并用Image Lab软件对其进行分析。
1.4 统计学分析 采用SPSS 17.0软件包分析实验数据,所有结果以均数±标准差(±s)表示,组间比较采用t检验,P<0.05有显著性差异。
2 结 果
2.1 PTE对SIR损伤后HUVEC细胞活力的影响如表1和图1所示,SIR处理显著降低了HUVEC细胞活力(与对照组相比,P<0.05),梯度浓度PTE预处理显著提高了细胞活力(与SIR组相比,P<0.05),其中2 μM/L的PTE保护效果更为明显。倒置显微镜下观察发现SIR组细胞受损皱缩,大量细胞死亡。PTE预处理后细胞死亡减少,细胞形态显著改善。
表1 PTE对SIR损伤后HUVEC细胞活力的影响(n=10,±s)

表1 PTE对SIR损伤后HUVEC细胞活力的影响(n=10,±s)
注:a与对照组比较P<0.05;b与SIR组比较P<0.05;c与PTE1 μM/L+SIR组相比P<0.05。
组别 OD值对照组 1.219±0.021 SIR组 0.593±0.036aPTE 1μM/L+SIR组 0.762±0.029bPTE 2 μM/L+SIR组 0.860±0.019bc
2.2 PTE对SIR损伤后HUVEC细胞培养液中MDA和SOD含量的影响 如表2所示,缺血再灌注损伤后HUVEC释放的MDA显著上升,而SOD的活性显著下降(与对照组相比,P<0.05)。给予PTE预处理后,一定程度上减少了MDA释放,提高了SOD活性(与SIR组相比,P<0.05)。且该作用呈一定的剂量依赖性(与PTE 1μM/L+SIR相比,P<0.05)。
表2 PTE对SIR损伤后HUVEC细胞培养液中MDA和SOD含量的影响(n=6,±s)
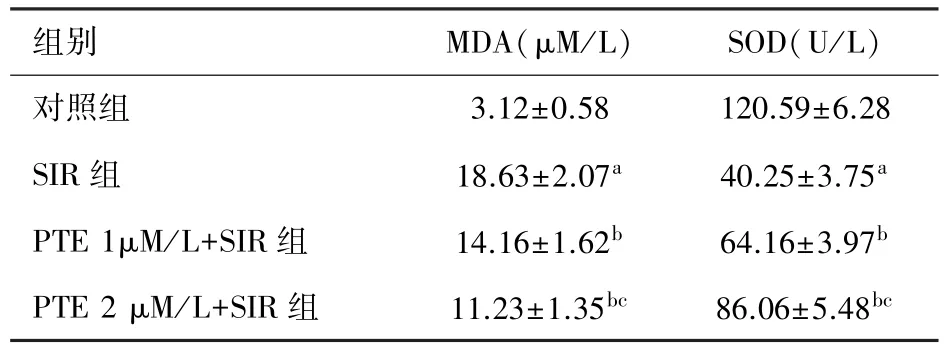
表2 PTE对SIR损伤后HUVEC细胞培养液中MDA和SOD含量的影响(n=6,±s)
注:a与对照组比较P<0.05;b与SIR组比较P<0.05;c与PTE1 μM/L+SIR组相比P<0.05。
组别 MDA(μM/L) SOD(U/L)对照组 3.12±0.58 120.59±6.28 SIR组 18.63±2.07a 40.25±3.75aPTE 1μM/L+SIR组 14.16±1.62b 64.16±3.97bPTE 2 μM/L+SIR组 11.23±1.35bc 86.06±5.48bc
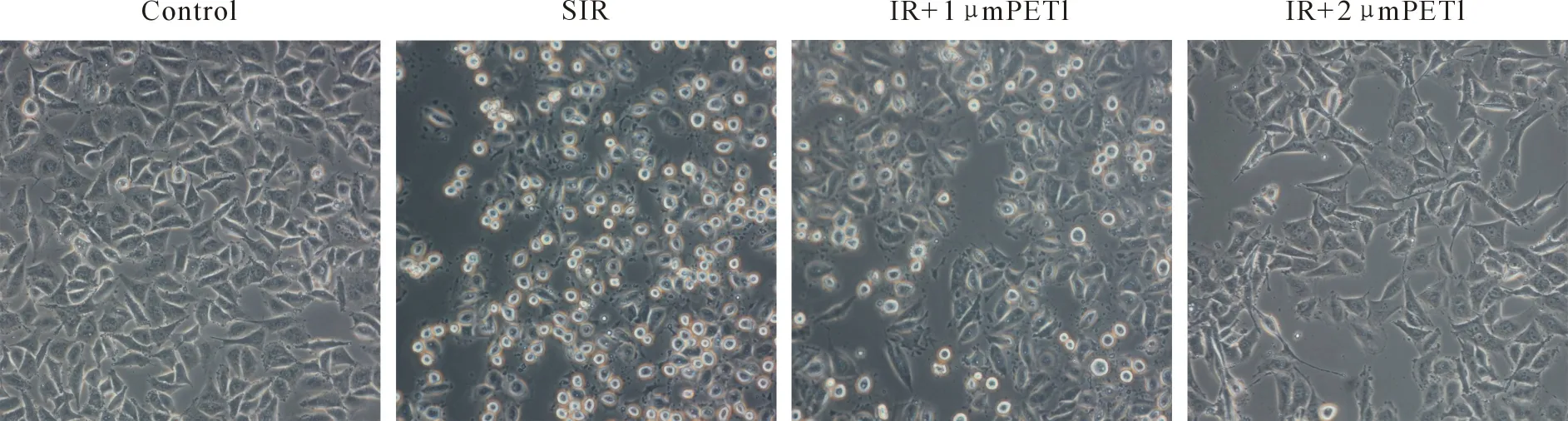
图1 PTE对SIR损伤后HUVEC细胞形态的影响(倒置显微镜,200倍)
2.3 PTE对SIR损伤后HUVEC细胞SIRT1和Ac-FOXO1蛋白及凋亡相关蛋白表达的影响 图2所示为各组Western blot典型结果,并用图像分析软件进行统计分析。可见:与对照组相比,SIR处理显著降低了SIRT1的表达水平,同时上调了Ac-FOXO-1的表达( P<0.05);降低了抗凋亡蛋白Bcl-2表达,上调了凋亡蛋白Bax表达( P<0.05)。与SIR组相比,PTE预处理显著提高了SIRT1表达,同时下调了Ac-FOXO1表达( P<0.05);增加了抗凋亡蛋白Bcl-2表达,下调了凋亡蛋白Bax表达( P<0.05)。该作用有剂量依赖性,2 μM/L PTE保护效果更为明显( P<0.05)。
2.4 PTE与EX527共处理对SIR损伤后HUVEC细胞的影响 前期结果显示2 μM/L的PTE具有较好的保护效果,给予SIRT1阻断剂后检测细胞活力值发现,与PTE+SIR组相比,PTE+SIR+EX527组细胞活力显著下降( P<0.05)。与SIR组相比,EX527 +SIR组对HUVEC细胞活力没有影响( P>0.05)。见表3。
表3 PTE与EX527共处理对SIR损伤后HUVEC细胞活力的影响(n=10,±s)

表3 PTE与EX527共处理对SIR损伤后HUVEC细胞活力的影响(n=10,±s)
注:a与SIR比较P<0.05;b与PTE+SIR组比较P<0.05;c与PTE+SIR+EX527组比较P<0.05。
组别 OD值SIR组 0.502±0.042 PTE+SIR组 0.743±0.031aPTE+SIR+EX527组 0.6140±0.025bEX527+SIR组 0.490±0.056c

图2 PTE对SIR损伤后HUVEC细胞SIRT1、Ac-FOXO1、Bcl-2、Bax等蛋白表达的影响
2.5 PTE与EX527共处理对SIR损伤后HUVEC细胞的影响 图3所示为各组Western blot典型结果,并用图像分析软件进行统计分析。可见:与SIR组相比,PTE+SIR处理组SIRT1的表达水平显著增加,同时Ac-FOXO-1的表达显著下降( P<0.05);抗凋亡蛋白Bcl-2表达明显增加,凋亡蛋白Bax表达明显下降( P<0.05)。与PTE+SIR组相比,PTE+SIR+EX527组SIRT1表达轻微下降,Ac-FOXO1表达显著增加( P<0.05);抗凋亡蛋白Bcl-2表达下降,凋亡蛋白Bax表达增加( P<0.05)。与SIR组相比,EX527+SIR组未引起各蛋白表达显著变化。

图3 PTE与EX527共处理对SIR损伤后HUVEC细胞SIRT1、Ac-FOXO1、Bcl-2、Bax等蛋白表达的影响
3 讨 论
紫檀芪可以通过多种作用机制,可以保护多种组织细胞,对多种疾病具有治疗和预防作用[5,8]。以前的研究显示紫檀芪可以剂量依赖性的促进人脐静脉内皮细胞eNOS磷酸化,增强NO合成,最终可以阻止内皮细胞功能紊乱[10]。对于氧化修饰的低密度脂蛋白所诱发的内皮细胞凋亡,紫檀芪同样可以发挥保护作用,机制涉及其抗氧化应激功能[9],该课题组的另一项研究显示紫檀芪可以促进内皮细胞发生保护性自噬,最终避免凋亡的命运[9]。上述证据都支持紫檀芪可以通过调节内皮细胞功能,抑制细胞凋亡,对于心血管疾病具有预防和治疗作用。笔者的研究在人脐静脉内皮细胞缺血再灌注模型上探讨了紫檀芪的保护作用,最终发现了类似的保护效果。结果提示缺血再灌注处理的内皮细胞氧化应激明显增强,凋亡指数明显增加,这些效果可以被紫檀芪抑制。
Sirtuins是一个高度保守的家族,包含7个NAD+依赖的脱乙酰化酶,Sirt1是一种位于细胞核的脱乙酰化酶[12-13]。Sirt1可以作用于其下游的多种底物发挥生理效应,叉头转录因子1(fork head transcription factor 1,FOXO1)是其中重要的一种[14-15]。SIRT1可以作用于FOXO1,通过去乙酰化作用激活FOXO1。以前的研究证明SIRT1/FOXO1信号通路在心脏缺血再灌注损伤中发挥保护作用[15]。并且该信号通路同Bax和Bcl-2凋亡信号通路密切相关[16-17],它可以增加Bcl-2/Bax比例,最终抑制凋亡的发生[16]。在本研究中笔者同样发现内皮细胞缺血再灌注处理后Sirt1下调,乙酰化FOXO1上调,Bcl-2/Bax比例下调,凋亡增加。紫檀芪处理后可以抑制这些效应的发生,保护内皮细胞,并且这种保护作用表现为剂量依赖性。紫檀芪的保护效应可以被Sirt1阻断剂抵消,进一步肯定了SIRT1/FOXO1凋亡信号通路参与紫檀芪对内皮细胞的保护作用。
综上,笔者发现紫檀芪可以保护内皮细胞抵抗缺血再灌注损伤,其机制是激活SIRT1/FOXO1保护性信号通路,抑制内皮细胞凋亡。
参考文献:
[1]Luo T,Chen B,Zhao Z,et al.Histamine h2 receptor activation exacerbates myocardial ischemia/reperfusion injury by disturbing mitochondrial and endothelial function[J].Basic Res Cardiol,2013,108(3):342.
[2]Pushpakumar S,Kundu S,Sen U.Endothelial dysfunction:The link between homocysteine and hydrogen sulfide[J].Curr Med Chem,2014,21(32):3662-3672.
[3]Zhu T,Yao Q,Hu X,et al.The role of mcpip1 in ischemia/reperfusion injury-induced huvec migration and apoptosis[J].Cell Physiol Biochem,2015,37(2):577-591.
[4]Urban D,Hartel FV,Gadiraju K,et al.Extracellular atp attenuates ischemia-induced caspase-3 cleavage in human endothelial cells[J].Biochem Biophys Res Commun,2012,425(2):230-236.
[5]Estrela JM,Ortega A,Mena S,et al.Pterostilbene:Biomedical applications[J].Crit Rev Clin Lab Sci,2013,50(3):65-78.
[6]Yang Y,Wang J,Li Y,et al.Ho-1 signaling activation by pterostilbene treatment attenuates mitochondrial oxidative damage induced by cerebral ischemia reperfusion injury[J].Mol Neurobiol,2015.
[7]Yang Y,Yan X,Duan W,et al.Pterostilbene exerts antitumor activity via the notch1 signaling pathway in human lung adenocarcinoma cells[J].PLoS One,2013,8(5):e62652.
[8]McCormack D,McFadden D.A review of pterostilbene antioxidant activity and disease modification[J].Oxid Med Cell Longev,2013,2013:575482.
[9]Zhang L,Zhou G,Song W,et al.Pterostilbene protects vascular endothelial cells against oxidized low-density lipoprotein-induced apoptosis in vitro and in vivo[J].Apoptosis,2012,17(1):25-36.
[10]Park SH,Jeong SO,Chung HT,et al.Pterostilbene,an active constituent of blueberries,stimulates nitric oxide production via activation of endothelial nitric oxide synthase in human umbilical vein endothelial cells[J].Plant Foods Hum Nutr,2015,70(3):263-268.
[11]Zhang L,Cui L,Zhou G,et al.Pterostilbene,a natural smallmolecular compound,promotes cytoprotective macroautophagy in vascular endothelial cells[J].J Nutr Biochem,2013,24(5):903-911.
[12]Chalkiadaki A,Guarente L.The multifaceted functions of sirtuins in cancer[J].Nat Rev Cancer,2015,15(10):608-624.
[13]Nogueiras R,Habegger KM,Chaudhary N,et al.Sirtuin 1 and sirtuin 3:Physiological modulators of metabolism[J].Physiol Rev,2012,92(3):1479-1514.
[14]Miranda MX,van Tits LJ,Lohmann C,et al.The sirt1 activator srt3025 provides atheroprotection in apoe-/-mice by reducing hepatic pcsk9 secretion and enhancing ldlr expression[J].Eur Heart J,2015,36(1):51-59.
[15]Hsu CP,Zhai P,Yamamoto T,et al.Silent information regulator 1 protects the heart from ischemia/reperfusion[J].Circulation,2010,122(21):2170-2182.
[16]Sin TK,Yu AP,Yung BY,et al.Modulating effect of sirt1 activation induced by resveratrol on foxo1-associated apoptotic signalling in senescent heart[J].J Physiol,2014,592(Pt 12):2535-2548.
[17]Yang Y,Duan W,Lin Y,et al.Sirt1 activation by curcumin pretreatment attenuates mitochondrial oxidative damage induced by myocardial ischemia reperfusion injury[J].Free Radic Biol Med,2013,65:667-679.
(修订日期:2015-11-04)
(收稿日期:2015-10-20)
通讯作者:金振晓,E-mail:13571921011@ 163.com
基金项目:国家自然科学基金(81570231,81570230,81570232,81470415,81270170,81200151,81470411);陕西省国际科技合作与交流计划项目(2015KW-047);陕西省社会发展公关计划(2015SF104,2012K15-02-01);陕西省科技统筹创新工程计划项目(2013KTCL03-01);陕西省自然科学基金( 2014JM4106 );西京医院学科助推计划( XJZT14203,XJGX12C11,XJGX13LC15)
DOI:10.13498/j.cnki.chin.j.ecc.2016.01.13
作者单位:710032西安,第四军医大学西京医院心血管外科(冯 笑、段维勋、梁洪亮、金振晓、俞世强);710032西安,第四军医大学预防医学系(杨 阳);710003陕西西安,西安市中心医院胸心外科;710038陕西西安,第四军医大学唐都医院胸外科(范崇熙、狄守印);710032陕西西安,第四军医大学生物医学工程系(胡 伟)

