猪繁殖与呼吸综合征与猪圆环病毒2型混合感染的诊断分析
李明波,宋忠旭,董斌科,孙 华,雷 斌,梅书棋**
(湖北省农业科学院畜牧兽医研究所、动物胚胎工程及分子育种湖北省重点实验室,武汉 430209)
猪繁殖与呼吸综合征与猪圆环病毒2型混合感染的诊断分析
李明波,宋忠旭,董斌科,孙 华,雷 斌,梅书棋**
(湖北省农业科学院畜牧兽医研究所、动物胚胎工程及分子育种湖北省重点实验室,武汉 430209)
猪繁殖与呼吸综合征和猪圆环病毒病是目前养猪业广泛存在且危害较大的疾病,严重影响了种猪的繁殖性能和仔猪的生长性能,多表现为地方性流行和持续性感染,是其他猪病多发和频发的主要原因。2016年5月,湖北省某规模化猪场内育肥前期猪只出现以呼吸困难、高热、皮肤出现不规则丘疹、渐行性消瘦等临床症状的急性传染病,造成猪只生长发育受阻、饲料转化率降低。根据临床症状,结合流行病学、临床剖检观察、实验室诊断等方法,最终确诊其为猪繁殖与呼吸综合征与猪圆环病毒2型的混合感染引起,同时对检测数据进行分析并采取相应措施,有效减缓了疾病的流行与蔓延。研究通过对该场疾病发生的原因及防控措施进行分析,以期为当前养殖场该类疾病的临床防控提供参考。
猪繁殖与呼吸综合征;猪圆环病毒2型;诊断分析
猪繁殖与呼吸综合征是由猪繁殖与呼吸综合征病毒(P orcine Reproductive and Respiratory Syndrome Viruses,PRRSV)引起的猪高度接触感染性传染病。该病主要引起初胎和妊娠后期母猪的流产、产死胎、高热等;哺乳仔猪、保育猪最易感染出现临床症状或者继发其他细菌性疾病如链球菌、副猪嗜血杆菌、巴氏杆菌等,病死率较高,以出现发热、眼结膜水肿、呼吸衰竭、关节肿胀、间质性肺炎等综合症状为主。病毒可经呼吸道、胎盘、公猪精液感染传播[1]。研究表明,当前我国养殖场主要流行变异的PRRSV,且不同毒力的毒株引起的临床症状具有较大差异[2,3]。
猪圆环病毒病2型(Porcine Circovirus,PCV2)是新近发现的最小的DNA病毒,基因组大小为1 766 bp。该病可以感染各年龄阶段的猪只,包括断奶仔猪的多系统衰竭综合征(PMWS)、出生猪的先天震颤和生长猪的皮炎肾病综合征、增生性肠炎、妊娠母猪产死胎等。断奶仔猪多系统衰竭综合征(Postweaning Muhisystemic Wasting Syndrome,PMWS)是临床较常见也是造成经济损失最大的猪圆环病毒病。临床患PMWS的仔猪表现为皮肤苍白、呼吸道症状、进行性消瘦、腹股沟淋巴结肿大和生长不整齐,容易继发细菌感染等。该病可经猪的粪尿、鼻腔、乳汁、胎盘和公猪精液等途径传播[4,5]。
PRRSV和PCV2是引起猪群免疫抑制性疾病的重要病原。临床上,PRRSV和PCV2感染与其他病原体感染引起的呼吸系统疾病表现极为相似,并常伴随混合感染和继发感染。根据流行病学、临床表现以及剖检变化很难做出准确诊断,需要结合病原学和血清学等方法来做出综合判断。
2016年5月,湖北省某规模化猪场内育肥期猪只出现急性呼吸系统疾病,发病率20%左右,发病猪临床症状表现为食欲减退、阵发性咳嗽、高热(体温41 ℃以上)、皮肤出现不规则红紫斑及丘疹;严重病例表现为呼吸困难、渐行性消瘦、被毛粗乱及苍白等症状。为切实掌握发病情况,本研究结合流行病学、临床剖检观察、实验室病原学诊断等方法,最终确诊其为猪蓝耳病与猪圆环病毒2型的混合感染引起。同时采取综合防控措施,及时了解疾病的发展规律,有效减缓了疾病的暴发与蔓延。
1 材料与方法
1.1 材料
选择该规模化猪场内临床症状典型的发病猪只2头;无菌抽取保育阶段健康猪只血样10份、疑似发病的育肥期猪只血样20份,冷藏保存后送至华中农业大学动物疫病诊断中心检测。
1.1.1 主要仪器
德国eppendorf离心机匀浆机,PCR仪,Bio-RAD凝胶成像系统,DYY-7C电泳仪等。
1.1.2 引物及试剂
扩增PRRSV部分NSP2序列及PCV2 ORF2基因引物,Taq DNA polymerase(PCR聚 合 酶 )、dNTPs、 反转录试剂盒及DNA快速回收试剂盒为上海生工生物工程产品,Trizol总RNA提取试剂盒为Omiga公司产品,DL 2000 DNA Marker等均为大连宝生物公司(TaKaRa)产品。阳性对照样品由华中农业大学动物传染病诊断中心保存。
1.2 检测方法
1.2.1 流行病学调查和临床剖检
了解评估该养殖场内种猪群和各阶段生长猪只前期主要疫病的血清抗体和病原检测结果,以及猪群疫苗免疫程序等防控措施,观察发病猪只临床症状,选取2头发病猪只进行解剖,记录病例剖检变化。
1.2.2 主要疫病血清抗体的检测
无菌抽取保育阶段健康猪只血样10份、疑似发病的育肥期猪只血样20份,分离血清后采用ELISA(酶联免疫吸附试验)抗体检测试剂盒分别检测PRRS抗体、PCV2抗体、伪狂犬gE抗体、猪传染性胸膜肺炎放线杆菌抗体(ApxIV)等。ELISA抗体检测试剂盒为武汉科前生物制品公司产品。
1.2.3 血清中主要疫病病原的检测
按RNATrizol试剂说明书提取血清中病毒总基因组,进行PRRSV、PCV2等疑似病原的检测。采用PCR方法扩增PCV2 ORF2基因,样品中有PCV2存在时,可扩增出494bp的片段,PCR引物为:上游引物:5′-CACGGATATTGTAGTCCTGGT-3′,下游引物:5′-CGCACCTTCGGATATACTGTC-3′。另采用RT-PCR方法扩增PRRSV NSP2基因中覆盖变异毒株缺失区域的基因片段,样品中有变异性PRRSV时,可扩增出678bp的片段;样品中有经典PRRSV时,可扩增出768bp的片段。PCR引物为:上游引物(Dnsp-1161):5’-CAAAGAYCAGATGGAGGAG-3’,下游引物(Dnsp-1928):5’-ATRATGGCTTGAGCTGAG-3’( 下 划 线代表兼并碱基),基因特异性反转录引物(RTnsp-2850):5’-AGAATGAAGGA-3’。
2 结果与分析
2.1 流行病学调查结果
初步评估该场前期对疑似发病猪组织样的检测结果,发现场内存在变异PRRSV、PCV2的感染和流行,在防控PRRS上使用某公司生产的JXA1-R株减毒活疫苗免疫分娩后母猪和配种前后备猪,育肥阶段猪只未免疫PRRS疫苗;场内前期监测到的PCV2病原为PCV2b亚型,种猪和生产仔猪均免疫PCV2全病毒灭活疫苗。通过了解,该养殖场自2011年起开展了猪瘟、猪伪狂犬病净化等方面的工作,目前已达到净化的目标。
2.2 临床症状及剖检变化
本次发病的猪只为保育转入育肥阶段群体,平均体重30 kg以上,发病猪最初以高热(41.5 ℃),表现出急、慢性呼吸道疾病呈腹式呼吸,鼻腔有黏稠黏液,眼结膜潮红且分泌物增多,部分猪只背部有不规则丘疹,早期应用林可霉素、5%黄芪多糖、维生素C等复合制剂进行隔离治疗后转归,但生长受阻;严重病例的表现为食欲减退、苍白消瘦乃至呼吸衰竭致死(图1),个别病猪排出黄色水样稀粪。
对急性发病猪只和濒死的猪只进行解剖检查,发现病变多表现为:心包有积液、肺脏组织水肿出现虾肉样病变、全身淋巴结肿大出血,尤其是腹股沟和肠系膜淋巴结肿大充血明显(图2),肾脏色泽变淡,1头重症猪只脾脏严重肿大淤血。

图1 发病猪临床症状
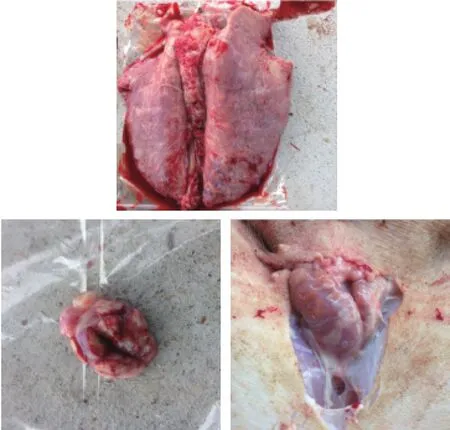
图2 发病猪只剖检症状
2.3 主要疫病血清抗体检测结果
使用商品化试剂盒分别检测10份保育猪和20份育肥期猪只血清中猪蓝耳病(PRRS)、猪圆环病毒2型(PCV2)、伪狂犬gE野毒(PRV-gE)、猪胸膜肺炎放线杆菌(ApxIV)抗体,阳性/阴性样品判定标准参照试剂盒使用说明,检测结果如表1所示。

表1 血清学抗体检测结果

图3 血清中PRRSV RT-PCR扩增产物
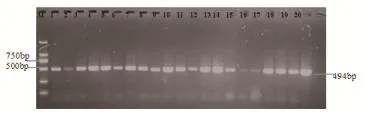
图4 血清中PCV2 PCR扩增产物
2.4 血清中主要疫病病原的检测结果
通过RT-PCR或PCR方法对20份疑似发病的育肥猪血清样品进行了PRRSV、PCV2病原的检测,结果表明20份样品中检出PRRSV变异毒株阳性比例为80%,检出PCV2病原阳性比例为100%,PCR扩增结果如图3、图4所示。
3 讨论
3.1 病因分析
1)从检测结果来看,10头保育阶段健康猪只未检测出PRRS抗体,说明此阶段猪只未感染PRRSV,且PCV2疫苗免疫抗体阳性率为100%(抗体均值为0.502),这部分猪从临床来看健康水平也较好;20头疑似发病育肥猪血清中检出PRRS抗体阳性率为95%,说明在保育转育肥阶段或许就感染了PRRSV,这个也可从血清中PRRSV的病原检测结果反应出来,其病原阳性率为80%(16/20),从RT-PCR扩增结果来看,PRRSV信号为弱阳性,说明猪只个体被感染的病毒剂量还不是很大,但却可以诱发细菌性疾病以及PCV2在猪体内复制能力增强,从而导致呼吸系统疾病,这些很好解释了当前该场育肥期猪只病情不稳定的一些问题。下步将对血清样品中检测出的PRRSV、PCV2病原分别进行GP5和ORF2基因序列测序分析,进一步明确毒株的来源和其在该场的传播规律。
2) PCV2与PRRS都属免疫抑制性疾病,可以互相促进感染增殖,从育肥猪PCV2病原检测结果来看,PCR扩增信号为强阳性,虽然该场在仔猪21日龄已进行该病的疫苗免疫,但是已有研究表明,不管是PCV2还是PRRSV,猪只免疫2种疫苗后都不能完全清除体内病毒,只能在一定程度上减少病毒血症时间或者部分抑制猪只排毒[6]。PCV2感染后可诱发呼吸系统疾病,姜平等研究表明热应激促进PCV2的复制与Hsp70(热休克蛋白)和Hsp27蛋白相关,这或许可以解释夏季PCV2感染能力增强的一些原因,如猪的皮炎肾病综合征(图1所示)。
3)保育和育肥阶段猪群中均未检测到猪胸膜肺炎放线杆菌抗体和伪狂犬野毒抗体。从疫病流行病学、临床症状、病理变化及实验室检测结果来看,育肥前期猪只疫病的发生有以下几个原因:一是PRRSV+PCV2感染是诱因,导致继发细菌性疾病如多杀性巴氏杆菌、支原体等感染的现象;二是该场猪群及饲养环境控制力度不够,不同日龄阶段的猪部分混群、栏舍饲养密度大等;三是养殖场现有防疫与生物安全防控基础条件不足,且猪舍主动通风和除尘措施较差;四是夏季蚊虫多发,通过交叉传播增加了病原感染几率。
3.2 防控措施
1)加强饲养管理,重视场内环境卫生工作,严格执行空圈栏舍的彻底消毒冲洗和消毒管理制度。实行定期带猪消毒,保持猪舍环境清洁卫生、干燥、通风良好,同时做到猪群转群全进全出,各生长阶段饲养猪群分区饲养,降低饲养密度。并及时将发病猪只和健康猪进行隔离饲养及治疗。
2)猪群转群后饲料中通过脉冲给药方式进行控制,添加10%替米考星1 000 mg/kg+黄芪多糖10~15 d,同时在饮水中添加葡萄糖、电解多维增强猪体质,减少应激反应。
3)保育阶段仔猪(35日龄左右)加强免疫PRRS疫苗一次,1头份/头,圆环病毒2b亚型灭活疫苗调整为28日龄免疫,1头份/头。
该养殖场通过实施上述防控方案及进一步加强饲养管理和生物安全防控措施后,有效降低了发病猪死淘率,猪群健康水平出现好转,猪场情况趋于稳定。
[1] BARBARA E S ,JEFFERY J Z, SYLVIE D A,et al.猪病学[M]. 9版.北京:中国农业大学出版社,2008: 423-445.
[2] 薛青红,张彦明,刘湘涛,等.中国部分地区2005-2007年猪繁殖与呼吸综合征病毒分离株ORF5基因和Nsp2基因遗传变异分析[J].中国农业科学,2009,42(5):1805-1802.
[3] LENG C L,TIAN Z J,ZHANG W C,et al.Characterization of two newly emerged isolates of porcine reproductive and respiratory syndrome virus from Northeast China in 2013[J]. Veterinary Microbiology ,2014,171: 41-52.
[4] 韦平,秦爱建.重要动物病毒分子生物学[M].北京:科学出版社,2008:478-496.
[5] 李文洁,李文涛,严伟东,等.中国部分地区猪圆环病毒2型的基因型分析[J].畜牧兽医学报,2009,40(9):1358-1362.
[6] MENGELING W L, LAGER K M, VORWALD A C,et al.Strain specificity of the immune response of pigs following vaccination with various strains of porcine reproductive and respiratory syndrome virus[J].Vet Microbiol,2003b,93:13-24.
2016-07-19)
农业部国家生猪产业技术体系武汉综合试验站项目(编号:CARS-36);十三五创新团队项目(编号:2016—620—004—001)。
李明波(1982-),男,湖北宜都人,硕士,助理研究员,研究方向:猪传染病的病原学诊断和临床防控技术(E-mail:lmb409@126.com)。
**通讯作者:梅书棋,研究员,研究方向:猪遗传育种,(E-mail:msqlfe@163. com)。

