锌和铁对浅水湖泊中浮游植物复苏影响研究——以玄武湖为例
滕益莉,王沛芳*,任凌霄,王 超,钱 进,刘佳佳(1.河海大学环境学院,南京210098;2.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,南京210098)
锌和铁对浅水湖泊中浮游植物复苏影响研究——以玄武湖为例
滕益莉1,2,王沛芳1,2*,任凌霄1,2,王超1,2,钱进1,2,刘佳佳1,2
(1.河海大学环境学院,南京210098;2.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,南京210098)
摘要:选取冬季12月的玄武湖水样,调整培养液的起始金属离子浓度(锌:0、3.25×10(-4)、3.25×10(-3)、3.25×10(-2)mg·L(-1);铁:0、2.80×10(-4)、2.80×10(-3)、2.80×10(-2)mg·L(-1)),探讨金属离子锌、铁对浮游植物复苏过程中群落结构的影响。结果表明:当锌为3.25×10(-2)mg·L(-1)时,蓝藻的复苏受到明显的抑制,绿藻及硅藻的生长受到胁迫作用,Fv/Fm值分别降至0.40、0.30、0;当铁浓度高于2.80×10(-2)mg·L(-1)时,蓝藻的复苏同样受到抑制,Fv/Fm值降为0.45,而绿藻和硅藻的Fv/Fm分别为0.33和0.07。高铁浓度下复苏后的浮游植物以蓝藻门的微囊藻为主,绿藻门的栅藻次之;高浓度锌胁迫下复苏后的浮游植物主要为绿藻门的栅藻,其次是绿藻门的小球藻,再后是蓝藻门的微囊藻。
关键词:浮游植物;复苏;金属离子;群落结构;光合作用活性
滕益莉,王沛芳,任凌霄,等.锌和铁对浅水湖泊中浮游植物复苏影响研究:以玄武湖为例[J].农业环境科学学报, 2016, 35(3):540-547.
TENG Yi-li, WANG Pei-fang, REN Ling-xiao, et al. Impact of zinc and iron on phytoplankton community structure during recruitment:A case study in Lake Xuanwu, Nanjing[J]. Journal of Agro-Environment Science, 2016, 35(3): 540-547.
随着湖泊流域人类活动的日益频繁,大量污染物流入水体,导致湖泊水体水质恶化等一系列的水环境问题。浅水湖泊的水华形成与暴发分为休眠、复苏、生物量增加、上浮与聚集形成水华四个主要阶段[1]。越冬复苏期间的藻细胞的生理活性最为薄弱、生物量最低[2],如果此时对浮游植物加以控制将有效减少水体中浮游植物的生物量,从而控制水华的暴发。浮游植物复苏的影响因子主要为温度、光照、营养盐、水动力[3-6],但湖泊的水体环境较为复杂,还包括锌、铁、铜、镁等金属离子的影响。研究表明,适当的锌、铁可促进浮游植物的生长[7],但高浓度的锌、铁会导致浮游植物细胞氧化系统受到破坏[8],改变浮游植物吸收营养盐(N、P、Si等)的速率和比例,影响浮游植物的种间竞争,进而影响其群落结构[9-10]。Kleinübing等[11]指出蓝藻细胞壁带有负电荷,具有较大的比表面积和粘性,可提供多种功能团与金属离子结合。汪苹等[12]认为蓝细菌体内也存在金属离子的结合点位,同时可以通过胞外多糖络合金属离子。闫峰等[13]研究发现,铁离子浓度为1.14×10-4mg·L-1时,铜绿微囊藻与四尾栅藻生长状态良好。而李瑞香等[14]指出,铁的浓度为2.80×10-5mg·L-1时,新月菱形藻与中肋骨条藻细胞密度较大,生长较快。田程[15]研究金属离子对浮游植物生长影响的结果表明,蛋白核小球藻在锌离子浓度为1.75×10-5mg·L-1时生长状态最佳。可见关于金属离子对浮游植物生长的研究已趋于成熟,而金属离子对其复苏的影响却未见报道。
本文以Phyto-PAM为测量手段,探索金属离子锌、铁对浅水湖泊中常见的蓝藻、绿藻、硅藻复苏时叶绿素含量的变化及对最大光量子产量(光合效率)的影响,旨在了解浮游植物复苏过程中群落结构的变化规律,进一步认识水华暴发的机理,为控制水华暴发提供理论依据。
1 材料与方法
1.1样品采集
2014年12月20日采集实验样品于南京市玄武湖东南湖区(32°4'2.97″N,118°48'4.61″E)。玄武湖面积3.7 km2,平均水深1.14 m,最大水深为2.31 m,蓄水量为5×106m3,是典型的浅水型淡水湖泊。玄武湖的浮游植物组成主要是蓝藻、绿藻及硅藻,其优势藻种为微囊藻,曾在2005年暴发大规模的蓝藻水华[16]。玄武湖水体TN、TP的质量浓度范围分别为1.43~2.96、0.05~0.26 mg·L-1[17],水质处于中度富营养化到重度富营养化状态之间。湖区水体中金属离子锌、铁的平均含量分别可达到0.007、0.154 mg·L-1[18],属于轻度污染。实验用5 L有机玻璃采水器从表层水开始,每隔50 cm进行分层采样,分别采取深度为0、50、100、150 cm水样四份。采样时水体的温度、溶解氧、pH、浊度和叶绿素用水质仪YSI6600(Yellow Spring Instruments,USA)测定。水样采集2 h内送至实验室进行处理保存。为了避免采样点浮游植物种类垂直分布的不均匀,将不同水层的水样等比例混合后放入4℃冰箱黑暗中保存10 d,使水中的浮游植物完全处于越冬状态[6]。
1.2实验方法
以往的研究表明[3-6],适宜的温度、较高的营养盐、合适的氮磷比、充沛的光照更有利于浮游植物的复苏,本实验选取无菌的HGZ培养基给浮游植物提供充足的营养、温度及合适的光照,消除了温度、光照及营养盐等方面的差异。先分别配置缺锌、铁的HGZ培养基,再分别添加浓度为0、3.25×10-4、3.25×10-3、3.25×10-2mg·L-1的硫酸锌(标记为Zn0、Zn1、Zn2、Zn3)和浓度分别为0、2.80×10-4、2.80×10-3、2.80×10-2mg·L-1的柠檬酸铁胺[18](标记为Fe0、Fe1、Fe2、Fe3)。为了避免不同锌、铁的交叉影响,分别在不同浓度梯度的锌实验组中铁的浓度按照HGZ培养基的配方添加,同样不同浓度铁的实验组中锌的浓度也按照HGZ培养基的配方添加。培养基中所含的EDTA与锌、铁结合形成的螯合物将可被浮游植物吸收利用,但少量沉淀对结果影响较小[18-19]。每次实验前,将所用的实验仪器放入120℃消煮锅进行灭菌消毒2 h。实验时用玻璃棒搅拌水样,充分混匀,避免浮游植物的种类和生物量的不同给实验带来误差。使用移液管取10 mL均匀混合水样添于150 mL改进的HGZ培养基中,混合后放入光照培养箱中培养,温度设置为16℃,光照强度2000 lx,光暗周期为12:12[3]。每天摇晃锥形瓶3次,使藻类处于悬浮状态,避免产生瓶壁效应。每个浓度设置3个平行样,培养器皿为250 mL锥形瓶,实验周期为20 d。所有药品均为分析纯。
1.3分析测定方法
1.3.1浮游植物镜检
由于Phyto-PAM的叶绿素检测限为0.1 μg·L-1,为了充分了解初始实验组浮游植物种类的组成,使用显微镜对物种进行鉴定。取3 mL混合水样于5 mL的离心管中,放入100℃水浴锅中5 min,充分摇匀,取100 μL均匀混合水样于浮游植物计数框,在40倍的光学显微镜下进行物种鉴别及计数,重复3次。
1.3.2叶绿素荧光参数的测定
Phyto-PAM用于测定水体中浮游植物的光合作用活性,它能够区分不同种群的浮游植物(蓝藻、绿藻和硅藻),同时分别测定其叶绿素含量及最大光量子产量(Fv/Fm),Fv/Fm即为最大可变荧光(Fm-Fo)与Fm的比值,反映了植物对光量子的最大利用潜能。因为快速光曲线与光合作用放氧量之间存在较好的线性关系,所以Fv/Fm也可以反映植物的光合作用活性。浮游植物的荧光参数采用Phyto-PAM(Walz,Effeltrich,Germany)荧光仪测定,控制软件为PhytoWin2.1。分别在实验第0、3、7、10、12、16、20 d测量水体中蓝藻、绿藻、硅藻及总叶绿素含量和各自的最大光量子产量,可得到浮游植物群落结构和最大光量子产量随时间的变化规律。具体操作步骤为:取水样2.0 mL,经暗适应15 min,首先打开测量光(ML),待初始荧光稳定后得到最小荧光(Fo),随后打开饱和脉冲(Satura tion Pulse),得到最大荧光(Fm)。随即将测量光频率调为32 Hz,而实时荧光(Ft)与叶绿素有较好的线性关系,可得到蓝藻、绿藻、硅藻及总叶绿素含量。
1.4数据分析
为保证分析的准确性,采用空白及多重样品进行平行测定。采用Excel 2007和Origin 8.5软件对获得数据进行分析处理。
2 结果与分析
2.1玄武湖水样理化参数
玄武湖从表层水至上覆水的各个指标相差较小,温度在6.43~8.19℃之间波动,溶解氧为8.90~11.05 mg·L-1,pH值为8.40±0.07,浊度在(5.2±1.2)Ntu之间,叶绿素为(6.89±1.31)μg·L-1。
2.2浮游植物种属的组成
Phyto-PAM检测表明,绿藻及硅藻的叶绿素含量分别为(2.62±0.46)μg·L-1和(4.21±0.69)μg·L-1,最大光合潜能Fv/Fm可分别达到0.34±0.13和0.42± 0.19,蓝藻含量低于检测限。对水样进行镜检发现,水体中有少量的鱼腥藻(Anabaena flos-aquae)、蓝纤维藻(Dactylococcopsis acicularis)、微囊藻(Microcystis sp.)等蓝藻种属,但优势藻种为绿藻及硅藻,如小球藻(Chlorella vulgaris)、栅藻(Scenedesmus sp.)、卵囊藻(Oocystis sp.)、小环藻(Cyclotella sp.)、舟形硅藻(Navicula sp.)、直链硅藻(Melosira sp.)数量较多(表1)。
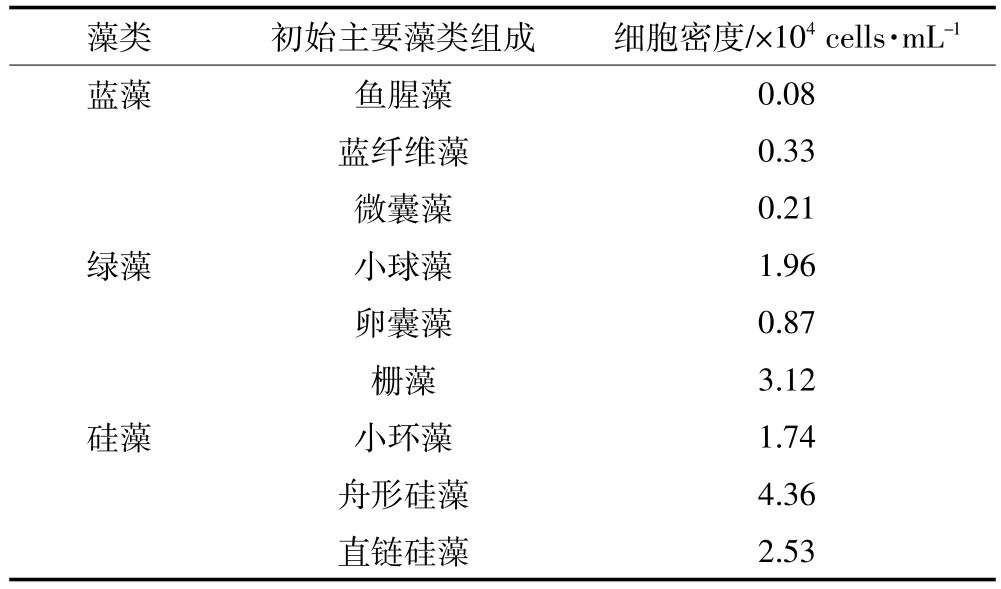
表1 玄武湖初始水样中浮游植物的组成Table 1 Community composition of phytoplankton in initial water samples from Xuanwu Lake
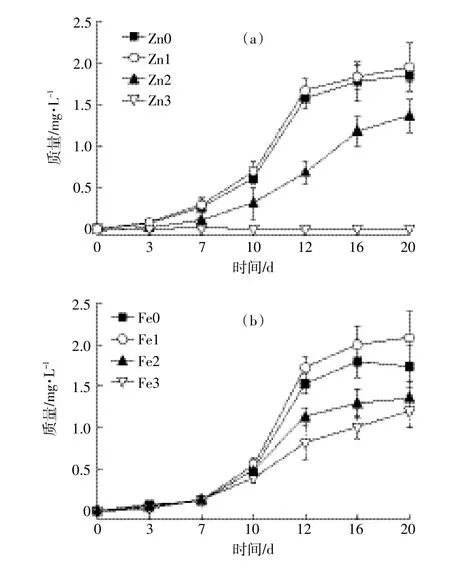
图1 浮游植物复苏时生长曲线Figure 1 Phytoplankton growth curves during recruitment
2.3浮游植物的生长变化曲线
由图1a可以看出,随着金属离子锌的浓度变化,浮游植物的复苏状况呈现先抑制、再促进、再抑制的状态。当锌浓度为3.25×10-4mg·L-1时,浮游植物的复苏时间最短,生长量最大,第20 d时达到1.7 mg·L-1,高于缺锌实验组中的浮游植物的生物量;浮游植物在锌的浓度为3.25×10-3mg·L-1时,生物量明显低于对照组,显示浮游植物受到锌的胁迫作用;同时锌浓度为3.25×10-3mg·L-1的高锌实验组中,浮游植物的质量一直保持不变,即浮游植物已停止生长,在此浓度下浮游植物的生长严重受到锌的胁迫。
由图1b观察到,随着铁离子浓度的逐步增加,浮游植物的生长趋势同样呈现出抑制、再促进、再抑制的状态,即当铁的浓度适量时,浮游植物的复苏状态较好,缺铁和铁过量均抑制其生长;第7 d时,浮游植物的生理生化活性开始缓慢恢复,生物量开始增加。实验前期,各实验组中浮游植物复苏状况大致相同,之后,铁浓度为2.8×10-3mg·L-1实验组中的浮游植物生物量低于其他实验组,说明此时,浮游植物的复苏受到铁离子的胁迫;而当铁的浓度为2.8×10-4mg·L-1时,浮游植物的生物量最大,复苏状态最佳。
2.4最大光量子产量Fv/Fm的变化
由图2可以了解到在金属离子锌、铁的作用下蓝藻、绿藻、硅藻Fv/Fm随时间的变化规律。硅藻的Fv/ Fm在所有实验组中均有所降低,在高浓度锌胁迫下,其Fv/Fm降为0,在显微镜观察下也未发现硅藻。绿藻在所有的实验组中Fv/Fm一直维持在0.5~0.6之间,但在铁浓度达2.8×10-2mg·L-1时其值降至0.4左右,说明绿藻生长受到铁的胁迫作用;绿藻的Fv/Fm随着锌的浓度增加而有所降低,当锌浓度为3.25×10-2mg·L-1时,绿藻的生长明显受到抑制。在实验早期阶段,蓝藻的生理生化活性较低,藻细胞的Fv/Fm低于绿藻及硅藻,随着藻细胞活性的恢复,藻细胞的PSII光和系统得到充分恢复,其Fv/Fm值达到0.6,在高铁浓度中超过绿藻,说明复苏之后蓝藻对铁的耐受力高于其他浮游植物。
2.5浮游植物群落结构的变化
不同浓度的金属锌离子对冬季浮游植物复苏时群落结构变化的影响如图3所示。硅藻在实验开始所占比例较高,高于50%,随着浮游植物的生长,其比例有所降低,特别是当锌浓度为3.25×10-2mg·L-1时,比例降为0;低浓度锌时,经过一段时间的适应过程,硅藻比例有所上升,但不超过25%。在实验开始一周内,绿藻的比例大幅上升,高达50%以上,在高浓度锌时,其比例继续增加至75%;低浓度锌时,绿藻的比例有所降低,特别是在锌浓度为3.25×10-4mg·L-1时,降到20%。冬季蓝藻处于休眠期,在实验开始时,其含量较低,前12 d一直缓慢增长,在锌浓度为3.25×10-4mg· L-1时蓝藻比例超过50%,但在锌浓度达到3.25×10-2mg·L-1时,其比例一直在20%左右,可见低浓度的锌有利于蓝藻的复苏。随着锌浓度增加,绿藻逐渐成为优势藻种。硅藻在实验前期处于优势地位,在环境适宜时,其逐渐失去生长优势,被蓝藻、绿藻所取代。
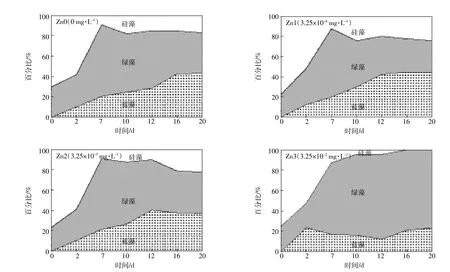
图3 浮游植物复苏时在不同锌浓度下群落结构的变化Figure 3 Variation of phytoplankton community structure at different concentrations of Zn during recruitment
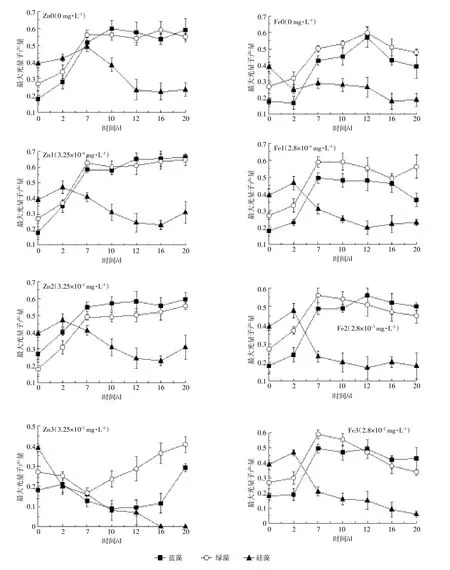
图2 在不同锌、铁浓度下蓝藻、绿藻、硅藻的Fv/Fm值变化Figure 2 Variation of Fv/Fm of blue algae,green algae,and diatoms at different concentrations of Zn and Fe
图4展示了在不同铁浓度时浮游植物复苏过程中群落的交替变化。所有实验组中硅藻比例随着实验的进行而下降,由50%降至10%~20%。绿藻在低浓度铁中依旧保持优势地位,但在高浓度铁中,比例逐渐降低。由于初始水样中蓝藻含量低,实验前10 d,其比例一直较低,但在实验后期的高浓度铁中,蓝藻的比例逐渐上升,甚至超过绿藻,成为优势藻。可见绿藻在低浓度铁中成为优势藻,但在高铁浓度的实验组中,逐渐被蓝藻所取代。
2.6群落组成
实验后期浮游植物在不同金属离子浓度下的群落结构变化如图5所示。在所有实验组中绿藻门主要以栅藻为主,小球藻次之;蓝藻门中微囊藻为主要优势藻种,鱼腥藻次之;小环藻则是硅藻门中的主要藻种,同时存在少量的舟形硅藻。在适宜的锌离子浓度下,浮游植物的群落组成主要为微囊藻、栅藻、小环藻、小球藻等,随着锌离子浓度的增加,栅藻和小球藻所占百分比增加,当锌离子浓度为3.25×10-2mg·L-1时,培养液中只存在栅藻、小球藻和微囊藻,绿藻门藻类处于优势地位。随着铁离子浓度的增加,水体中的优势藻逐渐由栅藻演替为微囊藻。硅藻门中舟形硅藻及小环藻在所有的铁实验组中均有发现,但所占比例一直较低。
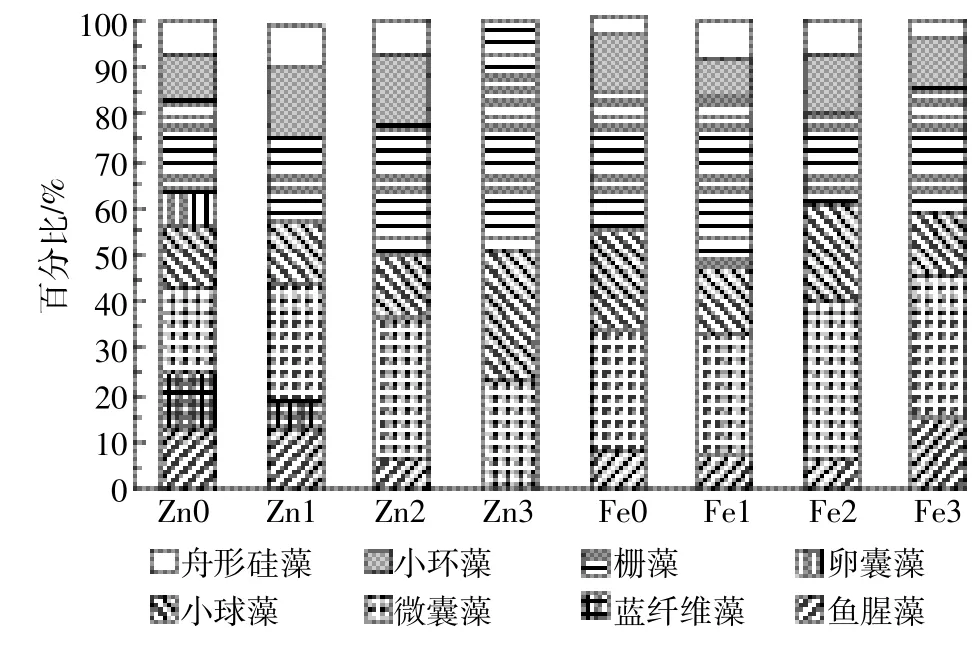
图5 不同锌、铁浓度下浮游植物第20 d时的群落组成Figure 5 Phytoplankton community composition at different concentrations of Zn and Fe on day 20
3 讨论
金属离子的浓度过高时,将使浮游植物的生长受到一定的抑制,表现出生长速率降低,光合系统活性受到抑制,甚至生物量减少等现象。本文结果同样表明,过量的金属离子抑制浮游植物的复苏。在锌、铁的浓度分别为3.25×10-4、2.8×10-4mg·L-1下,浮游植物的生物量最大,复苏状态达到最佳;而当锌、铁的浓度为3.25×10-2、2.8×10-2mg·L-1时,浮游植物的复苏则受到严重的抑制作用。有学者指出[20],过量的金属离子导致浮游植物的氧化系统受到胁迫,抑制其光系统的活性,而使其生长受到限制。
通过PAM检测藻细胞的PSII光合系统了解到,锌离子浓度高于3.25×10-3mg·L-1时,蓝藻的Fv/Fm下降,PSII光合系统受到抑制,生物量也明显下降;而绿藻的Fv/Fm值一直高于0.4,相应地,生物量高于蓝藻及硅藻。可见绿藻对锌胁迫作用的耐受力高于复苏阶段的蓝藻。锌离子毒性试验中发现,斜生栅藻的耐受毒性能力大于铜绿微囊藻[15],可能是斜生栅藻细胞具有较高的外排作用和胞内解毒作用。高浓度金属离子对硅藻复苏的影响尤为明显,如锌的浓度为3.25× 10-2mg·L-1时,Fv/Fm值降为0,硅藻全部死亡。在锌离子的浓度为2.66×10-4mg·L-1时,锌离子的毒性使小环藻的细胞器及细胞膜膨胀,影响细胞的正常生长[21]。有研究指出[22],在生长阶段硅藻受金属离子锌的半抑制浓度为0.36 mg·L-1,而绿藻受金属离子锌的半抑制浓度为2.47 mg·L-1。
在高浓度铁离子的胁迫作用下,蓝藻的Fv/Fm值高于其他浮游植物,从而在此浓度下蓝藻的生物量也占优势地位。可见,蓝藻在复苏时对铁的耐受力高于其他浮游植物。刘静[23]在研究铁离子对浮游植物的生理生态效应研究中发现,高浓度的铁离子可促进铜绿微囊藻细胞的生长和光合作用,并且铜绿微囊藻毒素的合成随着铁离子浓度的升高而缓慢上升。因此控制水体中的铁含量对抑制铜绿微囊藻的暴发有着重要现实意义。金属离子不仅构成浮游植物生长要素循环过程中的重要组成部分[24],对进一步认识浅水湖泊水华暴发机制也具有一定的研究意义。
4 结论
(1)浮游植物的复苏与金属离子的含量具有一定的相关性,当锌、铁的浓度分别高于3.25×10-3、2.8× 10-3mg·L-1时,浮游植物的复苏受到抑制作用。
(2)复苏时期不同的浮游植物种属对金属离子的耐受力各不相同。绿藻在复苏时对锌的耐受力高于其他浮游植物,锌的浓度高于3.25×10-2mg·L-1时,绿藻门的栅藻和小球藻为水体中的优势藻种;而蓝藻在复苏时对铁的胁迫作用的耐受力高于其他浮游植物,铁的浓度高于2.8×10-2mg·L-1时,蓝藻门的微囊藻为水体中的优势藻种。
参考文献:
[1] Tan X, Kong F X, Cao H S, et al. Seasonal variation of Microcystis in Lake Taihu and its relationships with environmental factors[J]. Journal of Environmental Sciences, 2009, 21(7):892-899.
[2]吴晓东,孔繁翔,曹焕生,等.越冬浮游植物光合作用活性的原位研究[J].湖泊科学, 2007, 19(2):139-145. WU Xiao-dong, KONG Fan-xiang, CAO Huan-sheng, et al. In situ study on the photochemical vitality of overwintering phytoplankton[J]. Journal of Lake Sciences, 2007, 19(2):139-145.
[3] Tan X, Kong F X. Effects of enhanced temperature on algae recruitment and phytoplankton community succession[J]. China Environmental Science, 2009, 29(6):578-582.
[4] Kristina A, Blomqvist P. Benthic overwintering of Microcystis colonies under different environmental conditions[J]. Journal of Plankton Research, 2002, 24(11):1247-1252.
[5] Ståhl-Delbanco A, Lars-Anders H, Gyllström M. Recruitment of resting stages may induce blooms of Microcystis at low N:P ratios[J]. Journal of Plankton Research, 2003, 25(9):1099-1106.
[6] Ståhl-Delbanco A, Lars-Anders H. Effects of bioturbation on recruitment of algal cells from the "seed bank" of laksediments[J]. Limnol O-ceanogr, 2002, 47(6):1836-1843.
[7] Li C, Liang W Y, Wang J L. Influence of iron to the growth and toxin production of Microcystis aeruginosa[J]. Journal of Safetyand Environment, 2009, 32(4):6-10.
[8] Pollingher U, Kaplan B, Berman T. The impact of iron and chelators on Lake Kinneret phytoplankton[J]. Journal of Plankton Research, 1995, 17 (10):1977-1992.
[9] Imai A, Fukushima T, Matsushige K. Effects of iron limitation and aquatic humic substances on the growth of Microcystis aeruginosa[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(10):1929-1937.
[10] Bertrand M, Poirier I. Photosynthetic organisms and excess of metals[J]. Photosynthetica, 2005, 43(3):345-353.
[11] Kleinübing S, Silva E, Sliva M, et al. Eauilibrium of Cu(Ⅱ)and Ni(Ⅱ)biosorption by marine algae Sargassum filipendula in a dynamic system:Competitiveness and selectivity[J]. Bioresource Technology, 2011, 102(7):4610-4617
[12]汪苹,胡章立.衣藻细胞的重金属结合特性及其抗性机制[J].环境科学与技术, 2009, 32(1):84-89 WANG Ping , HU Zhang-li. Mechanism of heavy metal tolerance and binding properties in Chlamydomonas[J]. Environmental Science & Technology, 2009, 32(1):84-89
[13]阎峰,储昭升,金相灿,等. Fe(Ⅲ)对太湖铜绿微囊藻和四尾栅藻竞争的影响[J].环境科学研究, 2007, 20(5):61-65. YAN Feng, CHU Zhao-sheng, JIN Xiang-can. et al. Effects of Fe onthe growth competition of Microcystis aeruginosa and Scenedesmus quadricauda[J]. Research of Environmental Sciences, 2007, 20(5): 61-65.
[14]李瑞香,朱明远.铁对自然群落浮游植物生长的影响[J].海洋科学进展, 2004, 22(1):50-54. LI Rui-xiang, ZHU Ming-yuan. Impact of iron on the growth of natural phytoplankton community[J]. Advances in Marine Science, 2004, 22 (1):50-54.
[15]田程.藻类荧光对重金属毒性响应规律的研究[D].石家庄:河北科技大学, 2010. TIAN Cheng. Study on the discipline of algae fluorescence response to heavy metal toxicity[D]. Shijiazhuang:Hebei University of Science & Technology, 2010.
[16]汪育文,李建宏,吴敏.南京玄武湖微囊藻水华种类组成的研究[J].环境科学, 2007, 28(10):2187-2191. WANG Yu-wen, LI Jian-hong, WU Min. Composition of microcystis species of the cyanobacterial bloom in Xuanwu Lake of Nanjing [J]. Chinese Journal of Environmental Science, 2007, 28(10):2187-2191.
[17]赵大勇,马婷.南京玄武湖富营养化及重金属污染现状[J].河海大学学报:自然科学版, 2012, 40(1):83-87. ZHAO Da-yong, MA Ting. Study on eutrophication and heavy metal pollution of Xuanwu Lake[J]. Journal of Hehai University(Natural Sciences), 2012, 40(1):83-87.
[18]李晓晨,赵丽,王超.玄武湖上覆水间隙水和沉积物中的重金属分布研究[J].环境科学与技术, 2008, 31(5):4-6. LI Xiao-chen, ZHAO Li, WANG Chao. Trace metal levels in overlying water, pore water and sediment of Xuanwu Lake, Nanjing[J]. Environmental Science & Technology, 2008, 31(5):4-6.
[19]储昭升,金相灿,阎峰. EDTA和铁对铜绿微囊藻和四尾栅藻生长和竞争的影响[J].环境科学, 2007, 28(11):2457-2461. CHU Zhao-sheng, JIN Xiang-can, YAN Feng. Effects of EDTA and iron on growth and competition of Microcystis aeruginosa and Scenedesmus quadricauda[J]. Chinese Journal of Environmental Science, 2007, 28(11):2457-2461.
[20] Branco D, Lima A. Sensitivity of biochemical markers to evaluate cadmium stress in the freshwater diatom Nitzschia palea(Kützing)W. Smith[J]. Aquatic Toxicology, 2010, 99(2):109-117
[21]丁腾达,倪婉敏,张建英.硅藻重金属污染生态学研究进展[J].应用生态学报, 2012, 23(3):857-866. DING Teng-da, NI Wan-min, ZHANG Jian-ying. Research advances in heavy metals pollution ecology of diatom[J]. Chinese Journal of Applied Ecology, 2012, 23(3):857-866.
[22]张首临,刘明星,李国基,等. 4种重金属离子对海洋三角褐指藻生长影响的研究[J].海洋与湖沼, 1995, 26(6):582-585. ZHANG Shou-lin, LIN Ming-xing, LI Guo-ji, et al. Influence of toxicity of heavy metal ions to growth of Phaeodactyium tricornutum[J]. Oceanologiaet Limnologia Limnologia Sinica, 1995, 26(6):582-585.
[23]刘静, Fe3+对富营养化水体中三种常见淡水藻类生长的影响[D].扬州:扬州大学, 2008. LIU Jing. Effects of Fe3+on the growths of three common algae in fresh water[D]. Yangzhou:Yangzhou University, 2008.
[24]王颖雪,王沛芳,王超,等.太湖浮游植物中重金属含量的季节变化特征及湖区差异[J].湖泊科学, 2015, 27(2):258-265. WANG Ying-xue, WANG Pei-fang, WANG Chao, et al. Seasonal variation and distribution characteristics of heavy metals in phytoplankton of different parts of Lake Taihu[J]. Journal of Lake Sciences, 2015, 27 (2):258-265.
Impact of zinc and iron on phytoplankton community structure during recruitment:A case study in Lake Xuanwu, Nanjing
TENG Yi-li1,2, WANG Pei-fang1,2*, REN Ling-xiao1,2, WANG Chao1,2, QIAN Jin1,2, LIU Jia-jia1,2
(1.College of Environment, Hohai University, Nanjing 210098,China 2.Key Laboratory of Integrated Regulation and Resources Development on Shallow Lakes, Ministry of Education, Hohai University, Nanjing 210098, China)
Abstract:Many studies have focused on the effects of temperature, light and dissolved oxygen on the growth of phytoplankton. However, the understanding of metal effects on phytoplankton during recruitment remains unclear. In the present study, water samples taken from Xuanwu Lake in December have been used to clarify the relationship between metal concentration and community structure change during phytoplankton recovery process. The initial zinc(0, 3.25×10(-4), 3.25×10(-3), 3.25×10(-2)mg·L(-1))and iron concentrations(0, 2.80×10(-4), 2.80×10(-3), 2.80×10(-2)mg·L(-1))were employed in cultivation experiment. Results showed that when zinc concentration was higher than 3.25×10(-3)mg·L(-1), the recruitment of blue algae was obviously inhibited and the growth of green algae and diatoms was reduced. The Fv/Fm values of these three algae were 0.4, 0.3 and 0,respectively. Similar results were also observed when iron concentration was over 2.80×10(-4)mg·L(-1). The recruitment of blue algae was inhibited. Fv/Fm values of blue algae, green algae and diatoms were reduced to 0.45, 0.33 and 0.07, respectively. It can be concluded that recruited phytoplankton was dominated by Microcystis of Cyanophyta, followed by Scenedesmus under high iron concentrations, while its dominant species was Scenedesmus, followed by Chlorella and Microcystis under zinc stresses.
Keywords:phytoplankton; recruitment; metal; community structure; Fv/Fm
*通信作者:王沛芳E-mail:pfwang2005@hhu.edu.cn
作者简介:滕益莉(1991—),女,安徽六安人,硕士研究生,主要研究方向为水污染控制理论与治理。E-mail:tengyili415@live.com
基金项目:国家自然科学基金面上项目(51479065);江苏省优势学科建设项目(PAPD)
收稿日期:2015-08-28
中图分类号:X524
文献标志码:A
文章编号:1672-2043(2016)03-0540-08
doi:10.11654/jaes.2016.03.018

