内蒙古地区菠菜猝倒病病原菌鉴定
银 玲京山幸二田 迅李依韦冀照君赵 汝
(1内蒙古民族大学生命科学学院,内蒙古通辽 028000;2岐阜大学流域圈科学研究中心,日本岐阜 501-1193)
内蒙古地区菠菜猝倒病病原菌鉴定
银 玲1京山幸二2田 迅1李依韦1冀照君1赵 汝1
(1内蒙古民族大学生命科学学院,内蒙古通辽 028000;2岐阜大学流域圈科学研究中心,日本岐阜 501-1193)
在内蒙古通辽市、包头市和巴彦淖尔市郊区大棚蔬菜种植区采集菠菜幼苗猝倒病病株,采用形态学和分子生物学方法对分离得到的病原物进行鉴定,并采用平板法测定代表菌株的致病性。结果表明:从82份病样中共获得60株腐霉菌株,分别为德里腐霉(Pythium deliense Meurs)、瓜果腐霉〔Pythium aphanidermatum(Edson)Fitzp〕和终极腐霉(Pythium ultimum Trow var. ultimum)。这3种腐霉均为菠菜猝倒病致病菌,但是发病率有所不同,P. deliense的发病率最高,为85.7%;其次是P. aphanidermatum,发病率为42.9%;发病率最低的是P. ultimum var. ultimum,为28.6%。
内蒙古;菠菜猝倒病;腐霉菌;rDNA-ITS
菠菜(Spinacia oleracea L.)别名波斯草、赤根菜、角菜,是黎科菠菜属中以绿叶为主要产品器官的一、二年生草本植物,原产于中亚,已有逾1 300年的栽培历史(Yamaguchi,1983)。早在7世纪菠菜就传入中国,目前在全国范围内被广泛种植,年产量约2 500万t,占世界菠菜总产量的89.2%(钱伟 等,2014)。菠菜喜冷凉,生长最适温度15~20 ℃,在我国北方露地难以周年生产。随着设施农业的发展,菠菜种植不仅摆脱了自然气候、季节的制约,还提高了单产,保证了全年均衡供应。但设施栽培容易形成高湿的不利环境,加上长期连作,加剧了土传病害的发生为害,其中与猝倒病和根腐病有关的土传病菌有:尖孢镰刀菌(Fusarium oxysporum Schl.)、瓜果腐霉〔Pythium aphanidermatum(Edson)Fitzp〕、立桔丝核菌(Rhizoctonia solani K ü hn)、螺壳状丝囊霉(Aphanomyces cochlioides Drechs)等(Sumner et al.,1976;Naiki et al.,1986;Sumner,1991;Larsson & Gerhardson,1992),被这些病原菌侵染的菠菜,出苗前和出苗后均有病害发生。在国内,已有关于粉霜霉菠菜专化型〔Peronospora farinosa(Fries)Fries f. sp. Spinaciae〕引起的菠菜霜霉病(田黎 等,1993)和菠菜匍柄霉(Stemphylium botryosum)引起的叶斑病(Zhou et al.,2011)的报道。但是关于腐霉属菌引起菠菜病害的报道很少。本试验在内蒙古东部地区的通辽市和西部地区的包头市及巴彦淖尔市郊区采集菠菜幼苗猝倒病病株,对其病原物进行分离鉴定及致病性测定,以期明确内蒙古地区菠菜猝倒病病原菌的主要种类。
1 材料与方法
1.1 病样采集
2012年在内蒙古通辽市、包头市和巴彦淖尔市郊区大棚蔬菜种植区,采用随机采集的方式,把具有典型猝倒病症状的菠菜幼苗整株连根带土挖出,装入洁净塑料袋,标明编号、地点、采集时间,带回实验室4 ℃保存。其中,包头市选择2个大棚,每个大棚采集18株病株,共计36株;巴彦淖尔市选择2个大棚,每个大棚采集15株病株,共计30株;通辽市选择1个大棚,采集16株病株。
1.2 病原菌分离
选择发病较轻的菠菜幼苗,在根系发病部位剪取3块5 mm左右的组织,先用自来水洗净表面,再用无菌水冲洗3次,吸干表面水分。将样品置于腐霉属菌选择性培养基NARM培养基(1 000 mL CMA培养基中加入制霉菌素10 mg、氨苄青霉素250 mg、利福平10 mg和咪康唑1 mg,蒸馏水1 000 mL,灭菌)平板上(Morita & Tojo,2007),25 ℃暗培养。2~3 d后将菌落边缘菌丝转移至新的NARM培养基上,进行纯化并编号保存。
1.3 形态学鉴定
1.3.1 鉴定依据 主要参考van der Plaats-Niterink(1981)和余永年(1998)的方法,根据孢子囊、雄器、藏卵器、卵孢子等的形态特征进行鉴定。
1.3.2 观察方法 采用草叶诱导法(Waterhouse,1967)诱导产生孢子囊、游动孢子、藏卵器、雄器和卵孢子等。将斜面试管保存的菌株转移至CMA培养基平板上,菌丝即将长满培养皿时用直径6 mm的灭菌打孔器打取圆形菌苔1块,置于新的CMA培养基平板上,将草坪草的叶片灭菌之后切成长5 mm的小段,放在菌丝块的周围,25 ℃暗培养。草叶被侵染后,放入已经灭菌的10 mL池塘水(V池塘水∶V蒸馏水=1∶2)中,25 ℃暗培养。诱导培养2~14 d内观察孢子囊、游动孢子、藏卵器、雄器及卵孢子的形态特征,以显微摄影作记录。
1.4 分子生物学鉴定
1.4.1 基因组DNA提取 将斜面试管保存的菌株转移至CMA培养基平板上,25 ℃暗培养,待长出菌落后在菌落边缘用直径6 mm的灭菌打孔器打取5块菌苔,置于50 mL马铃薯葡萄糖液体培养基上,180 r·min-1、25 ℃振荡培养5 d后,挑取适量的菌丝体,抽滤、晾干。采用由北京索莱宝科技有限公司提供的真菌基因组DNA提取试剂盒,按其说明书进行DNA提取。
1.4.2 rDNA-ITS序列分析 利用引物ITS1(5′-GTAGTCATATGCTTGTCTC-3′)和ITS4(5′-CTTCCGTCAATTCCTTTAAG-3′)(White et al.,1990)对提取的基因组DNA进行PCR扩增,引物由北京华大基因研究中心合成。PCR反应体系(50 μL):10×Taq反应缓冲液5 μL,1.5 mmo1·L-1MgCl23 μL,0.2 mmo1·L-1dNTPs 1 μL,0.5 μmo1·L-1引物2 μL,200 ng模板DNA 2 μL,5 U Taq DNA聚合酶0.5 μL,加ddH2O补足50 μL。PCR反应条件:94 ℃预变性3 min;94℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃延伸10 min,最终4 ℃保存。PCR产物经2.0%琼脂糖凝胶电泳、EB染色,在紫外灯下拍照检测,之后送中国农业科学院作物科学研究所进行双向测序。将测序获得的ITS序列用ChromasPro软件拼接校正,通过BanKit提交序列至NCBI,获得的序列登录号见表1。
进一步通过NCBI进行BLAST同源性比较,从GenBank中下载作为外群的致病疫霉Phytophthora infestans(Mont.)de Bary和与自测菌株相似度98%以上的腐霉模式菌株及其ITS序列,使用Clustal X(1.81)软件和MEGA 3.1软件进行分析,采用距离法构建系统发育树。

表1 供试腐霉菌株及其序列登录号
1.5 致病性测定
采用平板法进行致病性测定。将提取基因组DNA获得的含有大量菌丝的液体倒入直径9 cm的玻璃培养皿中,与灭菌栽培土混匀,覆盖塑料薄膜,25 ℃发酵1~3 d;用3%双氧水浸泡菠菜种子3 min进行表面消毒,然后用无菌水冲洗3次,25 ℃催芽;将发芽的种子播于腐霉发酵平皿培养土中,每皿7粒,置于人工气候培养箱中25 ℃培养、观察;以不接菌为对照,统计发病幼苗数,计算发病率。
发病率=猝倒死亡幼苗数/播种种子数×100%
2 结果与分析
2.1 病害症状
菠菜猝倒病在内蒙古通辽市、包头市和巴彦淖尔市郊区蔬菜大棚种植区均有发生。病害症状:幼苗出土后至3~4片真叶前,在小苗尚未萎蔫、叶片仍然保持绿色时就出现倒伏现象,最终萎蔫死亡。发病植株地表或地下的茎基部缢缩呈黄褐色,可向上、下扩展使发病部位呈细线状。该病发展迅速,初期仅有个别植株发病,几天后便以此为中心向周围蔓延,植株成片猝倒死亡。
2.2 病原菌分离结果
从82份菠菜猝倒病病样中共分离出60株腐霉菌株,其中通辽市17株、包头市26株、巴彦淖尔市17株。通辽市分离得到的17株菌株中,瓜果腐霉(P. aphanidermatum)9株,占分离总数的52.94%;终极腐霉(P. ultimum var. ultimum)8株,占47.06%;由此可见,通辽市郊区菠菜猝倒病病原菌以瓜果腐霉和终极腐霉为主。包头市分离得到的26株菌株中,德里腐霉(P. deliense)15株,占分离总数的57.69%;终极腐霉(P. ultimum var. ultimum)11株,占42.31%;说明德里腐霉和终极腐霉是包头市郊区菠菜猝倒病的主要病原菌。分离自巴彦淖尔市的17株菌株全部都是德里腐霉(P. deliense)。
2.3 病原菌鉴定结果
2.3.1 形态学鉴定结果 以Bts1-6b和Bts1-8a为代表的32株菌株的菌落在CMA培养基上呈放射状,菌丝基内生;孢子囊瓣状,常分枝或成簇顶生;藏卵器球形、近球形,直径14.4~30.1 μm,平均24.2 μm,多为顶生,大多数藏卵器柄明显弯向雄器;雄器多为同丝生,短棍棒状、弯棍棒状或囊袋状,每个藏卵器有1~2个雄器;卵孢子球形,直径13.4~30.1 μm,平均26.6 μm,不满器(图1-a、b、c)。
以H11-1和H11-2为代表的9株菌株的菌落在CMA培养基上无特定的形态,有大量气生菌丝;孢子囊为姜瓣状或不规则膨大菌丝;藏卵器多为顶生,球形,光滑,藏卵器柄较直,直径21.6~39.5 μm,平均26.8 μm;每个藏卵器上附着1~2个雄器,雄器同丝生、异丝生或间生,多数有柄,屋顶状、袋状或玉米粒状;卵孢子球形,直径13.9~23.4 μm,平均20.0 μm,多数不满器(图1-d、e、f)。
以H1-2和Bts-20b为代表的19株菌株的菌落在CMA培养基上无特定的形态,气生菌丝发达;菌丝膨大体近球形,顶生或多间生,直径13.1~21.5 μm,平均18.1 μm;藏卵器球形,平滑,多顶生,直径17.2~20.1 μm,平均18.4 μm;每个藏卵器有1~2个雄器,无柄,多紧贴藏卵器形成,弯曲、囊状,多同丝生,偶有异丝生和下位生;卵孢子球形,平滑,不满器,直径13.7~17.7 μm,平均15.5 μm(图1-g、h、i)。
以上3种腐霉菌株的形态特征分别与van der Plaats-Niterink(1981)描述的德里腐霉(P. deliense)、瓜果腐霉(P. aphanidermatum)以及终极腐霉(P. ultimum var. ultimum)一致。
2.3.2 rDNA-ITS序列分析结果 从经形态学观察初步鉴定的3种腐霉菌中分别选择2个代表菌株:Bts1-6b和Bts1-8a(P. deliense)、H11-1和H11-2(P. aphanidermatum)以及H1-2和Bts-20b(P. ultimum var. ultimum),分别提取基因组DNA,测定rDNA-ITS序列。获得的序列长度分别为774、773 bp,777、777 bp,826、825 bp。将所测ITS序列通过NCBI进行BLAST比对,菌株Bts1-6b、Bts1-8a以及H11-1、H11-2与德里腐霉菌株CBS11484的相似度为99%(HQ643520.1)、与CBS31433(HQ643522.1)和CBS314.33(AY598674.2)的相似度为98%,与瓜果腐霉菌株CBS118.80(AY598622.2)、CBS28779(HQ643439.1)和CBS11880(HQ643438.1)的相似度为99%。依据该结果无法判断这4株菌株是属于德里腐霉还是瓜果腐霉。H1-2、Bts-20b与终极腐霉菌株CBS398.51(AY598657.2)、CBS39851(HQ643865.1)和CBS291.31(KJ639270.1)的相似度为99%,可以确定这2株菌株为终极腐霉。
聚类分析结果表明(图2),菌株Bts1-6b和Bts1-8a与德里腐霉菌株HQ643520.1、HQ643522.1和AY598674.2的同源性较高,聚为一类;菌株H11-1和H11-2与瓜果腐霉菌株AY598622.2、HQ643439.1和HQ643438.1的亲缘关系最密切,聚为一类;说明菌株Bts1-6b和Bts1-8a是德里腐霉,而菌株H11-1和H11-2是瓜果腐霉。菌株H1-2和Bts-20b与终极腐霉菌株AY598657.2、HQ643865.1和KJ639270.1聚为一类,进一步证实了这2株菌株为终极腐霉。
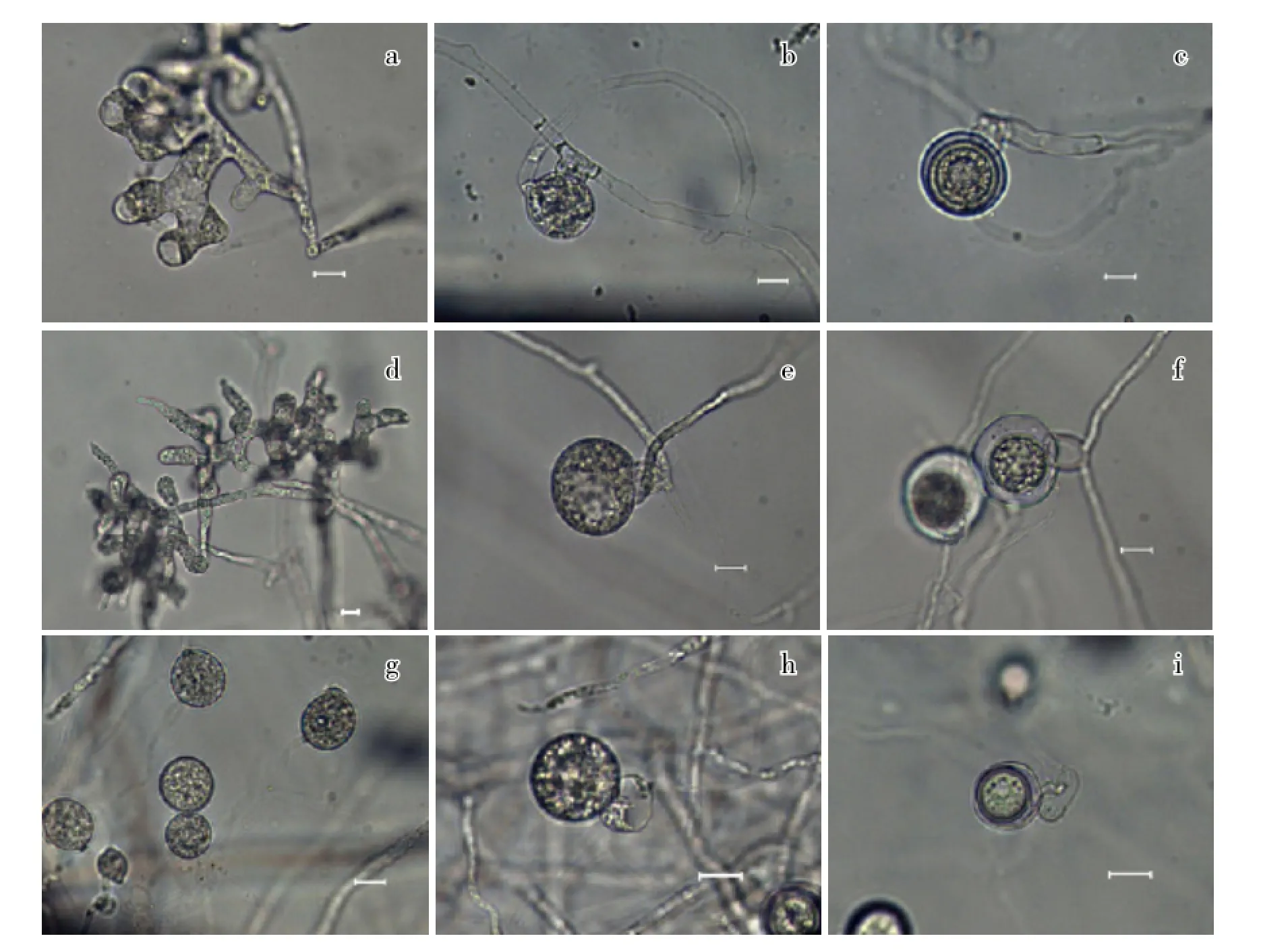
图1 菠菜猝倒病病原菌形态特征a、b、c,以Bts1-6b和Bts1-8a为代表的菌株的孢子囊、藏卵器、雄器和卵孢子;d、e、f,以H11-1和H11-2为代表的菌株的孢子囊、藏卵器、雄器和卵孢子;g、h、i,以H1-2和Bts-20b为代表的菌株的菌丝膨大体、藏卵器、雄器和卵孢子;标尺=10 μm。
2.4 致病性测定结果
从分离鉴定的3种腐霉菌中分别选择1个代表菌株Bts1-6b(P. deliense)、H11-1(P. aphanidermatum)和H1-2(P. ultimum var. ultimum),采用平板法进行致病性测定。结果表明(图3),接种3个菌株的菠菜幼苗均出现子叶仍为绿色、萎蔫前即从茎基部倒伏的现象;拔出幼苗后发现茎基部明显变为黄褐色,缢缩成细线状。而对照植株生长正常。
从病株发病部位再次分离腐霉菌,观察其孢子囊、藏卵器和雄器等,鉴定结果表明分离得到的菌株与原始接种菌株在形态特征上一致,表明所接种的3株菌株均为菠菜猝倒病的病原菌。
统计发病幼苗、计算发病率,结果显示接种菌株Bts1-6b(P. deliense)的发病率最高,为85.7%;其次是菌株H11-1(P. aphanidermatum),发病率为42.9%;发病率最低是菌株H1-2(P. ultimum var.ultimum),为28.6%。

图2 基于rDNA-ITS基因序列的腐霉菌聚类分析结果

图3 腐霉菌对菠菜幼苗的致病性测定结果
3 结论与讨论
本试验采用腐霉属菌选择性培养基(NARM培养基)对菠菜猝倒病病样进行病原菌分离纯化,以传统形态学鉴定为基础,结合rDNA-ITS序列分析以及致病性测定,初步确定内蒙古地区菠菜猝倒病病原菌为德里腐霉(P. deliense)、瓜果腐霉(P. aphanidermatum)和终极腐霉(P. ultimum var. ultimum)。这3种腐霉菌在内蒙古通辽市、包头市和巴彦淖尔市的出现频率不同,可能是与不同地区气温、采样时间等有关。
菠菜猝倒病在世界各地普遍发生,不同国家和地区菠菜猝倒病病原菌的分布情况有所不同。Bates和Stanghellini(1984)认为,美国亚利桑那州的菠菜猝倒病病原菌为瓜果腐霉(P. aphanidermatum)和宽胸腐霉(P. dissotocum)。Naiki等(1986)报道日本岐阜县的菠菜猝倒病病原菌为侧雄腐霉(P. paroecandrum)和瓜果腐霉(P. aphanidermatum),其中优势种为P. paroecandrum;Akashi等(1986)报道日本北海道的菠菜猝倒病病原菌为Pythium sp. 、终极腐霉(P. ultimum)、瓜果腐霉(P. aphanidermatum)以及刺腐霉(P. spinosum),其中Pythium sp. 和P. ultimum为优势种群。瑞典报道林器腐霉(P. sylvaticum Huds)、终极腐霉(P. ultimum var. ultimum)和异宗结合腐霉(P. heterothallicum)为当地菠菜猝倒病病原菌(Larsson,1994)。
本试验中分离得到的瓜果腐霉(P. aphanidermatum)和终极腐霉(P. ultimum var. ultimum)广泛分布于世界各地,为害多种植物,引起幼苗猝倒、成株根腐、茎腐和果腐等(van der Plaats-Niterink,1981)。德里腐霉(P. deliense)是最初由Meurs从印度尼西亚烟草上分离获得的,并命名为Pythium deliense Meurs(Meurs,1934)。P. deliense可以引起蒌叶(Lodhi et al.,2004)、哈密瓜(Teymoori et al.,2012)和花生(Parkunan et al.,2014)等植物病害。本文是P. deliense作为菠菜猝倒病病原菌的首次报道。
钱伟,张合龙,刘伟,徐兆生.2014.菠菜遗传育种研究进展.中国蔬菜,(3):5-13.
田黎,日孜旺古丽,陈舒云,马丹江.1993.新疆菠菜霜霉病的侵染及防治.新疆农业科学,(1):24-25.
余永年.1998.中国真菌志(第六卷·霜霉目).北京:科学技术出版社:54-138.
Akashi K,Maeda K,Abe H.1986.Studies on root diseases of spinach and soil scientific research on the occurrence Ⅱ.pathogens of damping-off occurring in fields around Sapporo city.Bulletin of Hokkaido Prefectural Agricultural Experiment Stations,54:1-8.
Bates M L,Stanghellini M E.1984.Root rot of hydroponically grown spinach caused by Pythium aphanidermarwn and P. dissorocum.Plant Disease,68:989-991.
Larsson M,Gerhardson B.1992.Disease progression and yield losses from root diseases caused by soilborne pathogens of spinach.Phytopathology,82:403-406.
Larsson M.1994.Prevalence and pathogenicity of spinach root pathogens of the genus Pythium in Sweden.Plant Pathology,43:261-268.
Lodhi A M,Shahzad S,Ghaffar A.2004.Pythium deliense,a new record from Pakistan.Pakistan Journal of Botany,36(3):673-676.
Meurs A.1934.Parasitic stemburn of deli tobacco.Phytopathology,7: 169-185.
Morita Y,Tojo M.2007.Modifications of PARP medium using fluazinam,miconazole and nystatin for detection of Pythium spp. in soil.Plant Disease,91:1591-1599.
Naiki T,Yasuhiro G,Kageyama K.1986.Pythium species causing damping-off of spinach seedlings under plastic-house cropping.Annals of the Phytopathological Society of Japan,52:772-778.
Parkunan V,Brenneman T P,Ji P.2014.First report of Pythium deliense associated with peanut pod rot in Georgia.Plant Disease,98:1269.
Sumner D R,Kays S J,Johnson A W.1976.Etiology and control of root diseases of spinach.Phytopathology,66:1267-1273.
Sumner D R.1991.Spinach(Spinacea oleracea L.):common names for plant diseases.Plant Disease,75:225-230.
Teymoori S,Shahri M H,Rahnama K,Afzali H.2012.Identification and pathogenicity of Pythium species on cantaloupe in Khorasan Razavi province of Iran.Journal of Crop Protection,1(3):239-247.
van der Plaats-Niterink A J.1981.Monograph of the genus Pythium.Studies in Mycology,21:1-242.
Waterhouse G M.1967.Key to Pythium pringsheim.Mycological Papers,109:1-15.
White T J,Bruns T,Lee S,Taylor J.1990.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics//Innis M A,Gelfand D H,Sninsky J J,White T J,eds.PCR protocol:a guide of methods and application.San Diego:Academic Press:315-322.
Yamaguchi M.1983.World vegetables:principles,production,and nutritive values.Westport:AVI Publishing:1-415.
Zhou Y F,Shi Y X,Xie X W,Guo Y L,Li B J.2011.Leaf spot of spinach caused by Stemphylium spinaciae sp. nov.Mycosystema,30(3):379-383.
Identif i cation of Spinach Damping-off Pathogens in Inner Mongolia Region
YIN Ling1,Koji Kageyama2,TIAN Xun1,LI Yi-wei1,JI Zhao-jun1,ZHAO Ru1
(1College of Life Science,Inner Mongolia University for Nationalities,Tongliao 028000,Inner Mongolia,China;2River Basin Research Center,Gifu University,Gifu 501-1193,Japan)
The samples of damping-off spinach seedlings were collected from the greenhouses in Tongliao,Baotou and Bayannur cities of Inner Mongolia.Pathogens were identified by morphological and molecular analysis,and pathogenicity tests of representative isolate of each species was carried out by seedlings infestation method.The result indicated that a total of 60 Pythium isolates were obtained from 82 plant samples.These isolates were identified as P. deliense,P. aphanidermatum and P. ultimum var. ultimum.Pathogenicity tests have proved that the Pythium species are pathogenic,causing damping-off,but with different disease severity.Among them P. deliense were the most pathogenic(infection rate 85.7%),the next was P. aphanidermatum (infection rate 42.9%),and the lowest was P. ultimum var. ultimum(infection rate 28.6%).
Inner Mongolia;Spinach damping-off;Pythium;rDNA-ITS
银玲,女,博士,副教授,专业方向:植物病原菌物分子生物学,E-mail:ginrei@163.com
2016-06-07;接受日期:2016-07-24
国家自然科学基金项目(31160353,31360574),通辽市与内蒙古民族大学科技合作项目(SXYB2012063)

