太湖藻源性颗粒物降解过程中营养盐转化及其生态效应
何 东,张毅敏,杨 飞,刘 庄,王 宇,刘其根,晁建颖*(.上海海洋大学,上海 0306;.环境保护部南京环境科学研究所,江苏 南京 004)
太湖藻源性颗粒物降解过程中营养盐转化及其生态效应
何东1,2,张毅敏2,杨飞2,刘庄2,王宇2,刘其根1,晁建颖2*(1.上海海洋大学,上海 201306;2.环境保护部南京环境科学研究所,江苏 南京 210042)
摘要:以太湖水体中藻源性颗粒有机物作为切入点,研究了不同环境条件下(有光,无光)藻源性颗粒有机物降解过程中C,N,P等营养元素的形态变化过程,分析了藻源性颗粒有机物对水体营养盐循环和浮游植物生长中的作用.实验结果显示,蓝藻水华过程中,藻源性颗粒有机物最高可占水体总C,N,P比例的81.51%,94.60%,97.47%,是水体营养元素的重要组成部分;有光组颗粒物APA显著高于无光组,说明有光组中颗粒态P降解和转化速率显著高于无光组,但有光组水体中SRP浓度低于无光组,Chl-a浓度高于无光组,说明有光组中藻源性颗粒物降解的同时伴随着藻类的生长,颗粒物释放的SRP被浮游植物吸收并转化为生物量;光照对C,N,P的降解过程有明显影响,无光组颗粒物中C,N,P降解速率是有光组的2倍,可降解比例是有光组的(2.5±0.1)倍;实验中还发现前7d各元素的降解速率要高于之后的降解速率.综上,藻源性颗粒物营养盐总量大,生物可利用性高,降解迅速,且降解产物可被浮游植物吸收,是藻类生长和水华发生重要的营养盐来源.
关键词:藻源性有机颗粒物;太湖;营养盐循环;磷补偿
* 责任作者, 助理研究员, cjy@nies.org
颗粒有机物(POM)作为水体中营养物质最重要的存储库,其形成,转化,都伴随着水体营养盐的迁移,转化和再生,是水生态系统中营养盐生物地球化学循环的重要环节[1-2].生物来源的POM极易被降解,且是水体营养物质的重要组成部分[3-4].随着湖泊富营养化程度的增加,POM占总有机物的比例不断增加[5-9].
对于湖泊生态系统,尤其是富营养化湖泊而言,维持其系统所需的营养盐很大程度上依赖于系统内部的循环和再生,而非外界输入[10-11],其中,作为水体营养盐重要载体的颗粒物的降解及其营养盐的释放过程可能是水体活性营养盐的重要来源[12].有研究显示, 蓝藻死亡分解过程中,水体胶体态和颗粒态营养盐含量都会有显著升高[13],而湖泊真光层产生的POM有40%~99%可以在水柱中被降解[14-15],POM和藻类营养物质的释放是UDOM的主要补给途径[16-17].
太湖是我国第三大淡水湖泊,是一个典型的大型浅水富营养化湖泊.对太湖的初步研究显示,在夏秋季伴随着水华的出现,水体中颗粒有机物的含量明显上升,POM占总悬浮颗粒物质量比也达到70%以上[18],虽然太湖水体富营养化严重,但是总磷主要以颗粒态形式存在,溶解态总磷和SRP浓度很低[19].因此,藻源性POM的降解可能是水体SRP潜在的重要补给来源.本实验从藻源性颗粒有机物入手,以水体营养盐形态变化为主线,通过室内模拟实验,研究太湖水体中藻源性颗粒有机物的理化生物学特性,降解过程和生态效应,以期为蓝藻水华的控制提供技术数据.
1 材料和方法
1.1实验设置
实验使用80L塑料桶,设计有光,无光两个实验组,无光组中塑料桶加盖并用锡箔纸将塑料桶包裹.每组3个平行,实验组之间随机摆放,并在水桶内放置小型电动搅拌器防止颗粒物沉降.初始叶绿素平均在880μg/L左右,使用自然光照,放入玻璃房内的水池中进行培养,以保证实验期间培养体系温度恒定.分别在第0,0.25,0.5,0.75,1, 1.5,2,3,4,5,6,7,8,11,14,20d进行采样,每次采取约0.5L水,通过GF/F膜过滤,收集颗粒物.
实验用水,蓝藻均采自于太湖梅梁湾口东岸“中国科学院太湖湖泊生态系统研究站”栈桥附近(120°12'49.67″E,31°29'09.99″N),距离岸边约200m,水深约1.6m.实验时间为2014年8月2~22日.
1.2测定项目及其方法
1.2.1藻源性颗粒物的含量及有机物含量将一定体积的水样过滤到事先在450℃下灼烧称重的GF/F膜上,在105℃下烘干4小时,冷却后称重;然后在550℃下灼烧5h,干燥皿中冷却后称重,分别计算悬浮颗粒物含量(SS)和颗粒物中有机物(POM)的含量[10].
1.2.2水体中基本理化指标测试水温,pH值,浊度,溶解氧等指标使用YSI测定;硝酸盐,亚硝酸盐使用SKALAR自动连续流动分析仪测定;叶绿素a,总氮,总磷,溶解性总氮,溶解性总磷,磷酸根,氨氮参照文献[20],在实验室测得.
1.2.3藻源性颗粒物有机C,N,P含量(POC, PON,POP)POC,PON直接使用元素分析仪测定.POP测定时,先用2张聚醚砜膜分别过滤一定量的水样,取其中一张膜用氧化剂消解后紫外分光光度计比色测定即为颗粒态总磷(TPP);另外一张膜在0.15M的盐酸中浸泡24h,其间晃动4 次,离心后测定PO43-浓度即为颗粒态无机磷(PIP)[18],两者相减即为颗粒态有机磷(POP).
1.2.4颗粒物及水体碱性磷酸酶活性(APA) APA采用硝基苯磷酸二钠(p-NPP)做为反应底物测定,取2mL水样,1mL 0.1mol/L Tris,2mL 0.001mol/L p-NPP,30℃温度下避光培养6h,然后加入0.5mL 0.1mol/L的NaOH终止反应进程.5000r/min离心10min,在分光光度计410nm测量吸光度.利用NPP在410nm波长的吸光值制作标准曲线,计算反应体系中水解产生的NPP浓度,从而计算APA[21].分别测定原水和滤后水的APA,相减得出颗粒物APA.
1.2.5颗粒物及水体生物可利用性磷本研究以可酶解磷(EHP)做为水体生物可利用性磷的替代指标.取100mL水样放入灭菌的玻璃瓶中,加入1mL 1.0mol/L Tris 缓冲溶液,5mL氯仿,30℃温度下培养5d,每天摇匀一次.比色法测定处理前后水体中的浓度差,即为水样EHP的含量[22].分别测出原水和滤后水的EHP,作差得出颗粒物的EHP.
1.3数据分析及作图
本实验数据分析采用SPSS 17.0统计软件包,作图使用origin 9.0软件.
2 结果与分析
2.1实验过程中培养体系基本环境因素变化情况
表1为实验过程中培养体系基本环境因素变化情况.由于采取水浴保温的办法,实验过程中温度保持在(30±1)℃之内.有光组的溶解氧要显著高于无光组(P<0.05),并在第4d分别达到最低值(46±7)%,(24±6)%.pH值和浊度随着藻的降解而下降,第7d有光组pH值达到最低值(7.51± 0.06),浊度达到最低值(115±7)NTU,然后随着藻类的生长开始上升;无光组一直处于下降过程,直到藻类完全降解之后出现反弹.有光组SS,POM含量在前7d内持续下降并达到最低值,之后波动上升,无光组SS,POM含量在实验期间持续下降.
无光处理组实验前7d POM显著下降,由(117±9)mg/L下降到(77±5)mg/L,但是POM/SS比例却呈上升趋势,从88.6%上升至95.1%;之后POM缓慢下降,SS缓慢上升,POM/SS在实验结束时下降到78%.有光组POM一直处于波动状态,而SS在前7d内从(135±12)mg/L下降到(100± 18) mg/L,之后才开始波动上升,POM占SS的比例在4~7d最高,接近100%.有光组实验阶段POM含量增加了16.4%,无光处理组下降了66.7%,有光处理组POM浓度显著高于无光处理组(P<0.05,n=24)说明无光是促进POM快速降解的主要影响因素.
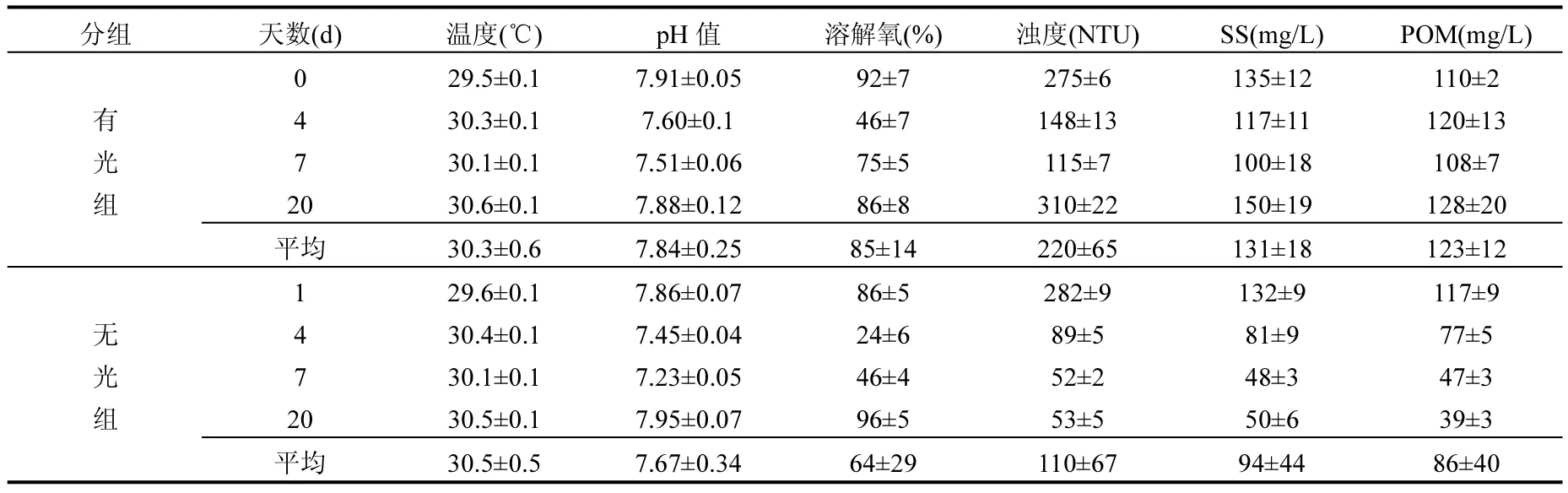
表1 实验过程水体理化指标Table 1 Physical and chemical indicators during the experiment
2.2 实验过程中藻源性颗粒物营养盐变化特征及对水体溶解态营养盐的释放
2.2.1降解过程中藻源性颗粒态C,N,P的变化实验过程中颗粒态C,N,P含量变化如图1所示.在实验初期,两处理的PP,PN浓度分别平均为8.09,0.707mg/L,占水中TP,TN的96.9%, 92.3%.实验前7d,PC,PN,PP均明显下降,第7d有光组的PC,PN,PP分别从最高值的74.9, 9.75,0.74mg/L达到最低值53.80,6.41,0.49mg/L,之后PC,PN,PP分别在56.1~64.2mg/L, 7.0~7.8mg/L, 0.51~0.59mg/L之间波动.无光组从初始阶段最高值的71.1,9.1,0.71mg/L在前7d迅速下降到23.6,1.9, 0.24mg/L,之后下降的速率明显放缓,实验结束时为19.7,1.1,0.13mg/L.
由颗粒态C,N,P含量可见,在实验前期(0~7d)和后期(8~20d)降解速率相差均较大.无光组颗粒态C,N,P的前期和后期的降解速率分别为6.786mg/(L·d),1.029mg/(L·d),0.067mg/(L·d)和0.300mg/(L·d),0.061mg/(L·d),0.008mg/(L·d).有光组颗粒态C,N,P前期的降解速率为3.014mg/ (L·d),0.477mg/(L·d),0.036mg/(L·d).由此可见,颗粒态C,N,P在无光情况下的的降解速率均要快于有光组,并且在实验前7d更加明显,无光组降解的速率约为有光组2倍.无光处理中,实验前期的降解速率要远大于实验后期,C,N,P前期的降解速率相比于后期的速率均超过了10倍.

图1 颗粒态C,N,P含量变化Fig.1 Particulate C, N, P content changes
相比有光条件,在无光条件下,可降解的C由27.5%增加到71.8%,可降解的N由32.9%增加到85.8%,可降解的P由32.2%增加到78.7%,可降解的C,N,P提升了约2.5倍.
2.2.2藻降解过程中水体中溶解态营养盐的变化(1)水体中氮元素变化过程: 图2a和图2b分别为实验过程中有光组和无光组中溶解态N元素各组分的含量.实验之初的24h之内,水体中各种溶解态N元素变化很小,,,,DON分别维持在(0.017±0.004) mg/L,(0.003±0.002) mg/L, (0.176±0.029)mg/L,(0.494±0.074) mg/L.但从24h开始,明显上升,有光组从 0.165mg/L上升第7d的峰值1.60mg/L,之后立刻迅速下降,实验结束时为0.413mg/L;无光组从24h的0.22mg/L上升到第7d的7.10mg/L,之后维持到第11d才迅速下降到实验结束的0.19mg/L.在上升最快的第1~7d里,有光组和无光组上升速率为0.26mg/(L·d),1.37mg/(L·d).有光组由于藻类的生长需要消耗一部分,所以比例要低于无光组.
无光处理组从第4d的0.009mg/L迅速上升到第7d的0.29mg/L,实验结束时上升到0.47mg/L,整个变化过程呈S形.而有光组则一直保持在低水平的(0.01±0.006) mg/L,无光组第4~8d TDP和上升速率分别为0.069mg/L, 0.078mg/L第8d到实验结束上升速率分别为0.012mg/L, 0.010mg/L.无光组占TDP的比例从第4d的 21.7%迅速上升到第5d的85%,之后继续上升,实验结束时比例已高达97%.由此可见,对于P元素的降解,颗粒态磷主要降解为.

图2 各溶解态N元素含量Fig.2 Content of each component of dissolved N element

图3 各溶解态P元素含量Fig.3 Content of each component of dissolved P element
2.3 藻源性颗粒物对水体营养再生的贡献及其生态效应
2.3.1可酶解磷含量及比例图4为实验中颗粒物中EHP的含量变化及其所占TPP的比例.EHP在实验初始阶段有光组和无光组分别在(0.64±0.01)mg/L,(0.59±0.08) mg/L范围内波动,有光组和无光组分别从最高点0.66mg/L, 0.63mg/L下降到到实验结束时的0.38mg/L, 0.05mg/L,两组的降解速率分别是0.015mg/(L·d), 0.032mg/(L·d),其中无光组前期的降解速率0.073mg/(L·d)要明显高于后期的降解速率0.014mg/(L·d).
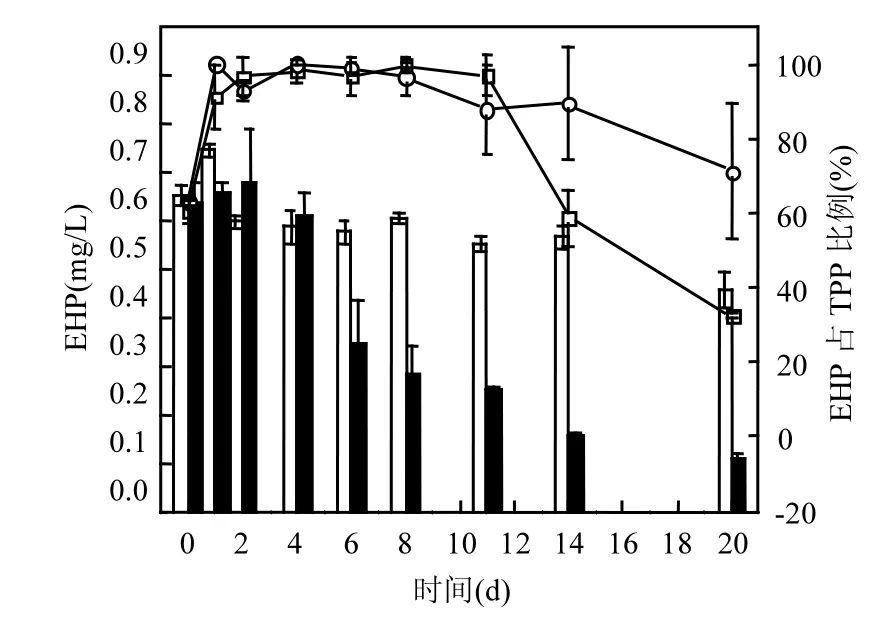
图4 颗粒物中可酶解磷的含量及其占颗粒态总磷比例Fig.4 The content of EHP in the particulate matter and the proportion of EHP in TPP

实验开始的第1d内,颗粒物内EAP占TPP的比例从初始的60%左右迅速上升到90%左右. 第2~8d EHP和TPP均保持下降,EHP所占比例维持在90%左右,之后EHP继续下降,且下降的速率要远高于TPP,从而EHP所占的比例下降,实验结束时有光组和无光组的比例分别是71%,32.4%.实验后期,无光组中大量的EHP被降解,从而无光组中EHP所占比例要低于有光组.
2.3.2颗粒物中APA及EHP的降解时间图5a和图5b为实验中颗粒物中碱性磷酸酶的活性(APA).APA在实验开始的第1d内随着EHP的迅速上升也迅速从0.010mmol/(L·h)上升到0.022mmol/(L·h).实验初始低浓度的,刺激了碱性磷酸酶对其的补偿能力,之后浓度上升,APA又回落.无光组由于藻类的死亡,水体中快速上升,APA处于较低水平的(0.0024± 0.0008)mmol/(L·h),而有光组随着藻类的生长,始终较低,故APA波动在一个较高水平的(0.01±0.002)mmol/(L·h).
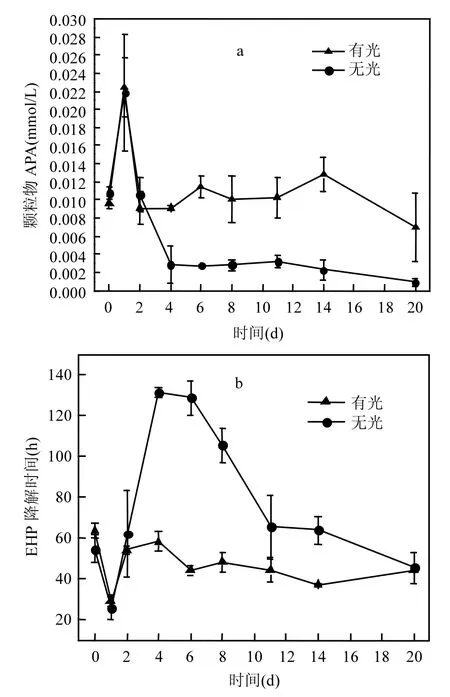
图5 颗粒物中碱性磷酸酶的活性及可酶解磷的降解时间Fig.5 The APA in the particulate matter and the degradation time of EHP
实验中可酶解磷的降解时间在第1d随着APA的上升,从70h左右下降到30h左右,之后随着APA下降而上升,在第4d分别达到峰值,有光组58.1h,无光组131.4h.降解过程中有光组的APA要明显高于无光组,有光组磷元素平均循环时间为45.8h,远低于无光组的96.3h.说明颗粒物降解过程中,光照促进了藻类生长,藻类在生长过程中释放APA,加速了水体磷循环.
2.3.3水体Chl-a浓度变化趋势实验中,Chl-a含量变化如图6所示.Chl-a从实验开始后随着藻类的死亡开始下降,有光组从初始的910.8 μg/L下降到第4d的最低值465.7μg/L,之后伴随着水中残余藻类的重新生长,水体中Chl-a在(533.6± 39.1)μg/L内呈现波动性增长.而无光组中藻类的持续死亡,Chl-a也持续降低,第7d和实验结束时分别达到89.3μg/L,11.3μg/L.POM和Chl-a的浓度呈极显著的相关性(R=0.922,P<0.01, n=48),说明此次实验中颗粒态有机物主要来自藻类.

图6 各实验组Chl-a含量Fig.6 Content of Chl-a in each experimental group
3 讨论
3.1大型浅水湖泊藻源性颗粒有机物的性质
本实验在实验中模拟了太湖蓝藻发生堆积时的藻体降解过程,实验体系Chl-a初始浓度为(880±20)μg/L,这一浓度在太湖湖湾蓝藻堆积区比较常见[23-24].另外,颗粒物含量在133.5mg/L左右,与夏季太湖梅梁湾水体中SS相当[16].整个实验过程中,水体POM和Chl-a的浓度呈极显著的相关性(R=0.922,P<0.01,n=48),说明蓝藻暴发时颗粒态有机物主要来自藻类.实验初始POM占SS的比例85.2%~90.6%,略高于胶州湾夏季的比例58.73%~72.1%[17],远高于太湖7%的平均水平[8],实验初始POM的含量108~126mg/L也远高于胶州湾夏季悬浮颗粒物浓度范围12~17.4mg/L.颗粒态有机N,P最高值达到9.43mg/L,0.71mg/L,远高于深水湖泊中的0.276mg/L和0.025mg/L[25],也高于长江入海口的最高值的1.34mg/L和0.51mg/L[26].这说明富营养化水体水华过程中水体POM总量和各组分含量及其占SS的比例高于非水华期和贫营养水体,这是富营养化水体在营养盐分布中的一个重要特征.
无光处理组中,藻类不能进行光合作用,模拟了藻类死亡和降解的过程;而在有光处理组中藻类可以进行光合作用,所以模拟的是藻类死亡和生长两个同步过程.从实验结果来看无光处理组的SS和POM含量均出现了显著的下降,下降幅度分别为64%和69%,说明以有机物为主的颗粒物在实验期间出现了明显的降解过程,易降解有机物以溶解态形式进入了水体;由于光照和营养盐等条件较为适宜,有光处理组藻类生物量在实验室后期没有明显的下降,而是维持在一个相对稳定的水平,Chl-a浓度约为500μg/L,藻体的存在为水体提供了大量颗粒有机物.整个实验周期内,有光处理组SS和POM仅下降了26%和2%,说明藻死亡降解和藻生长处于相对平衡的状态.以上研究也说明,藻源性颗粒物降解与光照有显著的关系,无光条件能够极大促进藻源性颗粒物含量的下降.
3.2藻源性颗粒有机物降解潜力,降解过程及其影响因素
有光处理组的颗粒有机物含量在整个降解过程中保持在较高的水平,且颗粒态EHP占水体总EHP比例一直维持在96%以上,和春初温度下黑藻在70d 的磷的释放率85.94%相当[27],远高于千岛湖的46.1%和富春江的44.4%[28],也高于太湖风浪扰动过程的比例[14],这说明藻源性颗粒物以易降解的有机物为主要组成成分,在短期内能够降解,而且水体EHP含量充足;丰富的生物可利用性营养物质及光照条件又提供了藻类生长的基本条件,这也是有光处理组Chl-a浓度持续维持在高浓度的主要原因.无光处理组颗粒态EHP占水体总EHP比例在第8d之后显著下降,实验结束时下降至27.5%,这可能有两方面的原因:一是无光处理组颗粒物含量下降迅速,在实验第7d时已经下降至初始值的36%,且颗粒物营养盐大部分也已经变成溶解态;二是颗粒物中易降解的P形态在第8d之后已经很少,剩余颗粒态P以生物难以利用惰性P形态为主,这与海洋颗粒物沉降过程中易降解有机物比例逐渐降低的趋势相似[29].
有光处理组中颗粒物和Chl-a浓度相对于无光组虽然一直保持在较高水平,但是此处理中颗粒物并不是静态的维持在这一水平.从APA活性来看,从实验第4d开始,光照处理组颗粒态APA一直处于较高水平,不仅高于一般水体平均水平,也显著高于无光处理组的水平,这说明光照处理组水体及颗粒物中的有机磷正在进行着迅速的降解过程,颗粒态EHP降解时间平均为50h,高于无光处理组.虽然颗粒态P正在迅速降解并转变成SRP,但是光照处理组水体SRP并没有出现如无光处理组中的累积现象,而是一直维持在较低水平(均值为0.016mg/L),这说明一方面颗粒物进行着快速的降解,另一方面藻类快速吸收了SRP,因为实验中后期颗粒态的C,N,P比为302:31:1,远高于Redfield[30]比值106:16:1,说明蓝藻爆发时,藻类处于磷饥饿状态.所以有光组中颗粒物的降解和藻类的生长两个过程将水体颗粒物含量维持在一个动态平衡水平,最终反映的降解比例较低,颗粒物最低存留量达到74.1%.而在无光处理组中,虽然颗粒物APA低于有光处理组,但是由于无光条件下藻类无法光合作用合成糖类而不能正常生长,颗粒物仅是单向降解过程,在实验期内可降解的颗粒物均降解并转化为溶解态,最终颗粒物存留量仅为37.9%.导致了SRP以及其他溶解态营养盐的积累,从而增加了无光组C,N,P的降解速率和可降解的比例.
本实验中,实验前期(0~7d)N,P分别降解了33%,32%.Burkhardt 等[31]的研究中,将采自Oregon海岸的颗粒物烘干后,在12h:12h的光照下培养6d后,可降解的N,P占到总的PN,PP的7%,35%,N元素降解率明显低于本实验,说明颗粒物表面的微生物对N元素的降解有着重要的影响,而水体中大量的碱性磷酸酶可以弥补对P元素的影响.本实验显示在蓝藻降解过程中,颗粒态有机氮,先被分解氨化成,再通过硝化作用,转化成,这一过程和海洋表面中N元素的循环过程相同[32];颗粒态有机磷主要降解产物为,胡正峰[33]研究发现格兰德河水体中水生生物释放磷的形态主要以小分子溶解态为主和本实验结果类似.
3.3藻源性颗粒有机物降解的生态效应
实验中,无光处理组水体中无机盐的浓度明显升高,实验结束时SRP浓度为0.47mg/L,说明藻源性颗粒物能够快速降解并向水体中释放大量的无机盐,而且以生物可以直接利用的形态为主[34-35],可以作为浮游植物生长的营养物质;而有光情况下,无机盐上升的速率要明显低于无光组,实验后期SRP浓度仅为0.076mg/L,低于无光处理组数倍.在降解初期,溶解态N主要以形式存在,不能固氮的微囊藻对有着较高的竞争力[36],这将有助于在水华暴发后,后续微囊藻的继续繁殖并占取优势,从而造成蓝藻水华的进一步加剧.从浮游植物生长的结果来看,有光处理组的Chl-a在实验中后期分布范围为300~700μg/L,一直维持在较高的水平上,显著高于无光处理组,这说明有光处理组的浮游植物在实验期间明显出现了生长.以上结果显示,在有光情况下,浮游植物可以很好的利用水体中藻源性颗粒物降解释放的营养盐进行生长繁殖.
4 结论
4.1在太湖水华暴发过程中,藻源性颗粒有机物最高可占水体总C,N,P比例的81.51%,94.60%, 97.47%,是水体营养元素的重要组成部分.
4.2光照对藻源性颗粒有机物的降解影响较大,有光条件下,缺少磷元素的藻类释放大量碱性磷酸酶,加快了水体营养盐在颗粒态和溶解态以及营养盐形态之间的转化.无光条件下,藻类单向的降解导致颗粒物中C,N,P实际降解速率是有光情况下的2倍,可降解比例是有光情况下(2.5± 0.1)倍.藻源性颗粒物在无光条件下前期(0~7d)C, N,P的降解速率是后期(8~20d)10倍以上.
4.3藻类死亡后形成的颗粒物会在短时间内降解并释放出大量的营养盐.N元素先被转化,再被转化成,最终转化成;P元素基本都被转化成生物可直接利用的.,SRP等生物可直接利用的营养盐会为浮游植物尤其是对不能固氮的微囊藻的生长和水华重新暴发提供充足的营养盐条件.
参考文献:
[1] Sannigrahi P, Ingall E D, Benner R. Nature and dynamics of phosphorus-containing components of marine dissolved and particulate organic matter [J]. Geochimica Et Cosmochimica Acta, 2006,70(23):5868–5882.
[2] Volkman J K, Tanoue E. Chemical and biological studies of particulate organic matter in the ocean [J]. Journal of Oceanography, 2002,58(2):265-279.
[3] Poulomi S, Ingall E D, Ronald B. Cycling of dissolved and particulate organic matter at station Aloha: Insights from 13C NMR spectroscopy coupled with elemental, isotopic and molecular analyses [J]. Deep Sea Research Part I: Oceanographic Research Papers, 2005,52(8):1429–1444.
[4] Smith D C, Simon M, Alldredge A L, et al. Intense hydrolytic enzyme activity on marine aggregates and implications for rapid particle dissolution [J]. Nature, 1992,359(6391):139-142.
[5] Frka S, Gašparović B, Marić D, et al. Phytoplankton driven distribution of dissolved and particulate lipids in a semi-enclosed temperate sea (Mediterranean): Spring to summer situation [J]. Estuarine, Coastal and Shelf Science, 2011,93(4):290-304.
[6] Yoshimura T, Nishioka J, Saito H, et al. Distributions of particulate and dissolved organic and inorganic phosphorus in North Pacific surface waters [J]. Marine Chemistry, 2007,103(1): 112-121.
[7] Wetz M S, Wheeler P A. Production and partitioning of organic matter during simulated phytoplankton blooms [J]. Limnology & Oceanography, 2003,48(5):1808-1817.
[8] 晁建颖,高光,汤祥明,等.生态系统结构对太湖有机聚集体理化性质的影响 [J]. 环境科学, 2009,30(11):3196-3202.
[9] Guinder V A, Popovich C A, Perillo G M. Particulate suspended matter concentrations in the Bahía Blanca Estuary, Argentina: implication for the development of phytoplankton blooms [J]. Estuarine, Coastal and Shelf Science, 2009,85(1):157-165.
[10] Taylor W D, Hudson J J, Schindler D W. Planktonic Nutrient Regeneration And Cycling Efficiency In Temperate Lakes [J]. Nature International Weekly Journal of Science, 1999,400(6745): 659-661.
[11] 秦伯强,胡维平,高光,等.太湖沉积物悬浮的动力机制及内源释放的概念性模式 [J]. 科学通报, 2003,48(17):1822-1831.
[12] Halemejko G Z, Chrost R J. The role of phosphatases in phosphorus mineralization during decomposition of lake phytoplankton blooms [J]. Archiv. Fur Hydrobiologie Stuttgart, 1984,101(4):489-502.
[13] 孙小静,秦伯强,朱广伟.蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放 [J]. 中国环境科学, 2007,27(3):341-345.
[14] 晁建颖,高光,汤祥明,等.风浪扰动中太湖OA对水体磷循环影响的原位实验研究 [J]. 环境科学, 2011,32(10):2861-2867.
[15] Ye L, Shi X, Wu X, et al. Nitrate limitation and accumulation of dissolved organic carbon during a spring-summer cyanobacterial bloom in Lake Taihu (China) [J]. Journal of Limnology, 2012, 71(1):67-71.
[16] 张运林,秦伯强,杨龙元.太湖梅梁湾水体悬浮颗粒物和CDOM的吸收特性 [J]. 生态学报, 2006,26(12):3969-3979.
[17] 毕玲玲,白洁,赵忠生,等.胶州湾夏季悬浮颗粒物组成特征研究 [J]. 海洋环境科学, 2007,26(6):518-522.
[18] Aspila K I, Agemian H, Chau A S Y. A semi-automated method for the determination of inorganic, organic and total phosphate in sediments [J]. Analyst, 1976,101(1200):187.
[19] 高光,朱广伟,秦伯强,等.太湖水体中碱性磷酸酶的活性及磷的矿化速率 [J]. 中国科学, 2005,35(z2):157-165.
[20] 刘鸿亮.湖泊富营养化调查规范 [M]. 北京:中国环境科学出版社, 1987.
[21] 黄清辉,王东红,马梅,等.沉积物和土壤中磷的生物有效性评估新方法 [J]. 环境科学, 2005,26(2):206-208.
[22] Chrost R J. A method for determining enzymatically hydrolyzable phosphate (EHP) in natural waters [J]. Limnology and Oceanography, 1986,31(3):662-667.
[23] Chuai X, Ding W, Chen X, et al. Phosphorus release from cyanobacterial blooms in Meiliang Bay of Lake Taihu, China [J]. Ecological Engineering, 2011,37(6):842–849.
[24] Huang Q, Wang Z, Wang D, et al. Distribution and origin of biologically available phosphorus in the water of the Meiliang Bay in summer [J]. Science in China, 2006,49(1Supplement): 146-153.
[25] 董云仙,洪雪花,谭志卫,等.高原深水湖泊程海氮磷形态分布特征及其与叶绿素a的相关性 [J]. 生态环境学报, 2012,21(2): 333-337.
[26] 张立娟.长江口及其邻近水域碳、氮、磷的时空分布 [M]. 青岛:中国海洋大学, 2009.
[27] 叶春,王博,李春华,等.沉水植物黑藻腐解过程中营养盐释放过程 [J]. 中国环境科学, 2014,34(10):2653-2659.
[28] 王芳,朱广伟,贺冉冉.五种天然水体胶体相可酶解磷的含量及分布特征 [J]. 湖泊科学, 2009,21(4):483-489.
[29] Magen C, Chaillou G L, Crowe S A, et al. Origin and fate of particulate organic matter in the southern Beaufort Sea –Amundsen Gulf region, Canadian Arctic [J]. Estuarine Coastal & Shelf Science, 2010,86(1):31–41.
[30] Redfield A C. The influence of organisms on the composition of sea-water [J]. The Sea, 1963,26-77.
[31] Burkhardt B G, Watkins-Brandt K S, Defforey D, et al. Remineralization of phytoplankton-derived organic matter by natural populations of heterotrophic bacteria [J]. Marine Chemistry, 2014,163(4):1-9.
[32] Arrigo K R. Erratum: Marine microorganisms and global nutrient cycles [J]. Nature, 2005,438(7057):349-355.
[33] 胡正峰.加拿大格兰德河水体磷素形态转化及水生生物对磷素吸收释放研究 [D]. 重庆:西南大学, 2013.
[34] Berman T. The role of DON and the effect of N: P ratios on occurrence of cyanobacterial blooms: Implications from the outgrowth of Aphanizomenon in Lake Kinneret [J]. Limnology & Oceanography, 2001,46(2):443-447.
[35] Bai X, Ding S, Fan C, et al. Organic phosphorus species in surface sediments of a large, shallow, eutrophic lake, Lake Taihu, China [J]. Environmental Pollution, 2009,157(8/9):2507-2513.
[36] Blomqvist P, Pettersson A, Hyenstrand P. Ammonium-nitrogen: a key regulatory factor causing dominance of non-nitrogen-fixing cyanobacteria in aquatic systems [J]. Archiv. Für Hydrobiologie, 1994,132(2):141-164.
致谢:本实验的测定工作由中国科学院太湖湖泊生态系统试验站薛静琛实验员协助完成,在此表示感谢.
The transformation of the nutrient in the degradation process of the phytoplankton-derived particulate organic matter and it’s ecological effect.
HE Dong1,2, ZHANG Yi-ming2, YANG Fei2, LIU Zhuang2, WANG Yu2, LIU Qi-gen1, CHAO Jian-ying2*(1.Shanghai Ocean University, Shanghai 201306, China;2.Nanjing Institute of Environmental Science, Ministry of Environmental Protection, Nanjing 210042, China). China Environmental Science, 2016,36(3):899~907
Abstract:The phytoplankton-derived particulate organic matter was taken in Lake Taihu as the breakthrough point.We studied the changing process of the C, N & P elements in the degradation process of the phytoplankton-derived particulate organic matter under the different environmental conditions (light or dark), and analyzed the role of phytoplankton-derived particulate organic matter in the nutrient water cycling and the growth of phytoplankton. During the cyanobacteria blooms, the contents of C, N & P in the phytoplankton-derived particulate organic matter can account for 81.51%, 94.60% and 97.47% of the total content in the water respectively at most, and they were the important parts of the nutrient elements in the water. The APA under the light condition was significantly higher than that in the dark, which showed that the rate of degradation and transformation of P in the particulate organic matter under the light condition is significantly higher than that in the dark. However, the concentration of SRP under the light condition was less than that in the dark and the concentration of Chl-a was higher. The algae grew along with the degradation of the particulate organic matter under the light condition, absorbing the SRP in the water and converted to biomass. The light had a significant impact on the degradation of the C, N & P, for the degradation rates of the C, N & P in the dark were twice that in the light, and the proportion of degradable in the dark was 2.5±0.1 times of that in the light. The degradation of each element during the first seven days was higher than that after the seventh day. In conclusion, the nutrient in phytoplankton-derived particulate organic matter with high yield gross, biological availability, rapid degradation, and degradation products could be assimilated by the phytoplankton, was the important nutrient sources of algae growth.
Key words:phytoplankton-derived particulate organic matter;Lake Taihu;nutrient cycling;phosphorous release
作者简介:何东(1990-),男,安徽马鞍山人,硕士研究生,主要从事湖泊水生态研究.
基金项目:国家水体污染控制与治理科技重大专项课题(2012ZX07101-007);国家自然科学基金项目(41301556);江苏省自然科学基金项目(BK2011081)
收稿日期:2015-06-29
中图分类号:X524
文献标识码:A
文章编号:1000-6923(2016)03-0899-09

