大口黑鲈对饲料中丁基羟基茴香醚的耐受性评价
于利莉薛 敏王 嘉 韩 芳 郑银桦 吴秀峰 吴立新(.大连海洋大学水产与生命学院,大连603;.中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京0008)
大口黑鲈对饲料中丁基羟基茴香醚的耐受性评价
于利莉1,2薛敏2∗王嘉2韩芳2郑银桦2吴秀峰2吴立新1
(1.大连海洋大学水产与生命学院,大连116023;2.中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081)
摘要:本试验旨在通过生长性能、血浆生化指标、组织抗氧化指标及肝脏、肠道组织学变化,评价大口黑鲈对饲料中丁基羟基茴香醚(BHA)的耐受性。以初始体重为(6.20±0.01)g的大口黑鲈为靶动物,在基础饲料中依次添加0(D0组,作为对照组)、150(D150组)、300(D300组)和1 500 mg/ kg(D1500组)的BHA,其中300和1 500 mg/ kg分别是最高推荐剂量(150 mg/ kg)的2和10倍,进行为期10周的饲喂试验。每组6个重复,每个重复30尾鱼。结果表明:4组中以D150组的生长性能最好,其余各组的终末均重、特定生长率、增重率和摄食量无显著差异(P>0.05)。各组肥满度、脏体比和肝体比无显著差异(P>0.05)。对照组血浆中总胆固醇、甘油三酯含量及碱性磷酸酶活性显著高于其余各组(P<0.05)。D150和D300组血浆中高密度脂蛋白胆固醇/总胆固醇显著高于对照和D1500组(P<0.05)。D1500组血浆中谷草转氨酶、谷丙转氨酶活性显著低于对照组(P<0.05),与D150、D300组无显著差异(P>0.05)。D150和D300组肝脏中超氧化物歧化酶活性显著低于对照组(P<0.05),与D1500组无显著差异(P>0.05)。饲料中添加1 500 mg/ kg BHA可以显著提高肝脏中总抗氧化能力(P<0.05);饲料中添加150、300、1 500 mg/ kg BHA均显著降低了血浆、心脏和肝脏中丙二醛的含量(P<0.05)。对照、D150和D1500组大口黑鲈的肝脏、肠道都有不同程度的损伤,但D150和D1500组的损伤相对较少。上述结果表明,饲料中添加150 mg/ kg BHA对大口黑鲈具有一定的脂肪代谢促进作用和抗氧化保护功能,且对大口黑鲈是安全的,安全系数为10倍。
关键词:大口黑鲈;丁基羟基茴香醚;耐受性;生长;血液指标;抗氧化;组织学
大口黑鲈(Micropterus salmoides),又名加州鲈,原产于美国加利福尼亚州,于20世纪80年代引入我国,因其具有生长迅速、抗病力强、肉质鲜美、营养丰富等优点,已成为我国淡水养殖中的一种重要经济鱼类[1]。大口黑鲈作为典型的肉食性鱼类,对脂肪需求较高,对饲料氧化非常敏感[2]。而鱼类饲料中含有大量多不饱和脂肪酸,非常容易氧化变质形成各种有毒产物,如氢过氧化物、脂肪酸烷氧基、醛类等,从而损坏细胞的组成物质,如蛋白质、DNA和小分子物质,进而影响细胞的完整性[3]。为了维持鱼体健康,防止饲料的氧化变质,必须采用有效的抗氧化系统,如内源性自由基清除剂和外源性抗氧化剂。
丁基羟基茴香醚(butyl hydroxyanisole,BHA)是一种外源性酚类抗氧化剂,主要通过抽氢反应产生较稳定的苯氧自由基来终止链式反应[4]。BHA对热比较稳定,易溶于油脂,在弱碱条件下不易被破坏,与金属离子作用不着色,有较强的抗菌力,可抑制黄曲霉菌的生长[5]。据报道,100 mg/ kg BHA对阿霉素诱发的小鼠肝脏和心肌组织损伤具有显著的保护作用[6],0.2%和0.5%的BHA对醋氨酚所致小鼠肝损伤均具有显著保护作用[7]。此外,适量的BHA还能延缓黄曲霉毒素诱发大鼠肝癌的过程,显著降低肝癌诱发率,并推迟其他肿瘤的发生[8]。关于BHA的毒性作用说法不一,Sgaragli等[9]研究表明,高剂量的BHA能够损害生物膜系统,并且诱导人体红细胞中高铁血红蛋白的形成。Kahl等[10]发现长期摄入BHA会诱发大鼠前胃肿瘤。Verhagen等[11]报道BHA不仅会诱发大鼠前胃胃癌,而且会致使腺胃、小肠和直肠等组织产生癌变。此外,BHA的毒性与使用剂量密切相关,1 250 mg/ kg的BHA会引起大鼠前胃上皮细胞增生,5 000 mg/ kg的BHA会诱发大鼠前胃肿瘤,而10 000 mg/ kg的BHA则会诱发大鼠前胃胃癌[12]。但也有研究结果显示,20 000 mg/ kg的BHA不会引起大鼠前胃胃癌[13]。目前,对BHA的研究大多集中在食品中其含量的检测方法方面,对其在动物饲料中应用的研究较少。因此,本试验参考欧盟对动物饲料中BHA单独添加或与其他抗氧化剂复合使用时的最高推荐剂量150 mg/ kg,以大口黑鲈为靶动物,对BHA进行耐受性评价试验,以确定BHA在水产饲料中添加的安全限量。
1 材料与方法
1.1试验动物
试验用水产靶动物为大口黑鲈,于2014年6月购自佛山市三水白金水产种苗有限公司。正式试验开始前,试验鱼在养殖系统中暂养3周,暂养期间投喂基础饲料。
1.2试验饲料
本试验依据农业部《饲料原料和饲料添加剂水产靶动物耐受性评价试验指南(试行)》进行。在大口黑鲈的基础饲料中分别添加0、150、300、1 500 mg/ kg的BHA,其中150 mg/ kg为最高推荐添加剂量,而300和1 500 mg/ kg分别是它的2和10倍,制成4种直径为2.0 mm的硬颗粒料,自然晾干后备用。4种试验饲料依次命名为D0(对照)、D150、D300、D1500。饲料中的水分、粗灰分、粗蛋白质、粗脂肪含量和总能分别采用105℃常压干燥法、550℃灼烧法、凯氏定氮法、全脂肪测定法和氧弹仪燃烧法测定。试验饲料组成及营养水平见表1。
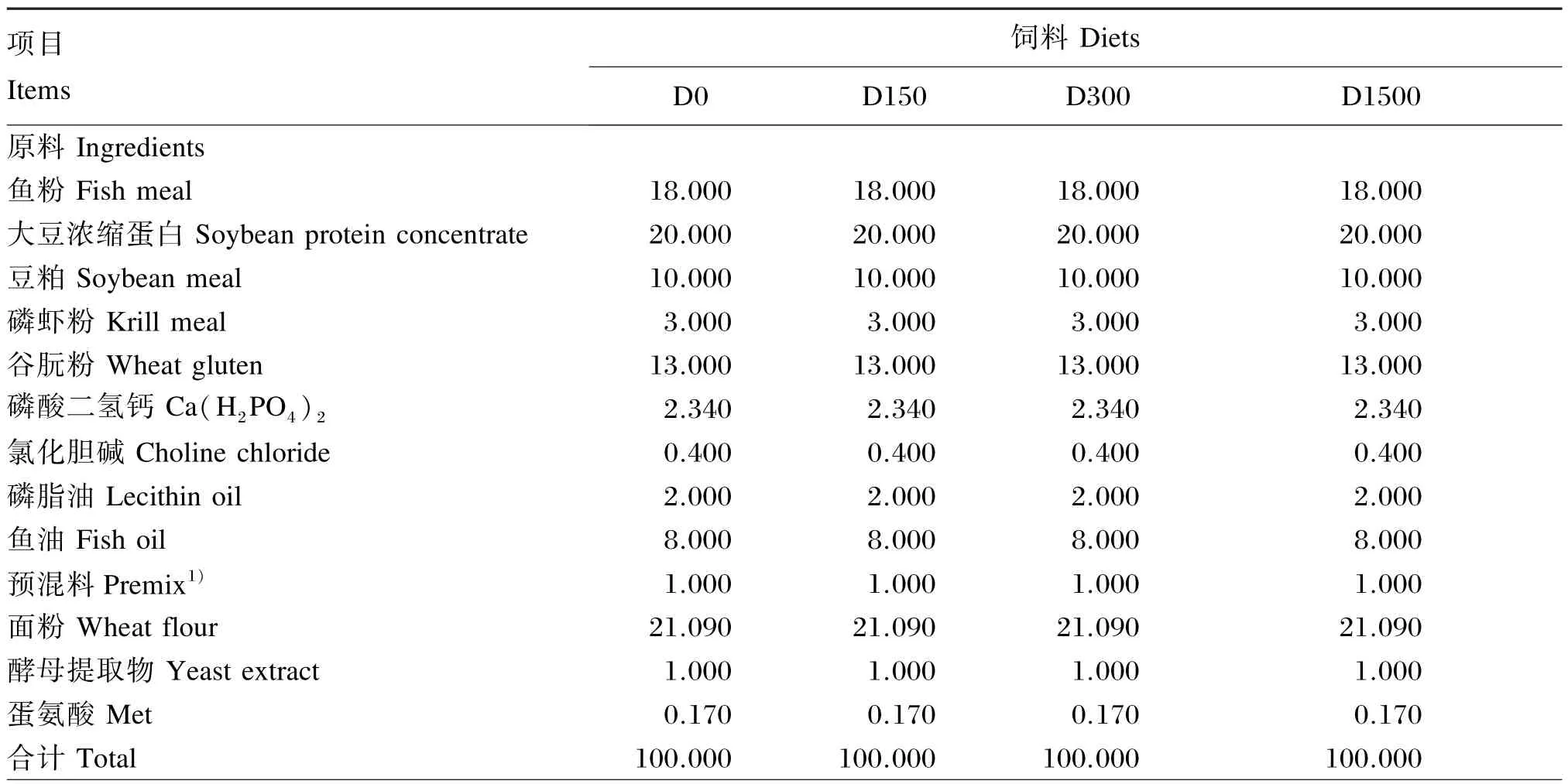
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
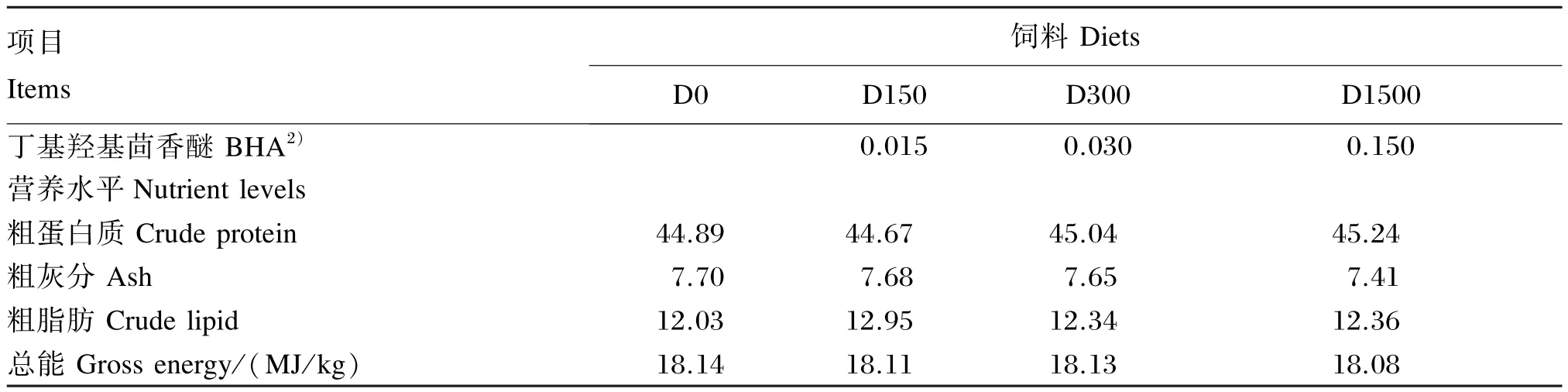
续表1
1.3试验分组及饲养管理
试验在国家水产饲料安全评价基地(北京,南口)室内循环流水养殖系统中进行。随机挑选体质健康、个体均匀[平均体重(6.20±0.01)g]的大口黑鲈,分配到容积为0.26 m3的圆锥形养殖桶中。本试验设计4个组,对应饲喂4种试验饲料,每组6个重复(桶),每桶30尾鱼。
试验鱼每天表观饱食投喂2次,投喂时间分别为08:00、16:00。定期检测水质,水质条件保持在溶氧(DO)浓度>7.0 mg/ L,氨氮(-N)浓度<0.3 mg/ L,pH 7.5~8.5,水温(23±1)℃。养殖试验从2014年7月15日到2014年9月23日,共70 d。
1.4样品采集与指标测定
1.4.1生长指标
养殖70 d后,分别对各桶鱼称重并统计摄食量(feed intake,FI)、存活数,计算生长指标,各指标计算公式如下:

1.4.2形体指标
每桶随机取3尾鱼,测量体长、体重、内脏重、肝脏重,计算形体指标,各指标计算公式如下:

1.4.3血浆生化指标
每桶随机取6尾鱼,三氯叔丁醇麻醉后尾静脉取血,采用氟化钠草酸钾抗凝剂,在4℃、4 000 r/ min的条件下离心10 min,取上层血浆保存于-80℃冰箱中待测。按照试剂盒说明书测定血浆生化指标,所用试剂盒均购自南京建成生物工程研究所。
1.4.4抗氧化指标
每桶随机取5尾鱼,采血制备血浆并取肝脏、心脏和肌肉,放在-80℃待测。按照试剂盒说明书测定血浆及各组织中抗氧化指标,所用试剂盒均购自南京建成生物工程研究所。
1.4.5组织切片
D0、D150和D1500组每桶随机取2尾鱼的肝脏和后肠组织,经中性福尔马林固定后,再经酒精逐级脱水、透明、透蜡、包埋后,用组织切片机切片,最后用苏木精-伊红(HE)染色法染色,显微镜下观察组织切片结构。
1.5数据统计
试验数据以平均值±标准误(mean±SE)表示,所有数据用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),Duncan氏法多重比较检验组间差异的显著性,显著性水平为P<0.05。
2 结 果
2.1BHA对大口黑鲈生长性能的影响
在饲料中添加BHA对大口黑鲈生长性能的影响见表2。结果显示:各组SR和FCR无显著差异(P>0.05)。D150组的终末均重、SGR、WGR和FI显著高于D300、D1500组(P<0.05),其余各组间无显著差异(P>0.05)。
2.2BHA对大口黑鲈形体指标的影响
饲料中添加BHA对大口黑鲈形体指标的影响见表3。结果显示:各组CF、VSI和HSI无显著差异(P>0.05)。

表2 BHA对大口黑鲈生长性能的影响Table 2 Effects of BHA on growth performance of largemouth bass(Micropterus salmoides)(n=6)
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row,values with no letter or the same letter superscripts mean no significant difference(P>0.05),while with different small letter superscripts mean significant difference(P<0.05). The same as below.
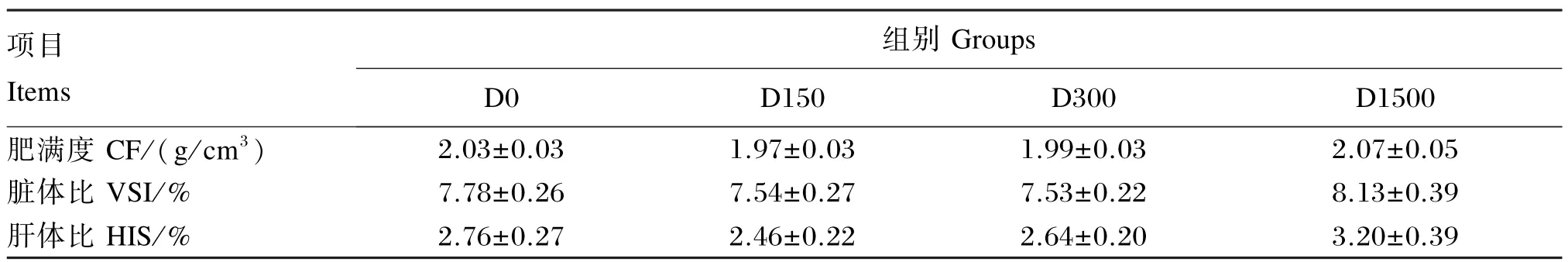
表3 BHA对大口黑鲈形体指标的影响Table 3 Effects of BHA on morphometric parameters of largemouth bass(Micropterus salmoides)(n=18)
2.3BHA对大口黑鲈血浆生化指标的影响
表4显示:各组血浆中总蛋白(TP)、葡萄糖(GLU)和尿素氮(UN)含量均无显著差异(P>0.05)。对照组血浆中总胆固醇(TC)、甘油三酯(TG)含量及碱性磷酸酶(AKP)活性显著高于其余各组(P<0.05),其余各组间无显著差异(P>0.05)。D150、D300组血浆中高密度脂蛋白胆固醇(HDL-C)含量显著高于D1500组(P<0.05),与对照组无显著差异(P>0.05)。D150和D300组血浆中HDL-C/ TC显著高于对照和D1500组(P<0.05)。D1500组血浆中谷丙转氨酶(ALT)、谷草转氨酶(AST)活性显著低于对照组(P<0.05),与D150、D300组无显著差异(P>0.05)。
2.4BHA对大口黑鲈抗氧化指标的影响
2.4.1BHA对大口黑鲈肝脏抗氧化指标的影响
表5显示:过氧化氢酶(CAT)活性各组间无显著差异(P>0.05)。对照组的丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性显著高于D150和D300组(P<0.05),与D1500组无显著差异(P>0.05)。总抗氧化能力(T-AOC)以D1500组最高,显著高于其余各组(P<0.05),其余各组间无显著差异(P>0.05)。谷胱甘肽硫转移酶(GST)活性以D150组最低,显著低于其余各组(P<0.05),其余各组间无显著差异(P>0.05)。

表4 BHA对大口黑鲈血浆生化指标的影响Table 4 Effects of BHA on plasma biochemical indexes of largemouth bass(Micropterus salmoides)(n=8)
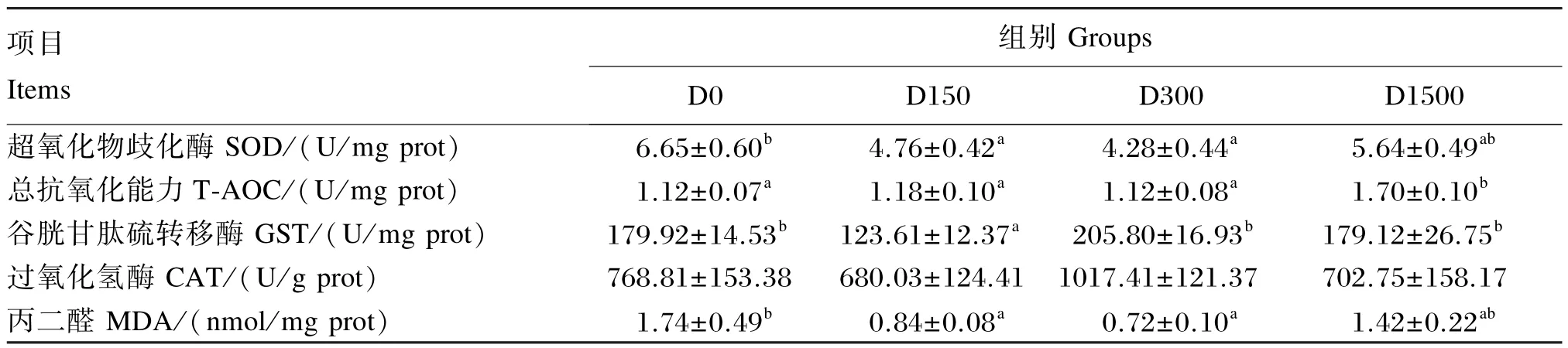
表5 BHA对大口黑鲈肝脏抗氧化指标的影响Table 5 Effects of BHA on antioxidant indexes in liver of largemouth bass(Micropterus salmoides)(n=8)
2.4.2BHA对大口黑鲈肌肉抗氧化指标的影响
表6显示:SOD、GST、CAT活性及T-AOC各组间无显著差异(P>0.05),但D150、D300组的MDA含量显著低于对照和D1500组(P<0.05)。
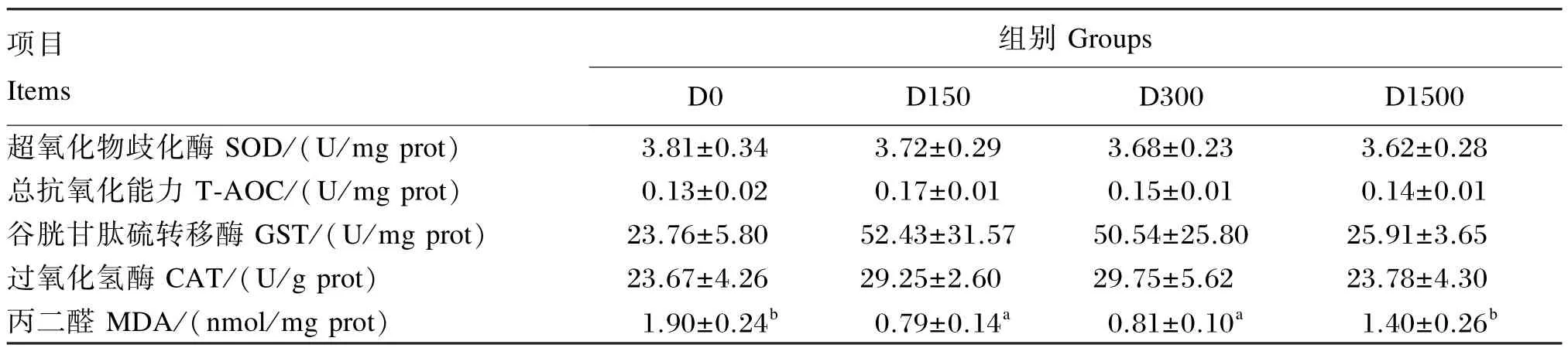
表6 BHA对大口黑鲈肌肉抗氧化指标的影响Table 6 Effects of BHA on antioxidant indexes in muscle of largemouth bass(Micropterus salmoides)(n=8)
2.4.3BHA对大口黑鲈心脏抗氧化指标的影响
表7显示:T-AOC及CAT活性各组间无显著差异(P>0.05)。对照组的SOD活性显著高于D150组(P<0.05),与D300、D1500组无显著差异(P>0.05)。MDA含量以对照组最高,显著高于其余各组(P<0.05)。
2.4.4BHA对大口黑鲈血浆抗氧化指标的影响
表8显示:SOD、CAT活性及T-AOC各组间无显著差异(P>0.05)。D150组的GST活性显著低于对照和D300组(P<0.05),与D1500组无显著差异(P>0.05)。谷胱甘肽过氧化物酶(GSHPx)活性以D1500组最高,显著高于其余各组(P<0.05),其余各组间无显著差异(P>0.05)。MDA含量随着BHA添加量的增加先显著降低(P< 0.05),在D300组达到最低,之后在D1500组有所升高,但仍显著低于对照和D150组(P<0.05)。
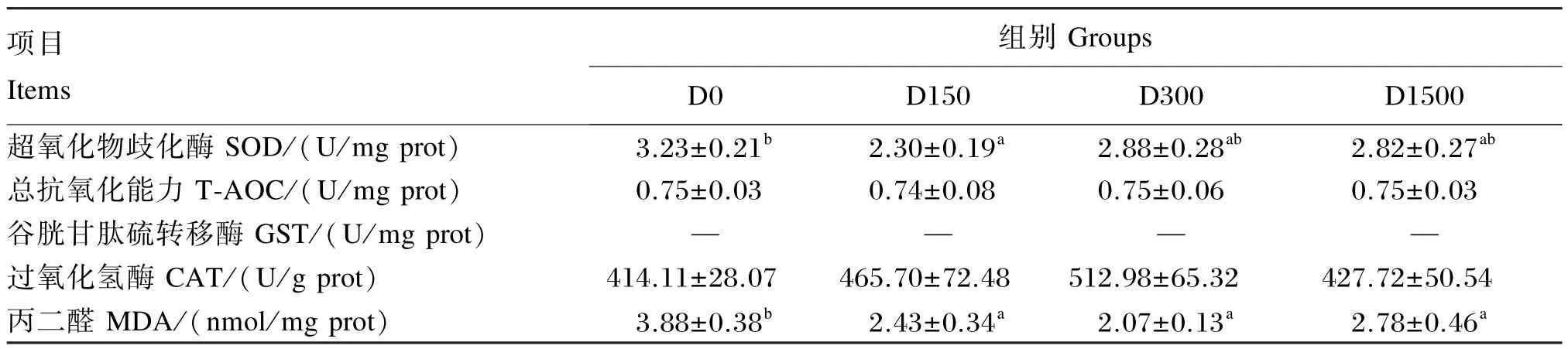
表7 BHA对大口黑鲈心脏抗氧化指标的影响Table 7 Effects of BHA on antioxidant indexes in heart of largemouth bass(Micropterus salmoides)(n=8)

表8 BHA对大口黑鲈血浆抗氧化指标的影响Table 8 Effects of BHA on antioxidant indexes in plasma of largemouth bass(Micropterus salmoides)(n=8)
2.5大口黑鲈肝脏和后肠组织学观察
2.5.1肝脏组织学观察
如图1所示,各组肝脏均出现不同程度的损伤。对照组(D0组)观察了12尾鱼,1尾正常,5尾出现肝脏细胞脂肪浸润,6尾肝纤维化,细胞崩解;D150组观察了12尾鱼,4尾正常,8尾出现不同程度肝纤维化,细胞崩解,出现肝脏细胞脂肪浸润;D1500组观察了12尾鱼,3尾正常,4尾出现肝脏细胞脂肪浸润,5尾肝纤维化。
2.5.2后肠组织学观察
如图2所示,对照组(D0组)观察了12尾鱼,9尾正常,3尾损伤,1尾肠上皮细胞损伤,1尾肠上皮细胞损伤并与固有层脱落,1尾上皮微绒毛轻微损伤;D150组观察了12尾鱼,11尾正常,1尾上皮细胞轻微损伤;D1500组观察了12尾鱼,11尾正常,1尾肠上皮细胞脱落。
3 讨 论
3.1BHA对大口黑鲈生长的影响
饲料在加工与存储过程中容易发生氧化变质形成各种有毒有害物质,从而影响鱼类生长。为了维持鱼体健康,防止饲料的氧化变质,必须采用有效的抗氧化系统。本试验结果显示,饲料中添加150 mg/ kg BHA能显著提高大口黑鲈的生长性能,这可能是由于150 mg/ kg的BHA能有效延缓饲料氧化,防止鱼体受氧化胁迫。Hansen等[14]和Würtzen等[15]均报道400 mg/ kg的BHA会显著降低妊娠母猪的增重率,还会引起肝脏和甲状腺肿大。此研究结果表明高剂量的BHA可能会影响动物的生长,加重机体损伤。但本试验中D300 和D1500组的大口黑鲈的生长性能与对照组相比没有显著差异,说明饲料中添加高剂量的BHA没有抑制大口黑鲈摄食,这可能与不同动物的耐受性或饲料中的脂肪来源和含量有关。
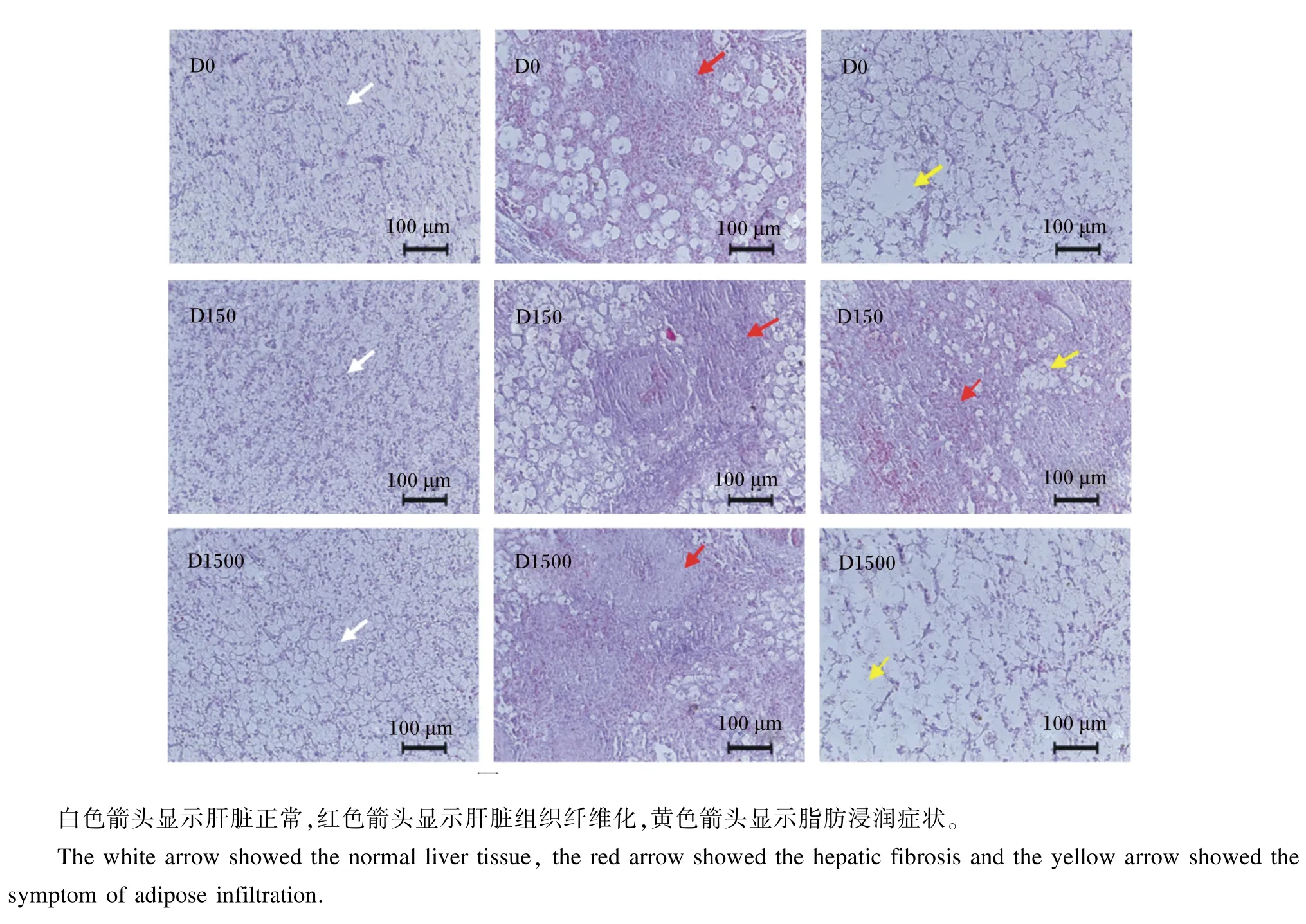
图1 D0、D150和D1500组大口黑鲈肝脏组织学观察Fig.1 Observation on hepatic histology of largemouth bass(Micropterus salmoides)in groups D0,D150 and D1500
3.2BHA对大口黑鲈血浆生化指标的影响
血液生化指标与鱼类机体代谢,营养水平及疾病有着密切的联系,它既能反映鱼类的正常生理状态,也可用于评价其病理学变化,是衡量鱼体是否处于相对健康状态的一项重要指标[16]。本试验结果显示,BHA对各组大口黑鲈血浆中TP、GLU和UN含量均无显著影响,说明BHA的添加没有对大口黑鲈机体蛋白质调节和糖代谢产生显著影响。TC和TG是血液脂肪的组成成分,其含量的高低主要反映脂类的吸收与代谢状况[17],本试验中,各BHA添加组血浆中TC和TG含量均显著低于对照组,而且150和300 mg/ kg添加量的BHA可显著提高大口黑鲈血浆中HDL-C含量和HDL-C/ TC,表明BHA的添加可显著改善大口黑鲈血液脂肪转运和代谢,降低血脂含量,有利于维持鱼体健康。AKP、AST和ALT活性主要反映动物肝脏受损程度,正常生理条件下鱼体血浆中AKP、AST和ALT活性很低,当动物肝细胞受损时其活性会显著升高,升高程度与肝细胞受损程度相一致[18]。本试验中,BHA的添加显著降低了大口黑鲈血浆中的AKP活性,且D1500组血浆中AST和ALT活性均显著低于对照组,说明BHA的添加可有效缓解饲料脂肪氧化和大口黑鲈机体的氧化损伤,从而降低肝脏的氧化应激,减轻肝脏氧化损伤。
3.3BHA对大口黑鲈肝脏、肌肉、心脏、血浆抗氧化功能的影响
当受到氧化应激时,动物体内的氧化与抗氧化作用失衡,从而引起机体内高活性分子活性氧自由基激增,并且产生大量的氧化中间产物,若不及时清除多余的活性氧自由基,则会导致机体出现脂质过氧化损伤[19]。为了抵御自由基对生物体的损害作用,维持机体健康与代谢平衡,必须建立有效的防御机制[20]。机体防御机制一种是具有特异性的抗氧化酶系统,包括SOD、GSH-Px、GST、CAT等,另一种是非酶促系统,主要包括合成抗氧化剂、维生素、微量元素等[21]。

图2 D0、D150和D1500组大口黑鲈后肠组织学观察Fig.2 Observation on distal intestinal histology of largemouth bass(Micropterus salmoides)in groups D0,D150 and D1500
本研究结果显示,BHA的添加对大口黑鲈肝脏中CAT活性无显著影响,而对照组肝脏中SOD活性和MDA含量显著高于D150和D300组,与D1500组无显著差异。SOD是具有核基因编码的一类含有金属元素的氧化还原酶类,是唯一以超氧阴离子()为底物的酶[22],可催化转化为过氧化氢(H2O2)和氧气(O2),从而清除,维持生物体自由基产生与消除的动态平衡。MDA是脂质过氧化最重要的产物之一,其含量的高低可间接反映机体细胞受自由基攻击的严重程度。组织中SOD和MDA常常相互配合,共同反映生物体自由基的代谢状态。本研究中,对照组肝脏中SOD活性显著高于D150和D300组,这可能是由于大口黑鲈长期摄入未添加外源性抗氧化剂的氧化饲料,导致细胞中氧自由基等生物活性物质的浓度升高,即抗氧化酶的反应底物浓度增加,从而提高了大口黑鲈肝脏中SOD的活性。本试验中D150组肝脏中GST活性显著低于其余各组。GST是一类与肝脏解毒有关的酶,在肝细胞中大量存在,具有消除体内过氧化物及解毒双重功能,同时GST活性的升高常常作为肝脏损伤的敏感指标[23]。有研究显示,BHA能显著提高大鼠和小鼠肝脏中GST的活性[24],本研究结果与之相反。肝损伤程度分至少3个层次,即脂肪浸润、肝纤维化、癌变。目前HE病理切片仅显示组织形态的变化,并不能明确其和动物生理水平的关系。因此,D150组肝脏中GST活性显著低于其他组,主要与肝功能和机体抗氧化系统的反应相关。D1500组肝脏中T-AOC最高,说明1 500 mg/ kg的BHA显著提高了大口黑鲈肝脏的抗氧化能力。
本研究中,D150和D300组肌肉中MDA含量显著低于对照组,说明BHA的添加可有效缓解大口黑鲈肌肉的脂质过氧化。自由基对肌肉中的多不饱和脂肪酸具有很高的亲和力,可引发脂质氧化,形成不稳定的氢过氧化物,并迅速降解成MDA等物质,促使MDA含量升高[25]。据报道,BHA在添加量为120 mg/ kg时,对猪肉脂肪的抗氧化效果较好且添加量较小[26];Sebranek等[27]研究发现,2 500 mg/ kg的BHA对新鲜猪肉香肠具有显著的抗氧化效果;Ahn等[28]研究发现,BHA比天然迷迭香萃取物更能有效抑制熟牛肉的氧化变质。但本试验中D1500组肌肉中MDA含量较D150和D300组显著升高,这可能是由于过量的抗氧化剂伴随着自由基对机体的损伤加重,BHA添加剂量过高对肉质的抗氧化效果反而会下降[29]。
小鼠心脏中的SOD和CAT活性显著低于肝脏[30],这与本试验结果一致,但对照组心脏中SOD活性显著低于D150组,可能原因是150 mg/ kg的BHA降低了心脏中MDA的含量,从而降低了大口黑鲈心脏的氧化应激,机体不需要过多的SOD来清除自由基,从而导致SOD活性下降。相关研究结果显示,阿霉素可导致小鼠心肌中MDA含量极显著升高,而预先饲喂100 mg/ kg 的BHA能显著抑制小鼠心肌中MDA含量的升高[6],这与本试验中BHA的添加显著降低了大口黑鲈心脏中MDA含量的结果相吻合。GST广泛存在于哺乳动物各组织中,在心肌细胞抗氧化损伤中占有重要地位[31],可协同保护膜系统巯基不被自由基破坏。但心肌组织中GST活性很低,且GST同工酶检测不出来,这些抗氧化酶的减少或缺失会使心肌细胞极易受到氧自由基的攻击而产生损伤。本研究中,GST在大口黑鲈心脏中未检出,可能由于GST在大口黑鲈心脏中不表达或对大口黑鲈心脏应激反应不敏感[32]。
本试验中,BHA的添加对大口黑鲈血浆中SOD、CAT活性及T-AOC无显著影响,但显著降低了大口黑鲈血浆中MDA含量。这可能是BHA的添加提高了机体内源性抗氧化酶的活性,有效缓解了大口黑鲈机体脂质过氧化,从而减少了血浆中氧化产物的水平[6]。D150组血浆中GST活性显著低于对照和D300组。BHA是Ⅱ相酶的单功能诱导剂,对GST具有诱导作用[33],能够提高机体GST活性,达到清除自由基,对有害物质解毒的效果,当肝细胞受损害时,GST常常很早释放到血液中。本试验中,饲料中添加150 mg/ kg的BHA显著降低了大口黑鲈血浆中GST的活性,原因可能是摄食添加150 mg/ kg BHA饲料的大口黑鲈的肝脏受损程度较轻,所以释放到血浆中的GST也较少,这也与肝脏组织切片中显示的150 mg/ kg的BHA可有效缓解大口黑鲈肝脏损伤的结果相吻合。GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解的酶,其活性中心为硒半胱氨酸。GSH-Px有5种同工异构酶,每种异构酶的活性随组织的不同表达量也不同[34],它们均可以谷胱甘肽(GSH)为底物,将H2O2和烷烃氢过氧化物还原,可以起到保护细胞膜结构和功能完整的作用。本试验中D1500组血浆中GSH-Px活性最高,可能原因是高剂量的BHA对GSH具有显著诱导作用,促进GSH-Px与底物GSH和H2O2反应生成水和氧化型谷胱甘肽(GSSG)。
3.4BHA对大口黑鲈肝脏、后肠组织学的影响
本研究针对对照、D150和D1500组的大口黑鲈肝脏、后肠组织进行了病理学分析。从大口黑鲈的肝脏组织切片可以看出,对照、D150和D1500组的肝脏均出现了不同程度的损伤,尤其是未添加外源性抗氧化剂的对照组,出现肝脏纤维化、脂肪浸润、大量脂肪空泡和细胞崩解等病变。在后肠组织切片中,对照、D150和D1500组的后肠组织也均有损伤,对照组出现肠上皮细胞损伤,部分上皮细胞与固有层分离,上皮微绒毛损伤等病变,但D150和D1500组上述病变有所减轻,说明BHA可有效缓解肠道组织损伤。各组大口黑鲈的肝脏和肠道均发生了不同程度的病变,这可能是因为本试验是模拟野外大口黑鲈养殖过程中饲料储存条件(室温,储存期3个月),由于饲料长期在夏季高温高湿的环境下放置,会发生不同程度的氧化变质所致。大口黑鲈对脂质氧化非常敏感[2],长期摄食氧化油脂会导致其组织受损;也有可能是因为大口黑鲈对人工配合饲料的适应性不足,导致养殖后期出现生长缓慢,诱发肝脏、肠道病变等。关胜军等[35]研究表明,投喂人工配合饲料20 d后,大口黑鲈出现了生长缓慢,肝脏病变等现象,这与本试验结果相吻合。本试验结果显示,饲料中添加150 mg/ kg的BHA可有效缓解肝脏、后肠组织损伤,但饲料中仅添加BHA仍未能完全抵御大口黑鲈由氧化油脂所造成的组织损伤。
4 结 论
饲料中添加150 mg/ kg的BHA对大口黑鲈具有一定的脂肪代谢促进作用和抗氧化保护功能,且对大口黑鲈是安全的,安全系数为10倍。
参考文献:
[1] 丁庆秋,陈宇航,曹双俊,等.大口黑鲈的营养需求研究进展[J].养殖与饲料,2013(11):38-43.
[2] YUAN Y,CHEN Y J,LIU Y J,et al.Dietary high level of vitamin premix can eliminate oxidized fish oil-induced oxidative damage and loss of reducing capacity in juvenile largemouth bass(Micropterus salmoides)[J].Aquaculture Nutrition,2014,20(2):109-117.
[3] HALLIWELL B,AESCHBACH R,LÖLIGER J,et al. The characterization of antioxidants[J]. Food and Chemical Toxicology,1995,33(7):601-617.
[4] 魏金涛,齐德生,张妮娅.饲料抗氧化剂作用机理及其活性评价方法研究进展[J].饲料工业,2007,28 (2):7-10.
[5] WILLIAMS G M,TANAKA T,MAEURA Y. Doserelated inhibition of aflatoxin B1induced hepatocarcinogenesis by the phenolic antioxidants,butylated hydroxyanisole and butylated hydroxytoluene[J].Carcinogenesis,1986,7(7):1043-1050.
[6] 王立新,林三仁.2(3)-叔丁基-4-羟基茴香醚对阿霉素诱发小鼠毒性的保护作用及其抗氧化机制[J].药学学报,1998,33(11):807-811.
[7] 程燕,王立新,林三仁.叔丁基羟基茴香醚对小鼠醋氨酚中毒性肝损伤的保护作用[J].胃肠病学,2000,5(2):109-111.
[8] 严瑞琪,陈志英,苏建家,等.叔丁基对羟基茴香醚(BHA)和核黄素(VB2)对黄曲霉毒素(AFT)诱发大鼠肿瘤的影响[J].癌症,1983,2(4):232-235.
[9] SGARAGLI G,CORTE L D,PULITI R,et al.Oxidation of 2-t-butyl-4-methoxyphenol(BHA)by horseradish and mammalian peroxidase systems[J]. Biochemical Pharmacology,1980,29(5):763-769.
[10] KAHL R,KAPPUS H.Toxicology of the synthetic antioxidants BHA and BHT in comparison with the natural antioxidant vitamin E[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung,1993,196(4):329-338.
[11] VERHAGEN H,FURNÉE C,SCHUTTE B,et al. Dose-dependent effects of short-term dietary administration of the food additive butylated hydroxyanisole on cell kinetic parameters in gastro-intestinal tract[J]. Carcinogenesis,1990,11(9):1461-1468.
[12] ITO N,FUKUSHIMA S,TAMANO S,et al.Dose response in butylated hydroxyanisole induction of forestomach carcinogenesis in F344 rats[J].Journal of the National Cancer Institute,1986,77(6):1261-1265.
[13] LAURIAULT V,GRASSO P,POWELL C J.Butylated hydroxyanisole(BHA)does not cause forestomach hyperplasia by inhibiting the release of gastric mucus[J].Toxicology,1990,64(3):281-290.
[14] HANSEN E V,MEYER O,OLSEN P.Study on toxicity of butylated hydroxyanisole(BHA)in pregnant gilts and their foetuses[J].Toxicology,1982,23(1):79-83.
[15] WÜRTZEN G,OLSEN P. BHA study in pigs[J]. Food and Chemical Toxicology,1986,24(10/11):1229-1233.
[16] SILVEIRA-COFFIGNY R,PRIETO-TRUJILLO A,ASCENCIO-VALLE F.Effects of different stressors in haematological variables in cultured Oreochromis aureus S[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2004,139(4):245-250.
[17] 王宗伟,牟晓玲,杨国伟,等.日粮营养素水平对东北肉鹅生长性能及血液生化指标的影响(1~28日龄)[J].核农学报,2009,23(5):891-897.
[18] NYBLOM H,BERGGREN U,BALLDIN J,et al. High AST/ ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol and Alcoholism,2004,39(4):336-339.
[19] HALLIWELL B,GUTTERIDGE J M C.Oxygen toxicity,oxygen radicals,transition metals and disease [J].Biochemical Journal,1984,219(1):1-14.
[20] PUGH S Y,DIGUISEPPI J L,FRIDOVICH I.Induction of superoxide dismutases in Escherichia coli by manganese and iron[J]. Journal of Bacteriology,1984,160(1):137-142.
[21] 黄权,苏琳.动物体内氧化应激与抗氧化剂应用研究进展[J].中国兽药杂志,2013,47(5):66-69.
[22] WINSTON G W,DI GIULIO R T D.Prooxidant and antioxidant mechanisms in aquatic organisms[J]. A-quatic Toxicology,1991,19(2):137-161.
[23] SEN A,KIRIKBAKAN A. Biochemical characterization and distribution of glutathione S-transferases in leaping mullet(Liza saliens)[J].Biochemistry:Moscow,2004,69(9):993-1000.
[24] BENSON A M,BATZINGER R P,OU S Y L,et al. Elevation of hepatic glutathione S-transferase activities and protection against mutagenic metabolites of benzo (a)pyrene by dietary antioxidants[J]. Cancer Research,1978,38(12):4486-4495.
[25] FERNÁNDEZJ,PÉREZ-ÁLVAREZJA,FERNÁNDEZ-LÓPEZ J A.Thiobarbituric acid test for monitoring lipid oxidation in meat[J].Food Chemistry,1997,59(3):345-353.
[26] 张根生,任媛媛,石慧,等.两种抗氧化剂协同增效剂对猪脂肪抗氧化性的影响[J].肉类研究,2012,26 (5):10-13.
[27] SEBRANEK J G,SEWALT V J H,ROBBINS K L,et al. Comparison of a natural rosemary extract and BHA/ BHT for relative antioxidant effectiveness in pork sausage[J]. Meat Science,2005,69(2):289-296.
[28] AHN J,GRÜN I U,FERNANDO L N. Antioxidant properties of natural plant extracts containing polyphenolic compounds in cooked ground beef[J].Journal of Food Science,2002,67(4):1364-1369.
[29] 尹守铮.外源抗氧化剂对肉鸡机体氧化还原状态和生产性能的影响[D].硕士学位论文.武汉:华中农业大学,2010.
[30] DOROSHOW J H,LOCKER G Y,MYERS C E.Enzymatic defenses of the mouse heart against reactive oxygen metabolites:alterations produced by doxorubicin[J]. Journal of Clinical Investigation,1980,65 (1):128-135.
[31] RÖTH E,MARCZIN N,BALATONYI B,et al.Effect of a glutathione S-transferase inhibitor on oxidative stress and ischemia-reperfusion-induced apoptotic signalling of cultured cardiomyocytes[J].Experimental&Clinical Cardiology,2011,16(3):92-96.
[32] 刘金桃,艾立川,王嘉,等.大口黑鲈对饲料中乙氧基喹啉的耐受性评价[J].动物营养学报,2015,27 (4):1152-1162.
[33] PROCHASKA H J,TALALAY P.Regulatory mechanisms of monofunctional and bifunctional anticarcinogenic enzyme inducers in murine liver[J].Cancer Research,1988,48(17):4776-4782.
[34] ARTHUR J R.The glutathione peroxidases[J].Cellular and Molecular Life Sciences,2000,57(13/14):1825-1835.
[35] 关胜军,吴锐全,谢骏,等.两种饲料对大口黑鲈生长、消化道指数和消化酶活性的影响[J].饲料工业,2007,28(2):32-36.
(责任编辑菅景颖)
Tolerance Evaluation of Butyl-Hydroxyanisole in Diets of Largemouth Bass(Micropterus salmoides)
YU Lili1,2XUE Min2∗WANG Jia2HAN Fang2ZHENG Yinhua2WU Xiufeng2WU Lixin1
(1. College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;2. National Aquafeed Safety Assessment Station,Feed Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Abstract:A 10-week growth trail was conducted to evaluate the tolerance of largemouth bass(Micropterus salmoides)on butyl-hydroxyanisole(BHA)based on the changes of growth performance,plasma biochemical indexes,tissue antioxidant indexes and histology of liver and intestine. Four experimental diets were prepared with BHA supplemental levels at 0(D0 group,as control group),150(D150 group),300(D300 group)and 1 500 mg/ kg(D1500 group),in which 150 mg/ kg was designed as the maximum recommended level,otherwise the 300 and 1 500 mg/ kg were 2 and 10 fold levels of the maximum recommended level,respectively.The largemouth bass were chosen as the target animal,and each diet was fed to 6 replicates with 30 largemouth bass with the initial body weight of(6.20±0.01)g. The results showed as follows:fish in D150 group showed the best growth performance,and no significant differences in final average body weight,weight gain rate,special gain rate and feed intake were observed among other groups(P>0.05). The condition factor,hepatosomatic index and viscerasomatic index in all groups had no significant differences(P>0.05). Plasma total cholesterol(TC),triglyceride(TG)contents and alkaline phosphatase(AKP)activity in control group were significantly higher than those in other groups(P<0.05). Plasma high density lipoprotein cholesterol (HDL-C)/ TC in D150 and D300 groups was significantly higher than that in control and D1500 groups(P<0.05). Plasma aspartate aminotransferase(AST)and alanine aminotransferase(ALT)activities in D1500 group were significantly lower than those in control group(P<0.05),but had no significant differences with those in D150 and D300 groups(P<0.05). Liver superoxide dismutase(SOD)activity in D150 and D300 groups was significantly lower than that in control group(P<0.05),but had no significant difference with that in D1500 group(P<0.05). Supplementation of 1 500 mg/ kg BHA could significantly enhance the liver total anti-oxidant ability(T-AOC)(P<0.05),and malondialdehyde(MDA)content in plasma,heart and liver were significantly decreased in each BHA supplemental groups(P<0.05). Different degrees of liver and intestinal histological damage were observed in control,D150 and D1500 groups,but fish fed diets with 150 and 1 500 mg/ kg BHA relieved the symptom. The results show that the supplementation of 150 mg/ kg BHA can enhance the fat metabolism and antioxidant protection of largemouth bass,and a 10 fold of safety margin is obtained in the present study.[Chinese Journal of Animal Nutrition,2016,28(3):747-758]
Key words:largemouth bass(Micropterus salmoides);butyl hydroxyanisole;tolerance;growth;blood indexes;antioxidant;histology
Corresponding author∗,professor,E-mail:xuemin@cass.cn
通信作者:∗薛 敏,研究员,博士生导师,E-mail:xuemin@cass.cn
作者简介:于利莉(1990—),女,江苏盐城人,硕士研究生,研究方向为水产动物营养与饲料科学。E-mail:yulili060590@163.com
基金项目:国家自然科学基金(31101907,31372539,31572631);公益性行业(农业)专项经费项目(201203015);北京市现代农业产业技术体系(SCGWZJ 20161103-1);国家重点基础研究发展计划项目(2014CB138600)
收稿日期:2015-09-15
doi:10.3969/ j.issn.1006-267x.2016.03.015
中图分类号:S963
文献标识码:A
文章编号:1006-267X(2016)03-0747-12

