短短芽孢杆菌DFG对金黄色葡萄球菌的抑制效果
刘红美,胡 越,李玉权,陶小买,任建国
(贵州医科大学生物技术教研室,贵州贵阳550004)
短短芽孢杆菌DFG对金黄色葡萄球菌的抑制效果
刘红美,胡 越,李玉权,陶小买,任建国*
(贵州医科大学生物技术教研室,贵州贵阳550004)
为短短芽孢杆菌(Brevibacillus brevis)DFG菌株的开发应用提供参考,采用不同化学物质处理方法结合琼脂打孔法研究不同培养基、接种量和发酵时间对其发酵液抑菌活性的影响,并在此基础上研究温度、蛋白酶、酸碱、紫外线照射和反复冻融等因素对其抑菌物质稳定性的影响。结果表明:NA培养基培养的DFG菌株其发酵液对金黄色葡萄球菌(Staphylococcus aureus)的抑制作用最强,抑菌圈直径达2.4cm;发酵液经100℃处理30min,抑菌率仍达65%;对酸碱也具有较强的稳定性;经紫外线照射和反复冻融后性质稳定;对胃蛋白酶、胰蛋白酶及蛋白酶K不敏感,可用有机溶剂对短短芽孢杆菌DFG菌株抑菌物质进行部分萃取。
短短芽孢杆菌;金黄色葡萄球菌;发酵液;抑菌物质;抑菌特性
金黄色葡萄球菌(Staphylococcus aureus)属葡萄球菌属(Staphylococcus),是人类的一种重要致病病原菌,临床上可引起肺炎、骨髓炎和败血症等全身性感染,以及毛囊炎、甲沟炎和外科切口、创伤等局部化脓性感染[1]。目前,该菌是医院和社区最常见的感染病原菌之一[2]。金黄色葡萄球菌在自然界中分布广泛,因此,食品受其污染的机会较多。值得重视的是,随着临床上抗生素的广泛应用,金黄色葡萄球菌耐药菌株不断被发现,而且出现多重耐药性,已经成为全球医院首要的致病菌[3-5],特别是耐甲氧西林金黄色葡萄球菌等多重耐药菌的出现,以多重耐药、高感染率及高致死率等特点使金黄色葡萄球菌成为名副其实的超级细菌[6-7]。近年来,筛选对金黄色葡萄球菌具有强抑制或杀灭作用的拮抗菌、分离抗菌成分、解析结构并探索其作用机理已成为研究热点。
短短芽孢杆菌(Brevibacillus brevis)属短短芽胞杆菌属,能分泌几丁质酶和短杆菌肽[8-10]等多种活性物质,其中,短杆菌肽可与细胞膜发生作用导致细胞膜结构破坏,细胞内含物释放而死亡,其对很多病原真菌,尤其对G+菌有较强的抑制作用[11-12]。短短芽孢杆菌目前在生物防治上已得到广泛应用[13],但由于短杆菌肽作用专一性小,具有溶血细胞毒性和肝、肾的细胞毒性,所以限制了其在临床上的应用。近年来,有关以短杆菌肽结构合成毒性小或无毒性类似物的研究已取得新进展[14]。笔者从贵州省大方县半夏根际土壤中分离、筛选、鉴定得到短短芽孢杆菌DFG菌株[15],前期研究发现,该DFG菌株对金黄色葡萄球菌以及白色念株菌等临床致病菌均有抑制作用。为此,笔者在前期研究基础上进一步研究该菌株对金黄色葡萄球菌的抑制作用及其抑菌特性,以期为该菌株抑菌成分分离鉴定、结构解析和作用机理的研究奠定基础,并为该菌株的进一步开发应用提供参考。
1材料与方法
1.1供试材料
1.1.1菌株 短短芽孢杆菌DFG菌株,由贵州医科大学生物技术教研室分离、鉴定、保存。受试菌为金黄色葡萄球菌,系贵州医科大学病原生物学重点实验室保存菌株。
1.1.2试剂 有机试剂乙醚、异丁醇、乙酸乙酯和氯仿(上海沃凯生物技术有限公司)。牛肉膏、蛋白胨、氯化钠、脱脂奶粉、酵母提取物、胰蛋白胨、酵母粉、3.7mmol/L KH2PO4、2.9mmol/L K2HPO4、2.0mmol/L MgSO4·7H2O、0.7mmol/L NaCl、0.05mmol/L MnCl2·4H2O、0.036mmol/L FeSO4· 7H2O、0.15mmol/L CaCl2、72%农用硫酸链霉素及蒸馏水。
1.2试验方法
1.2.1材料预处理1)培养基制备。牛肉膏液体培养基(0.3%牛肉膏+1%蛋白胨+0.5%氯化钠+蒸馏水定容至1 000mL,pH 7.4);NA培养基(1%蛋白胨+1%牛肉膏+0.1%氯化钠+蒸馏水定容至1 000mL,pH 6.8);SY培养基[16](1%脱脂奶粉+0.1%酵母提取物+3.7mmol/L KH2PO4+2.9mmol/L K2HPO4+2.0mmol/L MgSO4·7H2O+0.7mmol/L NaCl+0.05mmol/L MnCl2·4H2O+0.036mmol/L FeSO4·7H2O+0.15mmol/L CaCl2+蒸馏水定容至1 000mL,pH 6.8);ZS培养基[15](0.5%牛肉膏+1%胰蛋白胨+0.5%酵母粉+1%氯化钠+蒸馏水定容至1 000mL,pH 7.0);1%脱脂牛奶培养基[16](1%的脱脂奶粉+蒸馏水定容至1 000mL,自然pH)。2)受试菌菌液制备。接种活化的金黄色葡萄球菌单菌落于30mL牛肉膏液体培养基中,37℃200r/min恒温振荡培养24h,用无菌蒸馏水稀释至1.2×109cfu/mL备用。
1.2.2短短芽孢杆菌DFG菌株的生长曲线 用接种环挑取短短芽孢杆菌DFG菌株单菌落接种于30mL牛肉膏液体培养基中,28℃、200r/min恒温振荡培养24h,获得种子液。取种子液1mL接种于50mL牛肉膏液体培养基,28℃、200r/min恒温振荡培养,分别在2h、4h、6h、8h、10h、12h、14h、16h、18h、20h、24h、28h、32h、36h、48h和72h时吸取1mL培养液,于紫外分光光度计600nm处测定OD值,以OD值为纵坐标,培养时间为横坐标,作DFG菌株的生长曲线。通过菌液生长情况确定种子液培养时间。每处理3次重复。
1.2.3短短芽孢杆菌DFG菌株最适发酵培养基的筛选 试验设4个处理,即取DFG菌株种子液100μL分别接种于30mL NA培养基(P1)、30mL SY培养基(P2)、30mL ZS培养基(P3)及1%脱脂牛奶培养基(P4),28℃、200r/min恒温振荡培养36~48h,分别取发酵上清液用琼脂打孔法测定其抑菌活性,筛选最适DFG分泌抑菌活性物质的发酵培养基。
1.2.4短短芽孢杆菌DFG菌株最佳接种量与发酵时间的确定 采用双因素试验设计,即接种量(A),发酵时间(B)。将制备好的种子液分别以1% (A1)、2%(A2)、3%(A3)和4%(A4)的接种量接入50mL最适培养基中,28℃、200r/min恒温振荡培养,分别取培养24h(B1)、36h(B2)、48h(B3)、60h (B4)和72h(B5)的离心上清液检测其抑菌活性,根据抑菌圈性大小确定最佳接种量和发酵时间。以0.1mg/mL 72%农用硫酸链霉素为阳性对照(CK)。
1.2.5短短芽孢杆菌DFG菌株无菌发酵液的制备 按照步骤1.2.2~1.2.4所得最适条件进行DFG菌株培养,12 000r/min离心10min取上清液,并用0.22μm过滤器过滤获得无菌发酵液。
1.2.6发酵液对金黄色葡萄球菌的抑菌活性及最低抑菌浓度(MIC)的测定 将DFG菌株接种于1.2.3筛选出的最适培养基中,按1.2.4筛选的接种量和发酵时间进行培养后离心取上清液,经0.22μm过滤器过滤备用。
1)抑菌活性。采用琼脂打孔法检测发酵液的抑菌活性,即取金黄色葡萄球菌菌液100μL均匀涂于牛肉膏蛋白胨培养基上,用8mm枪头打孔,然后每孔加入100μL DFG菌株无菌发酵液,用浓度为0.1mg/mL的72%农用硫酸链霉素100μL作阳性对照,用空白发酵培养基100μL作阴性对照,封口,置37℃培养箱培养20h观察结果,用十字交叉法测量抑菌圈直径。
2)最低抑菌浓度(MIC)。采用液体培养基连续稀释法[17-20]测定。即,将无菌发酵上清液分别装入10支试管,再将其逐步稀释后再按照试菌∶菌液=3∶1在试管中分别加入金黄色葡萄球菌,至金黄色葡萄球菌菌液终浓度为1.0×106cfu/mL,并设置未加入发酵上清液的同浓度受试菌液为空白对照,摇匀放置于37℃恒温培养箱12h。用紫外分光光度计于600nm处测定初始OD值和发酵后OD值,制作抑菌曲线,抑菌率达99%的抑菌浓度为发酵液对金黄色葡萄球菌的最低抑菌浓度。DFG菌株发酵液浓度用平板计数法测定。
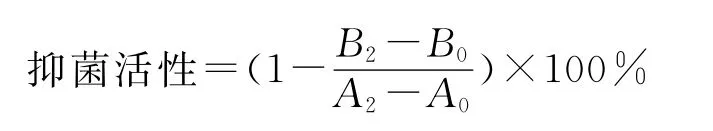
式中,A为对照组OD600,A0为0h数据,A2为12h数据;B为添加发酵上清液处理组OD600,B0为0h数据,B2为12h数据。
1.2.7温度、pH、蛋白酶、紫外线及反复冻融等因素对无菌发酵液抑菌活性稳定性的影响 参照文献[21]的方法进行测定。
1)温度。试验设4个处理。取4支1.5mL离心管分别装入无菌发酵液1mL,然后分别放入50℃(T1)、80℃(T2)和100℃(T3)的水浴锅中处理30min,121℃(T4)高压处理30min。
2)蛋白酶。试验设3个处理。取3支1.5mL离心管分别装入无菌发酵液1mL,然后分别加入1mg/mL的胃蛋白酶(D1)、胰蛋白酶(D2)及蛋白酶K(D3)1μL,37℃水浴1h。
3)酸碱。取6支1.5mL离心管分别装入无菌发酵液1mL,用1mol/mL盐酸和1mol/mL氢氧化钠溶液调节其pH至2、4、6、8、10和12,混匀静置,反应30min后调回中性。
4)紫外照射。取2支1.5mL离心管分别装入无菌发酵上清液1mL,用20W紫外灯距离80cm照射2h。
5)反复冻融。取2支1.5mL离心管分别装入无菌发酵上清液1mL,于-20℃冰箱和室温反复冻融10次,每次冻融5min。
6)保存条件。取8支1.5mL离心管分别装入无菌发酵上清液1mL,-20℃和-4℃冰箱各放4支,分别保存5d、10d、30d和50d后取出室温解冻。
取处理后的无菌发酵上清液用琼脂打孔法测定抑菌活性,以空白处理的作对照。将处理与空白处理后上清液抑菌圈直径作百分比,以观察温度、pH、蛋白酶、紫外线及反复冻融、保存条件等因素对无菌发酵液抑菌活性的影响。
1.2.8有机溶剂萃取物制备及其抑菌活性 参照文献[22]的方法,分别取6mL无菌发酵上清液加入4支50mL试管,标记,按照等体积分别加入有机试剂乙醚、异丁醇、乙酸乙酯、氯仿,混匀振荡15min,室温静置20min后再振荡15min,4℃冰箱静置过夜24h分层,次日分离有机相和水相,用0.22μm过滤器过滤,并测定分离后有机相和水相抑菌效果。设置相应有机试剂即乙醚、异丁醇、乙酸乙酯、氯仿处理为空白对照。
1.3数据统计与分析
用SPSS 20软件进行数据的分析、作图。
2结果与分析
2.1短短芽孢杆菌DFG菌株的生长曲线
从图1可知,短短芽孢杆菌DFG菌株培养0~4h为延迟期,4~20h为对数生长期,OD值≤1.15;20h之后进入稳定生长期,OD值为1.18~1.26。菌株在对数生长期内,生长迅速,生命力强,代谢旺盛,适合做种子液。所以,选择培养时间为20h的菌液做种子液。
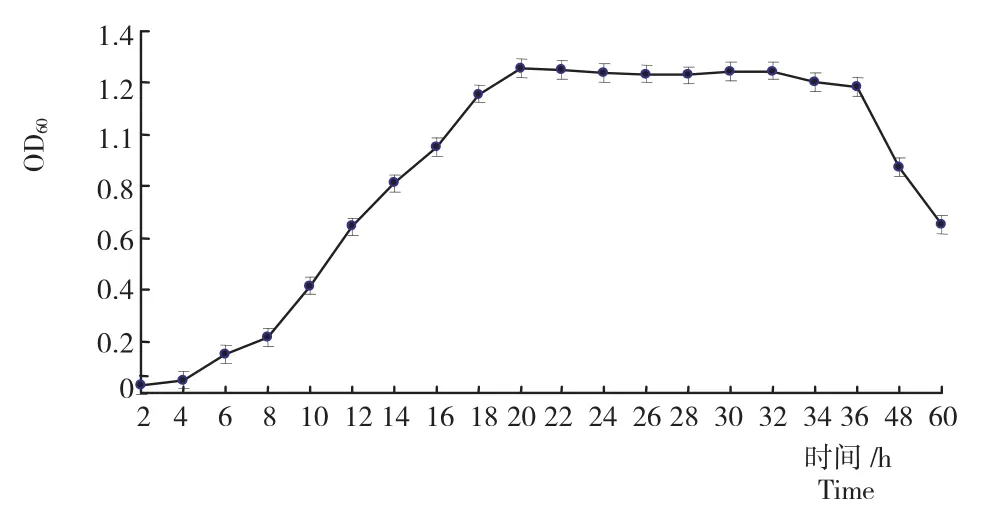
图1 短短芽孢杆菌DFG菌株的生长曲线Fig.1 Growth curve of B.brevis DFG strain in beef extract liquid medium
2.2不同发酵培养基短短芽孢杆菌DFG菌株的抑菌活性
由图2可知,P1发酵液的抑菌活性最强,抑菌圈直径为1.97cm;其次是P2和P3,抑菌圈直径分别为1.48cm和1.33cm,SY强于ZS,二者差异达显著水平;P4发酵液的抑菌活性最低,抑菌圈直径为1.14cm。P1的抑菌活性与P2和P3达显著差异,与P4达极显著差异。所以,确定NA培养基为最佳发酵培养基。
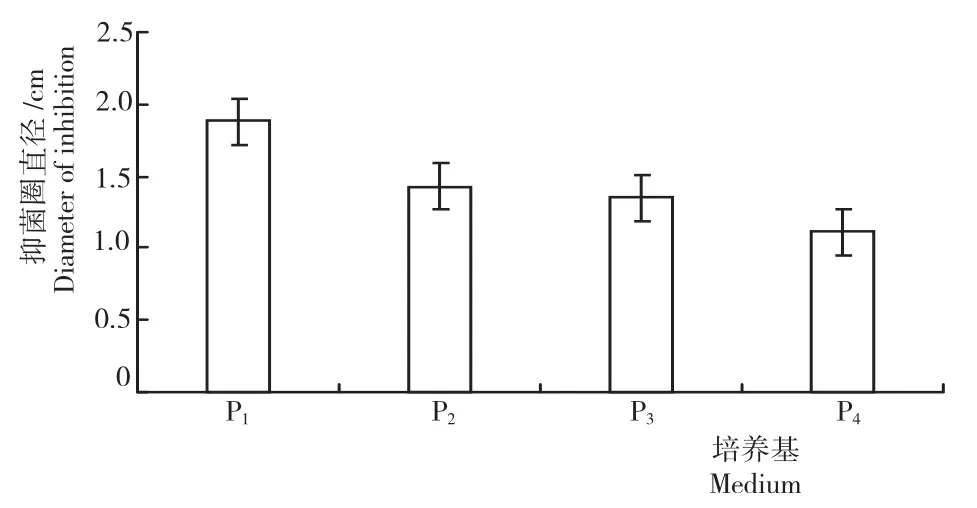
图2 4种发酵培养基短短芽孢杆菌DFG菌株的抑菌活性Fig.2 Bacteriostatic activity of Brevibacillus brevis DFG strain in four fermentation media
2.3不同接种量与发酵时间短短芽孢杆菌DFG菌株的抑菌活性
由图3可知,接种量对DFG菌株发酵液的抑菌活性有影响,以接种量为2%时的抑菌活性最强,抑菌圈直径可达(22±1)mm,接种量>2%或者<2%,DFG菌株发酵液的抑菌效果均下降。不同发酵时间对DFG菌株发酵液的抑菌效果也有影响,其中,24h时最低,之后随培养时间增加抑菌活性呈上升趋势;当发酵时间达36h时其抑菌活性最高;超过36h后,发酵液的抑菌效果呈波动变化,但均低于2%接种量发酵时间36h时的抑菌效果。所以,确定接种量为2%,发酵时间为36h。
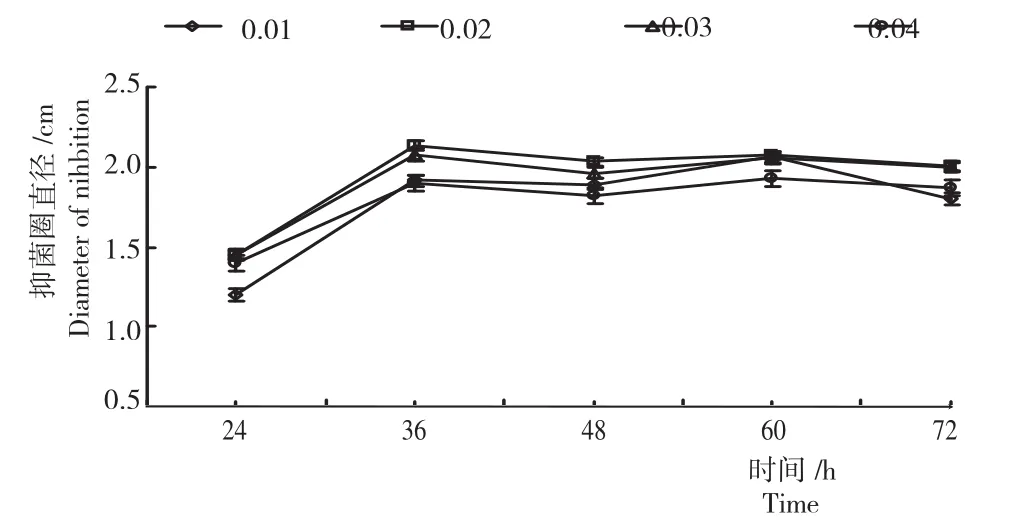
图3 不同接种量与培养时间短短芽孢杆菌DFG菌株的抑菌活性Fig.3 Bacteriostatic activity of Brevibacillus brevis DFG strain under different inoculum size and incubation time
2.4DFG菌株发酵上清液对金黄色葡萄球菌的抑制作用
从图4可知,DFG菌株无菌发酵上清液对金黄色葡萄球菌有明显的抑制作用,其抑菌圈直径达2.4cm,与阳性对照(浓度为0.1mg/mL的72%农用硫酸链霉素)的抑菌圈大小相同(dCK=2.4cm)。
通过平板计数法测得DFG菌株作用最强时菌液浓度为1.46×107cfu/mL。从图5可知,不同稀释浓度无菌发酵液中加入金黄色葡萄球菌液培养12h后,随着稀释菌液的浓度升高,其抑菌率呈上升趋势。其中,当DFG菌株无菌发酵液浓度达5.41×105cfu/mL时,对金黄色葡萄球菌的抑菌率最高,达99%,培养液澄清;当浓度低于5.41×105cfu/mL时其抑菌率低,培养液浑浊。所以,确定无菌发酵液浓度5.41×105cfu/mL为最低抑菌浓度(MIC)。

图4 短短芽孢杆菌DFG菌株无菌发酵液对金黄色葡萄球菌的抑制作用Fig.4 Inhibition effect of B.brevis DFG strain against S.aureus in sterile fermentation broth
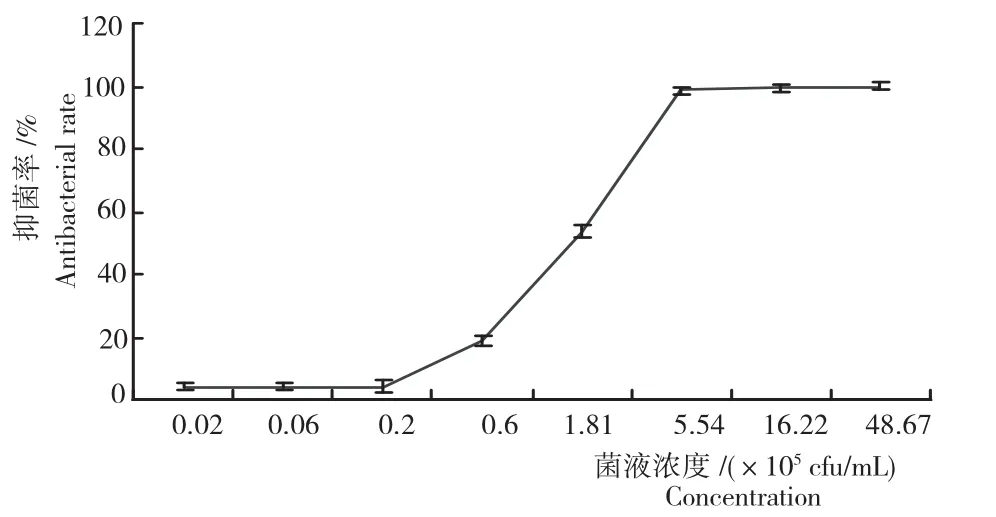
图5 短短芽孢杆菌DFG菌株的抑菌曲线Fig.5 Bacteriostatic curve of B.brevis DFG strain
2.5温度、pH、蛋白酶、紫外线及反复冻融和不同保存条件下短短芽孢杆菌DFG菌株发酵上清液的抑菌稳定性
2.5.1热稳定性 从图6可知,经过30min不同温度热处理的无菌发酵液其抑菌活性存在差异,其活性随温度升高而逐渐降低,50~80℃处理抑菌效果达80%以上。其中,对照的抑菌活性最强,50℃处理的抑菌活性其次,达95.5%;80℃处理的抑菌活性有所下降,为87.33%;100℃处理30min后抑菌活性降至65%,而121℃处理完全丧失抑菌活性。表明,DFG菌株无菌发酵液抑菌活性物质在一定温度范围具有热稳定性,温度过高会使抑菌活性丧失。所以,DFG菌株发酵液对热稳定性较强。
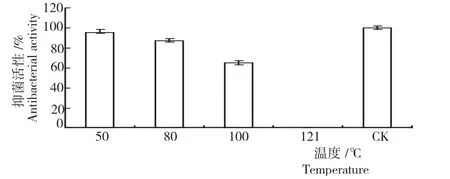
图6 不同温度下短短芽孢杆菌DFG菌株无菌发酵液的热稳定性Fig.6 Heat stability of B.brevis DFG strain in sterile fermentation broth at different temperature
2.5.2酸碱稳定性 从图7可知,DFG菌株无菌发酵上清液在不同pH条件下其抑菌活性没有明显降低,可见,pH 2~12均有抑菌活性,且在80%以上,其中pH 6~8时,抑菌率为100%。说明,DFG菌株发酵液对酸碱具有较强稳定性,在强酸强碱条件下仍有抑菌活性。
图7 不同pH条件下短短芽孢杆菌DFG菌株无菌发酵液的酸碱稳定性Fig.7 pH stability of B.brevis DFG strain in sterile fermentation broth under different pH
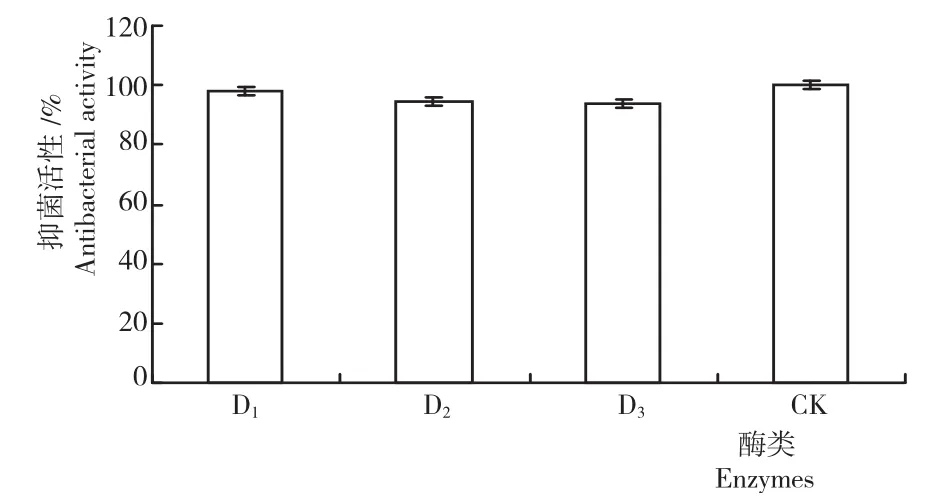
图8 短短芽孢杆菌DFG菌株无菌发酵液的蛋白酶稳定性Fig.8 Protease stability of B.brevis DFG strain in sterile fermentation broth
2.5.3蛋白酶稳定性 从图8可知,DFG菌株发酵液对胃蛋白酶(D1)、胰蛋白酶(D2)和蛋白酶K (D3)不敏感,处理后其抑菌活性均在90%以上,且无显著差异。说明,DFG菌株发酵液对蛋白酶稳定。
2.5.4紫外照射与反复冻融稳定性 从图9可知,DFG菌株发酵液经紫外线照射2h,抑菌活性不受影响,表明DFG菌株发酵液活性对紫外线照射稳定。无菌发酵上清液经反复冻融处理后抑菌圈大小与未处理对照无显著差异,故反复冻融也不影响其抑菌活性。
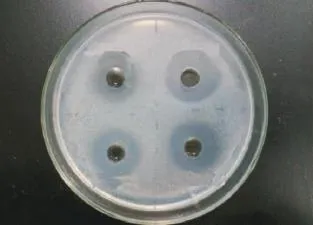
图9 紫外照射与反复冻融下短短芽孢杆菌DFG菌株无菌发酵液的抑菌稳定性Fig.9 Bacteriostatic stability of B.brevis DFG strain in sterile fermentation broth under ultraviolet irradiation and repeating freeze thawing
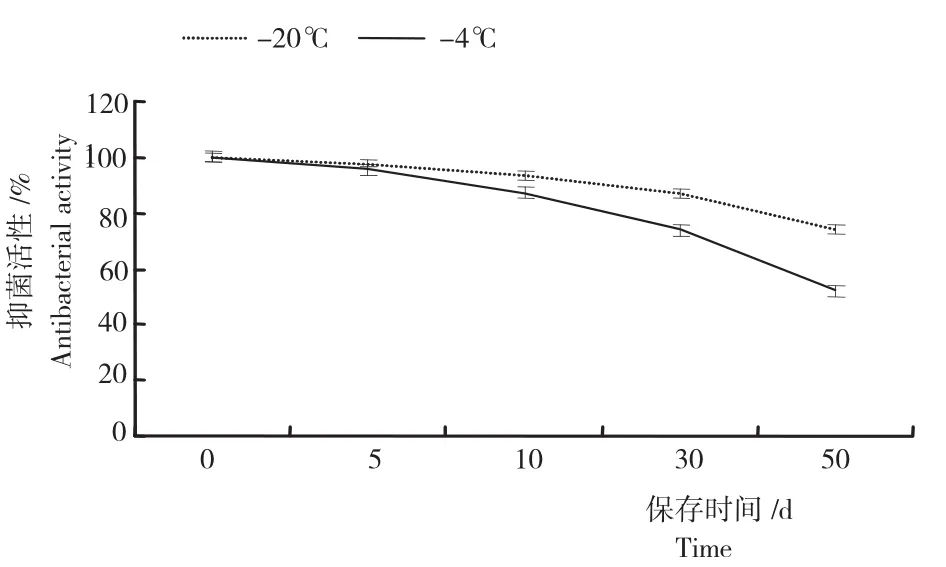
图10 不同保存条件下菌株DFG发酵液的稳定性Fig.10 Stability of B.brevis DFG fermentation broth under different preservation condition
2.5.5不同保存条件稳定性 由图10可知,随着保存时间增加菌株DFG发酵上清液抑菌活性随之降低,-20℃保存后对其抑菌活性的影响较小,在保存至50d时其抑菌活性仍达到74%,-4℃保存其抑菌活性丧失较快,保存50d后抑菌活性为52%,抑菌物质可能发生分解。
2.6有机溶剂萃取物的抑菌活性
从图11可知:1)乙酸乙酯萃取。以未经处理的发酵上清液为对照,有机相没有抑菌作用,水相抑菌效果与对照相比没有差别,乙酸乙酯对金黄色葡萄球菌没有抑制作用,表明抑菌物质不能被乙酸乙酯萃取。
2)乙醚萃取。有机相和水相均有抑菌活性,乙醚对金黄色葡萄球菌没有抑制作用。表明,抑菌物质可以被乙醚部分萃取。
3)异丁醇萃取。水相和有机相均有抑菌活性,异丁醇本身对金黄色葡萄球菌没有抑制作用。表明,短短芽孢杆菌DFG菌株发酵上清液中抑菌物质能被异丁醇部分萃取。
4)氯仿萃取。有机相和水相均有抑菌活性,有机相抑菌圈略大于水相抑菌圈,加入氯仿的孔可见微小抑菌圈,并且菌体生长缓慢;氯仿本身对金黄色葡萄球菌有一定抑制作用。表明,短短芽孢杆菌DFG菌株发酵液中抑菌物质能被氯仿部分萃取。
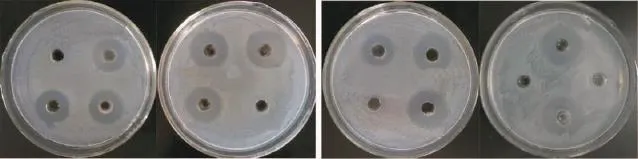
图11 有机溶剂对短短芽孢杆菌DFG菌株发酵液的萃取效果Fig.11 Extract effect of organic solvent on fermentation broth of B.brevis DFG strain
3结论与讨论
短短芽孢杆菌DFG菌株发酵液对金黄色葡萄球菌有较为稳定的抑制作用,发酵液抑菌活性物质在强酸强碱条件均有明显抑菌效果,说明其具有抗酸碱性;粗提液经过高温(100℃)处理仍具有部分抑菌作用,反复冻融和紫外线对其抑菌作用均无明显影响;通过不同蛋白酶处理其抑菌物质活性不改变,说明对蛋白酶也具有较强的稳定性;在-20℃储存50d仍具有较高的抑菌活性。
无菌发酵上清液用乙醚、乙酸乙酯、异丁醇及氯仿萃取后其水相部分均有抑菌活性。说明,DFG菌株产生的抑菌物质具有水溶性,能透过0.22μm滤过膜,且有机溶剂不能使其失活;部分抑菌物质能被乙醚、异丁醇及氯仿萃取,推测抑菌物质可能是小分子物质,如小肽类。这为下一步分离纯化选择分离条件提供了参考,也为今后深入研究抑菌活性物质和开发利用提供奠定了基础。
该研究初步探讨了短短芽孢杆菌DFG菌株发酵液对金黄色葡萄球菌的抑菌活性,后续试验将对其具体抑菌作用物质进一步分离和纯化,并深入研究其作用机理,以发掘该菌在医药上的潜在应用价值。
[1]陈菲菲,狄红霞,蓝乐夫.金黄色葡萄球菌重要毒力因子的功能及其抑制剂研究进展[J].科学通报,2013 (36):3743-3752.
[2]徐 艳,杨 怀,杨锦玲,等.医院感染金黄色葡萄球菌的临床分布与耐药性分析[J].中华医院感染学杂志,2010,20(12):1803-1805.
[3]马筱玲.金黄色葡萄球菌耐药性、耐药机制与分子流行病学研究[D].合肥:安徽医科大学,2009.
[4]李晓芳,范昕建,过孝静,等.金黄色葡萄球菌耐药机制的研究[J].四川大学学报(医学版),2006,37(3):365-368.
[5]王丽春,李大江,熊中华,等.金黄色葡萄球菌医院感染的临床及耐药性分析[J].中华医院感染学杂志,2008,18(10):1485-1488.
[6]SKOV R,CHRISTIANSEN K,DANCER S J,et al.Update on the prevention and control of communityacquired meticillin-resistant Staphylococcus aureus (CA-MRSA)[J].International Journal of Antimicrobial Agents,2012,39(3):193-200.
[7]袁文常.金黄色葡萄球菌适应性耐药及MRSA耐药调控机制的研究[D].重庆:第三军医大学,2013.
[8]李 盛,顾真荣.短短芽抱杆菌(Brevibacillus brevis No.G1)几丁质酶的提纯和分离鉴定[J].生物化学与生物物理学报,2002,34(2):690-696.
[9]薛东红.短短芽孢杆菌XDH的鉴定及其抗菌物质的分离、纯化与部分性质研究[D].济南:山东农业大学,2006.
[10]SONG Z,LIU QX,GUO H,et al.Tostadin,a novel antibacterial peptide from an antagonistic microorganismBrevibacillus brevis XDH[J].Bioresour Technol,2012,111:504-506.
[11]马桂美,车建美,刘 波,等.短短芽孢杆菌功能基因的研究及其应用[J].生物技术进展,2012,2(2):92-97.
[12]KITTELBERGERL R,PAVELA-VRANCIC M,V ON D H.Active site titration of gramicidin S synthetase 2:evidence for misaction and editing in non-ribosomal peptide biosynthesis[J].FEBS Letters,1999,461(3):145-148.
[13]易有金.烟草内生细菌及其对烟草青枯病的防治作用研究[D].长沙:湖南农业大学,2007,37(3):301-306.
[14]张庆华.抗菌肽P3类似物JH3的筛选及抗菌作用研究[D].新乡:河南科技学院,2015.
[15]石建龙,李玉权,胡琨敏,等.贵州半夏块茎腐烂病病原菌的分离与鉴定[J].微生物学通报,2014,42(2):289-299.
[16]TOMONORI Nakai,DAISUKE Yamauchi,KOU Kub ota.Enhancement of Linear Gramicidin Expression from Bacillus brevis ATCC 8185by Casein Peptide [J].Bioscience Biotechnology &Biochemistry,2005,69(4):700-704.
[17]江 滟,王 和.微生物学实验教程[M].北京:科学出版社,2011.
[18]张明霞.分支杆菌MIC测定中需要注意哪些问题[J].中华检验医学杂志,2005,28(8):794-796.
[19]李春美,邓 明,谢笔钧.柚皮提取物对金黄色葡萄球菌抑制作用的初步研究[J].食品工业科技,2004,25 (5):64-66.
[20]胡 静,赵小慧,朱春玉,等.槐糖脂对金黄色葡萄球菌的抑菌机理[J].食品科学,2012,33(5):33-36.
[21]彭虹旎.短小芽孢杆菌(Bacillus pumilus 4D-14)的分离与分子鉴定、抑菌性及微生态制剂应用研究[D].青岛:中国海洋大学,2013.
[22]郝晓娟,刘 波,葛慈斌.短短芽孢杆菌JK-2菌株抑茵活性物质产生条件的优化[J].河北农业科学,2009,13(6):46-49.
[23]卢 行.短短芽孢杆菌X23外泌抗菌肽edeineB的纯化和鉴定[D].郑州:河南农业大学,2014.
[24]GHADBANE M,DAOUD H,ATEF I L,et al.Purification and biochemical characterization of a highly thermostable bacteriocin isolated from Brevibacillus brevis strain GM100[J].Biosci Biotechnol Biochem,2013,77(1):151-160.
(责任编辑:王 海)
畜牧·兽医·水产
Animal Husbandry·Veterinary·Fishery
Antibacterial Effect of Brevibacillus brevis DFG Strain Against Staphylococcus aureus
LIU Hongmei,HU Yue,LI Yuquan,TAO Xiaomai,REN Jianguo*
(Teaching and Research Section of Biotechnology,Guizhou Medical University,Guiyang,Guizhou550025,China)
The effect of different medium,inoculum size and fermentation time on the bacteriostatic activity of B.brevis DFG strain fermentation broth was studied by different chemical treatment and agar punch method and the effect of temperature,protease,pH value,ultraviolet irradiation and repeating freeze thawing on the bacteriostatic stability of B.brevis DFG strain fermentation broth to provide a reference for development and application of B.brevis DFG strain.Results:The fermentation broth of DFG strain cultured in NA medium has the maximum inhibition effect against S.aureus and its bacteriostatic diameter reaches 2.4cm.The bacteriostatic rate of the fermentation broth treated for 30min at 100℃still is up to 65%.The fermentation broth is of strong stability under different pH value.The quality of the fermentation broth after ultraviolet irradiation and repeating freeze thawing is stability.The bacteriostatic substance of B.brevis DFG strain can be partially extracted with organic solvents because B.brevis DFG strain is no sensitive to pepsin,trypsin and protease K.
Brevibacillus brevis;Staphylococcus aureus;fermentation broth;antimicrobial active substance;antibacterial characteristics
S182
A
1001-3601(2016)11-0472-0098-06
2016-04-18;2016-10-13修回
贵州省中药现代化项目“贵州半夏块茎腐烂病防治体系关键技术研究与应用示范”[黔科合成字(2013)5014];贵州省科技厅联合基金项目“防治半夏块茎腐烂病微生物有机肥研制与效应”[黔科合LH字(2014)7094]
刘红美(1975-),女,副教授,从事药用植物生物技术及病害防治研究。E-mail:hmliu@gmc.edu.cn
*通讯作者:任建国(1973-),男,副教授,从事应用微生物研究。E-mail:jianguoren2002@126.com

