SPIO标记BMSCs移植治疗局灶性脑梗死的MRI示踪研究
黄晓蕾,周国兴,王博成,吴金亮,薛杨,蔡伶伶,邢进,宗根林,詹青,赵江民*
SPIO标记BMSCs移植治疗局灶性脑梗死的MRI示踪研究
黄晓蕾1,周国兴2,王博成1,吴金亮1,薛杨1,蔡伶伶1,邢进1,宗根林2,詹青3*,赵江民1*

目的 通过采用磁共振技术示踪在体超顺磁性氧化铁(super paramagnetic iron oxide, SPIO)标记骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs),观察SPIO标记的BMSCs在局灶性脑梗死模型中的迁移及治疗情况。材料与方法 28只雄性SD大鼠随机分为正常对照组(CON, n=4)、假手术组(SHAM, n=4)、局灶性脑梗死对照组(MCAO+SPIO,n=10)和SPIO标记BMSCs治疗组(MCAO+SPIO-BMSC, n=10)。通过普鲁士蓝染色法及CCK8法选取SPIO标记BMSCs的最佳浓度,并使用立体定向注射方法进行最佳浓度SPIO及SPIOBMSC的移植,术后第1、9、20、30、43天行1.5 T MRI扫描,检测两者在局灶性脑梗死中的生物学行为,普鲁士蓝染色观察细胞迁移分布情况。结果 当SPIO标记浓度为50 μg/m l时,BMSCs普鲁士蓝染色效率为100%,CCK8检测增殖活性较对照组及75 μg/m l组均有明显差异(P<0.05)。使用T2WI和SWI序列均能明确检测到MCAO+SPIO组和MCAO+SPIO-BMSC 组中移植区域信号减低。与T2WI序列相比,SW I序列显示低信号范围更广,示踪时间更长。与MCAO+SPIO组比较,MCAO+SPIO-BMSC 组可见SPIO标记的BMSCs向缺血梗死区迁移。普鲁士蓝染色检查发现:普鲁士蓝染色阳性的细胞聚集在梗死区域周围。结论 MRI技术能够有效示踪50 μg/m l SPIO标记的BMSCs,显示BMSCs在局灶性脑梗死模型中随时间变化发生的生物学行为,并对BMSCs在局灶性脑梗死中的迁移治疗情况进行动态观测。
超顺磁性氧化铁;骨髓间充质干细胞;脑梗死;磁共振成像
Received 4 Jan 2016, Accepted 11 Mar 2016
ACKNOW LEDGMENTSThis work was part of key projects of Shanghai Municipal Science and technology innovation action plan (No. 10411953400); Project of Medicine School of Shanghai Jiaotong University (No. 12XJ30061); Project of Shanghai health and Fam ily Planning Commission (No. 20124194); Scientific research project of Science and Technology Comm ittee of Baoshan District Shanghai (No. 14-E-4).
缺血性脑梗死是一种常见的血管性疾病,占全部脑血管病的70%。脑细胞对缺血缺氧状态非常敏感,因此血流中断30分钟以上神经细胞即会出现不可逆损伤。且脑缺血时间越长,血管再通后的再灌注损伤越重。加之成熟神经元不可再生,容易导致永久性的神经功能缺陷。因此,尽管有不断完善的早期诊断方法及溶栓技术,但缺血性脑卒中的致死致残率一直较高[1]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)能向损伤部位定向迁移,分泌多种神经营养因子调控梗死区微环境稳定,进而促进神经功能恢复。且不涉及伦理问题,是细胞替代治疗的理想种子[2-3]。但BMSCs在缺血性脑梗死病灶中的生物学行为有待活体监测。MRI是一种常用的无创影像检查方法,能够为实验性干细胞移植后的生物学行为提供非侵入性的活体动态监测。还可对同一研究对象进行纵向研究,可视化监测病理生理过程[4]。笔者通过观察MRI示踪超顺磁性氧化铁(super param agnetic iron oxide, SPIO)标记BMSCs在局灶性脑梗死模型中的迁移情况,比照缺血梗死病灶不同时间段的影像学进展情况,评估MRI技术示踪SPIO标记BMSCs的可行性,进而评估干细胞在局灶性脑梗死模型中的迁移治疗情况。
1 材料与方法
1.1 实验动物、主要仪器与试剂
选取体质量(80±20) g雄性清洁级SD大鼠6只,体质量(280±20) g雄性清洁级SD大鼠28只,由解放军第二军医大学实验动物中心提供。动物生产许可证号:2008001646859,使用许可证号:SCXK(沪)2013-0016。
DMEM/F12培养基(Gibco公司,美国),胎牛血清(Gibco公司,美国),细胞培养瓶(Corning,美国),CCK-8试剂盒(上海复申生物),普鲁士蓝染料(上海复申生物),微量注射器(Ham ilton,瑞士),大鼠专用5 cm四通道线圈(上海辰光公司),1.5 T MRI(GE,美国)。
1.2 实验方法
1.2.1 BMSC的分离与培养
取SD大鼠(80±20) g脱颈处死,置于碘伏中浸泡20 m in。用无菌手术剪刀分离取出股骨、胫骨及肱骨,置于酒精中浸泡10 m in,PBS缓冲液中洗2遍。取无菌手术剪暴露长骨骨髓腔,用10 m l无菌注射器吸取含体积分数15% FBS的DMEM/F12培养液反复冲洗骨髓腔,以2×108个/m l的细胞密度接种于10 cm培养皿中,放置于5% CO2、37℃恒温箱中培养。接种后8 h首次换液,以后隔天换液1次。7 d后待细胞生长至80%~90%融合状态时,用0.25%胰蛋白酶-EDTA消化,传代。实验选用3~5代细胞。
1.2.2 SPIO标记BMSCs的生物学特性检测
普鲁士蓝检测标记效率:取四代BMSCs计数后接种于6孔板中,每孔约5000个细胞。使用含15%FBS的DMEM/F-12培养液,除一孔为正常对照外,其余均加入0.75 μg/m l多聚赖氨酸,SPIO浓度分别调整至25 μg/m l、50 μg/m l、75 μg/m l。培养24 h待细胞全部贴壁后,PBS冲洗三遍,用4%多聚甲醛固定20 m in后行普鲁士蓝染色,在倒置显微镜下观察染色情况并计数阳性细胞。计3个低倍镜视野内200个细胞中的阳性细胞,计算标记效率(阳性细胞比率=阳性细胞数÷细胞总数×100%)。
CCK8方法检测细胞增殖活性:将标记三种不同浓度SPIO的BMSCs及正常对照细胞接种于96孔板中,每孔约1×104个细胞。培养24 h待细胞全部贴壁后,加入正常培养液置于细胞培养箱中孵育48 h。加入CCK8液后用酶联免疫检测仪测定各孔的OD值。
1.2.3 分组与给药方法
实验分组:28只大鼠根据随机数字表法,分为正常对照组(CON,n=4)、假手术组(SHAM,n=4)、局灶性脑梗死对照组(MCAO+SPIO,n=10)和SPIO标记BMSCs治疗组(MCAO+SPIO-BMSC,n=10)。局灶性脑梗模型的制作采用右侧大脑中动脉线栓法。重(280±20) g(n=20)大鼠行腹腔麻醉(10%水合氯醛,0.3 m l/100g),备皮、消毒。暴露颈前鼠毛,钝性分离皮下组织,分离右侧动脉鞘,结扎颈总动脉、颈外动脉,眼科剪剪口,置入肝素化鱼线(直径2.4 mm),鱼线深度1.8~2.0 cm至大脑中动脉分叉处。栓塞术后2 h拔除线栓,制备大鼠局灶性脑梗死模型。假手术组仅结扎颈总动脉、颈外动脉。在大脑中动脉栓塞术后第3天,正常对照组及假手术组不做处理,MCAO+SPIO组大鼠通过立体定向注射方法注射6 μl浓度为50 μg/m l SPIO,MCAO+SPIO-BMSC 组取5.0×105个SPIO标记BMSCs于EP管中,用50 μl PBS混匀,共注射6 μl细胞悬液。立体定向注射的进针位置位于海马区(前囟后3.5 mm,中线右旁2.5 mm,距颅骨表面3.0 mm),注射速率为0.02 μl/m in。注射完成后,针头留置10 m in,以避免注射液从针头周围漏出。
1.2.4 SPIO标记BMSC的在体MRI扫描
大脑中动脉栓塞术后第3天,行MRI检查明确模型有无梗死及梗死范围。于大鼠脑立体定向注射术后第1、9、20、30、43天,分别对MCAO+SPIO组及MCAO+SPIO-BMSC组行1.5 T MRI(GE公司)扫描,所用线圈为上海辰光公司5 cm四通道大鼠专用线圈。扫描MRI序列包括T2W I、弥散加权成像(diffusion weighted imaging, DW I)、磁敏感加权成像(suscep tibility weighted im aging, SW I)。大鼠采取尾先进,俯卧位,头颅中心点与线圈中心点重合。MRI扫描序列及参数如下:(1)T2W I采用快速自旋回波FSE序列,TR/TE=2050/80 ms,NEX= 4,FOV 10 mm,层厚2.0 mm。(2)SW I采用SWAN序列,TR/TE=87.2/44.3 ms,NEX=1,Flip angle 15°,层厚1.0 mm。(3)DW I采用DW-EPI序列,TR/TE=3200/85.9 ms,b值为0和800 s/mm2,NEX=4,层厚2.0 mm。
1.2.5 大鼠脑切片的普鲁士蓝染色
在MRI检测43天结束后,将大鼠脑组织放入10%的甲醛溶液中固定,距额极2.5 mm处向后切取2.5 mm脑组织,常规脱水、透明、石蜡包埋、切片(厚约4 μm)、干燥,普鲁士蓝染色,光学显微镜下观察梗死区周围染色情况。
1.2.6 统计学方法
采用G raphpad p rism 5 软件进行分析与作图,两组间比较采用t检验,以P<0.05表示差别有统计学意义。
2 结果
2.1 普鲁士蓝染色标记效率及细胞增殖活性检测
光学显微镜下,正常对照组未见明显阳性染色结果(图1A),SPIO标记组均可见细胞胞浆内被染成蓝黑色的铁颗粒,散在分布于细胞核周围(图1B~D)。对不同浓度SPIO的标记情况进行比较后发现,BMSCs内铁含量随SPIO孵育浓度的增加而增加,50 μg/m l和75 μg/m l两组的SPIO标记率可达100%。25 μg/m l组有少量细胞未被染色,标记效率为80%。CCK 8法结果显示,25 μg/m l组、50 μg/m l组与对照组相比,细胞增殖受到一定抑制(P<0.05),75 μg/m l组与对照组相比,细胞增殖受到明显抑制(P<0.05),见图2。
综合普鲁士蓝染色和CCK8实验结果,50 μg/m l浓度的SPIO能够有效标记BM SCs,且对BMSCs增殖活性影响较小,可用于标记BMSCs进行MRI在体示踪的研究。
2.2 局灶性脑梗死模型制备及其MRI表现
使用1.5 T M RI于大脑中动脉栓塞术后第3天,对正常对照组、假手术组及手术组行MRI检查,结果发现正常对照组与假手术组在DW I、SW I及T2W I上无明显异常信号(图3A)。而手术组第3天在DW I及T2W I上可见右侧大脑半球斑片状高信号,SWI序列未见明显高信号(白色箭头所指),提示大鼠发生急性脑梗死,梗死范围主要为大脑皮质和纹状体区脑组织。10天后再次行MRI检查发现梗死灶DWI及T2W I高信号更加明显,提示脑组织液化坏死。
2.3 局灶性脑梗死局部脑注射SPIO的MRI表现
MCAO+SPIO组于第1、9、20、30天行MRI扫描,结果发现术后第1天MCAO+SPIO组移植部位在T2W I及SWAN上均有明显低信号改变。随着时间推移,低信号范围未见明显扩大且低信号强度逐渐减低,说明SPIO仍停留在注入部位,未发生明显迁移。大鼠右侧梗死脑皮质边缘T2W I信号随时间逐步增高,与MCAO 10天后的梗死面积及信号强度变化大致相仿,提示SPIO对脑梗死预后无明显影响(图3B)。
2.4 局灶性脑梗死局部脑注射SPIO-BMSC的MRI表现
大鼠脑立体定向注射术后第1、9、20、30、43天行MRI扫描,MCAO+SPIO-BMSC组在T2W I和SWAN序列上均能清楚检测到移植侧SPIO标记的BMSCs,移植细胞在两个序列的图像上表现为右侧海马区明显的信号减低,且SW I较T2W I显示范围更广(图3C)。MCAO+SPIO-BMSC组9天后行MRI发现低信号区以移植部位为基础沿周围神经纤维束向右侧脑皮质及纹状体区梗死灶迁移,影像学上表现为右侧脑梗死灶边缘斑片状低信号(图3B),提示BMSCs在脑组织内发生了向损伤区域的定向迁徙与扩散。与MCAO+SPIO组相比,右侧梗死脑皮质边缘T2WI、DW I脑梗死高信号范围及强度随时间逐渐减弱,说明局灶性脑梗死程度在影像学上有所改善。
2.5 大鼠脑切片的普鲁士蓝染色结果
脑立体定向注射移植术后43天,取梗死灶周围脑组织切片行普鲁士蓝染色,每张切片选取局灶性脑梗死区域内5个不连续视野进行显微镜下观察,移植侧普鲁士蓝染色可见阳性染色细胞分布于局灶性梗死区域周围,提示部分SPIO存留于BMSCs内(图4)。
3 讨论
本研究的主要目的在于通过采用MRI技术示踪在体SPIO标记BM SC s,观察SPIO标记的BMSCs在局灶性脑梗死模型中的迁移及治疗情况。本实验中,笔者采用脑内立体定向注射方法将50 μg/m l SPIO标记的BMSCs移植到右侧脑梗死大鼠海马区,利用BMSCs能向炎性病灶趋化及SPIO能够缩短T2信号的特性,研究MRI示踪活体实验性干细胞移植后的迁移及行为学的可行性。
骨髓间充质干细胞的治疗机制主要包括:移植细胞向损伤部位定向迁移并分化成神经元,在损伤部位促进血管生成,抗胶质细胞增生,抗细胞凋亡等。BM SCs能够分泌多种神经营养因子,如脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)等促进侧脑室周围神经干细胞向损伤部位的迁移分化,即促进内源性神经修复[1, 5-7]。这些均能明显改善缺血性脑梗死大鼠的神经损伤情况。
大脑中动脉闭塞导致的脑组织损伤主要集中于大脑皮质及纹状体等[8]。通过MRI示踪SPIOBMSC后发现,BMSCs沿神经纤维束向右侧大脑皮质及纹状体移行,说明大脑皮质及纹状体缺血梗死形成的炎性环境促使移植细胞发生了趋化。脑梗死发生后病灶微环境紊乱,营养成分匮乏,氧自由基较多,这些不利条件使BMSCs在梗死区域难以存活,但功能恢复情况又与损伤区域存活的神经元数量密切相关[9]。通过立体定向注射方法进行BMSCs移植能够避免细胞首过效应,特别是肺组织吞噬的影响,保证移植数量优势。确保移植细胞准确到达脑实质,且移植过程不会破坏血脑屏障完整性,保证内环境稳定性,有效促进梗死区域的血管生成、树突塑形及轴突出芽[10-11]。
SPIO以单晶体氧化铁为基础,具有超顺磁性。能产生较强的T2负性对比效应,很低浓度即可被MR检测到,且易生物降解。超顺磁性氧化铁标记干细胞具有简单易行、无创、可进行个体的持续纵向研究的特点。笔者前期通过全骨髓贴壁法分离培养BMSCs,并对SPIO标记的BMSCs进行了体外MRI表现探究[12]。通过研究发现当对BMSCs进行标记的SPIO浓度为50 μg/m l时,相比于其他浓度,BMSCs的标记效率高且对生长、增殖情况无明显影响,与多数文献报道相符[8, 13-14]。以往报道的关于SPIO示踪BM SCs的时间多为3周以内,超高场强(≥7 T)小动物专用MRI可延长一定时间的示踪时间窗。笔者研究所用1.5 T MRI对SPIOBMSC的活体检测时间长达43 d。本研究中,笔者选用大剂量的BMSCs注射,移植的SPIO-BMSCs数量为6×104个[15],但SPIO在BMSCs内随细胞有丝分裂及外周巨噬细胞的吞噬,浓度不断减低,导致其在T2上的低信号强度随时间逐渐减弱。MRI检测不到SPIO信号后,只能通过病理学检查评估BMSCs的生物学行为。Bon Chul Ha等[16]通过尾静脉注射方法向局灶性脑梗死大鼠中移植2.5×105个SPIO标记的人骨髓间充质干细胞,应用3 T MRI定期检测干细胞迁移情况,结果发现SW I序列较T2W I、T2*W序列能够更敏感、更早期、更长期地检测到SPIO信号。但现有的影像学方案对SPIO的可探测程度仍然有限,导致我们不能对增殖迅速的骨髓间充质干细胞做长期纵向观察研究。目前课题组正在研究使用Fth1(铁蛋白合成基因)转染的BMSCs进行活体移植,以期进行长期示踪研究。
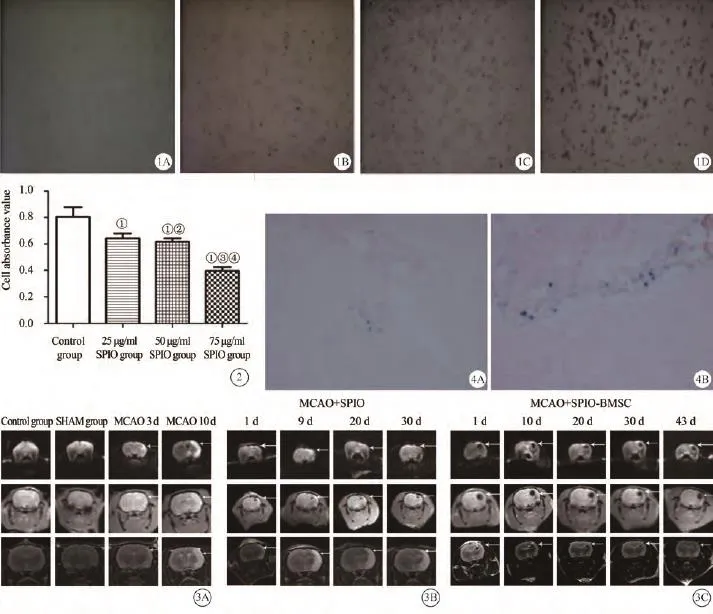
图1 A~D分别为正常对照组、25 μg/m l、50 μg/m l、75 μg/m l 三种不同浓度SPIO标记BMSCs的普鲁士蓝染色情况(40×)图2 CCK8法测定不同浓度SPIO标记BMSCs 增殖活性的统计学分析:与对照组相比,①P<0.05;与25 μg/m l SPIO组相比,②P>0.05;与50 μg/m l SPIO组相比,③P<0.05;与75 μg /m l SPIO组相比,④P<0.05 图3 A:从左至右依次为正常对照组、假手术组及MCAO后3、10天的MRI扫描序列DW I、SW I、T2W I图像;B:MCAO+SPIO组MRI扫描序列DW I、SW I、T2WI图像;C:MCAO+SPIO-BMSC组MRI扫描序列DW I、SWI、T2W I图像图4 大鼠脑组织普鲁士蓝染色观察(100×) (A、B为不同位置局灶性脑梗死灶周围普鲁士蓝分布情况)Fig. 1 Efficiency of Prussian blue staining in different concentrations of BMSCs labled w ith SPIO. Fig. 2 Statistic analysis of CCK8 method in detecting effects of different concentrations of SPIO in proliferative activity of BMSCs. Compared w ith the control group,①P<0.05; Compared w ith the 25 μg/m l SPIO group,②P>0.05; Compared w ith the 50 μg/m l SPIO group,③P<0.05; Compared with the 75 μg/m l SPIO group,④P<0.05. Fig. 3 A: From left to right: MR images (DW I, SW I, T2W I sequences) of CON, SHAM, MCAO groups in day3, day10; B: MR im ages (DW I, SW I, T2W I sequences) of MCAO+SPIO group; C: MR images (DW I, SWI, T2W I sequences) of MCAO+SPIO-BMSC group. Fig. 4 Prussian blue staining observation of rat brain (100×) (A, B for different locations of focal cerebral infarction in the surrounding area of the distribution of the blue)
Ishizaka等[5]选取三个不同的移植时间点(梗死后第1、4、7天)进行局灶性脑梗死模型的干细胞治疗,结果发现第1、4天移植的干细胞能广泛迁移到梗死灶周围,且模型神经功能评分明显改善。而第7天移植的干细胞只有极少数能迁移到梗死区域且神经功能无明显改善。其机制可能与早期行干细胞移植能够明显降低活化小神经胶质细胞的数量,增加反应性星形胶质细胞的表达,下调MMP-9的表达有关。MMP-9与脑缺血损伤后血脑屏障破坏、血管源性水肿及炎性反应呈正相关。因此移植治疗时间窗的选择影响到宿主微环境的稳定性,影响治疗效果。笔者选择在梗死后第3天做移植治疗,影像学评估显示,与MCAO+SPIO组相比,MCAO+SPIO-BMSC组T2W I高信号梗死病灶的范围及强度随时间逐渐减弱,说明BMSCs对局灶性脑梗死具有一定的治 疗作用,这一作用可以通过影像学方法进行评估。脑缺血后血管扩张能够加重损伤区域的炎症,不排除SPIO是通过巨噬细胞的吞噬迁移至脑梗死区域,因为有研究显示铁沉积的区域均分布于血管周围[8]。笔者研究的不足之处在于动物样本量较少,缺乏对SPIO-BMSC治疗缺血性脑梗死病理机制的深入研究。
本实验采用50 μg/m l浓度的 SPIO标记BMSCs,观测到MCAO+SPIO-BMSC组各时间点缺血梗死灶内斑片状T2WI低信号,且MCAO+SPIO-BMSCs组较M CAO+SPIO组各时间点脑梗死病程进展轻,提示BMSCs立体定向移植有助于减缓或改善局灶性脑梗死病情,而磁共振技术可对BMSCs在局灶性脑梗死中的迁移治疗情况进行动态观测,有助于对BMSCs的在体生物学行为进行更深入的认识。但探测SPIO标记的骨髓间充质干细胞的MRI敏感性受多种因素的影响,如MRI方案及软件。笔者的影像学方案可能对某些移植细胞或小的细胞聚集簇不敏感,需要重复实验来进一步证明。
[References]
[1]Jiang W, Liang G, Li X, et al. Intracarotid transplantation of autologous adipose-derived m esenchym al stem cells significantly improves neurological deficits in rats after MCAo. J M ater Sci M ater M ed, 2014, 25(5): 1357-1366.
[2]Shichinohe H, Yamauchi T, Saito H, et al. Bone marrow stromal cell transplantation enhances recovery of motor function after lacunar stroke in rats. Acta Neurobiol Exp (Wars), 2013, 73(3): 354-363.
[3]Lin YC, Ko TL, Shih YH, et al. Human umbilical mesenchymal stem cells promote recovery after ischemic stroke. Stroke, 2011, 42(7): 2045-2053.
[4]Hua P, Wang YY, Liu LB, et al. In vivo magnetic resonance imaging tracking of transp lanted superparamagnetic iron oxidelabeled bone m arrow m esenchymal stem cells in rats w ith myocardial infarction. Mol Med Rep, 2015, 11(1): 113-120.
[5]Ishizaka S, Horie N, Satoh K, et al. Intra-arterial cell transplantation provides timing-dependent cell distribution and functional recovery after stroke. Stroke, 2013, 44(3): 720-726.
[6]Tian F, Yamashita T, Deguchi K, et al. In vivo optical imaging correlates w ith im provement of cerebral ischem ia treated by intravenous bone marrow stromal cells (BMSCs) and edaravone. Neurol Res, 2013, 35(10): 1051-1058.
[7]Jeong CH, Kim SM, Lim JY, et al. M esenchym al stem cells exp ressing brain-derived neurotrophic factor enhance endogenous neurogenesis in an ischemic stroke model. Biomed Res Int, 2014, 2014(1): 129145.
[8]Tarulli E, Chaudhuri JD, Gretka V, et al. Effectiveness of m icron-sized superparamagnetic iron oxide particles as markers for detection o f m igration o f bone m arrow-derived mesenchymal stromal cells in a stroke model. J Magn Reson Imaging, 2013, 37(6): 1409-1418.
[9]Guo L, Ge J, W ang S, et al. A novel method for efficient delivery of stem cells to the ischem ic brain. Stem Cell Res Ther, 2013, 4(5): 116.
[10]Andres RH, Horie N, Slikker W, et al. Human neural stem cells enhance structural plasticity and axonal transport in the ischaem ic brain. Brain, 2011, 134(Pt 6): 1777-1789.
[11]Horie N, Pereira MP, Niizuma K, et al. Transplanted stem cellsecreted vascular endothelial grow th factor effects poststroke recovery,inflammation,and vascular repair. Stem Cells, 2011, 29(2): 274-285.
[12]Zhao JM, Liu J, Lin YB, et al. Biological characteristics and MR imaging features of SPIO labeled BMSCs in vitro. Chin J Magn Reson Imaging, 2014, 5(2): 138-143.
赵江民, 刘佳, 林雁冰, 等. SPIO标记浓度对BMSCs生物学特性的影响及体外MRI表现. 磁共振成像, 2014, 5(2): 138-143.
[13]Chen CQ, W ang XY, Chen C, et al. In vivo MR tracking im aging o f SPIO-labeled adipose-derivedstem cells transplantation in rat models of brain infarction. Chin J Magn Reson Imaging, 2010, 1(1): 50-54.
陈长青, 王小宜, 陈晨, 等. SPIO标记脂肪干细胞移植治疗大鼠脑梗死的磁共振示踪成像研究. 磁共振成像, 2010, 1(1): 50-54.
[14]Shim J, Kwak BK, Jung J, et al. Evaluation of engraftm ent of superparamagnetic iron oxide-labeled mesenchymal stem cells using three-dimensional reconstruction of magnetic resonance imaging in photothrombotic cerebral infarction models of rats. Korean J Radiol, 2015, 16(3): 575-585.
[15]M oisan A, Pannetier N, Grillon E, et al. Intracerebral injection of hum an m esenchym al stem cells im pac ts cereb ral microvasculature after experimental stroke: MRI study. NMR Biomed, 2012, 25(12): 1340-1348.
[16]Ha BC, Jung J, Kwak BK. Susceptibility-weighted imaging for stem cell visualization in a rat phototh rom botic cerebral infarction model. Acta Radiol, 2015, 56(2): 219-227.
MRI tracking study of SPIO labeled bone marrow stromal cells transp lantation for treatment of lacunar stroke
HUANG Xiao-lei1, ZHOU Guo-xing2, WANG Bo-cheng1, WU Jin-liang1, XUE Yang1,
CA I Ling-ling1, XING Jin1, ZONG Gen-lin2, ZHAN Qing3*, ZHAO Jiang-m in1*1The Nine Peop le's Hospital A ffiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 201999, China
2Department of M edical Im aging, Oriental Hospital of Shanghai City, Shanghai 200120, China
3Shanghai Seventh People’s Hospital, Shanghai 200137, China
Objective: To explore the feasibility of MRI technology in tracing bone marrow mesenchymal stem cells labeled w ith SPIO, and observe m igration and therapeutic condition of BMSCs in focal cerebral infarction model. M aterials and M ethods: Investigate label efficiency and proliferation activity of three different concentrations of SPIO (25 μg/m l, 50 μg/m l, 75 μg/m l ) by Prussian blue staining and CCK 8 method. A total of 28 male SD rats w ere random ly divided into normal control group (CON, n=4), sham operation group(SHAM, n=4), focal cerebral infarctiongroup treated w ith SPIO only (MCAO+SPIO, n=10), and focal cerebral infarction treated w ith op tmal SPIO-BMSCs (MCAO+SPIO-BMSC, n=10), MRI scan was underwent on 1 day, 9 days, 20 days, 30 days, 43 days after cell transplantation. Distribution of cell m igration were observed by Prussian blue staining. Resu lts: When label concentration was 50 μg/m l, Prussian blue staining efficiency was 100%. Compared w ith control group and 75 μg/m l group, 50 μg/m l group was significantly different (P<0.05). In MCAO+SPIO and MCAO+SPIO-BMSC groups, transplanted cells on T2W I and SW I sequences obviously showsignal reducing area. Compared with T2W I sequences, SW I sequences show a longer, w ider range of low signal. Compared w ith MCAO+SPIO group, MCAO+SPIO-BMSC group can observe that bone marrow mesenchymal stem cells m igrate into infarction areas. Prussian blue staining showed that positive cells gathered around the infarction area. Conclusion: MRI techniques can effectively trace mesenchymal stem cells labeled with 50 μg /m l SPIO, monitor m igration and therapeutic condition of BMSCs in focal cerebral infarction model, and evaluate the imaging improvement of focal cerebral infarction.
Superparamagnetic iron oxides; Bone marrow mesenchymal stem cells; Stroke; Magnetic resonance imaging
上海市科委科技创新行动计划重点项目(编号:10411953400);上海交通大学医学院项目(编号:12XJ30061);上海市卫生计生委项目(编号:20124194);上海市宝山区科学技术委员会科研项目(编号:14-E-4)
1. 上海交通大学医学院附属第九人民医院,上海 201999
2. 同济大学附属东方医院,上海 200015 3. 上海市第七人民医院,上海 200137
詹青,E-mail: zhanqing@tongji.edu.cn;赵江民,E-mail: johnmzhao@sjtu.edu.cn
2016-01-04接受日期:2016-03-11
R445.2;R743.3
A
10.12015/issn.1674-8034.2016.04.012
黄晓蕾, 周国兴, 王博成, 等. SPIO标记BMSCs移植治疗局灶性脑梗死的MRI示踪研究. 磁共振成像, 2016, 7(4): 303–309.
*Correspondence to: Zhan Q, E-mail: zhanqing@tongji.edu.cn; Zhao JM, E-mail: johnmzhao@sjtu.edu.cn

