会同杉木器官间C、N、P化学计量比的季节动态与异速生长关系
陈 婵,王光军,3,*,赵 月,周国新,李 栎,高吉权
1 中南林业科技大学,长沙 410004 2 南方林业生态应用技术国家工程实验室,长沙 410004 3 湖南会同杉木林国家重点野外科学观测研究站, 会同 418307
会同杉木器官间C、N、P化学计量比的季节动态与异速生长关系
陈 婵1,2,王光军1,2,3,*,赵 月1,2,周国新1,2,李 栎1,2,高吉权1,2
1 中南林业科技大学,长沙 410004 2 南方林业生态应用技术国家工程实验室,长沙 410004 3 湖南会同杉木林国家重点野外科学观测研究站, 会同 418307
生态化学计量特征能够反映植物器官的内稳性及其相互关系。以湖南会同25年生杉木人工林为研究对象,分析了叶、枝、根的C、N、P及其化学计量季节动态,探讨了养分元素的变异性特征、变异来源,以及元素间的异速生长关系。结果表明:C、N、P含量的年平均值均在叶中表现最大,分别为(527.60±15.07)、(10.55±1.89)、(2.13±0.31) g/kg;而C∶N、C∶P、N∶P的年平均值最大的则是根,分别为(78.12±12.54)、(619.46±48.23)、(7.13±3.57);不同器官的年均C∶N∶P排序为根>枝>叶。叶和根的C、N含量及N∶P、叶和枝的P含量变化趋势均为先升高后降低再升高,叶、根的C∶N值则表现为先降低后升高再降低的变化趋势。叶、枝、根的年平均N∶P比(均小于14)远低于我国年平均水平(16.3);不同器官的C含量变异系数较小,均低于9%,N、P含量及其化学计量比变异系数较大,均高于30%,其中枝叶的P含量和枝的N∶P变异系数分别高达65.04%和62.41%;根据变异来源分析,器官、月份和器官与月份的交互作用对C、N、P含量及其化学计量变异的影响均达到显著水平(P<0.05)。叶、根的C与N具有显著的异速生长关系(N-C2.777,P=0.008;N-P2.574,P=0.002),叶、枝、根的N、P含量表现出正相关性,异速生长指数分别为0.539、0.617、0.721。研究表明25年生杉木的生长更多的受到N元素的限制,养分利用效率在根中最高;叶、枝、根C-P的异速生长关系证明不同器官对于各自的养分分配是具有相似性的。
杉木;植物器官;生态化学计量特征;变异系数;异速生长关系
C、N、P是植物生长所需的最基本营养元素[1],其生态化学计量特征能够反映植物器官的内稳性及相互关系[2],同时,计量比对反映生长速率的快慢、养分利用效率的高低、限制性元素的判断具有重要的意义[3- 4]。Fan等[5]研究了亚热带地区桉树人工林的碳氮磷化学计量特征,证明化学计量特征通过养分限制对森林的特性和功能进行调控。Yao等[6]研究中总结并比较了中国针叶树种、落叶树种和常绿树种枝干的C、N、P及化学计量特征,为更深入理解森林的生物地球化学循环提供了理论支撑。赵亚芳等[7]的研究表明,华北落叶松细根的生态化学计量特征在不同的季节下相对稳定,对生态系统中养分动态的分析具有重要的作用。李征等[8]比较了不同时期盐地碱蓬叶片C、N、P营养元素的化学计量特征,研究表明其养分含量随着生长过程呈现出差异性。物种对元素的吸收、运输、分配和利用过程可以通过异速生长关系来反映。一些研究表明,植物体内C、N、P含量之间的异速生长关系表现出显著相关性,N随C呈等速增长,P随C呈3/4幂指数增长[9- 11]。目前,对于森林生态系统的研究主要集中于森林群落、种群、单一植被器官的C、N、P及其生态化学计量特征[12- 14],关于植被个体不同器官养分元素间的相互作用和分配差异尚不清楚,各器官适应环境的机制对植被的养分循环是否存在影响也仍未确认。
杉木(Cunninghamialanceolata)是南方地区最重要的速生用材树种,具有生长快、再生力强、经济价值高、栽培地区广等优点,其木材优良、用途广,在林业生产上占据了重要的地位。本研究调查了25年生杉木不同器官的C、N、P含量及其生态化学计量的季节动态特征,分析杉木器官养分元素在不同影响因子下的变异性特征、变异来源以及异速生长关系,揭示了杉木不同器官养分元素间的相关关系和分配规律,对杉木生态系统养分循环的调控机理的深层理解有重要意义,有利于从养分分配的角度剖析杉木对环境的适应策略,同时,25年生杉木已属于成熟林,足以为深入理解杉木的生物能量过程和代谢理论提供数据支撑。本研究旨在为有效提高杉木人工林的经营培育和管理提供理论支撑。
1 材料与方法
1.1 研究区概况
试验地选取在湖南会同杉木林国家重点野外科学观测研究站Ⅲ号集水区,地理位置为109°45′E,26°50′N,海拔300—500 m,年均降雨量1100—1400 mm,属亚热带湿润气候区,年平均气温16.8℃,地带性植被属中亚热带常绿阔叶林。该地区处于云贵高原向长江中下游平原过渡的中山丘陵地段,其森林资源对长江中下游的生态环境保护有着重要的作用。Ⅲ号集水区是1987年炼山整地后种植的杉木纯林,林内灌草植物主要有油桐(Verniciafordii)、冬青(Ilexpurpurea)、杜茎山(Maesajaponica)、菝葜(Smilaxchina)、铁笀箕(Dicranopterislinearis)、华南毛蕨(Cyclosorusparasiticus)、狗脊蕨(Woodwardiajaponica)等。杉木林分的基本情况及其土壤理化性质分别见表1和表2。

表1 样地林分特征

表2 样地土壤理化性质
1.2 实验设计与样品采集
在Ⅲ号集水区由上往下共设置9块20 m×20 m的固定样方。野外采样于2014年1月、4月、7月、10月进行,按照品字布点采集杉木的根、枝和叶的样品,每块样方随机选取3株杉木:(1)在选取的每株杉木最低枝干上采集两年生部分,将叶片和枝干分离后分别装袋;采集所选杉木的细根(直径≤2 mm,杉木的根去掉表皮为紫红色),清理土壤和杂质后分别装入布袋后带回实验室;(2)用烘箱烘干至恒重,烘干后用粉碎机粉碎过筛,用于C、N、P含量测定。
1.3 测定方法与数据分析
1.3.1 测定方法
分别用测高仪(LD6172)、围尺、ProCheck手持式多功能读表以及环刀取样法测定样地内的树高、胸径、土壤温度和湿度以及土壤容重(0—15,15—30,30—45 cm)。土壤pH值用pH分析仪测定。每块固定样方内以S型均匀设置1 m×1 m的3块正方形凋落物收集网,每月月底收集收集器上的凋落物带回实验室进行称重,便于计算凋落物量。植物器官的有机碳采用重铬酸钾外加热法测定,全氮采用凯氏定氮法测定,全磷采用硝酸-高氯酸消煮-钼锑抗分光光度法测定[15]。
1.3.2 数据分析
应用 Excel 2010和SPSS 19.0对数据进行统计与分析,采用One-Way ANOVA,对叶、枝、根的C、N、P及计量比进行差异性检验;采用Pearson分析叶、枝、根之间的C、N、P及计量比的相关性;应用SigmaPlot 12.0绘制C、N、P含量以及计量比的季节动态变化图、标准化主轴关系图;使用SPSS 19.0对各器官C∶N∶P生态化学计量进行描述统计分析,变异系数(coefficient of variation, CV) =100%×标准差/平均值计算得出,采用单因素方差分析方法进行变异来源分析。采用SPSS19.0的简约主轴回归分析杉木各器官的C、N、P异速生长关系。C、N、P含量以单位质量的养分含量(g/kg)表示,C∶N、C∶P、N∶P、C∶N∶P采用质量比。
2 结果与分析
2.1 不同器官的C、N、P含量及计量比的季节动态特征
从表3可知,C、N、P含量的年平均值均在叶中表现最大,分别为(527.60±15.07)、(10.55±1.89)、(2.13±0.31) g/kg;而C∶N、C∶P、N∶P的年平均值最大的则是根,分别为(78.12±12.54)、(619.46±48.23)、(7.13±3.57)。各器官C∶N∶P大小排序表现为根>枝>叶,根的C∶N∶P达到450∶7∶1。叶、根的N、C∶N、N∶P均具有显著的差异性(P<0.05)。叶的C、P含量分别与枝、根存在差异性,各器官之间的C∶P均具有差异性。

表3 杉木林各植物器官C、N、P含量及计量比的年平均值
小写字母表示植物器官之间的差异性,其中具有相同字母表示差异性不显著(P>0.05)
叶、枝、根的C、N、P含量的季节动态特征见图1。杉木叶、枝、根的C、N、P含量在不同季节具有各自的变化规律,其中各器官的C含量最大值均为4月份,分别为(564.99±8.32)、(542.68±10.92)、(530.08±6.65) g/kg,叶、根的C含量变化趋势均为先升高后降低再升高;叶、枝的N含量在10月份最高,分别为(15.39±0.53)、(13.76±0.23) g/kg,根在4月份最高,为(10.90±0.34) g/kg,叶和根的季节变化呈现出先升高后降低再升高的趋势;叶、枝的P含量最大值出现在10月份,分别为(2.98±0.13)、(3.15±0.21) g/kg,根最高为1月份,为(1.45±0.31) g/kg,叶、枝的变化趋势为先升高后降低再升高,根则表现出逐渐下降的季节变化。同一器官不同月份的C、N、P含量均存在不同程度的差异性,其中叶、根的C含量在4月份与7月份的均差最大;叶、枝的N含量差异最大的均为7月和10月;各器官的P含量均在1月份和10月份差异最大。
各器官C∶N最大值均为7月份,分别为(76.28±8.87)、(106.27±13.18)、(109.23±22.11),随着季节的变化,叶、根的C∶N值表现为先降低后升高再降低的变化趋势,枝呈现出先升高后降低的动态趋势。叶、枝的C∶P值在1月份最高,分别为(368.92±39.41)、(724.41±56.67),根在4月份最高,为(691.02±139.52)。叶、根的N∶P值表现为4月份最大,分别为(5.56±0.33)、(13.66±2.53),枝的最大值为1月份,为(12.81±1.80),N∶P在叶、根中呈现出相同的变化趋势,均为先升高后降低再升高,在枝中却逐渐降低。各器官在不同月份的化学计量比均存在不同程度的差异性,其中叶、枝的C∶N差异性最大的为7月份与10月份;叶、枝的C∶P在1月份和10月份差异最大;叶、枝、根的N∶P差异最大的月份均不相同。

图1 不同器官的C、N、P含量及计量比的季节动态特征Fig.1 Seasonal dynamics of C, N, P contents and C∶N, C∶P, N∶P mass ratios in different organs大写字母表示同一器官不同月份的差异性,其中具有相同字母表示差异性不显著(P>0.05)
2.2 杉木各器官C∶N∶P生态化学计量的相关关系和变异特征、变异来源分析
从表4可以看出,叶与枝的C、N、P、C∶N、C∶P和N∶P均呈现为极显著正相关关系;叶与根的C、N、C∶N存在极显著正相关关系,叶和根的N∶P呈现显著正相关关系;枝和根的C∶N具有极显著正相关性。不同器官的C含量变异系数较小,均低于9%,其中根>枝>叶。各器官N含量的变异系数均高于35%,排序为枝>叶>根。P含量的变异系数均高于30%,各器官变异系数排序为枝>根>叶,其中枝的变异系数高达65.04%。杉木人工林各器官C∶N变异系数均高于42%,排序为根>枝>叶,其中根的C∶N变异系数达54.26%。不同月份间各器官C∶P的变异系数排序与C∶N相同,均高于34%。不同月份N∶P变化除了叶的变异系数小于30%,枝和根的变异系数均大于60%。
杉木器官和不同月份因素及其交互作用对杉木C、N、P含量及其计量比的影响各不相同(表5),均为显著水平(P<0.05),其中,器官、月份对C的影响达到极显著水平(P<0.001),器官、月份和器官与月份的交互作用对N、P、N∶P均表现为极显著影响(P<0.001),月份对C∶N的影响为极显著水平(P<0.001),器官、器官与月份的交互作用对C∶P的影响极显著(P<0.001)。从表5可以看出,杉木的C含量和N含量主要受季节影响;对C∶P变异的影响则主要是器官,其次是月份;而P含量、C∶N变异的主要影响来源是月份,N∶P变异则主要受到器官的影响,其次则是器官与月份的交互作用。

表4 不同器官生态化学计量特征的相关关系和变异情况
CC: 相关系数,包含相同字母表示不同器官间具有相关关系,*:显著相关(P<0.05);**:极显著相关(P<0.01);CV:变异系数
表5 杉木不同器官C、N、P含量及其计量比的整体变异来源分析
Table 5 The effect of variation from different organs, month and both interactions on C, N, P, and C∶N, C∶P, N∶P mass ratios inCunninghamialanceolate

因子Factors自由度dfCNPC∶NC∶PN∶PMSSSMSSSMSSSMSSSMSSSMSSS器官Organs(S)27481.27**14962.5375.98**151.959.35**18.693662.35*7324.701078202.01**2156404.01110.48**220.94月份Month(M)320531.50**61594.50197.71**593.126.90**20.7112826.16**38478.48186368.93*559106.7978.91**236.72器官×月份S×M62246.10*13476.6145.03**270.193.82**22.921888.70*11332.20209601.94**1257611.6693.46**560.77器官间误差S-error96910.0587365.214.28411.250.2321.69811.9677948.2946121.164427631.669.64925.00
SS: 离差平方和,MS: 均方,*: 影响显著(P<0.05);**: 影响极显著(P<0.001)
2.3 不同器官C、N、P的异速生长关系
异速生长反映了生物体两种属性之间随生长发育所表现出的变化规律,常用公式为[16-17]:y=axb,式中a、b均为常数,x、y是生物的属性, 例如植物的C、N、P含量。实际研究中异速生长关系函数更多的用对数的形式表示:log(y) =blog(x) + log(a),式中b为该直线的斜率,即异速生长指数[18]。从图2和表6看,叶、根的C与N含量存在正相关关系,其斜率相似,并具有显著的异速生长关系(N-C2.777,P=0.008;N-C2.574,P=0.002),枝的C与N异速生长关系不显著;杉木不同器官C、P均未表现出显著的异速生长关系;叶、枝、根的N、P含量表现出正相关性,均具有极显著的异速生长关系(N-P0.539,P=0.000;N-P0.617,P= 0.001;N-P0.721,P=0.001),其中根和枝的斜率相似。
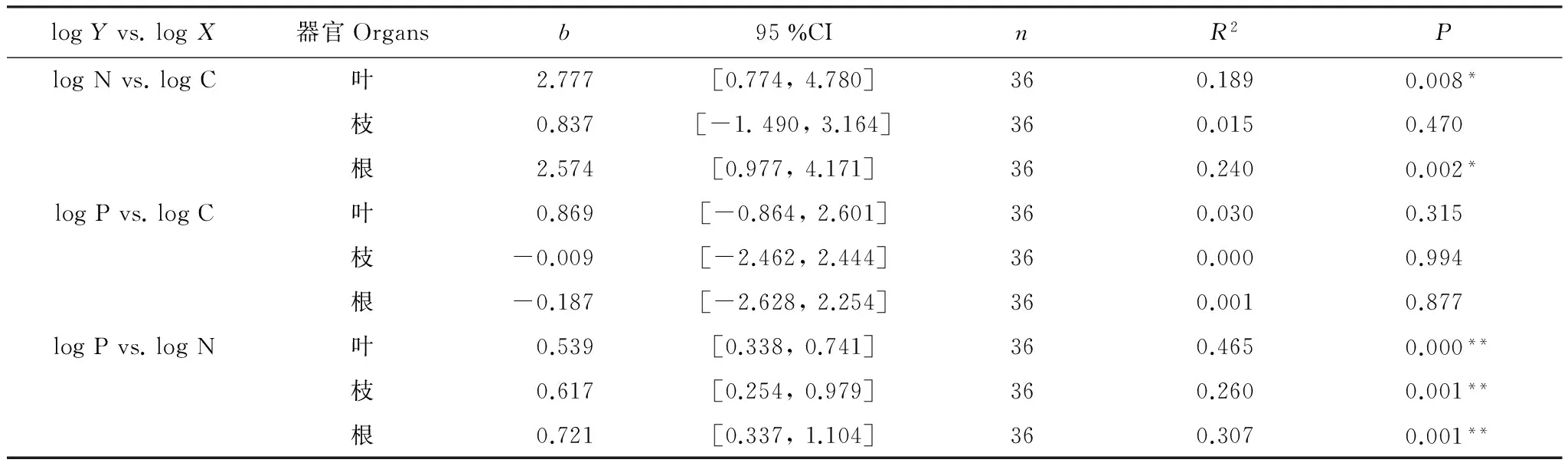
表6 杉木不同器官C、N、P含量的异速生长关系
*:显著(P<0.05),**:极显著(P<0.05)

图2 杉木不同器官C、N、P含量的标准化主轴关系Fig.2 Standardized major axis (SMA) relationships of C, N, and P contents of different organs in Cunninghamia lanceolate
3 结论与讨论
3.1 杉木不同器官C、N、P含量及生态化学计量的季节动态特征
实验结果表明,叶的C含量从冬季到春季逐渐增加,在4月份达到最大值,这与赵亚芳等[7]对华北落叶松针叶C含量的研究结果相似,其原因是生长季温度升高,杉木的光合作用较强,叶片代谢旺盛积累了较多的C;同时,C含量在10月又开始回升,这与Herbert等[19]的研究结果相似。叶中的N、P含量在秋季相对较高,与谢会成等[20]对华北落叶松人工林叶N 浓度在9—10月迅速下降,P含量较稳定的研究结果相反,原因是由于试验地在该季节温度较高,杉木叶片在生长旺盛期吸收和贮存的N、P含量还未开始向根发生转移和储存。枝的C含量变化趋势表现为先升高后降低,而枝的N、P含量在7月份相对较低,10月份相对较高,与王文新等[21]的研究结果相近。25年生杉木的根生长缓慢,在季节变化中P呈现出相对稳定的状态,该结果与杨秀云等[22]对华北落叶松的研究结果相似。实验结果表明,Ⅲ号集水区杉木叶、枝、根中的N含量要低于我国陆生植物的N含量,叶的P含量高于陆生植物,而枝、根的P含量接近对我国陆生植物的P含量[23-24]。
叶和枝的C∶N、C∶P在7月份和1月份相对较高,与牛得草等[4]对阿拉善荒漠区不同植物叶片的C∶N、C∶P结果相似,这是由于该时期叶片和枝中的N素、P素利用率相对较高。根在4月份和10月份C∶P相对较高,说明根在植物生长季节对P素利用率相对较高。有研究表明,在植物的生长过程中,N∶P<14表现为N限制,N∶P>16为P限制,14 本研究中杉木叶的C∶N∶P比(248∶5∶1)低于王晶苑等[29]得出的亚热带人工常绿针叶林叶的C∶N∶P比(728∶18∶1),与韩文轩等[14]植物全叶的C∶N∶P(242∶14∶1)结果接近,枝和根的C∶N∶P比分别为(325∶6∶1)、(450∶7∶1),均高于叶片的C∶N∶P比,说明杉木根的养分利用效率最高,杉木对于不同器官的营养元素分配是显著不同的。 3.2 杉木不同器官C、N、P化学计量比的相关性、季节差异动态分析 研究结果发现,叶与枝、叶与根的C呈极显著正相关关系,表明杉木不同器官之间的C元素是相互移动、相互影响的,可能原因是叶在光合作用下产生C,在枝和根中形成浓度差,造成C元素向枝和根转移。叶、枝、根的C∶N呈现为极显著正相关关系,表明杉木不同器官之间的生长速率是相互联系、相互影响的。叶与枝的C∶P表现为极显著正相关关系,表明其养分利用效率是紧密联系的,原因是实验所采集枝叶位于同一枝干上,叶和枝对于养分的汲取和吸收是同步的。叶分别和枝、根的N∶P呈现极显著、显著正相关关系,表明其具有相同的限制性元素。 本研究中,杉木各器官的C含量随季节变化的变异较小,原因是C的吸收主要是通过植物光合作用,而植物体内的C含量保持在稳定水平。杉木枝的N、P含量变异系数达到了41.78%和65.04%,表明枝随着不同季节的变化产生的变异显著,可能的原因是枝在不同月份时对N、P的吸收具有差异性,从植物特性来说,杉木叶片与枝干相连,其N、P养分的交换最主要是枝干,而本研究中叶片N、P含量随季节的变化同样具有很大的变异性,因此枝的变异性在一定程度上是受到叶片的影响。根的C∶N、C∶P变异系数最显著,反映了杉木根的生长速率、养分利用效率受季节影响的特性,试验地杉木的细根发达,是杉木从土壤汲取养分的主要媒介,因此侧面反映了杉木生长随着季节变化具有差异性。 随着植物的生长,C、N、P含量及其化学计量比往往会发生变化[30],本研究发现,杉木C、N、P含量及C∶N、C∶P和N∶P的变异特征不仅与器官类型有关,在不同生长季节也表现出较大的差异性。本研究中由于所有植物样品采集都在同一小范围内,环境的空间异质性可以不予考虑,进一步突出器官和生长阶段的影响。刘万德[31]等研究结果表明,同一生境条件下,植物C、N、P含量及其化学计量比主要受生长阶段影响,本研究结果与其较为一致。本研究中,杉木的C、N含量主要受季节影响,其可能原因是试验地不同季节温度和降雨的变化较显著,夏季高温降雨多,冬季温度偏低较为干旱,因此影响了杉木对养分元素的吸收。对C∶P变异的影响则主要是器官,其次是月份,表明杉木各个器官对P的需求不同,季节变化对C∶P的影响小于器官;而P含量、C∶N变异的主要影响来源是月份,表明生长过程中杉木自身对养分的利用能力较强,在不同生长阶段所需的元素具有较大的差异性。N∶P变异则主要受到器官的影响,可能原因是不同器官受到N元素限制的程度不同,对养分的利用效率有所差异。 3.3 杉木不同器官C、N、P含量异速生长关系 一些研究表明,标准化主轴关系中,植物体不同器官养分浓度的斜率相同截距不同是由于受到环境因素的直接影响所导致的[32-33],本研究中叶、根的C-N含量存在斜率相似,异速生长指数相近,但其截距不同,这是因为杉木的叶、根所处环境具有差异性,叶片暴露在空气中,而细根则位于土壤中;叶、枝、根的C、P均未表现出显著的异速生长关系,该结果与Liu等[34]对盐地碱蓬不同器官C-P异速生长结果相似,证明不同器官各自的养分分配是具有相似性的,可能的原因是杉木对于养分的利用规律的一致性,并未由于各器官生长发育的不同而产生较大的差异;Wang等[35]对西北干旱盐碱环境中植物的研究中证明叶片N-P具有极显著的异速生长关系,本研究中叶片N-P的标准化主轴关系并未表现出显著的正相关性,也未具有显著的异速生长关系,结果不一致的原因可能是区域环境的差异所造成的,实验地处于亚热带地区,土壤养分肥沃,水分充足,与干旱盐碱地的环境完全相反。叶、枝、根的N-P异速生长关系显著,证明其生长情况随着养分浓度的增加具有显著的变化。 本研究只对单一林龄的杉木人工林不同器官的C、N、P生态化学计量特征进行了研究,考虑到影响整个杉木林生态系统的因子还有很多,需要进一步分析凋落物、土壤的养分含量及生态化学计量的季节变化特征,才能更加全面揭示养分元素的调控机制,提高杉木林的经营和管理措施。 [1] Sardans J, Rivas-Ubach A, Peuelas J. The elemental stoichiometry of aquatic and terrestrial ecosystems and its relationships with organismic lifestyle and ecosystem structure and function: a review and perspectives. Biogeochemistry, 2012, 111(1/3): 1- 39. [2] Song Z L, Liu H Y, Zhao F J, Xu C Y. Ecological stoichiometry of N∶P:Si in China′s grasslands. Plant and Soil, 2014, 380(1/2): 165- 179. [3] 周鹏, 耿燕, 马文红, 贺金生. 温带草地主要优势植物不同器官间功能性状的关联. 植物生态学报, 2010, 34(1): 7- 16. [4] 牛得草, 李茜, 江世高, 常佩静, 傅华. 阿拉善荒漠区6种主要灌木植物叶片C∶N∶P化学计量比的季节变化. 植物生态学报, 2013, 37(4): 317- 325. [5] Fan H B, Wu J P, Liu W F, Yuan Y H, Hu L, Cai Q K. Linkages of plant and soil C∶N∶P stoichiometry and their relationships to forest growth in subtropical plantations. Plant and Soil, 2015, 392(1/2): 127- 138. [6] Yao F Y, Chen Y H, Yan Z B, Li P, Han W X, Fang J Y. Biogeographic patterns of structural traits and C∶N∶P stoichiometry of Tree Twigs in China′s forests. PLoS One, 2015, 10(2): e0116391. [7] 赵亚芳, 徐福利, 王渭玲, 王玲玲, 王国兴, 孙鹏跃, 白小芳. 华北落叶松根茎叶碳氮磷含量及其化学计量学特征的季节变化. 植物学报, 2014, 49(5): 560- 568. [8] 李征, 韩琳, 刘玉虹, 安树青, 冷欣. 滨海盐地碱蓬不同生长阶段叶片C、N、P化学计量特征. 植物生态学报, 2012, 36(10): 1054- 1061. [9] Niklas K J, Cobb E D. N, P, and C stoichiometry ofEranthishyemalis(Ranunculaceae) and the allometry of plant growth. American Journal of Botany, 2005, 92(8): 1256- 1263. [10] Niklas K J, Owens T, Reich P B, Cobb E D. Nitrogen/phosphorus leaf stoichiometry and the scaling of plant growth. Ecology Letters, 2005, 8(6): 636- 642. [11] Niklas K J. Plant allometry, leaf nitrogen and phosphorus stoichiometry, and interspecific trends in annual growth rates. Annals of Botany, 2006, 97(2): 155- 163. [12] 陈军强, 张蕊, 侯尧宸, 马丽娜, 丁路明, 龙瑞军, 尚占环. 亚高山草甸植物群落物种多样性与群落C、N、P生态化学计量的关系. 植物生态学报, 2013, 37(11): 979- 987. [13] 阎恩荣, 王希华, 郭明, 仲强, 周武. 浙江天童常绿阔叶林、常绿针叶林与落叶阔叶林的C∶N∶P化学计量特征. 植物生态学报, 2010, 34(1): 48- 57. [14] 韩文轩, 吴漪, 汤璐瑛, 陈雅涵, 李利平, 贺金生, 方精云. 北京及周边地区植物叶的碳氮磷元素计量特征. 北京大学学报: 自然科学版, 2009, 45(5): 855- 860. [15] 中华人民共和国林业行业标准. 森林土壤分析方法. 北京: 中国标准出版社, 1999. [16] Peters R H. The Ecological Implications of Body Size. Cambridge: Cambridge University Press, 1983: 197- 198. [17] Niklas K J. Size-dependent variations in plant growth rates and the“3/4 Power Rule". American Journal of Botany, 1994, 81(2): 134- 144. [18] 韩文轩, 方精云. 幂指数异速生长机制模型综述. 植物生态学报, 2008, 32(4): 951- 960. [19] Herbert D A, Williams M, Rastetter E B. A model analysis of N and P limitation on carbon accumulation in Amazonian secondary forest after alternate land-use abandonment. Biogeochemistry, 2003, 65(1): 121- 150. [20] 谢会成, 葛云, 孙居文, 李际红, 杨茂生. 华北落叶松人工林叶内营养元素含量的变异. 福建林学院学报, 2005, 25(2): 163- 166. [21] 王文新, 郭景唐, 陈峻崎. 华北落叶松各器官营养元素分布及季节变化. 北京林业大学学报, 1992, 14(S1): 124- 129. [22] 杨秀云, 韩有志, 张芸香, 武小钢. 采伐干扰对华北落叶松细根生物量空间异质性的影响. 生态学报, 2012, 32(1): 64- 73. [23] Han W X, Fang J Y, Guo D L, Zhang Y. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist, 2005, 168(2): 377- 385. [24] Elser J J, Acharya K, Kyle M, Cotner J, Makino W, Markow T, Watts T, Hobbie S, Fagan W, Schade J, Hood J, Sterner R W. Growth rate-stoichiometry couplings in diverse biota. Ecology Letters, 2003, 6(10): 936- 943. [25] Koerselman W, Meuleman A F M. The vegetation N∶P ratio: a new tool to detect the nature of nutrient limitation. Journal of Applied Ecology, 1996, 33(6): 1441- 1450. [26] 贺金生, 韩兴国. 生态化学计量学: 探索从个体到生态系统的统一化理论. 植物生态学报, 2010, 34(1): 2- 6. [27] 田大伦, 康文星, 文仕知. 杉木林生态系统学[M]. 北京: 科学出版社, 2003. [28] 吴统贵, 吴明, 刘丽, 萧江华. 杭州湾滨海湿地3种草本植物叶片N、P化学计量学的季节变化. 植物生态学报, 2010, 34(1): 23- 28. [29] 王晶苑, 王绍强, 李纫兰, 闫俊华, 沙丽清, 韩士杰. 中国四种森林类型主要优势植物的C∶N∶P化学计量学特征. 植物生态学报, 2011, 35(6): 587- 595. [30] Kerkhoff A J, Enquist B J, Elser J J, Fagan W F. Plant allometry, stoichiometry and the temperature-dependence of primary productivity. Global Ecology and Biogeography, 2005, 14(6): 585- 598. [31] 刘万德, 苏建荣, 李帅锋, 郎学东, 张志钧, 黄小波. 云南普洱季风常绿阔叶林优势物种不同生长阶段叶片碳、氮、磷化学计量特征. 植物生态学报, 2015, 39(1): 52- 62. [32] Leishman M R, Haslehurst T, Ares A, Baruch Z. Leaf trait relationships of native and invasive plants: community- and global-scale comparisons. New Phytologist, 2007, 176(3): 635- 643. [33] Liu F D, Yang W J, Zhang M, Liu Y H, Zheng J W, Wang W J, Zhang S T, Wang Z S, An S Q. Does strategy of resource acquisition in tropical woody species vary with life form, leaf texture, and canopy gradient?. European Journal of Forest Research, 2010, 129(6): 1093- 1108. [34] Liu F D, Liu Y H, Wang G M, Song Y, Liu Q, Li D S, Mao P L, Zhang H. Seasonal variations of C∶N∶P stoichiometry and their trade-offs in different organs ofSuaedasalsain Coastal Wetland of Yellow River Delta, China. PLoS One, 2015, 10(9): e0138169. [35] Wang L L, Zhao G X, Li M, Zhang M T, Zhang L F, Zhang X F, An L Z, Xu S J. C∶N∶P stoichiometry and leaf traits of halophytes in an arid saline environment, Northwest China. PLoS One, 2015, 10(3): e0119935. Seasonal dynamics and allometric growth relationships of C, N, and P stoichiometry in the organs ofCunninghamialanceolatafrom Huitong CHEN Chan1,2, WANG Guangjun1,2,3,*, ZHAO Yue1,2, ZHOU Guoxin1,2, LI Li1,2, GAO Jiquan1,2 1CentralSouthUniversityofForestryandTechnology,Changsha410004,China2NationalEngineeringLabforAppliedTechnologyofForestryandEcologyinSouthChina,Changsha410004,China3HuitongEcologicalStationforChineseFirPlantation,Huitong418307,China Organ-specific comparisons of carbon (C), nitrogen (N), and phosphorus (P) stoichiometrics and allometrics reflected the interfaces of the functional differentiation of plant tissues and the inuence of environmental constraints. Here, we explored the seasonal constraints of organ-specific C, N, and P stoichiometrics and allometrics in a 25-year-oldCunninghamialanceolatastand in Huitong, which located in subtropical China. Leaves, branches, and roots of trees covering a wide topographical gradient were collected at different seasons (January, April, July, October). We analyzed the seasonal dynamics of C, N, P content and C∶N∶P ecological stoichiometry in leaf, branch and root, and then revealed the variation、variation sources and allometric relationship of nutrient elements with different organs and months. The results showed that the C, N, and P contents and stoichiometries of theC.lanceolatavaried in different organs and changed with seasons, reflecting a plastic seasonal variation and strong ontogenetic self-regulation. In all organs, the annual average N∶P ratios (<14) were much lower than the average level in China (16.3), suggesting that the growth ofC.lanceolatain this region is relatively limited by N. The maximum C contents were observed in April for all organs, which was likely due to the increment of temperature in the growing season. The maximum C∶N ratios were observed in July in all cases, indicating a relatively higher utilization rate of N in summer. In addition, the coefficients of variation (CVs) for N, P, C∶N, C∶P, and N∶P were all higher than 30%, and the CVs for the P content and the N∶P ratio in the branch were 65.04% and 62.41%, respectively. N and P of leaves, branches, and roots showed a positive correlation and an extremely significant allometric growth relationship between them(P<0.001), with allometric exponents of 0.539, 0.617, and 0.721, respectively. This result demonstrated that growth rate changes significantly with an increase in nutrient concentration. The leaves and branches showed the highest N and P contents in October, which is possibly because of a temperature effect. The C∶P ratios were the highest in winter. The changing trend of P showed an initial increase, followed by a decrease and then another increase. The highest N∶P ratios in the leaves and roots were found in spring. The changing trends of C, N, and N∶P were an initial increase, followed by a decrease and then another increase. By contrast, the C∶N ratio changing trend was an initial decrease followed by an increase and then another decrease. C, N, and C∶N showed extremely significant positive correlations (P<0.001), and the N∶P ratio showed a significantly positive correlation with leaves and roots. C and N were positively correlated, with a similar slope and significant allometric growth relationships (P<0.05), which can be attributed to a difference in the environment of the leaves and roots. The highest annual average C, N, and P contents were measured in the leaves, with a mean value of (527.60 ± 15.07), (10.55 ± 1.89), and (2.13 ± 0.31) g/kg, respectively. The greatest CVS for N, P, and N∶P were found in the branches, proving that the absorption of N and P varies with seasons. The highest annual average C∶N, C∶P, and N∶P were in the roots, with a mean value at (78.12 ± 12.54), (619.46±48.23), and (7.13 ± 3.57), respectively. The roots showed the highest CVs of C∶N and C∶P, indicating that the growth rate and nutrient use efficiency of the roots are strongly influenced by seasonal changes. Organ and season had an extremely significant effect on C content (P<0.001), N, P, and N∶P (P<0.001). Furthermore, the influence of season for C∶N reached an extremely significant level (P<0.001), and the main effect of organ and the interaction between organ and month showed extremely significant effects for the C∶P ratio (P<0.001). The C and N contents inC.lanceolatachanged with seasons, which is likely due to the change of temperature and precipitation in different seasons. The main influencing factor of C∶P and N∶P was organs, reflecting a different demand of N and P in each organ. Finally, the main influencing source of P and C∶N was month, indicating that there are very different demands for these elements at different growth stages. Cunninghamialanceolata; plant organs; stoichiometry characteristics; coefficient of variation; allometric growth relationships 2014年度湖南省高校创新平台开放基金项目(14k115);湖南省研究生科研创新课题项目(CX2013B355);2014湖南省自然科学基金创新研究团体项目 2015- 12- 14; 2016- 05- 18 10.5846/stxb201512142500 *通讯作者Corresponding author.E-mail: wanggj652@163.com 陈婵,王光军,赵月,周国新,李栎,高吉权.会同杉木器官间C、N、P化学计量比的季节动态与异速生长关系.生态学报,2016,36(23):7614- 7623. Chen C, Wang G J, Zhao Y, Zhou G X, Li L, Gao J Q.Seasonal dynamics and allometric growth relationships of C, N, and P stoichiometry in the organs ofCunninghamialanceolatafrom Huitong.Acta Ecologica Sinica,2016,36(23):7614- 7623.

