不同耕作方式下草甸栗钙土燕麦田土壤微生物特征
郝雅星, 张立峰,2,*, 韩凯虹, 王伟婧
1 河北农业大学 农学院, 保定 071000
2 农业部张北农业资源与生态环境重点野外科学观测试验站, 张家口 076450
不同耕作方式下草甸栗钙土燕麦田土壤微生物特征
郝雅星1, 张立峰1,2,*, 韩凯虹1, 王伟婧1
1 河北农业大学 农学院, 保定071000
2 农业部张北农业资源与生态环境重点野外科学观测试验站, 张家口076450
摘要:河北坝上地区高寒半干旱的独特生态环境,土地沙化风蚀严重,作物产量低,土壤微生物的活动尚未有深入研究,尤其是人为干扰下的土壤微生物在作物生长季的动态变化。为了明确耕作方式对草甸栗钙土土壤微生物性状的影响特征,依托定位12a的免耕、深松、常规耕作田间试验基础,通过辅助设置12a免耕、深松后的翻耕处理,监测了燕麦田土壤微生物量碳、活跃微生物量和土壤呼吸速率等性状。结果表明,土壤微生物量碳与活跃微生物量围绕燕麦抽穗期为“W型”时序变化,长期免耕与深松下呈现0—10 cm表层土壤富集微生物量碳的空间分布特征。免耕与深松有利于提高0—10 cm土层土壤微生物量,多年免耕和深松后翻耕能使土层间土壤活跃微生物量差异减小。燕麦田土壤呼吸速率呈现“U型”时序变化,免耕0—10 cm土层呼吸速率具有较其他耕作方式更高的趋势。在燕麦生育期内,土壤呼吸商一直处于较低而平稳的水平,燕麦收获后进入土壤微生物的高活性期;0—10 cm土层翻耕与多年免耕与深松后的翻耕处理土壤呼吸商有高于免耕处理的趋势。翻耕对于促进冷凉区土壤库存养分的活化与适时供应具有重要作用。
关键词:耕作方式;微生物量碳;活跃微生物;土壤呼吸;草甸栗钙土
土壤微生物作为一项生物性特征指标在评价土壤质量中具有重要地位[1- 2]。土壤微生物在土壤形成、有机质代谢、植物养分转化和污染物降解,以及陆地生态系统元素的生物地球化学循环和能量的代谢中都有不可替代的作用[3- 4]。耕作措施通过直接影响土壤物理结构间接调控着土壤化学、生物性状[5]。与传统耕作相比,免耕可有效抑制土壤水分蒸发而增加土壤水分的有效性[6- 7]。免耕覆盖方式,由于避免扰乱表层土壤与增加秸秆投入,免耕田具有提高土壤微生物丰富度、增加土壤微生物含量的显著效果[8]。不同利用方式下土壤有机质不同,微生物分解其成分的所需水分条件也不一样[9- 10]。研究表明,土壤微生物量碳虽在土壤有机质中占很小比例,它却是最为活跃的部分,特别是在土壤碳、氮循环中发挥着关键作用[3],是土壤有机碳矿化的决定因素[11]。土壤微生物量碳的表现与耕作土壤理化性状等紧密相关[12],土壤理化性质的剧烈改变必然引起土壤微生物数量及活性的显著变化[13],土壤养分特别是土壤有机质含量的增加会大大加快土壤微生物量的累积[14]。
分布于内蒙古高原农牧交错带的草甸栗钙土,是我国北方重要的农作土壤。草甸栗钙土区气候寒旱、昼夜温差大,土壤瘠薄、风蚀严重,作物生长季短、产量低。面对干旱贫瘠、风蚀退化的农田土壤背景,本文通过对不同耕作方式下燕麦田土壤微生物量碳、活跃微生物量和土壤呼吸速率的研究,深度分析三者之间的关系机制,以揭示不同耕作方式对土壤微生物的影响特征,为区域农田蓄墒保土提高水养资源生产效率的耕作技术选择与创新提供理论依据。
1材料与方法
1.1试区概况
试验于2013年5—10月,在位于内蒙古农牧交错带的河北坝上地区河北农业大学张北实验站12a耕作方式定位试验的基础上进行,试验地基本土壤理化性状如表1,表2。区域为半干旱地区,海拔1420 m,年降水量340—450 mm,年均温2.6 ℃。供试作物为燕麦坝莜一号。 2013燕麦生育期内日降水量情况如图1。试验设5个处理,在12a免耕(NT)、深松(P T、翻耕(CT)3处理基础上,再设免耕后翻耕(NC)、深松后翻耕(PC)两个处理。各处理机械收割后留20 cm高麦茬还田,免耕与深松处理田面立茬,其他处理根茬翻入土壤;深松采用凿型深松铲作业,幅宽为25 cm,深度25 cm;翻耕采用铧式犁,作业深度20 cm。翻耕与深松时间为11月15日左右。所有处理随播种施用肥料,磷酸二铵[(NH4)2HPO4]60 kg/hm2,尿素[CO(NH2)2]15 kg/hm2,不施有机肥,无灌溉。每处理3次重复,每处理区面积25 ×17 m。

表1 0—20 cm土层供试土壤理化性状
SOM: Soil organic matter; TN: Total nitrogen; TPP: Total phosphorus; AN: Available nitrogen; APP: Available phosphorus; APK: Available potassium;
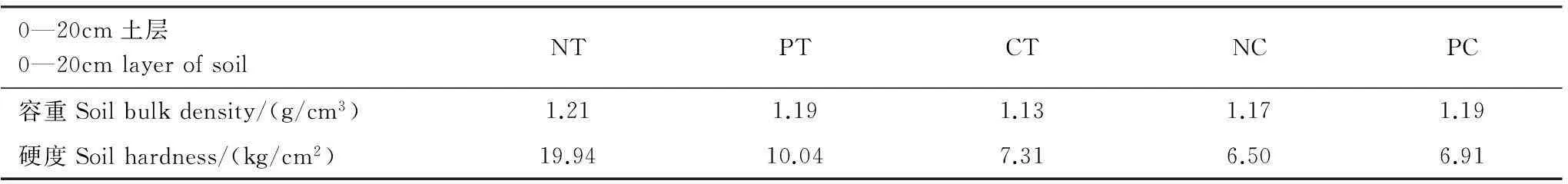
表2 0—20 cm土层供试土壤容重与硬度
NT:免耕No tillage with high stubble; PT: 深松Subsoiling tillage with high stubble; CT: 翻耕Conventional tillage with straw returning; NC: 免耕后翻耕Conventional tillage after no tillage; PC: 深松后翻耕Conventional tillage after subsoiling tillage

图1 2013年燕麦生育期内日降雨量与温度分布Fig. 1 Daily rainfall of naked oats growth stage in 2013
1.2试验材料取样方法
于2013年的燕麦苗期(6月13日)、分蘖期(7月3日)、拔节期(7月17日)、抽穗期(8月6日)、收获期(9月5日)及收获后的9月15日、10月1日、10月15日分8次取样。土样分为0—10 cm和10—20 cm两个层次。土样4 ℃冰箱保存, 4 d之内测完。
1.3测定项目与方法1.3.1土壤微生物量碳
土壤微生物量碳的测定应用基质诱导呼吸法。取5 g鲜土,加入5 mL 10 mmol/L葡萄糖溶液和0.025 g滑石粉。22 ℃培养2 h,测定CO2呼吸量[15]。
1.3.2土壤活跃微生物
土壤活跃微生物的测定用呼吸曲线数学分析法。取1 g鲜土加入0.4 mL葡萄糖培养基(葡萄糖3.000 g、酵母膏0.750 g、MgSO4· 7H2O 0.300 g、KH2PO40.250 g、水1000 mL),在20 ℃培养10 h后测定CO2呼吸量[15]。
1.3.3土壤呼吸
土壤呼吸的测定采用CO2释放量法。取5 g鲜土于试剂瓶中,28 ℃培养24 h后测CO2呼吸量[16]。以上CO2的产生量均用ECA光合仪测定,土壤均以干土重计算。
1.3.4呼吸商的计算
呼吸商是土壤呼吸与土壤微生物量碳间比率,即每单位微生物生物量碳的土壤呼吸速率。
2结果分析
2.1耕作方式对微生物生物量碳的影响
季节与耕作方式显著影响草甸栗钙土土壤的微生物量碳(图2)。监测表明,从燕麦苗期的6月13日到收获后的10月15日,5种耕作方式下的土壤微生物量碳围绕抽穗期(8月6日)呈“W型”时序变化,抽穗期最高,分蘖期(7月3日)与9月15日—10月1日为低谷,9月15日—10月1日土壤微生物量碳最低。抽穗期的土壤微生物量碳最高,与坝上地区期间水热丰沛有关,高额的微生物量加速了养分矿化,提高了土壤养分供应能力。
比较表明,免耕处理0—10 cm土层微生物量碳含量显著高于翻耕,深松处于二者之间。图2表明,免耕和深松处理在燕麦拔节期(7月17日)0—10 cm土层微生物量碳达最大值,分别为33.30mg/100g和26.00 mg/100g,是翻耕的5.68倍和4.44倍。10—20 cm土层免耕处理微生物量碳含量有较翻耕降低的趋势,抽穗期免耕为翻耕的54.91%,差异显著;深松趋势不明显。免耕与深松处理多年的秸秆地表存留,为土壤微生物生长繁殖提供了营养基质,微生物量碳以及相应矿化养分的土壤表层富集,成为长期免耕与深松方式下土壤肥力结构演化的重要特征。
试验监测(图2)表明,长期免耕与深松后的一次翻耕作业(NC与PC),微生物量碳土壤表层富集的现象即可消除。翻耕将地表秸秆与富集的微生物均匀地翻入耕层,使土层间的微生物量碳含量差异不显著。

图2 不同耕作方式下土壤微生物量碳Fig. 2 Soil microbial biomass C under different tillage treatmentsNT:免耕No tillage with high stubble; PT: 深松Subsoiling tillage with high stubble; CT: 翻耕Conventional tillage with straw returning; NC: 免耕后翻耕Conventional tillage after no tillage; PC: 深松后翻耕Conventional tillage after subsoiling tillage
2.2耕作方式对活跃微生物的影响
不同耕作方式下的土壤活跃微生物量时序变化与微生物量碳相近(图3),同样呈以燕麦抽穗期为核心的“W型”变化特征。从苗期开始,活跃微生物量下降,在分蘖期进入第一低谷;之后快速上升于抽穗期达到第一峰值;之后又下降至成熟期的9月5日—9月15日间进入第二低谷;在10月1日达到第二个高峰。土壤活跃微生物量在燕麦拔节-抽穗期的快速上升与燕麦群体快速发育时序吻合,有利于燕麦生产。
免耕和深松处理的土壤活跃微生物量在0—10 cm土层具有明显优势;而翻耕处理则在10—20 cm土层土壤活跃微生物量相对较高。苗期免耕和深松0—10 cm土层活跃微生物量为12.34mg/kg和10.05mg/kg,是翻耕田的1.76倍和1.43倍。拔节期和抽穗期翻耕处理10—20 cm土层活跃微生物量分别为14.40mg/kg和27.23 mg/kg,是免耕田的2.63倍和1.79倍。拔节-抽穗期翻耕处理10—20 cm土层较高的活跃微生物量,为燕麦快速发育提供了优越的土壤肥力资源;相比之下免耕处理最低的土壤活跃微生物量,将成为燕麦生育养分供应的限制因素。
分析表明,多年免耕与深松后的土壤翻耕,土壤活跃微生物量土层间含量差异显著减小,但一次翻耕仍不能使10—20 cm土层活跃微生物量达到常年翻耕的水平。

图3 不同耕作方式下土壤活跃微生物Fig. 3 Soil active microbial biomass under different tillage treatments
2.3耕作方式对土壤呼吸的影响
草甸栗钙土燕麦田不同耕作方式下土壤呼吸速率时序变化如图4。自燕麦苗期的6月13日至收获后的10月15日,各耕作方式下的土壤呼吸速率呈现“U型”曲线;期间的拔节期有一小幅上升,燕麦收获后的9月15日为低谷期。同土壤微生物量碳、活跃微生物量比较,土壤呼吸速率没有出现抽穗期明显的高峰,其原因可能与抽穗期土壤的高温干旱有关,此时水分成为土壤呼吸的限制因素;而9月15日之后土壤呼吸速率的再度上升,可能与燕麦收获后还田的秸秆与根系等呼吸基质的输入有关。
免耕处理0—10 cm土层土壤呼吸速率具有较其他耕作方式更高的趋势,特别是在燕麦的生育前期。免耕处理苗期与拔节期土壤呼吸速率分别为0.84 mg kg-1h-1和0.52 mg kg-1h-1,是翻耕处理的1.63倍和1.58倍,差异显著;其他4种处理间差异不显著。10—20 cm土层土壤呼吸速率较0—10 cm土层变化比较平缓,监测期内各处理间差异不显著。图4表明,在9月15日—10月1日,各处理土壤呼吸速率快速升高,以多年免耕后的翻耕(NC)和多年深松后的翻耕(PC)增幅最大,期间两处理分别增长了4.0倍和2.5倍;而深松和翻耕的土壤呼吸速率已明显超过了苗期。结果表明,通过秸秆的翻埋还田,有利于促进10—20 cm土层的土壤呼吸和根层的养分供应。
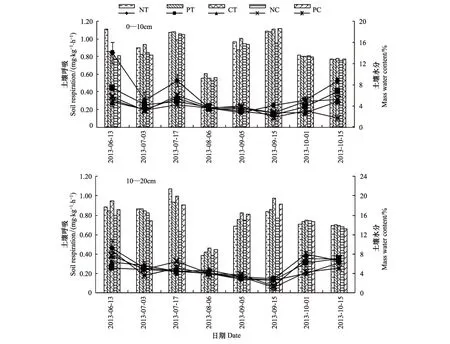
图4 不同耕作方式下土壤呼吸速率Fig. 4 Soil respiration rate under different tillage treatment
2.4耕作方式对土壤呼吸商的影响
由图5可知,在燕麦生育期内,土壤呼吸商一直处于较平稳的水平,而在燕麦收获后呼吸商表现大幅度增长。与土壤微生物量时序变化相比,燕麦田呼吸商在抽穗期进入低谷,表明期间存在高额的微生物数量与低效的微生物活性的双重特征;而在燕麦收获后,土壤呼吸速率出现监测期内的峰值,土壤呼吸速率较土壤微生物量更快速度的增长标志着土壤微生物进入高活性期。燕麦收获后的存留秸秆与根茬为土壤微生物提供了营养基质,成为激发微生物活性的重要因素。
图5表明,0—10 cm土层各翻耕处理土壤呼吸商有高于免耕处理的趋势,特别是在土壤微生物高活性期间的10月1日,免耕后的翻耕(NC)与常年翻耕处理土壤呼吸商达13.45 μgCO2/mg和7.73 μgCO2/mg,分别为免耕的2.04倍和1.17倍;10—20 cm土层各处理呼吸商变化趋势与0—10 cm土层相近,翻耕处理在9月15日和10月1日表现出更高的呼吸商,其值分别为9.37 μgCO2/mg和21.72 μgCO2/mg,是免耕的1.33倍和1.29倍。结果表明,翻耕具有提高土壤微生物活性的作用,这对于促进冷凉区土壤库存养分的活化与适时供应具有重要意义。
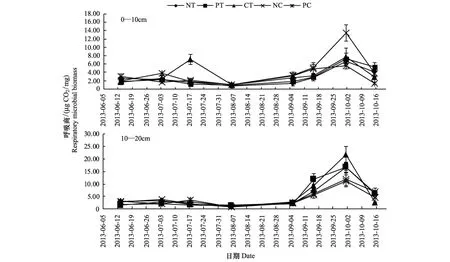
图5 不同耕作方式下土壤呼吸商Fig. 5 Soil respiration quotient under different tillage treatments
3讨论
3.1免耕下土壤微生物量碳的表层富集与养分供应
土壤微生物量是衡量土壤质量、维持土壤肥力和作物生产力的一个重要指标[17]。有报道认为,土壤微生物量更易受碳和氮的限制,在全球尺度上主要受土壤温度的影响[18- 19],对外界因素引起的变化较敏感,成为土壤生态系统变化的预警指标[20]。衡涛等研究认为对于高寒草甸生态系统,生长季温度升高对土壤微生物量碳影响不大,增温但降水减少使底层微生物量碳比例增加[21]。本试验表明,在坝上寒旱区草甸栗钙土燕麦田的整个测定时期内,免耕和深松处理0—10 cm土层的土壤微生物量碳明显高于10—20 cm土层,与WARDLE D A、翟瑞常的研究结果一致[22- 23]。土壤微生物量碳以及相应矿化养分的土壤表层富集,与免耕和深松下植物残体集中在表层土壤,以及连续免耕使土壤变硬[24]植物根系多集中分布于表层有关,如此表层土壤大量的碳和氮源,促进了土壤微生物的繁衍[25]。坝上寒旱区松免耕作有利于抑制农田起沙扬尘,然而矿化养分的土壤表层积累影响了对作物的有效性,采取松免耕与翻耕定期交换的轮耕方式,有助于实现农田生态保持与作物稳定丰产的兼顾。
3.2土壤活跃微生物的时序活性与养分供应
土壤微生物活性受土壤物化因素及人为土壤管理的影响[26];土壤温度和含水量被认为是决定土壤微生物季节动态的最主要因素[27- 28];土壤水分对微生物的活性有调节作用,当土壤相对含水量为60%时土壤微生物活性最高[29]。本研究表明,土壤活跃微生物量变化与坝上寒旱区光温、降水供应及燕麦生育相同步,这为区域旱作生产、高效利用夏季地气资源提供了养分保证。监测发现,在燕麦收获25 d后的10月1日,土壤活跃微生物量达到第二高峰,期间土壤微生物的高活性应与秸秆与根系死亡而添加了土壤有机碳氮营养有关,大量衰亡的根系也为微生物提供丰富的能源[30- 31]。Deluca T H[32]与Edwards K A[33]认为,土壤冻融交替具有刺激微生物活动作用。由于坝上地区高寒低温环境,特异的喜凉性微生物活动,也可能是冻融期间土壤表现高额微生物活性的原因。
3.3土壤微生物活性与田间土壤呼吸的关系
土壤呼吸是把植物固定的CO2重新释放到大气中的重要环节[34]。呼吸商(qCO2)将微生物量与微生物活性有机联系起来,研究认为qCO2值大,表明微生物呼吸矿化有机碳的能力强[35]。不同的土地利用方式,土壤呼吸有显著差异[36]。本研究发现,燕麦田呼吸商在抽穗期进入低谷,与土壤微生物量碳、土壤活跃微生物量变化趋势相反,燕麦抽穗期土壤微生物的高额数量与活性潜质,并没有在田间实现。研究表明,土壤湿度和温度是决定土壤呼吸空间变异的重要因子[37],降雨后土壤呼吸明显增强[38- 40],甚达降雨前的9倍[41]。因此,坝上寒旱区燕麦抽穗期土壤呼吸商的低谷,与期间的土壤干旱有关。保持与创造坝上寒旱区作物生育盛期的农田土壤适宜水分,是发挥土壤微生物质量潜势、提高区域地气资源利用效率的关键,也是保护性耕作技术研发的重要方面。
4结论
草甸栗钙土燕麦田土壤微生物量碳与活跃微生物量围绕抽穗期(8月6日)呈 “W型”时序变化;长期免耕与深松处理的微生物量碳与活跃微生物量呈现0—10 cm表层土壤富集的空间特征。燕麦苗期免耕和深松处理0—10 cm土层活跃微生物量是翻耕田的1.76倍和1.43倍;拔节期微生物量碳达翻耕的5.68倍和4.44倍。相比之下翻耕提高了10—20 cm土层的微生物量。燕麦田土壤呼吸速率呈现“U型”时序变化,抽穗期土壤的高温干旱抑制了土壤呼吸;免耕0—10 cm土层呼吸速率具有较其他耕作方式更高的趋势,苗期与拔节期土壤呼吸速率分别是翻耕的1.63倍和1.58倍。监测表明,在燕麦生育期内,土壤呼吸商一直处于较平稳的水平,而在燕麦收获后进入土壤微生物的高活性期。0—10 cm土层翻耕与多年免耕与深松后的翻耕处理土壤呼吸商有高于免耕处理的趋势。翻耕对于促进冷凉区土壤库存养分的活化与适时供应具有重要作用。
参考文献(References):
[1]任天志. 持续农业中的土壤生物指标研究. 中国农业科学, 2000, 33(1): 68- 75.
[2]Devi N B, Yadava P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, North-east India. Applied Soil Ecology, 2006, 31(3): 220- 227.
[3]Tate R LⅢ. Soil Microbiology. 2nd ed. New York: John Wiley and Sons, Inc, 2000.
[4]Nsabimana D, Haynes R J, Wallis F M. Size, activity and catabolic diversity of the soil microbial biomass as affected by land use. Applied Soil Ecology, 2004, 26(2): 81- 92.
[5]张心昱, 陈利顶, 傅伯杰, 李琪, 齐鑫, 马岩. 农田生态系统不同土地利用方式与管理措施对土壤质量的影响. 应用生态学报, 2007, 18(2): 303- 309.
[6]张海林, 秦耀东, 朱文珊. 覆盖免耕土壤棵间蒸发的研究. 土壤通报, 2003, 34(4): 259- 261.
[7]王建政. 旱地小麦保护性耕作对土壤水分的影响. 中国水土保持科学, 2007, 5(5): 71- 74.
[8]张洁, 姚宇卿, 金轲, 吕军杰, 王聪慧, 王育红, 李俊红, 丁志强. 保护性耕作对坡耕地土壤微生物量碳、 氮的影响. 水土保持学报, 2007, 21(4): 126- 129.
[9]Craine J M, Gelderman T M. Soil moisture controls on temperature sensitivity of soil organic carbon decomposition for a mesic grassland. Soil Biology & Biochemistry, 2011, 43(2): 455- 457.
[10]吕丽平, 刘国栋, 王登峰, 魏志远, 漆智平, 唐树梅. 不同温湿条件对土壤微生物量碳的影响. 南方衣业学报, 2013, 44(10): 1671- 1676.
[11]毕明丽, 宇万太, 姜子绍, 周桦, 沈善敏. 施肥和土壤管理对土壤微生物生物量碳、氮和群落结构的影响. 生态学报, 2010, 30(1): 32- 42.
[12]张凤华, 梁静, 庞玮. 不同恢复模式对新疆弃耕地土壤理化性质和生物学特性的影响. 水土保持学报, 2013, 27(5): 169- 172.
[13]Hansen K, Vesterdal L, Schmidt I K, Gundersen P, Sevel L, Bastrup-Birk A, Pedersen L B, Bille-Hansen J. Litterfall and nutrient return in five tree species in a common garden experiment. Forest and Ecology Management, 2009, 257(10): 2133- 2144.
[14]郭子武, 俞文仙, 陈双林, 李迎春, 杨清平. 林地覆盖对雷竹林土壤微生物特征及其与土壤养分制约性关系的影响. 生态学报, 2013, 33(18): 5623- 5630.
[15]高云超, 朱文珊, 陈文新. 秸秆覆盖免耕土壤细菌和真菌生物量与活性的研究. 生态学杂志, 2001, 20(2): 30- 36.
[16]许光辉, 郑洪元. 土壤微生物分析方法手册. 北京: 农业出版社, 1986: 226- 227.
[17]Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: A review. Biology and Fertility of Soils, 1999, 29(2): 111- 129.
[18]Powlson D S, Brookes P C, Christensen B T. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation. Soil Biology & Biochemistry, 1987, 19(2): 159- 164.
[19]何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义. 土壤, 1997, 29(2): 61- 69.
[20]王利民, 邱珊莲, 林新坚, 黄东风, 李卫华, 邱孝煊. 不同培肥茶园土壤微生物量碳氮及相关参数的变化与敏感性分析. 生态学报, 2012, 32(18): 5930- 5936.
[21]衡涛, 吴建国, 谢世友, 武美香. 高寒草甸壤土碳和氮以及微生物量碳和氮对温度和降水量变化的响应. 中国农学通报, 2011, 27(3): 425- 430.
[22]Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biological Reviews, 1992, 67(3): 321- 358.
[23]翟瑞常, 张之一. 耕作对土壤生物碳动态变化的影响. 土壤学报, 1996, 33(2): 201- 210.
[24]陈学文, 张晓平, 梁爱珍, 贾淑霞, 时秀焕, 范如芹, 魏守才. 耕作方式对黑土硬度和容重的影响. 应用生态学报, 2012, 23(2): 439- 444.
[25]徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响. 土壤学报, 2002, 39(1): 89- 96.
[26]张丽华, 黄高宝, 张仁陟. 旱作条件下免耕对土壤微生物量碳、氮、磷的影响. 甘肃农业科技, 2006, (12): 3- 6.
[27]陈全胜, 李凌浩, 韩兴国, 董云社, 王智平, 熊小刚, 阎志丹. 土壤呼吸对温度升高的适应. 生态学报, 2004, 24(11): 2649- 2655.
[28]Raich J W, Schlesinger W H. The global carbon-dioxide flux in soil respiration and its relationship to vegetation and climate. Tellus B, 1992, 44(2): 81- 99.
[29]Moyano F E, Manzoni S, Chenu C. Responses of soil heterotrophic respiration to moisture availability: An exploration of processes and models. Soil Biology & Biochemistry, 2013, 59: 72- 85.
[30]Bastida F, Barberá G G, García C, Hernández T. Influence of orientation, vegetation and season on soil microbial and biochemical characteristics under semiarid conditions. Applied Soil Ecology, 2008, 38(1): 62- 70.
[31]蒋跃利, 赵彤, 闫浩, 黄懿梅, 安韶山. 黄土丘陵区不同土地利用方式对土壤微生物量碳氮磷的影响. 水土保持通报, 2013, 33(6): 62- 68.
[32]Deluca T H, Keeney D R. Soluble carbon and nitrogen pools of prairie and cultivated soils: Seasonal variation. Soil Science Society of America Journal, 1994, 58(3): 835- 840.
[33]Edwards K A, McCulloch J, Kershaw G P, Jefferies R L. Soil microbial and nutrient dynamics in a wet Arctic sedge meadow in late winter and early spring. Soil Biology & Biochemistry, 2006, 38(9): 2843- 2851.
[34]Högberg P, Read D J. Towards a more plant physiological perspective on soil ecology. Trends in Ecology and Evolution, 2006, 21(10): 548- 554.
[35]张丽华, 陈亚宁, 李卫红, 赵锐锋, 葛洪涛. 干旱区荒漠生态系统的土壤呼吸. 生态学报, 2008, 28(5): 1911- 1922.
[36]陈书涛, 刘巧辉, 胡正华, 刘艳, 任景全, 谢薇. 不同土地利用方式下土壤呼吸空间变异的影响因素. 环境科学, 2013, 34(3): 1017- 1025.
[37]陈书涛, 张勇, 胡正华, 史艳姝, 沈小帅. 臭氧浓度升高与土壤湿度对农田土壤微生物呼吸温度敏感性的影响. 环境科学, 2012, 33(5): 1476- 1483.
[38]Conant R T, Dalla-Betta P, Klopatek C C, Klopatek J M. Controls on soil respiration in semiarid soils. Soil Biology Biochemistry, 2004, 36(6): 945- 951.
[39]Davidson E A, Belk E, Boone R D. Soil water content and temperature as independent or confounded factors controlling soil respiration in a temperate mixed hardwood forest. Global Change Biology, 1998, 4(2): 217- 227.
[40]Borken W, Xu Y J, Brumme R, Lamersdorf N. A climate change scenario for carbon dioxide and dissolved organic carbon fluxes from a temperate forest soil Drought and rewetting effects. Soil Science Society America Journal, 1999, 63(6): 1848- 1855.
[41]Davidson E A, Verchot L V, Cattnio J H, Ackerman I L, Carvalho J E M. Effects of soil water content on soil respiration in forests and cattle pastures of eastern Amazonia. Biogeochemistry, 2000, 48(1): 53- 69.
Characteristics ofmicrobes in loamy meadow chestnut soil planted with naked oats using different tillage methods
HAO Yaxing1, ZHANG Lifeng1,2,*, HAN Kaihong1,WANG Weijing1
1CollegeofAgronomy,AgriculturalUniversityofHebei,Baoding071000,China2ZhangbeiAgriculturalResourcesandEcologicalEnvironmentKeyFieldResearchStation,MinistryofAgricultureofChina,Zhangjiakou076450,China
Abstract:The Bashang plateau in Hebei Province has a unique ecological environment: high altitude, low temperature, and a semiarid climate, where the arable land shows serious desertification, wind erosion, and low crop productivity. The actions of the soil microbes in this region, especially those in the arable land, during crop growth seasons are still unclear. In this study, we monitored the soil microbial carbon (C), active-microbe amounts, and the soil respiration rate in the field-planted naked oats according to a 12-year permanent-location tillage experiment. We tested the treatments “no tillage” (NT), subsoiling tillage with high stubble (PT), and conventional tillage with straw returning (CT), in order to determine the effects of tillage methods on microbial activities in the meadow chestnut soil. The results showed that the soil microbial biomass C and the active-microbe amount exhibited a change pattern of the “W shape” around the heading stage. After lengthy NT and PT treatments, the soil microbial biomass C in the 0—10 cm soil layer was enriched. The difference in the active microbial amounts among various soil layers between NT and PT was decreased after longer tillage treatments. The soil respiration rate in the field displayed a change pattern of the “U shape” during various tillage treatments. NT yielded higher values in the 0—10 cm soil layer than did PT and CT. Across the whole growth stage, the respiration quotient (qCO2) in the soil was always low during all tillage treatments and significantly increased after the harvest. Nonetheless, in comparison with NC and PC, NT increased qCO2 in the 0—10 cm soil layer. In addition, CT was confirmed to play an important role in activation of the soil nutrient stocks and in promotion of the release of available nutrients in the cold ecological region.
Key Words:tillage methods; soil microbial biomass C; active microbe amount; soil respiration rate; loamy meadow-chestnut soil
基金项目:农业部公益性行业(农业)科研专项经费资助(201003053)
收稿日期:2014- 07- 22; 网络出版日期:2015- 07- 22
DOI:10.5846/stxb201407221489
*通讯作者Corresponding author.E-mail: zlf@hebau.edu.cn
郝雅星, 张立峰, 韩凯虹, 王伟婧.不同耕作方式下草甸栗钙土燕麦田土壤微生物特征.生态学报,2016,36(5):1462- 1470.
Hao Y X, Zhang L F, Han K H,Wang W J.Characteristics ofmicrobes in loamy meadow chestnut soil planted with naked oats using different tillage methods.Acta Ecologica Sinica,2016,36(5):1462- 1470.

