汞在新建水库食物网中生物累积与风险评价研究进展
李嗣新, 胡菊香, 池仕运, 胡 俊
水利部水工程生态效应与生态修复重点实验室,水利部中国科学院水工程生态研究所,武汉 430079
汞在新建水库食物网中生物累积与风险评价研究进展
李嗣新*, 胡菊香, 池仕运, 胡俊
水利部水工程生态效应与生态修复重点实验室,水利部中国科学院水工程生态研究所,武汉430079
摘要:汞是唯一参与全球循环的液态重金属。1974年,自美国学者Smith首次报道水库中鱼类总汞含量高于邻近自然湖泊以来,水库中鱼类汞升高的风险成为新建水库环境影响评价中的重要内容之一。汞在水库生态系统生物组分和非生物组分中含量升高的现象先后在世界各国报道,包括加拿大、美国、芬兰、泰国和巴西等。通过对系列的野外研究进行回顾,表明了水库形成后生态系统中汞的甲基化过程发生了变化。水库形成对汞在食物网中的鱼类、底栖生物、浮游生物的累积产生影响。水库中汞的生物累积、迁移转化主要与被淹没土壤和植物腐解过程有着直接或间接的关系。水库形成后,总汞、甲基汞和甲基汞比例在生态系统食物网各组分中的变化并不一致。蓄水后,水体中总汞变化较小,甲基汞和甲基汞比例上升明显;浮游生物尤其是浮游动物中总汞升高,但甲基汞和甲基汞比例升高更为明显;与浮游动物类似,底栖水生昆虫中总汞升高,甲基汞和甲基汞比例升高也更为明显;鱼类作为食物网顶级消费者,甲基汞比例一般在80%以上,在水库形成后鱼类总汞和甲基汞均明显升高,但甲基汞比例变化已经不大。这些变化揭示了水库形成后甲基汞在食物网传递的两个主要可能途径,一是微型生物食物网。通过悬浮颗粒物、浮游植物、浮游动物这一环节,甲基汞和甲基汞比例有明显的增加。第二个途径是底层生物食物网。通过悬浮颗粒物、细菌、碎屑食性底栖水生昆虫、肉食型底栖水生昆虫环节,甲基汞和甲基汞比例明显增加。这两种途径均能导致以水生昆虫、小鱼、甲壳类等为食的肉食性鱼类汞含量增加。水库形成后,生态系统中汞的甲基化发生了明显的“加速”过程。这种“加速”过程最直接的因素是成库后大量土壤淹没使得汞的甲基化平衡被打破。这个过程主要有两方面的影响。一方面是直接影响,被淹没土壤和植被在腐解过程中主动或被动地将甲基汞释放到水库生态系统中;另一方面是间接影响,被淹没土壤和植被的腐解使水库底部形成厌氧环境,有利于无机汞从被淹没土壤和植被中溶出,为甲基化反应提供充裕的、可供甲基化的无机汞,同时腐解产生的大量营养物质为微生物提供丰富食物来源,使硫酸盐还原菌大量繁殖,促进无机汞的甲基化。在我国,有关汞在新建水库食物网中生物累积和风险评价的研究有待进一步加强。
关键词:汞;新建水库;食物网;生物累积
20世纪50年代末,世界先后出现了一些重大的污染事件,按照污染物质的化学性质可将这些污染事件大致分为3个类型[1]:(1)重金属,如汞(Hg)引起的水俣病、镉引起的骨痛病等;(2)有机农药类,如滴滴涕及衍生物(DDT、DDE和DDD)在鸟类的生物富集;(3)放射性核素,如放射性铯(137Cs)和放射性碘(131I)在鱼类中高浓度富集。野外的污染事件极大地推动了生态毒理这门新兴学科的发展。在此之前,人们对污染的认识可以概括为“污染稀释”模式[1],即污染物可以往更大的海洋生态系统进行排放和降解。但这些野外案例打破了人们旧有的观念,即使水体中的污染物质含量很小,也能够在食物网中进行累积和传递,形成生物放大的现象。这类物质通常具有不易被生物代谢和降解的特性,使得生态系统食物网中营养级越高的生物具有更高的污染物质浓度。
汞在新建水库生态系统中迁移转化的关注始于1974年美国学者Smith的野外调查研究。Smith等[2]首次报道了新建的威拉德湾水库鱼体内总汞含量普遍高于邻近的自然湖库的现象。威拉德湾水库鱼体总汞浓度大量超标,均超出世界卫生组织汞限量标准(0.50 μg/g 湿重)。当时世界上主要的发达地区北美、欧洲正大量兴建大坝。在大坝修建之前,人们对汞风险认识的欠缺使得水库蓄水前的数据积累并不多。在大坝兴建之后,Smith等[2]的研究促使人们开始关注汞在新建水库中迁移转化和生态风险等问题。新建水库中鱼类汞升高的风险开始成为环境影响评价中的重要研究课题。在此之后,水库形成引起鱼体汞含量升高的野外案例先后在美国、加拿大、芬兰、泰国等国家被报道,鱼体汞含量往往超过世界卫生组织汞限量标准值的数倍或数十倍,有关汞在新建水库食物网中生物累积与风险评价的研究才逐渐增多。水库形成是否引起鱼体汞含量升高,汞在水库形成前后的迁移转化机制、汞在水生食物网中生物累积、生物放大等动力学过程,逐渐成为后续研究的重点。
1世界区域内水库形成引起鱼体汞含量升高的研究报道
1.1亚北极地区1.1.1加拿大
在加拿大马尼托巴省北部的丘吉尔河,Bodaly等[3]报道了3个湖泊蓄水前后鱼体总汞含量变化。南印第安湖1976年开始蓄水,湖中的肉食性鱼类北美梭鱼由蓄水前的 0.25—0.35 μg/g 湿重增加到蓄水后(1979至1982年)的0.67—0.95 μg/g 湿重。大眼蓝鲈由蓄水前的 0.19—0.30 μg/g 湿重增加到蓄水后(1978至1982年)的0.57—0.75 μg/g 湿重。另外,这两种肉食性鱼类在其他2个流域(瑞特流域和柏林伍特流域)10个湖泊蓄水后总汞含量接近或超过了1.00 μg/g 湿重。这10个湖泊既没有工业点源污染和强烈的农业活动,大气沉降也不是湖泊内鱼体总汞含量升高的主导因素。在瑞特湖和怒提吉湖,两种肉食性鱼类总汞含量最高,变化范围为1.15—2.90 μg/g 湿重。水库形成后淹没土壤的细菌甲基化被认为是导致成库后湖泊内鱼体总汞含量升高的主要原因。在蓄水后的2—3a,鱼体中总汞含量上升迅速,而且在蓄水后的5—8a仍然没有下降。
此后,Bodaly等[4]测定了马尼托巴省北部14个湖泊蓄水后(最长蓄水时间达35a)3种鱼类的总汞浓度。鱼体总汞浓度在蓄水前为0.06—0.14 μg/g 湿重,在邻近自然湖泊中为0.03—0.06 μg/g 湿重,在蓄水后增加到0.19—0.40 μg/g 湿重。在大多数水库中,白鲑总汞含量在蓄水后的6a达到峰值,在蓄水后的10—20a回到蓄水前的背景值。肉食性鱼类北美梭鱼和大眼蓝鲈总汞浓度在蓄水前为0.19—0.47 μg/g 湿重,在邻近自然湖泊中为0.35—0.47 μg/g 湿重,在蓄水后2—8a达到最高,范围为0.73—2.59 μg/g 湿重,蓄水后的10—23a回归至蓄水前的背景值水平。
在加拿大魁北克省西北部的拉格朗德河,Verdon等[5]报道了水电站蓄水后两种非肉食性鱼类(白鲑和真亚口鱼)和两种肉食性鱼类(北美梭鱼和大眼蓝鲈)的总汞含量。成库后非肉食性鱼类总汞含量比肉食性鱼类在更短时间内达到峰值,在蓄水后5a增长了4倍。而肉食性鱼类北美梭鱼总汞含量在蓄水后的9a仍在继续增长[6- 7]。
1.1.2芬兰
在芬兰北部,Lodenius等[8]报道了成库后的人工湖库里鱼体总汞含量高于自然湖泊。波蒂帕塔水库江鳕和梭鱼总汞含量最高,超过了芬兰国家安全标准值(0.50 μg/g 湿重),其次是洛卡水库和凯米亚威水库的鱼类,3个水库鱼体总汞含量均明显高于邻近的路易洛加维湖(表1)。Porvari[9]报道了芬兰西部和北部18个水库江鳕、鲈、北美梭鱼、拟鲤、白鲑和高白鲑鱼体总汞含量长达16a的监测。研究结果发现,在淹没后鱼体总汞含量短期内迅速升高,在15—25a后仍高于成库前的背景值。
1.2温带地区1.2.1美国
在美国犹他州,Smith等[2]首次报道了新建的威拉德湾水库和5个相邻湖库的鱼体总汞含量。调查结果发现,新建威拉德湾水库鱼体内总汞含量远远高于邻近的自然湖库的现象。威拉德湾水库鱼体总汞浓度均大量超标,其中,肉食性鱼类大眼蓝鲈和大口黑鲈有着较高的总汞含量,其含量平均值远远超出世界卫生组织汞限量标准(0.50 μg/g)3至4倍(表2)。

表1 芬兰北部湖库鱼体总汞含量[8]
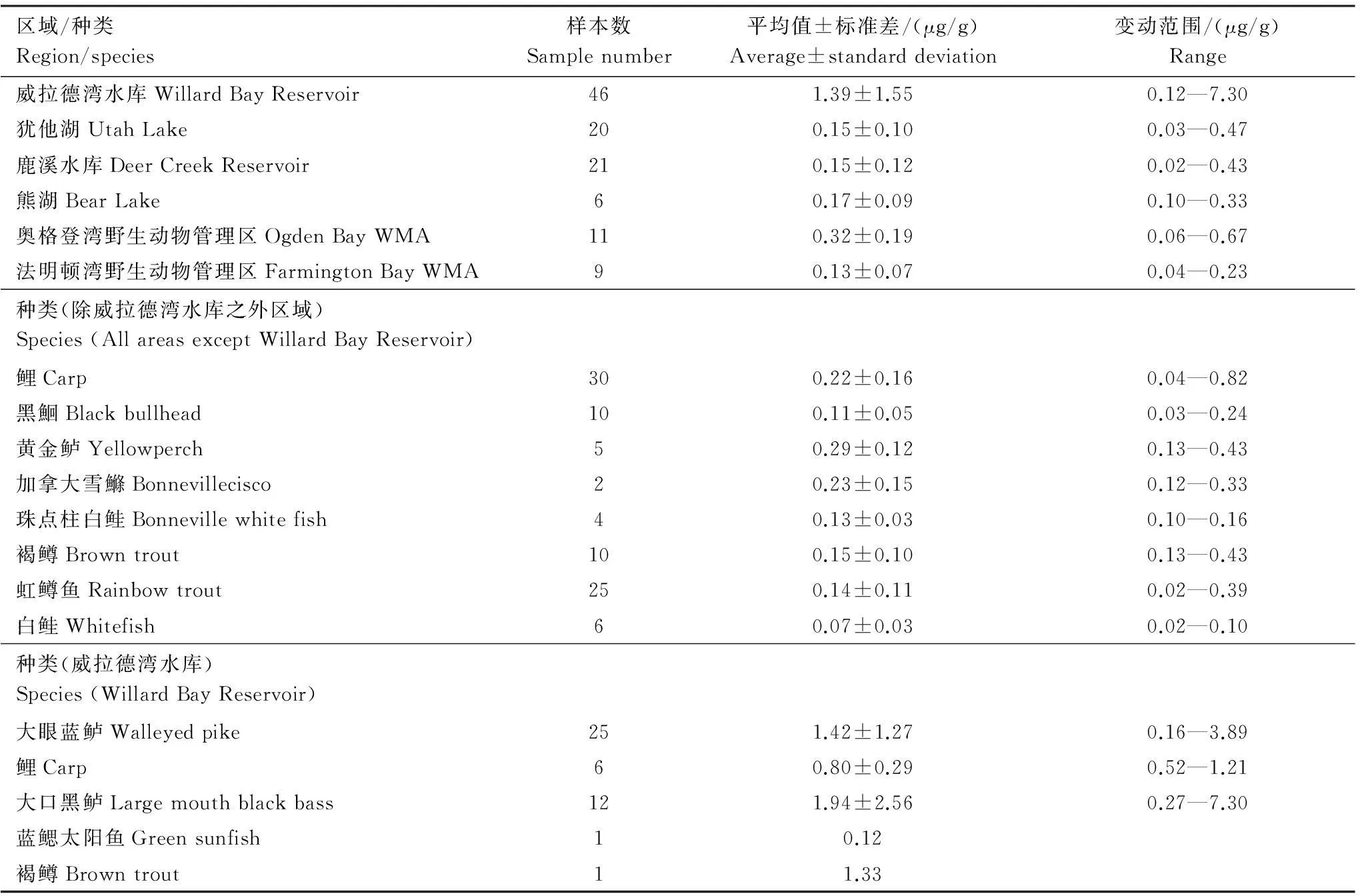
表2 1970至1971年美国犹他州鱼体内总汞含量[2]
在美国东南部的卡罗来纳州,Abernathy和Cumbie[10]调查了3个水库中大口黑鲈的总汞含量。大口黑鲈总汞含量最高的是库龄最小的贫营养型水库约卡西湖,最低的是库龄最大的富营养化水库哈特维尔湖(表3)。水库中鱼体总汞含量的升高取决于被淹没土壤中细菌发生甲基化过程的速率,较小库龄的水库中更加厌氧的条件使得细菌甲基化过程更加迅速,相比较大库龄的水库鱼体总汞含量更高。

表3 1973至1975年美国卡南罗来纳州不同水库中大口黑鲈总汞含量[10]
在美国伊利诺州南部,Cox等[11]发现成库后锡达湖大口黑鲈总汞平均含量为0.48 μg/g 湿重,接近0.50 μg/g 湿重限值(表4),而另一种肉食性鱼类双刺盖鲈的总汞含量平均值也高达0.59 μg/g 湿重(15个样本)。位于食物链低端的蓝鳃太阳鱼总汞含量则较低,平均值在0.29 μg/g湿重以下。

表4 1976年秋季美国伊利诺州锡达湖大口黑鲈总汞含量[11]
1.3热带地区
1.3.1泰国
1990年,Yingcharoen和Bodaly[12]对泰国的2个水库和1个即将建成水库的区域进行了鱼体内总汞含量调查(表5)。调查表明,考兰水库和席那克林水库鱼体内总汞含量高于即将成库的南长河区域。考兰水库(5年库龄)的一些鱼类总汞含量低于席那克林水库(10年库龄),相比温带和亚北极地区水库,热带地区水库成库后汞的甲基化过程更快,持续时间更短。

表5 1990年泰国3个水库鱼体总汞含量[12]
1.3.2巴西
在巴西中西部马托格罗索州库亚巴市,Hylander等[13]对曼索拉戈水库中鱼体总汞含量进行了蓄水前后的调查。在淹没之前7年,肉食性鱼类总汞含量为0.07—0.21 μg/g湿重,在刚淹没后肉食性鱼类总汞含量为0.07—0.76 μg/g湿重,在淹没后的第3年,肉食性鱼类(虎鲶、黄金河虎鱼)总汞含量增加到0.22—0.94 μg/g湿重[13](表6)。在淹没后的第6年,水库中鱼类(3种肉食性鱼类和1种杂食性鱼类)总汞的平均含量仍然5倍高于蓄水前的背景值[14]。
表6巴西里约曼索河和卡斯卡河(刚淹没,1999年)和曼索拉戈水库(淹没后3a,2002年)鱼体总汞含量、体重和体长值[13]
Table 6Total mercury concentrations, body weight and length of fish from Rio Manso River, Rio Casca River (with 1 year after flood, 1999) and Lago Manso reservoir (3 years after flood, 2002), Brazil[12]

年份、种类Yearandspecies样本数量Samplenumber总汞/(μg/g湿重)Totalmercury范围Range均值±标准差average±standarddeviation体重/gBodyweight范围Range均值±标准差average±standarddeviation体长/cmBodylength均值±标准差average±standarddeviation1999扁吻半丘油鲶Hemisorubimplatyrhynchos30.14—0.370.23±0.131020—38502230±145948±10条纹鸭嘴鲶Pseudoplatystomacoruscans10.11230057虎鲶Pseudoplatystomafasciatum10.13220055缘锯脂鲤Serrasalmusmarginatus20.07—0.270.17±0.14168—246207±5519±2南美祖鲁鲿Zungarozungaro60.17—0.760.30±0.222670—73004428±165056±72002希氏大鳞脂鲤Bryconhilarii100.09—0.290.18±0.11464—1152688±20931±2虎鲶Pseudoplatystomafasciatum60.22—0.400.30±0.142400—36003133±44270±7红肚水虎鱼Pygocentrusnattereri140.08—0.450.22±0.2691—343173±6718±2黄金河虎鱼Salminusbrasiliensis50.34—0.940.71±0.622200—57003430±143455±6
2水库形成后汞释放对水体的影响
由于汞在生态系统食物网中生物放大作用,使得汞在生物体内含量要比在水体中高2—4个数量级。因此,在水生生态系统各组分中,天然水体中汞含量反而很低,尤其是甲基汞含量,一般为ng级,所要求的分析技术也更高。随着20世纪80年代末,水体中汞痕量分析技术的逐步建立,有关水库形成后被淹没土壤对水体汞释放影响的野外研究才开始陆续报道。
最初报道的研究地点在加拿大安大略省西北部的一个人工实验水库,Kelly等[15]研究发现,这个人工水库在蓄水2a后,水体中总汞含量只是略高于淹没前,而水体中甲基汞含量增长惊人,从0.10 ng/L增加到0.90 ng/L,浓度增长了近10倍,甲基汞占总汞的比率也增长了近7倍(图1),被淹没的湿地成为甲基汞释放的主要产所,无机汞向甲基汞的形态转化是水体甲基汞增加的主要原因。
在加拿大魁北克省西部,Montgomery等[16]对3个不同库龄水库(库龄分别为2个月、18a和69a)以及邻近自然湖泊中水体溶解态总汞和溶解态甲基汞的含量进行调查。研究发现,水体中溶解态甲基汞含量主要受到水库的水体滞留时间、水质参数影响。3个水库中溶解态总汞平均值与邻近自然湖泊相比,升高不大,但溶解态甲基汞平均值比邻近自然湖泊高出4.6倍(表7)。18a库龄水库水体中溶解态甲基汞仍为邻近自然湖泊的5倍,69a库龄水库水体中溶解态甲基汞才恢复至邻近自然湖泊的背景值。

图1 加拿大安大略省西北部的一个人工实验水库蓄水前后水体中汞变化[15]Fig.1 Mercury concentrations in water before and after the impoundment of an artificial experimental reservoir, northwestern Ontario, Canada[15]
Table 7Dissolved methylmercury and total mercury in water before and after impoundment of reservoirs in western Quebec, Canada
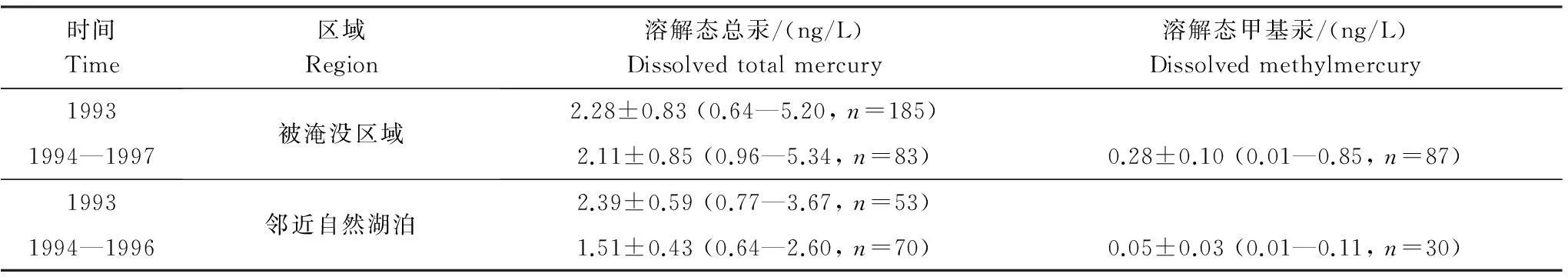
时间Time区域Region溶解态总汞/(ng/L)Dissolvedtotalmercury溶解态甲基汞/(ng/L)Dissolvedmethylmercury19931994—1997被淹没区域2.28±0.83(0.64—5.20,n=185)2.11±0.85(0.96—5.34,n=83)0.28±0.10(0.01—0.85,n=87)19931994—1996邻近自然湖泊2.39±0.59(0.77—3.67,n=53)1.51±0.43(0.64—2.60,n=70)0.05±0.03(0.01—0.11,n=30)

图2 美国好湖水库与邻近自然湖泊水体中总汞与甲基汞含量[17] Fig.2 Total mercury and methylmercury concentrations in water from Great Lake and adjacent natural lakes, USA[17]
在美国明尼苏达州西北部,Brigham等[17]对蓄水2a的好湖水库和3个邻近自然湖泊水体中总汞和甲基汞进行了为期2a的调查。结果表明,好湖水库蓄水2至4a期间,水库3个采样点水体中总汞含量与邻近自然湖泊相比,变化并不大,但甲基汞升高明显,比邻近自然湖泊高出2倍(图2)。
3水库形成后汞释放对浮游生物的影响
在加拿大安大略省西北部,Paterson等[18]调查了1个人工实验水库蓄水前后浮游动物总汞和甲基汞含量的变化(表8)。浮游动物样品通过不同网孔浮游生物网捞取和人工挑拣获得纯动物样品。结果显示,刚淹没的第1年,实验水库浮游动物总汞含量从蓄水前的0.09 μg/g 干重上升到蓄水后的0.50 μg/g干重以上,甲基汞含量从蓄水前的0.032 μg/g干重上升到蓄水后的0.30 μg/g干重以上。蓄水后通过浮游动物群落这一环节甲基汞通量增加了10至100倍,从水体或悬浮物到浮游动物的生物累积因子在蓄水前后并没有明显变化。
表8加拿大安大略省人工实验水库蓄水前后浮游动物汞含量和变化范围[18]
Table 8Concentrations and range of mercury in zooplankton from artificial experimental reservoir before and after impoundment, Quebec, Canada[10]

组分Component汞浓度Mercuryconcentration汞含量Hgcontent/(μg/g干重)人工实验水库L979蓄水前人工实验水库L979蓄水后对照湖泊L6321992—19931993199419951992—1995浮游动物甲基汞(80μm)32(11—54)346(79—692)319(37—615)300(29—664)102(7—293)Zooplankton甲基汞(400μm)87(33—151)410(126—658)530(68—1093)342(30—931)102(17—234)总汞(80μm)122(60—191)578(238—730)619(171—957)502(270—1173)222(45—504)总汞(400μm)235(32—490)甲基汞百分比(80μm)24(16—39)48(38—49)49(22—68)62(52—94)42(13—70)甲基汞百分比(400μm)47(24—78)水体Water甲基汞百分比/%7(2—23)35(12—58)32(8—67)34(8—68)10(5—21)

图3 加拿大魁北克省水库和邻近自然湖泊不同大小浮游生物甲基汞含量[19]Fig.3 Methylmercury concentrations in plankton with different sizes from adjacent natural lakes and reservoirs, Quebec, Canada[19]
在加拿大魁北克省北部,Tremblay等[19]调查了7个水库和5个自然湖泊中浮游生物甲基汞含量。浮游动物样品通过不同网孔浮游生物网捞取,未进行人工挑拣获得纯样。调查表明,水体中浮游生物总汞和甲基汞含量在蓄水后1a迅速增加,在蓄水后8a回归至邻近自然湖泊水平,变动范围为0.02—0.14 μg/g干重沿岸带浮游生物总汞含量在成库后16a仍然很高,变动范围为0.28—0.45 μg/g干重(图3)。蓄水后,从悬浮颗粒物、小型浮游生物至大型浮游生物是成库后甲基汞沿着浮游生物网传递的一个主要途径[20]。
4水库形成后汞释放对底栖生物的影响
在加拿大魁北克省北部,Tremblay等[21]对1个14a库龄拉格朗德二级水库和1个邻近自然湖泊的底栖水生昆虫总汞和甲基汞含量进行了调查。拉格朗德水库中底栖水生昆虫总汞含量高出自然湖泊2至3倍,甲基汞则高出4至12倍(图4)。腐食性、腐食植食性、植食肉食性和肉食性水生昆虫中甲基汞占总汞的比例依次升高,分别为20%—25%、30%—40%、60%—85%和95%。底栖水生昆虫作为鱼类的重要食物来源,很可能是水体中甲基汞向鱼类进行生物累积的途径中的重要环节。

图4 加拿大魁北克省拉格朗德二级水库和自然湖泊中不同营养级底栖水生昆虫总汞和甲基汞含量[21]Fig.4 Total mercury and methylmercury concentrations in benthic aquatic insects with different tropic levels from natural lakes and reservoirs of La Grande hydroelectric complex, Quebec, Canada[21]
随后建成的拉格朗德一级水库也存在着甲基汞在底栖水生昆虫中进行生物放大的现象,土壤淹没释放的悬浮颗粒物和伴随的细菌活动使得水体中的甲基汞向底栖水生昆虫进行迁移和累积[22]。Tremblay等[23]对拉格朗德水库的研究表明,蓄水后不仅水生昆虫生物量比邻近自然湖泊增长2倍,水生昆虫甲基汞含量也增长了2至3 倍。水库中水生昆虫的甲基汞含量为0.04—0.80 μg/g干重(图5),远远高于邻近自然湖泊中水生昆虫的甲基汞含量(0.03—0.09 μg/g干重)。水库蓄水后水生昆虫群落中甲基汞累积总量比邻近自然湖泊增加了2至4倍。
5水库形成后汞甲基化过程“加速”机制
综合以上研究,水库形成后汞的甲基化速率受到多种因素影响,主要取决于水库特征(库龄、运行方式、水位变化)、被淹没土壤(面积、类型、有机质含量、汞背景值)、微生物(种类、活性)、水体理化性质与底层环境(温度,pH值,氧化还原电位、TOC、营养水平)等[24- 26]。水库形成后,生态系统中汞的甲基化发生了明显的“加速”过程。这种“加速”过程最直接的因素是成库后大量土壤淹没使得汞的甲基化平衡被打破。这个过程主要有两方面的影响。一方面是直接影响,被淹没土壤和植被在腐解过程中主动或被动地将甲基汞释放到水库生态系统中;另一方面是间接影响,被淹没土壤和植被的腐解使水库底部形成厌氧环境,有利于无机汞从被淹没土壤和植被中溶出,为甲基化反应提供充裕的、可供甲基化的无机汞,同时腐解产生的大量营养物质为微生物提供丰富食物来源,使硫酸盐还原菌大量繁殖,促进无机汞的甲基化[27]。
回顾以上文献不难看出,水库形成后,总汞、甲基汞和甲基汞比例在生态系统食物网各组分中的变化并不一致。蓄水后,水体中总汞变化较小,甲基汞和甲基汞比例上升明显;浮游生物尤其是浮游动物中总汞升高,但甲基汞和甲基汞比例升高更为明显;与浮游动物类似,底栖水生昆虫中总汞升高,甲基汞和甲基汞比例升高也更为明显;鱼类作为食物网顶级消费者,甲基汞比例一般在80%以上,在水库形成后鱼类总汞和甲基汞均明显升高,但甲基汞比例变化已经不大。这些变化揭示了水库形成后甲基汞在食物网的传递的两个主要可能途径,一是微型生物食物网。通过悬浮颗粒物、浮游植物、浮游动物这一环节,甲基汞和甲基汞比例有明显的增加。第二个途径是底层生物食物网。通过悬浮颗粒物、细菌、碎屑食性底栖水生昆虫、肉食型底栖水生昆虫环节,甲基汞和甲基汞比例明显增加。这两种途径均能导致以水生昆虫、小鱼、甲壳类等为食的肉食性鱼类汞含量增加。
6展望
汞在水库生态系统中的生物累积与风险评价主要涉及环境化学、水生生物学两门学科交叉。由于主要的水生生物鱼类相对浮游生物和底栖生物来说易于采集获取,有关鱼类中汞生物富集的研究报道较多。20世纪80年代末水体中汞痕量技术的建立和在此之前发达国家大坝的大规模兴建,使得水库蓄水前水体中汞含量的本底数据缺乏,因此,有关水库蓄水前后水体中汞含量变化的报道并不多见。在我国高汞背景值的西南地区,汞在新建水库食物网中生物累积和风险评价的研究并不多,在我国乌江流域已有少量相关报道[28-30]。Yao等[29]报道了乌江成库了5a的洪家渡水库中鱼类总汞含量,调查结果表明所测定的鱼类样本没有超出世界卫生组织的0.50 μg/g的限值,被淹没土壤中发生的甲基化过程是缓慢的,甲基化速率也很低,成库后鱼类总汞含量没有上升或者上升缓慢。随后,Li等[28, 30]报道乌江下游彭水水库蓄水前后鱼体汞含量变化,在蓄水后的半年鱼体汞含量升高了3倍。但值得注意的是,97.1%的鱼类样本汞含量在0.50 μg/g的限值以下,超标率远远低于北美和欧洲亚北极地区。这些研究结果都说明乌江水库形成后发生的甲基化速率比国外北美、欧洲亚北极地区要低。但水库形成前后食物网中各营养级生物累积的甲基汞含量及其比例变化仍未有报道,成库后汞的甲基化发生过程、机制机理仍不清楚,鱼体中汞含量在成库后的变化趋势等等,在我国仍有待进一步加强研究。
致谢:感谢水利部中国科学院水工程生态研究所池仕运提供制图软件。
参考文献(References):
[1] Newman M C, Unger M A. Fundamentals ofEcotoxicology, Second Edition. Boca Raton, FL: CRC Press, 2009.
[2]Smith F A, Sharma R P, Lynn R I, Low J B. Mercury and selected pesticide levels in fish and wildlife of Utah: II. Levels of mercury, DDT, DDE, dieldrin and PCB in chukars, pheasants and waterfowl. Bulletin of Environmental Contamination and Toxicology, 1974, 12(2):153- 157.
[3]Bodaly R A, Hecky R E, Fudge R J P. Increases in fish mercury levels in lakes flooded by the Churchill RiverDiversion, Northern Manitoba. Canadian Journal of Fisheries and Aquatic Sciences, 1984, 41(4): 682- 691.
[4]Bodaly R A, Jansen W A, Majewski A R, Fudge R J P, Strange N E, Derksen A J, Green D J. Postimpoundment time course of increased mercury concentrations in fish in hydroelectric reservoirs of Northern Manitoba, Canada. Archives of Environmental Contamination and Toxicology, 2007, 53(3): 379- 389.
[5]Verdon R, Brouard D, Demers C, Lalumiere R, Laperle M, Schetagne R. Mercury evolution (1978-1988) in fishes of the La Grande hydroelectric complex, Quebec, Canada. Water, Air, and Soil Pollution, 1991, 56(1): 405- 417.
[6]Hecky R E, Ramsey D J, Bodaly R A, Strange N E. Increased methylmercury contamination in fish in newly formed freshwater reservoirs // Suzuki T, Imura N, Clarkson TW. Advances in Mercury Toxicology. New York: Plenum Press 1991, 33- 52.
[7]Schetagne R, Verdon R. Post-impoundment evolution of fish mercury levels at the La Grande Complex, Québec, Canada (from 1978 to 1996)// Lucotte M, Schetagne R, Thérien N, Langlois C, Tremblay A. Mercury in the biogeochemical cycle. Berlin: Springer, 1999, 235- 258.
[8]Lodenius M, Seppänen A, Herranen M. Accumulation of mercury in fish and man from reservoirs in Northern Finland. Water, Air, and Soil Pollution, 1983, 19(3): 237- 246.
[9]Porvari P. Development of fish mercury concentrations in Finnish reservoirs from 1979 to 1994. Science of the Total Environment, 1998, 213(1/3): 279- 290.
[10]Abernathy A R, Cumbie P M. Mercury accumulation by largemouth bass (Micropterussalmoides) in recently impounded reservoirs. Bulletin of Environmental Contamination and Toxicology, 1977, 17(5): 595- 602.
[11]Cox J A, Carnahan J, DiNunzio J, McCoy J, Meister J. Source of mercury in fish in new impoundments. Bulletin of Environmental Contamination and Toxicology, 1979, 23(1): 779- 783.
[12]Yingcharoen D, Bodaly R A. Elevated mercury levels in fish resulting from reservoir flooding in Thailand. Asian Fisheries Science, 1993, 6(1): 73- 80.
[13]Hylander L D, Gröhn J, Tropp M, Vikström A, Wolpher H, de Castro e Silva E, Meili M, Oliveira L J. Fish mercury increase in Lago Manso, a new hydroelectric reservoir in tropical Brazil. Journal of Environmental Management, 2006, 81(2): 155- 166.
[14]Tuomola L, Niklasson T, de Castro e Silva E, Hylander L D. Fish mercury development in relation to abiotic characteristics and carbon sources in a six-year-old, Brazilian reservoir. Science of the Total Environment, 2008, 390(1): 177- 187.
[15]Kelly C A, Rudd J W M, Bodaly R A, Roulet N P, St Louis V L, Heyes A, Moore T R, Schiff S, Aravena R, Scott K J, Dyck B, Harris R, Warner B, Edwards G. Increases in fluxes of greenhouse gases and methyl mercury following flooding of an experimental reservoir. Environmental Science & Technology, 1997, 31(5): 1334- 1344.
[16]Montgomery S, Lucotte M, Rheault I. Temporal and spatial influences of flooding on dissolved mercury in boreal reservoirs. Science of the Total Environment, 2000, 260(1/3): 147- 157.
[17]Brigham M E, Krabbenhoft D P, Olson M L, DeWild J F. Methylmercury in flood-control impoundments and natural waters of northwestern Minnesota, 1997-99. Water, Air, and Soil Pollution, 2002, 138(1/4): 61- 78.
[18]Paterson M J, Rudd J W M, Louis V S. Increases in total and methylmercury in zooplankton following flooding of a peatland reservoir. Environmental Science & Technology, 1998, 32(24): 3868- 3874.
[19]Tremblay A, Lucotte M, Schetagne R. Total mercury and methylmercury accumulation in zooplankton of hydroelectric reservoirs in northern Québec (Canada). Science of the Total Environment, 1998, 213(1/3): 307- 315.
[20]Lucotte M, Montgomery S, Bérgin M. Mercury dynamics at the flooded soil-water interface in reservoirs of northern Québec: In situ observations // Lucotte M, Schetagne R, Thérien N, Langlois C, Tremblay A. Mercury in the biogeochemical cycle, natural environments and hydroelectric reservoirs of Northern Québec (Canada). Berlin: Springer, 1999, 165- 189.
[21]Tremblay A, Lucotte M, Rheault I. Methylmercury in a benthic food web of two hydroelectric reservoirs anda natural lake of Northern Québec (Canada). Water, Air, and Soil Pollution, 1996, 91(3/4): 255- 269.
[22]Tremblay A, Lucotte M. Accumulation of total mercury and methyl mercury in insect larvae of hydroelectric reservoirs. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(4): 832- 841.
[23]Tremblay A, Cloutier L, Lucotte M. Total mercury and methylmercury fluxes via emerging insects in recently flooded hydroelectric reservoirs and a natural lake. Science of the Total Environment, 1998, 219(2/3): 209- 221.
[24]Downs S G, MacLeod C L, Lester J N. Mercury in precipitation and its relation to bioaccumulation in fish: A literature review. Water, Air, and Soil Pollution, 1998, 108(1/2): 149- 187.
[25]Zhang L, Wong M H. Environmental mercury contamination in China: sources and impacts. Environment International, 2007, 33(1): 108- 121.
[26]Feng X B, Qiu G L. Mercury pollution in Guizhou, Southwestern China — An overview. Science of the Total Environment, 2008, 400(1/3): 227- 237.
[27]Bodaly R A, St Louis V L, Paterson M J, Fudge R J P, Hall B D, Rosenberg D M, Rudd J W M. Bioaccumulation of mercury in the aquatic food chain in newly flooded areas. Metal Ions in Biological Systems, 1997, 34(9): 259- 287.
[28]Li S X, Zhou L F, Wang H J, Liang Y G, Hu J X, Chang J B. Feeding habits and habitats preferences affecting mercury bioaccumulation in 37 subtropical fish species from Wujiang River, China. Ecotoxicology, 2009, 18(2): 204- 210.
[29]Yao H, Feng X B, Guo Y N, Yan H Y, Fu X W, Li Z G, Meng B. Mercury and methylmercury concentrations in two newly constructed reservoirs in the Wujiang River, Guizhou, China. Environmental Toxicology and Chemistry, 2011, 30(3): 530- 537.
[30]Li S X, Zhou L F, Wang H J, Xiong M H, Yang Z, Hu J X, Liang Y G, Chang J B. Short-term impact of reservoir impoundment on the patterns of mercury distribution in a subtropical aquatic ecosystem, Wujiang River, southwest China. Environmental Science and Pollution Research, 2013, 20(7): 4396- 4404.
A review of the studies related to mercury bioaccumulation and risk assessment in the food web of newly constructed reservoirs
LI Sixin*, HU Juxiang, CHI Shiyun, HU Jun
KeyLaboratoryofEcologicalImpactsofHydraulic-projectsandRestorationofAquaticEcosystem,MinistryofWaterResources,InstituteofHydroecology,MinistryofWaterResources&ChineseAcademyofSciences,Wuhan430079,China
Abstract:Mercury is the only liquid metal in the global biogeochemical cycles. Since American scholar Smith first reported higher mercury concentrations in the muscle tissue of fish from reservoirs than in adjacent natural lakes in the USA, the risk of increased mercury levels in fish became a major issue in the assessment of an environmental impact of newly constructed reservoirs. Increased mercury concentrations in abiotic and biotic components of a reservoir ecosystem were reported in different countries, such as Canada, USA, Finland, Thailand, and Brazil. On the basis of the review of a series of field studies, it appears that the mercury methylation rate in an aquatic ecosystem changes after impoundment of the reservoir. Reservoir formation affects mercury bioaccumulation in fish, in benthic organisms, and plankton in the food web. Mercury bioaccumulation, migration, and transformation in a reservoir ecosystem are mainly related to the decomposition process in the flooded soil and vegetation directly or indirectly. After reservoir formation, total mercury concentrations, methylmercury concentrations, and the ratio of methylmercury to total mercury in the components of the food web of an aquatic ecosystem vary widely. After impoundment of the reservoir, methylmercury concentrations and the ratio of methylmercury to total mercury increase significantly while total mercury varies slightly in water. Total mercury concentrations increase while methylmercury concentrations and the ratio of methylmercury to total mercury increase more strongly in plankton (especially zooplankton). Similar results were also reported for benthic aquatic insects. Because fish are at the top of the food chain, the ratio of methylmercury to total mercury in fish has generally been above 80%. After reservoir formation, total mercury and methylmercury concentrations increase while the ratio of methylmercury to total mercury shows little or no change in fish. These results are indicative of two possible pathways of accumulation of methylmercury in the food web after reservoir formation. One is the plankton food web. Methylmercury bioaccumulates up from the suspended particulate matter, phytoplankton to zooplankton, and methylmercury concentrations and the ratio of methylmercury to total mercury increase. The other pathway is the benthic food web. Methylmercury bioaccumulates up from suspended particulate matter, from bacterial and detrivorous benthic aquatic insects to carnivorous benthic aquatic insects, whereas methylmercury concentration and the ratio of methylmercury to total mercury increase. Through these two pathways, methylmercury and the ratio of methylmercury to total mercury increase significantly in predatory fish that eat aquatic insects, small fish, and crustacean plankton. Mercury methylation in an aquatic ecosystem accelerates after reservoir formation. The balance of mercury methylation and demethylation changes and is affected by flooded soil and vegetation directly and indirectly. Methylmercury is released directly into a reservoir ecosystem during the process of microbial degradation of a flooded soil and vegetation. An anaerobic environment is formed via the degradation of the flooded soil and vegetation at the bottom of the water column of the reservoir. This process helps to dissolve inorganic mercury from the flooded soil and vegetation. The increased level of inorganic mercury is ready for methylation. Meanwhile, nutrients from the degradation serve as a food resource for microorganisms. Sulfate-reducing bacteria reproduce massively and contribute to methylation of inorganic mercury. In China, there is a need for more research on bioaccumulation and risk assessment of mercury in the food web of newly constructed reservoirs.
Key Words:mercury; newly constructed reservoir; food web; bioaccumulation
基金项目:国家自然科学基金(51279112); 水利部“948”项目(200709)
收稿日期:2014- 07- 15; 网络出版日期:2015- 07- 22
DOI:10.5846/stxb201407151442
*通讯作者Corresponding author.E-mail: lisixin@mail.ihe.ac.cn
李嗣新, 胡菊香, 池仕运, 胡俊.汞在新建水库食物网中生物累积与风险评价研究进展.生态学报,2016,36(5):1233- 1243.
Li S X, Hu J X, Chi S Y, Hu J.A review of the studies related to mercury bioaccumulation and risk assessment in the food web of newly constructed reservoirs.Acta Ecologica Sinica,2016,36(5):1233- 1243.

