淡黄花百合花药及子房不定芽诱导培养基筛选
刘 伟,常 征,丁长春
(1.文山学院 环境与资源学院,云南 文山 663099;2.文山州生物资源开发与研究中心,云南 文山 663099)
淡黄花百合花药及子房不定芽诱导培养基筛选
刘 伟1,2,常 征1,2,丁长春1,2
(1.文山学院 环境与资源学院,云南 文山 663099;2.文山州生物资源开发与研究中心,云南 文山 663099)
以淡黄花百合的花药和子房为外植体,采用MS培养基为基础培养基,研究不同植物生长调节剂及蔗糖对花药和子房不定芽诱导的影响,筛选出最佳诱导培养基。研究表明:花药作为外植体没有获得愈伤组织和不定芽,子房能培养出愈伤组织和生长健壮的不定芽;诱导子房产生愈伤组织的最佳培养基为NAA 0.5 mg/L+6-BA 0.5 mg/L+蔗糖4 g/L;诱导子房产生不定芽的最佳培养基为NAA 0.6 mg/L+ 6-BA 0.5 mg/L+蔗糖4 g/L。
淡黄花百合;花药;子房;组织培养
淡黄花百合是百合科(Liliaceae)百合属(Lilium)多年生草本球根植物,是具有观赏价值和药用价值的重要野生植物资源[1]。淡黄花百合可以用种子繁殖[2]、鳞片扦插繁殖[3]、也可以用组织培养技术来进行扩繁[4-6]。淡黄花百合作为重要的观赏植物资源,其重点应用在作为百合新品种培育的杂交亲本,但是在百合杂交育种中存在着基因库贫乏、种间杂交不亲和等局限性,而组织培养中的胚培养、花药培养等技术则可克服这些弊端。自1957年Robb首次发表了百合的组织培养文章后,到现在成功的百合组织培养方法已有40多种[7]。近年来,花丝、花托、花瓣等花器官已经用于百合的离体培养中[8],但有关淡黄花百合花药和子房的离体培养和快速繁殖尚未见报道。本试验以淡黄花百合的花药和子房为外植体进行不定芽的诱导,为进一步研究淡黄花百合花器官的组织培养技术奠定基础。
1 材料与方法
1.1 材料
以淡黄花百合成熟度高、花朵尚未开放的花药和子房为试验材料。
1.2 方法
1.2.1 外植体处理
剪取未开放的花蕾用自来水冲洗干净,放入锥形瓶中,在超净工作台上先用75%酒精浸泡2 min,再用0.1%氯化汞溶液浸泡5 min,无菌水洗5次后用手术刀将花蕾上的花瓣一片一片的去除,切取花药和子房作为外植体。
1.2.2 愈伤组织诱导
将已经处理好的外植体接种于以MS为基本培养基的不同培养基上,具体培养基配方见表1,每个处理的花药和子房各接种10瓶,每瓶1个外植体,置于光照12 h/d,光照强度1200 lx,温度(25±2)℃条件下培养,观察记录产生愈伤组织情况。
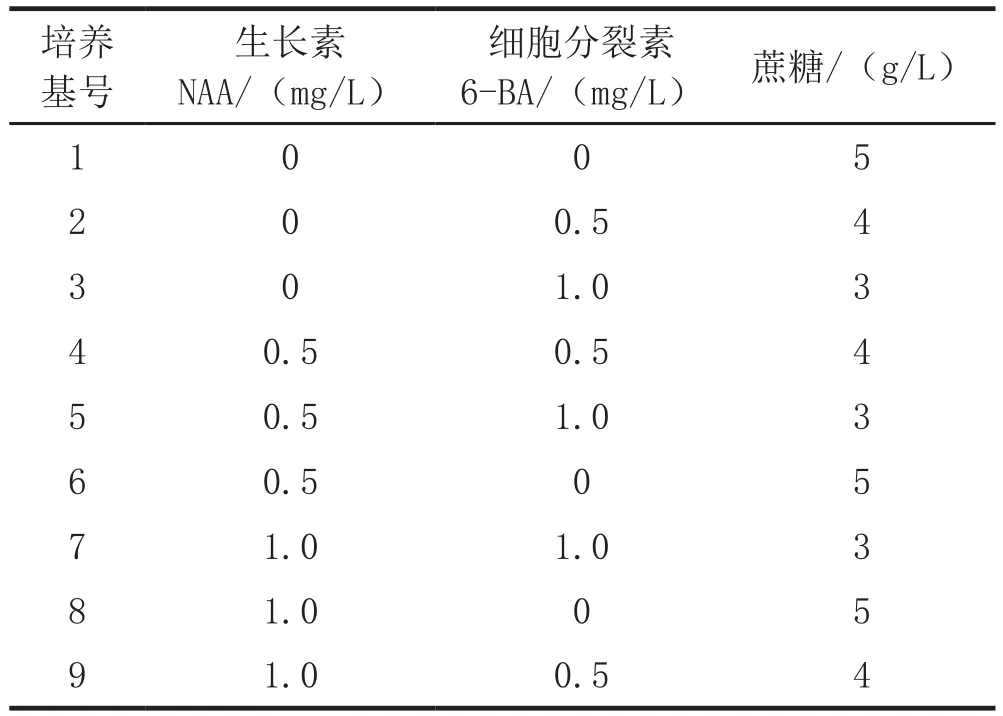
表1 诱导愈伤组织培养基配方
1.2.3 不定芽诱导
在诱导愈伤组织培养基中选择效果最好的组合为基本培养基,设计诱导芽的培养基为NAA 0.2、0.4、0.6 mg/L+6-BA 0.5 mg/L+蔗糖4 g/L,将获得的愈伤组织分别接种到芽诱导培养基上,在相同条件下培养,观察并记录不定芽产生情况。
2 结果与分析
2.1 不同培养基对愈伤组织诱导的影响
不同培养基对愈伤组织诱导的结果见表2。结果表明,所有培养基上培养的花药均在15~20 d内发生褐化、未产生愈伤组织,说明花药不宜作为外植体来进行组培快繁。将子房接种到培养基上后,20 d内所有外植体均保持绿色,未发生变化,至第30 d,除了2、4、9号培养基外,其它培养基上的子房也全部褐化死亡;至第60 d,2号培养上的子房仍保持绿色,但未产生愈伤组织,4号培养基上的子房明显膨大,产生较多愈伤组织,9号培养基上的子房膨大,有愈伤组织产生。由此可以看出,6-BA 0.5 mg/L+蔗糖4 g/L+一定浓度的NAA有利于子房愈伤组织的诱导。

表2 不同培养基对愈伤组织诱导情况
2.2 不同培养基对子房诱导芽的影响
以4号培养基为基础,设计子房产生的愈伤组织诱导不定芽的培养基为:NAA 0.2、0.4、0.6 mg/L+ 6-BA 0.5 mg/L+蔗糖4 g/L,将获得的愈伤组织分别接种到芽诱导培养基上,结果见表3。结果表明,在6-BA和蔗糖浓度一定的情况下,NAA浓度对不定芽的诱导有影响,本试验中,0.2 mg/L NAA效果最差,诱导率只有1.2,而且不定芽弱小,0.6 mg/L NAA效果最好,诱导率为2.5,而且不定芽长势好、生长快,呈现出健康的绿色。

表3 不同培养基对子房诱导芽的结果
3 结论与讨论
通过试验,淡黄花百合繁殖器官中花药不适合作为组织培养的外植体,子房作为外植体能够获得健康快速生长的不定芽;在子房愈伤组织及不定芽的诱导中,生长素和细胞分裂素都是必不可少的生长调节物质,其中细胞分裂素浓度不宜太高,生长素浓度也以中等为好,蔗糖在组培中能提供能量和碳源,也是不可或缺的重要成分,本试验得出以子房为外植体,诱导愈伤组织的最佳培养基为NAA 0.5 mg/L+6-BA 0.5 mg/L+蔗糖4 g/L;诱导不定芽的最佳培养基为NAA 0.6 mg/L+6-BA 0.5 mg/L+蔗糖4 g/L。
由于百合科百合属的许多植物既是重要的观赏资源又是重要的药用植物资源,因此对百合进行组织培养的研究很多,其中不少学者研究了花器官的组织培养[9]。用百合的花药和子房作为外植体研究植株再生的学者主要有三个目的,一是获得单倍体植株,二是脱毒培养获得无毒苗,三是为了快速扩繁,并且取得了成功。如袁素霞等[10]以CBM、MS和BDS三种培养基为基础,以百合未授粉子房为外植体,均诱导形成了胚胎并获得了再生植株;赵兴华等[11]以杂交百合的子房外植体得到了适合子房切片培养的培养基为MS+NAA 0~0.3 mg/L+蔗糖30000 mg/L ;而Sharp等[12]以铁炮百合的花药为外植体获得了单倍体植株。本试验中以淡黄花百合的子房为外植体获得不定芽的试验主要是为了快速繁殖,而单倍体的获得或者说胚胎的发生及植株的再生也可以继续研究,以花药为外植体进行愈伤组织和不定芽诱导却并未得到理想的结果,其原因尚未得知,有待于进一步研究。
[1] 张云, 原雅玲, 刘青林. 百合品种改良与生物技术研究进展[J]. 北京林业大学学报, 2001(6):56-59.
[2] 刘伟,曹晓慧.光照、pH值及NAA对野生淡黄花百合种子萌发的影响[J].北方园艺,2011(3):72-74.
[3] 刘伟,曹晓慧.不同层次、不同激素及浓度对淡黄花百合鳞片扦插的影响[J].北方园艺,2011(8):85-87.
[4] 李黛,谈锋,祝顺琴.淡黄花百合组织培养[J].种子,2005(9):27-29.
[5] 杨雪清,王淑芳,杨蕊,等.淡黄花百合丛生小鳞茎的诱导及快速繁殖[J].河南农业科学,2007(3):98-100.
[6] 张文娥,潘学军,胥青青,等.贵州野生淡黄花百合离体快繁研究[J].安徽农业科学,2008(14):5770-5772.
[7] 谭文澄,戴策刚. 观赏植物组织培养技术[M].北京:中国林业出版社,1991:290-297.
[8] 陈善娜,高建莉. 百合子房的组织培养[J].云南大学学报(自然科学报),1997(4):374-375.
[9] 李莺,徐薇,李星,等.百合黄天霸花丝离体快速繁殖体系的建立[J].种子,2013(11):29-33.
[10]袁素霞,李佳,明军,等.百合未授粉子房离体培养胚胎形成及植株再生[J].植物学报,2015(3):378-387.
[11]赵兴华,吴海红,杨佳明.百合远缘杂交未成熟子房的离体培养研究[J].北方园艺,2014(4):90-93.
[12] Sharp WR,Raskin RS,Sommer HE.Haploidy in Lilium[J]. Phytornorphology,1971(21):334-335.
Screening on Anther and Ovary Adventitious Bud Induction Medium of Lilium Sulphureum Baker
LIU Wei1,2, CHANG Zheng1,2, DING Changchun1,2
(1. School of Environment and Resources, Wenshan University, Wenshan Yunnan 663099, China; 2. Wenshan Biological Resources Development and Research Center ,Wenshan Yunnan 663099, China)
With yellow fl ower lily of anther and ovary as explants, using MS medium as basic medium, different plant growth regulators and sucrose's in fl uence on anther and ovary adventitious bud induction are studied and the best induction medium is selected. The results shows that the anther as explant callus and adventitious bud are not obtained, the ovary can cultivate callus and adventitious bud of robust growth; Ovary producing the best medium for callus induction is NAA0.5 mg/L + 6-BA0.5 mg/L + sucrose 4 g/L; ovary producing the best medium for adventitious bud induction is NAA0.6 mg/L + 6-BA0.5 mg/L + sucrose 4 g/L.
Lilium sulphureum Baker; anther; ovary; tissue culture
S628.29
A
1674-9200(2016)06-0001-03
(责任编辑 张 铁)
2016-04-27
云南省教育厅科研基金项目“淡黄花百合开花生物学特性研究”(2013Y582)。
刘伟,男,湖南祁东人,文山学院环境与资源学院副教授,硕士,主要从事植物学研究;常征,男,云南马关人,文山学院环境与资源学院副教授,硕士,主要从事生化与分子和药理学研究;丁长春,男,彝族,云南文山人,文山学院生物资源开发与研究中心副教授,博士,主要从事兰科植物种质资源保护利用研究。

