苦参生物碱和黄酮体外抑菌活性比较
黄琦,屈玟珊,高世军,马俊琳,刘龙元,徐麟,马鸿雁
(广东药科大学 1.中药学院,广东 广州 510006; 3.医药化工学院,广东中山 528453; 2.广州中医药大学 中药学院,广东 广州 510006)
苦参生物碱和黄酮体外抑菌活性比较
黄琦1,屈玟珊1,高世军2,马俊琳1,刘龙元3,徐麟1,马鸿雁1
(广东药科大学 1.中药学院,广东 广州 510006; 3.医药化工学院,广东中山 528453; 2.广州中医药大学 中药学院,广东 广州 510006)
目的 探讨苦参生物碱、黄酮及其单体(苦参碱、氧化苦参碱、苦参酮、槐属二氢黄酮G、5-methyl-Kushenol C、三叶豆紫檀苷和高丽槐素)对不同菌株的体外抑菌作用。方法 采用96孔板微量稀释法测定药物的最小抑菌浓度(MIC);薄层色谱-直接生物自显影法测定药物的抑菌检测限(LOD);纸片扩散法测定苦参黄酮单体的抑菌圈直径大小。结果 苦参总生物碱、总黄酮对金黄色葡萄球菌的MIC值范围分别为4.95~31.64 mg/mL和7.50~31.64 mg/mL,对大肠埃希菌的MIC值范围分别为1~4 mg/mL和1~4 mg/mL。苦参生物碱单体对金黄色葡萄球菌和大肠埃希菌的LOD值均大于10 μg;黄酮单体对金黄色葡萄球菌的LOD值为1.3~2.5 μg,对大肠埃希菌的LOD值小于1.3 μg。各黄酮单体中,槐属二氢黄酮G抑菌作用最强,其次是苦参酮和高丽槐素,三叶豆紫檀苷无抑制作用。结论 对金黄色葡萄球菌和大肠埃希菌,苦参总黄酮及单体的抑菌效果均优于苦参总生物碱及其单体。
苦参; 生物碱; 黄酮; 微量稀释法; 薄层色谱-直接生物自显影; 纸片扩散法; 抑菌作用
苦参(SophoraflavescensAit.)为豆科槐属植物,是我国历史悠久的传统药物之一,具有清热燥湿、杀虫、利尿的功效,临床常用于湿疹、皮肤瘙痒、滴虫性阴道炎等[1],疗效显著。生物碱成分一直被认为是苦参的主要有效成分,但并非苦参专属性成分,山豆根、苦豆子等同科中药具有与苦参非常相似的生物碱,却具有明显不同的临床应用[2-4],这提示仅用生物碱成分来评价苦参的质量和药效是有局限性的,苦参中除生物碱外可能另有起关键作用的有效成分。近年来,大量研究表明苦参中含有丰富的黄酮类成分,具有抗菌、抗感染、抗氧化、抗肿瘤、抗病毒等多方面的生物活性[5]。有关苦参生物碱和黄酮抑菌作用的已有很多研究报道[6-9],但两者抑菌活性孰强孰弱,目前仅有杜思邈等[10]对此进行了研究。本文采用微量稀释法、薄层色谱-直接生物自显影法和纸片扩散法比较苦参生物碱和黄酮对金黄色葡萄球菌、肺炎链球菌、伤寒杆菌、大肠埃希菌、痢疾志贺氏菌和铜绿假单胞菌的抑制作用,为苦参新型抑菌制剂的合理开发提供理论依据。
1 材料与试药
1.1 仪器与设备
FA(N)/IA(N)电子天平(上海民桥精密科学仪器有限公司);AY120万分之一天平(日本岛津公司);KQ-2200B超声波清洗器(巩义市予华有限公司);WZT-1M细菌浊度仪(麦氏单位,上海劲佳科学仪器有限公司);电热恒温培养箱HPX-9162MBE(上海博迅实业有限公司医疗设备厂);SW-CJ-1F型单人双面净化工作台(苏州净化设备有限公司);GF254薄层板(青岛海洋化工厂分厂);96孔板(Costar公司)。
1.2 药物与试剂
15个产地的苦参药材由广东药学院生药研究室马鸿雁副教授提供和鉴定,经鉴定均为豆科植物苦参(SophoraflavescensAit.)的干燥根(表1);苦参碱对照品(批号PS15040201)和氧化苦参碱对照品(批号PS14042001)均购自成都普思生物科技股份有限公司,纯度≥98%;苦参酮、槐属二氢黄酮G、三叶豆紫檀苷、高丽槐素和5-methyl-Kushenol C均为自制对照品,经HPLC峰面积归一化法计算,纯度均大于98%;普通营养肉汤、营养琼脂(BS1002;BS1003;杭州百思生物技术有限公司);2,3,5-氯化三苯基四氮唑显色剂(TTC,Amresco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐显色剂(MTT,Aladdin 公司);其他试剂均为分析纯。

表1 15个产地苦参样品的来源Table 1 Origins of Sophora flavescens Ait.
1.3 菌株
金黄色葡萄球菌(Staphylococcusaureus,ATCC29213)、大肠埃希菌(Escherichiacoli,ATCC25922)、肺炎链球菌(Streptococcuspneumoniae,ATCC49619)、伤寒杆菌(Salmonellatyphi,ATCC14028)、痢疾志贺氏菌(Shigelladysenteriae,CMCC51252)、铜绿假单胞菌(Pseudomonasaeruginosa,ATCC2783)均购于广东省微生物菌种保藏中心,经广东药科大学基础学院微生物教研室进行传代培养,并由马艳高级实验师鉴定确认后惠赠。将上述菌种接种于营养琼脂中,置37 ℃恒温培养箱培养24 h,4 ℃保存备用。
2 方法
2.1 培养基制备
普通营养肉汤、营养琼脂均按说明书方法配制,121 ℃高压灭菌30 min,备用。
2.2 显色剂
TTC显色剂:用蒸馏水配制成2.5 mg/ml TTC溶液,避光保存,备用。
MTT显色剂:用PBS缓冲液配制成质量浓度为5 mg/mL的MTT-PBS溶液。
2.3 苦参总生物碱提取物的制备
取15个产地苦参饮片10.0 g,加蒸馏水100 mL,煎煮30 min,趁热滤过,残渣加100 mL蒸馏水同法煎煮1次,滤过;合并滤液,浓缩至含生药500 mg/mL,4 ℃保存备用。
2.4 苦参总黄酮提取物的制备
参照文献[11]方法制备得到15个产地苦参总黄酮提取液,滤液蒸干,取适量浸膏配成质量浓度为32 mg/mL的储备液。实验时取适量储备液过0.45 μm微孔滤膜,用蒸馏水配成质量浓度为8 mg/mL的初始浓度药液。
2.5 溶液的制备
取苦参碱、氧化苦参碱、苦参酮、槐属二氢黄酮G和5-methyl-Kushenol C对照品,分别加甲醇配成初质量浓度为2 mg/mL对照品溶液,然后倍比稀释成1、0.5、0.25、0.125、0.0625 mg/mL甲醇溶液,备用。
取三叶豆紫檀苷、槐属二氢黄酮G、苦参酮、高丽槐素,分别精密称定1.0 mg,用蒸馏水配成质量浓度为0.1 mg/mL的药物原液,备用。
配制质量浓度为2.5 mg/mL的氨苄西林药液作为阳性对照,备用。
2.6 菌悬液制备
受试菌种用液体培养基配成菌悬液后,再用细菌浊度仪配制成浓度为5×108CFU/mL的菌液,备用。
2.7 微量稀释法测MIC值
参照文献[12]采用微量稀释法测定样品对不同菌株的MIC值,96孔板置37 ℃培养箱中培养18~24 h,培养结束前3 h每孔加入2.5 mg/mL TTC溶液10 μL,继续培养1~3 h后观察生长情况,有细菌生长孔呈红色,以肉眼观察不到菌落生长的最低药物浓度为该药物对该种细菌的MIC。
2.8 薄层色谱-直接生物自显影评价抑菌能力
参照文献[13]采用直接生物自显影方法评价苦参单体化合物对大肠埃希菌和金黄色葡萄球菌的抑菌效果。处理过的薄层板在37 ℃下培养10 h;培养结束后将5 mg/mL MTT-PBS溶液均匀喷洒到薄层板上,37 ℃下培养4~5 h后观察显色结果,有抑菌活性的斑点将在显色背景下表现出明显的抑菌圈。
2.9 纸片扩散法测定抑菌圈直径
取菌悬液0.2 mL涂布于琼脂培养基上,将灭菌的滤纸片(直径d0=7 mm)浸泡于药液中片刻,取出,略干后贴于平板表面,2%吐温80滤纸片为阴性对照,37 ℃培养24 h,测定抑菌圈直径(d)。
3 结果
3.1 15个产地苦参的最小抑菌浓度(MIC)
苦参总生物碱和总黄酮的MIC结果见图1。由结果可知,不同产地苦参均有一定的抑菌作用,苦参总生物碱对金黄色葡萄球菌和大肠埃希菌的MIC值范围分别为4.95~31.64 mg/mL和7.50~31.64 mg/mL;苦参总黄酮对金黄色葡萄球菌和大肠埃希菌的MIC值的范围均为1~4 mg/mL。通过比较苦参总生物碱和总黄酮的MIC,15个产地中湖南邵阳(6)所产苦参的抑菌效果最好,其次是河南南阳(1)和云南曲靖(7)。

图1 15个产地苦参总生物碱和总黄酮对金黄色葡萄球菌(A)和大肠埃希菌(B)的MICs
Figure 1 MICs of extracts from differentSophoraflavescensAit. againstStaphylococcusaureus(A) andEscherichiacoli(B)
3.2 苦参生物碱和黄酮单体的抑菌检测限(LOD)
苦参碱、氧化苦参碱、槐属二氢黄酮G、苦参酮和5-methyl-Kushenol C抑菌作用的结果见图2。苦参碱、氧化苦参碱对金黄色葡萄球菌和大肠埃希菌的LOD值均大于10 μg;槐属二氢黄酮G、苦参酮和5-methyl-Kushenol C对金黄色葡萄球菌的LOD值为1.3~2.5 μg,对大肠埃希菌的LOD值均小于1.3 μg。结果表明,相同浓度下,无论是金黄色葡萄球菌还是大肠埃希菌,黄酮单体的抑菌效果都明显优于生物碱单体。
3.3 苦参黄酮单体的抑菌圈直径
5个苦参黄酮单体抑菌作用的结果见表2。可见,槐属二氢黄酮G、苦参酮和高丽槐素对细菌均有抑制作用;槐属二氢黄酮G抑菌作用最强,对革兰阳性菌(金黄色葡萄球菌和肺炎链球菌)和革兰阴性菌(大肠埃希菌、伤寒杆菌和痢疾志贺菌)均有一定抑制作用;苦参酮和高丽槐素抑菌作用相当,都只对革兰阳性菌有抑制作用,对革兰阴性菌无抑制作用;三叶豆紫檀苷作用最弱,对革兰阳性菌和革兰阴性菌均无抑制作用;氨苄西林和苦参各成分对革兰阴性菌铜绿假单胞菌均无抑制作用。

A.苦参碱; B.氧化苦参碱; C.槐属二氢黄酮G; D.苦参酮; E.5-methyl-Kushenol C。
图2 直接TLC生物自显影比较苦参生物碱和黄酮单体化合物对金黄色葡萄球菌(左)和大肠埃希菌(右)的抑制作用
Figure 2 Comparison ofSophoraflavescensalkaloid and flavonoid monomers againstStaphylococcusaureus(left) andEscherichiacoli(right) by TLC-direct bioautography
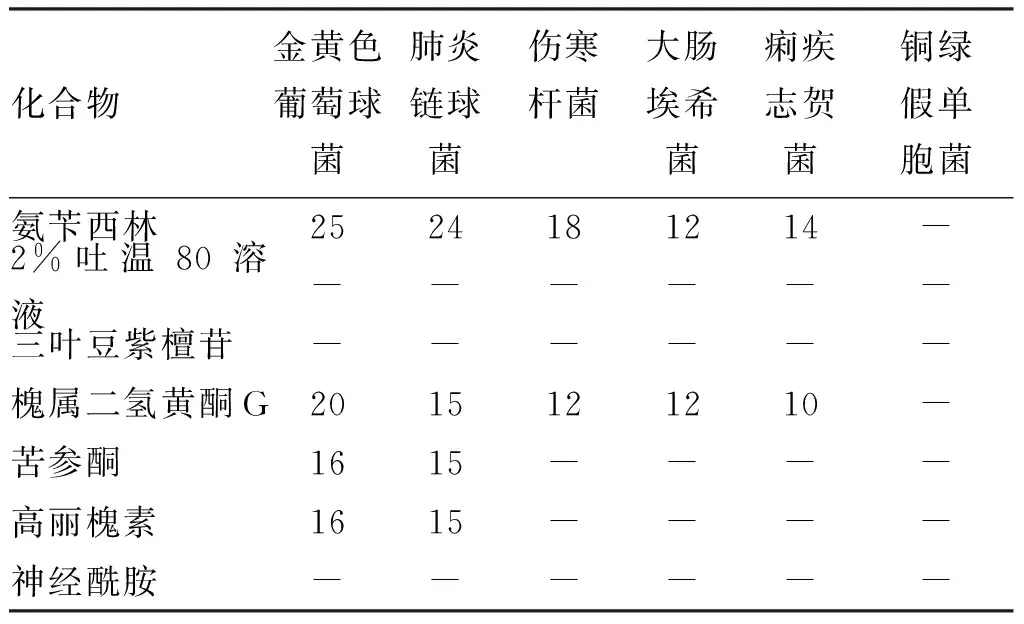
表2 苦参黄酮单体的抑菌圈直径
注:滤纸片直径d0=7 mm。“-”表示对相应供试菌种无抑制效果。
4 讨论
苦参主要成分是以苦参碱、氧化苦参碱、槐果碱、氧化槐果碱、槐定碱等为主的生物碱类化合物和以苦参酮、槐属二氢黄酮G、三叶豆紫檀苷、Kushenol I等为主的黄酮类化合物。生物碱提取常用三氯甲烷、三氯甲烷+浓氨水、水等作为提取溶剂,由于三氯甲烷有毒,而三氯甲烷+浓氨水溶液提取法操作繁琐、耗时,目前生物碱提取主要是用水煎煮或回流提取[14-15];黄酮提取常用甲醇、乙醇、乙酸乙酯等超声提取,其中以乙酸乙酯超声提取法对苦参黄酮类成分提取效率最高,杂质斑点较少,故本文选用该法提取苦参总黄酮[11,16]。本文采用微量稀释法、薄层色谱-直接生物自显影法和纸片扩散法同时比较苦参总生物碱和总黄酮对不同细菌的抑制作用,结果显示苦参黄酮化合物的抑菌效果明显强于生物碱,与杜思邈等[10]报道的结果一致。
中药及其有效部位的抑菌机制较为复杂且不完善,主要是通过改变药物的亲脂性,改变菌体细胞膜和离子通道的渗透性,抑制或干预菌体生物功能的合成、转化过程等来改变抑菌活性[17]。革兰阳性菌和革兰阴性菌结构、成分、性质和功能的差异[18],以及生物碱和黄酮结构的差异都会影响抑菌的效果。就构效关系而言,生物碱的抑菌活性与其氮原子的存在方式和结构修饰有关[19],黄酮的抑菌活性主要与A、B、C环上的羟基化和A、C环上的O、S、N取代有关,其中大多数异戊烯黄酮自身结构的特异性(容易羟基化和异戊烯基化)能增强其抑菌或杀菌活性[20-22]。Kohanski等[23]发现,杀菌性抗菌药能刺激革兰氏菌生成高度有害的羟基自由基,增加杀菌性抗菌药的杀菌效果,导致细胞死亡,而抑菌性抗菌药并不产生羟基自由基。这提示药物的抑菌效果可能与其羟基自由基的合成和药物浓度也有关系,为更好地筛选杀菌性抗菌药和抑菌性抗菌药,以及研究药物的杀菌活性和抑菌活性提供了科学依据。
生物碱和黄酮都是广泛存在于植物中较为复杂的化合物,也是药用植物中的主要活性成分,均具有广谱的药理活性和较低毒性。本文结果表明,苦参总黄酮及其单体均是有潜力的抗菌药物,提示研究苦参制剂抑菌作用时,可同时考虑其生物碱和黄酮作为有效部位。生物碱和黄酮对苦参的贡献是单独作用、协同作用,还是拮抗作用,还有待在今后继续研究。
[1] 国家药典委员会.中华人民共和国药典:2015年版一部[M].北京:中国医药科技出版社,2015:202-203.
[2] 季晓雯,张国伟.苦参生物碱的药理作用及临床应用[J].医学研究与教育,2014,31(6):85-99.
[3] 丁佩兰,陈道峰.中药山豆根及其制剂的药理作用、临床应用与不良反应[J].中国临床药学杂志,2003,12(5):315-318.
[4] 廖春燕,梁健,杨燕,等.苦豆子的药理及应用概述[J].中国民族民间医药,2009,18(5):6-8.
[5] 杨志欣,李霞,单柏松,等.苦参总黄酮的研究进展[J].中成药,2016,38(5):1119-1123.
[6] 戴五好,钱利武,杨士友,等.苦参、山豆根生物碱及其总碱的抑菌活性研究[J].中国实验方剂学杂志,2012,18(3):177-180.
[7] HAN Chunchao,GUO Jianyou. Antibacterial and anti- inflammatory activity of traditional Chinese herb pairs,Angelica sinensis andSophoraflavescens[J]. Inflammation,2012,35(3):913-919.
[8] SOHN H Y,SON KH,KWON C S,et al. Antimicrobial and cytotoxic activity of 18 prenylated flavonoids isolated from medicinal plants:MorusalbaL.,MorusmongolicaSchneider,Broussnetiapapyrifera(L.) Vent,SophoraflavescensAit andEchinosophorakoreensisNakai[J]. Phytomedicine,2004,11(8):666-672.
[9] OH I,YANG W Y,CHUNG S C,et al.Invitrosortase A inhibitory and antimicrobial activity of flavonoids isolated from the roots ofSophoraflavescens[J]. Arch Pharm Res,2011,34(2):217-222.
[10] 杜思邈,马丽强,孙俊杰,等.苦参提取物体外抗菌实验研究[J].中医药学报,2010,38(3):74-76.
[11] 马鸿雁,朱雅玲,杜憬生,等.苦参中黄酮类成分薄层色谱鉴别研究[J].中国现代中药,2013,15(8):659-661.
[12] 唐金凤,李莉,左国营.51种常见中草药抗菌活性筛选[J].时珍国医国药,2016,27(4):788-791.
[13] SHAI L J,MCGAW L J,MASOKO P,et al. Antifungal and antibacterial activity of seven traditionally used South African plant species active againstCandidaalbicans[J]. S Afr J Bot,2008,74(4):677-684.
[14] 马仁玲,周红华,于喜水,等.苦参药材提取方法的LC/MS研究[J].中成药,2003,25(10):831-832.
[15] LIU Guoqiang,DONG Jing,WANG Hong,et al. Chara-cterization of alkaloids inSophoraflavescensAit. by high-performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. J Pharm Biomed Anal,2011,54(5):1065-1072.
[16] YANG Xinzhou,BABURIN I,PLITZKO I,et al. HPLC-based activity profiling for GABAA receptor modulators from the traditional Chinese herbal drug Kushen (Sophoraflavescensroot)[J]. Mol Divers,2011,15(2):361-372.
[17] 阮贤妹,史道华.中药有效成分及单体抗菌作用机制的研究进展[J].中国微生态学杂志,2015,27(2):244-248.
[18] 陆德源.医学微生物学[M].5版.北京:人民卫生出版社,2001:12-13.
[19] 李杨,左国营.生物碱类化合物抗菌活性研究进展[J].中草药,2010,41(6):1006-1014.
[20] 游庭活,刘凡,温露,等.黄酮类化合物抑菌作用研究进展[J].中国中药杂志,2013,38(21):3645-3650.
[21] 赵平,张颖君,山本浩文,等.苦参异戊烯基黄酮类化合物的化学,活性及其生物合成研究进展[J].天然产物研究与开发,2004,16(2):172-178.
[22] 石晓伟,张嫡群,王云志.苦参异戊烯基黄酮生物活性研究进展[J].河北医科大学学报,2006,27(4):318-321.[23] KOHANKI M A,DWYER D J,HAYETE B,et al. A common mechanism of cellular death induced by bactericidal antibiotics[J]. Cell,2007,130(5):797-810.
(责任编辑:陈翔)
Comparison ofinvitroantibacterial activity of alkaloids and flavonoids ofSophoraflavescensAit.
HUANG Qi1,QU Wenshan1,GAO Shijun2,MA Junlin1,LIU Longyuan3,XU Lin1,MA Hongyan1
(1.SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China; 2.SchoolofTraditionalChineseMedicine,GuangzhouUniversityofChineseMedicine,Guangzhou510006,China; 3.SchoolofChemistryandChemicalEngineering,GuangdongPharmaceuticalUniversity,Zhongshan528453,China)
Objective To studyinvitroantibacterial activity of alkaloids,flavonoids and their monomers (matrine,oxymatrine,kurarinone,sophoraflavanone G,5-methyl-kushenol C,trifolirhizin and maackiain) ofSophoraflavescensAit. Methods Broth microdilution method with 96-well plate was used to determine MICs of extracts ofSophoraflavescensAit. The limit of detection (LOD) against different bacteria was determined by thin-layer chromatography (TLC)-direct bioautography. Disk diffusion method was used to determine the diameters of inhibition zone of flavonoid constituents. Results MICs of tatal alkaloids and total flavonoids againstStaphylococcusaureusandEscherichiacoliwere 4.95~31.64 mg/mL,7.50~31.64 mg/mL,1~4 mg/mL,and 1~4 mg/mL,respectively. The LODs of alkaloid monomers againstStaphylococcusaureusandEscherichiacoliwere both more than 10 μg,while flavonoid monomers′ were 1.3~2.5 μg and less than 1.3 μg,respectively. Sophoraflavanone G had the strongest antibacterial activity against the testing bacteria among all flavonoid monomers,followed by Kurarinone and Maackiain,while Trifolirhizin had no antibacterial activity. Conclusion The total flavonoids and flavonoid monomers ofSophoraflavescenshad a stronger antibacterial activity against bothStaphylococcusaureusandEscherichiacolithan tatal alkaloids and alkaloid monomers.
SophoraflavescensAit.; alkaloids; flavonoids; broth microdilution method; TLC-direct bioautography; disk diffusion method; antimicrobial
2016-07-10
清华信息科学与技术国家重点实验室项目(44548071);广东省科技计划项目(2014A020212416);广东药学院2013年大学生创新创业训练计划项目(201310573004)
黄琦(1991—),女,2014级硕士研究生,Email:459995268@qq.com;通信作者:马鸿雁(1981—),女,副教授,博士,主要从事中药的活性成分及质量评价研究。
时间:2016-10-08 11:38
http://www.cnki.net/kcms/detail/44.1413.R.20161008.1138.001.html
R285.5
A
1006-8783(2016)05-0577-05
10.16809/j.cnki.1006-8783.2016071001

