紫花苜蓿苗期抗寒敏感性生理生化指标的筛选
秘一先,鲁学思,马周文,廖斌太,郭志强,师尚礼
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业
可持续发展研究中心,甘肃 兰州 730070)
紫花苜蓿苗期抗寒敏感性生理生化指标的筛选
秘一先,鲁学思,马周文,廖斌太,郭志强,师尚礼
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业
可持续发展研究中心,甘肃 兰州730070)
摘要:通过测定俄罗斯杂花苜蓿和3个紫花苜蓿抗寒品系苗期的叶部及茎部的生理生化指标,研究了供试材料苗期的抗寒性生理生化指标对低温的响应并筛选出紫花苜蓿苗期抗寒性敏感生理生化指标。结果表明,紫花苜蓿苗期叶部GPX、FP、APX、SOD、MDA为最敏感性指标,CAT,SS和SP为较敏感性指标;茎部SP,MDA和FP为最敏感性指标,CAT,SS和SOD为较敏感性指标;苗期叶部、茎部APX、GPX为不敏感性指标。采用最敏感性指标和较敏感性指标综合评价了供试材料的抗寒性,其抗寒能力强弱顺序为:抗寒2号>抗寒3号>抗寒1号>俄罗斯杂花苜蓿。
关键词:紫花苜蓿;苗期;抗寒敏感性;生理生化指标
紫花苜蓿(Medicagosativa)为多年生豆科植物,是世界上栽培最早、面积最大、经济价值最高的牧草,有“牧草之王”的美誉[1]。近几年,我国北方苜蓿种植面积不断扩大,苜蓿产业发展迅速,但由于低温引起的苜蓿冻害使我国苜蓿生产蒙受巨大的经济损失[2]。俄罗斯杂花苜蓿(Medicagovaria)因其适应性强、抗寒、耐旱、越冬率高等优势被广泛种植与研究。目前,有关紫花苜蓿抗寒性的研究已取得了一些成果,研究方法也层出不穷,但有关生理生化指标对紫花苜蓿抗寒性的指示代表性还无统一的定论,因此,探究紫花苜蓿抗寒性及生理生化指标的指示性具有重要的理论和实践指导意义。
田间栽培试验确定苜蓿抗寒性较为准确,但所用时间长,不利于对大量品种进行快速筛选或预测,因此,试验通过对俄罗斯杂花苜蓿和3个紫花苜蓿抗寒品系苗期的膜渗透调节物质及保护酶等抗寒生理生化指标的测定,以期筛选并构建紫花苜蓿耐寒能力评价的敏感性指标体系。
1材料和方法
1.1试验材料
试验以俄罗斯杂花苜蓿(Medicagovaria)中的西伯利亚杂花苜蓿(MedicagovariaMartincv.Siberia)和3个紫花苜蓿抗寒品系(Medicagosativa),抗寒1号(M.sativa.cv.Algidus Ⅰ)、抗寒2号(M.sativa.cv.Algidus Ⅱ)、抗寒3号(M.sativa.cv.Algidus Ⅲ)为供试材料。其中,西伯利亚杂花苜蓿作为试验对照材料。种子均由甘肃农业大学草业生态系统重点实验室提供。
1.2试验方法
1.2.1低温处理2014年5月下旬,使用育苗盆进行沙培种植,45 d后进入10叶期,按照试验设计的胁迫温度分组置于低温恒温程控培养箱中进行人工低温胁迫。试验设计的低温胁迫温度分别为0℃和4℃,对照(22℃)。低温降温速度为5℃/h,当达到所要求的温度后维持该温度12 h,然后取出并采集叶部、茎部鲜样,所采样品用液氮速冻后于-80℃冰箱内冷冻保存,待测。
1.2.2生理生化指标的测定采用蒽酮比色法测定可溶性糖( SS)含量,酸性茚三酮法测定脯氨酸(Pro)含量,考马斯亮蓝G-250 染色法测定可溶性蛋白质含量,代巴比妥酸法测定丙二醛(MDA)含量,氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性,高锰酸钾滴定法测定过氧化氢酶(CAT)活性,抗坏血酸过氧化物酶(APX)和谷胱甘肽过氧化物酶(GSH-Px)活性的测定参照文献[3]的方法进行,均3次重复。
1.3数据处理
用Microsoft excel 处理数据并作图,用SPSS 17.0软件进行显著性分析、因子分析及主成分分析[4]。
2结果与分析
2.1低温胁迫对紫花苜蓿生理生化指标的影响
2.1.1低温胁迫对紫花苜蓿SS含量的影响由图1a可以看出,3个紫花苜蓿品系和对照叶部SS含量随温度的变化规律相似,都表现为先略微下降后剧烈上升的变化趋势。同时,茎部SS含量(图1b)呈现逐渐上升的变化趋势。抗寒2号、3号、西伯利亚杂花苜蓿、抗寒1号叶部SS含量在0℃达到峰值,依次为59.48%、57.34%、44.05%、30.87%;并且材料的茎部SS含量也在0℃达到峰值,依次为53.42%、43.23%、37.69%、33.21%,其中,叶部SS含量均高于茎部SS含量。在降温过程中,抗寒2号SS含量变化最大,变化幅度为叶部-4.35%~170.35%、茎部19.83%~31.12%,抗寒1号变化最小,变化幅度为叶部-9.09%~54.37%、茎部28.68%~7.52%,表明抗寒2号通过SS的渗透调节作用增加植株抗性的能力较强,抗寒1号通过SS积累的渗透调节能力较差,细胞易受伤害,抗寒3号、西伯利亚杂花苜蓿介于两者之间。
不同材料间的SS含量差异均达到显著水平。SS含量高低的顺序为:抗寒2号>抗寒3号>西伯利亚杂花苜蓿>抗寒1号。
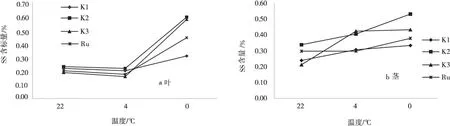
图1 不同温度下SS的含量Fig.1 Variances of soluble sugar content at different temperatures
2.1.2低温胁迫对紫花苜蓿Pro含量的影响随着处理温度的下降,抗寒2号、抗寒3号叶部(图2a)和抗寒1号茎部(图2b)的Pro含量均持续增大。表明在温度下降初期,紫花苜蓿的抗寒机制即启动。低温处理过程中,抗寒2号的Pro含量增加幅度最大,叶部为42.43%~54.62%、茎部为-3.83%~-33.22%,表明其渗透调节能力最强;而西伯利亚杂花苜蓿叶部和茎部及抗寒1号叶部的Pro含量变化呈现先增加后下降趋势。
在全株水平上,不同材料间的Pro含量差异均达到极显著水平。Pro含量高低顺序为:抗寒2号>西伯利亚杂花苜蓿>抗寒1号>抗寒3号。

图2 不同温度下的Pro含量Fig.2 Variances of praline content at different temperatures
2.1.3低温胁迫对紫花苜蓿SP含量的影响低温胁迫下,4个供试材料叶、茎部的SP含量变化如图3所示。抗寒2号和西伯利亚杂花苜蓿叶部的SP含量随着温度的下降呈现逐渐上升的趋势,抗寒1号和3号叶部的SP含量呈现先急剧上升后下降的变化趋势(图3a),但供试材料茎部的SP含量(图3b)均表现为先下降后上升,且抗寒2号和西伯利亚杂花苜蓿变化幅度明显高于抗寒1号和抗寒3号。抗寒2号、西伯利亚杂花苜蓿叶部的SP含量在0℃达到峰值,分别为6.18 mg/g、5.68 mg/g;抗寒3号和1号叶部的SP含量虽同在0℃达到峰值,但增幅不大,为3.09 mg/g、2.86 mg/g,说明其渗透调节能力低于抗寒2号与西伯利亚杂花苜蓿。
在全株水平上,不同材料间的SP含量差异均达到极显著水平。SP含量高低顺序为:抗寒2号>西伯利亚杂花苜蓿>抗寒3号>抗寒1号。
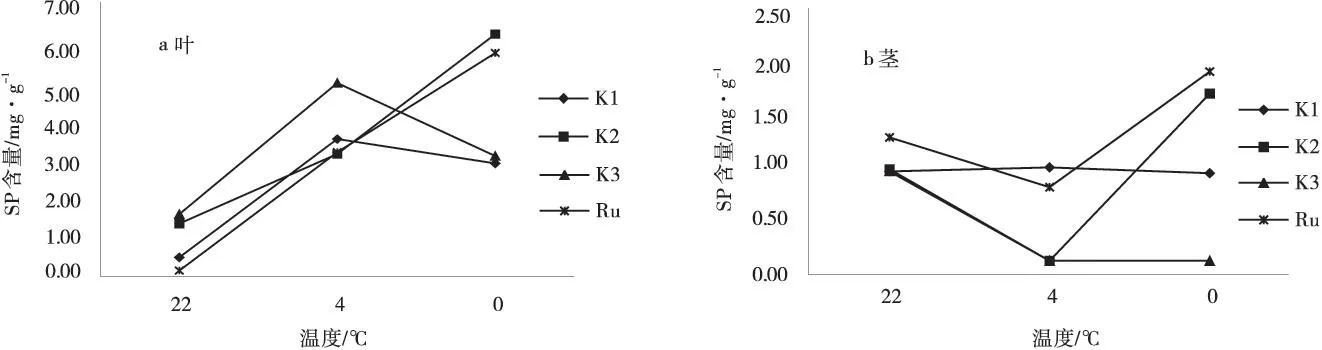
图3 不同温度下可溶性蛋白的含量Fig.3 Variances of soluble protein content at different temperatures
2.1.4低温胁迫对紫花苜蓿MDA含量的影响不同紫花苜蓿材料MDA的生成量存在差异。在低温处理过程中,抗寒3号叶部和茎部的MDA含量较低且增加幅度较小,表明其膜脂过氧化程度较低,抗寒1号叶部的MDA含量呈现先上升再略下降的趋势,但茎部MDA含量呈现持续上升趋势,西伯利亚杂花苜蓿叶部与茎部MDA含量较高且呈现剧烈上升的趋势,在0℃时MDA积累量达到峰值,为0.48 μmol/L,叶部变化为,40.00%~128.58%;茎部为,32.00%~39.39%,抗寒2号居中(图4)。
在全株水平上,不同材料间的MDA含量差异达到极显著水平。MDA含量的顺序为:抗寒3号>抗寒1号>抗寒2号>西伯利亚杂花苜蓿。
2.1.5低温胁迫对紫花苜蓿SOD活性的影响3个紫花苜蓿材料和西伯利亚杂花苜蓿叶、茎部的SOD活性均随着温度的降低呈现下降趋势,但抗寒2号和西伯利亚杂花苜蓿叶部SOD活性有略微增加(图5)。表明抗寒2号清除超氧化物阴离子自由基,保护细胞膜免受伤害的能力较强,而抗寒1号较差,膜易受伤害;西伯利亚杂花苜蓿、抗寒3号介于两者之间。抗寒2号的SOD酶活性最强,变化幅度为-0.91%~0.71%(叶部);-20.41%~-2.75%(茎部),其抗寒性优于其他材料,抗寒1号最差。供试材料在全株水平上酶活性差异均达到极显著水平。SOD活性强弱的顺序为抗寒2号>西伯利亚杂花苜蓿>抗寒3号>抗寒1号。

图4 不同温度下MDA的含量Fig.4 Variances of MDA content at different temperatures

图5 不同温度下的SOD活性Fig.5 Variances of SOD activity at different temperatures
2.1.6低温胁迫对紫花苜蓿CAT活性的影响从图6a可以看出,除抗寒1号叶部外,另2个紫花苜蓿材料和对照叶部的CAT活性都是随着温度的下降呈现先上升后下降的趋势,但4个供试材料茎部的CAT活性(图6b)变化趋势均不相同,无规律性。其中,抗寒1号叶部CAT活性在4℃达到峰值,为34.30 U/g FW。抗寒3、2号和西伯利亚杂花苜蓿峰值出现在22℃,分别为21.80 U/g FW,23.36 U/g FW和23.57 U/g FW。
不同材料在全株水平CAT活性差异均达到显著水平。CAT活性强弱的顺序为抗寒3号>抗寒1号>抗寒2号>西伯利亚杂花苜蓿。
2.1.7低温胁迫对紫花苜蓿APX活性的影响图7所示,随着处理温度的下降,抗寒1号和3号叶部与茎部的APX活性均呈先上升后下降趋势,且抗寒1号比3号变化剧烈,变化幅度为235.92%~-63.58%(茎部),抗寒2号叶部与茎部APX活性呈持续上升趋势,但西伯利亚杂花苜蓿APX活性变化不大。
不同材料间的APX活性差异不显著。APX活性强弱顺序为抗寒2号>西伯利亚杂花苜蓿>抗寒1号>抗寒3号。

图6 不同温度下CAT的活性Fig.6 Variances of CAT activity at different temperatures

图7 不同温度下APX的活性Fig.7 Variances of APX activity at different temperatures
2.1.8低温胁迫对紫花苜蓿GSH-Px活性的影响3个紫花苜蓿材料和对照叶部GSH酶活性(图8a)随温度的降低呈先降后升的趋势,且变化剧烈,均在4℃达到最小值,分别为0.66 μ/(g·min)、0.79 μ/(g·min)、0.73 μ/(g·min)、0.60 μ/(g·min)。抗寒1号和2号茎部的GSH酶活性(图8b)呈现先剧烈上升而后下降的趋势,但抗寒3号和西伯利亚杂花苜蓿则随温度的下降而逐渐下降。
不同材料间,叶部和茎部的GSH-Px活性差异不显著。GSH-Px活性大小的顺序为:抗寒1号>抗寒2号>抗寒3号>西伯利亚杂花苜蓿。

图8 不同温度下GSH-Px的活性Fig.8 Variances of GPX activity at different temperatures
2.2紫花苜蓿抗寒性生理生化指标的主成分分析及筛选
通过因子分析和主成分分析,确定每个抗寒性生理生化指标的特征向量,利用降维的思想,将8个抗寒性生理指标转化为少数几个综合指标,进而筛选出指示性强的生理生化指标组合[4]。
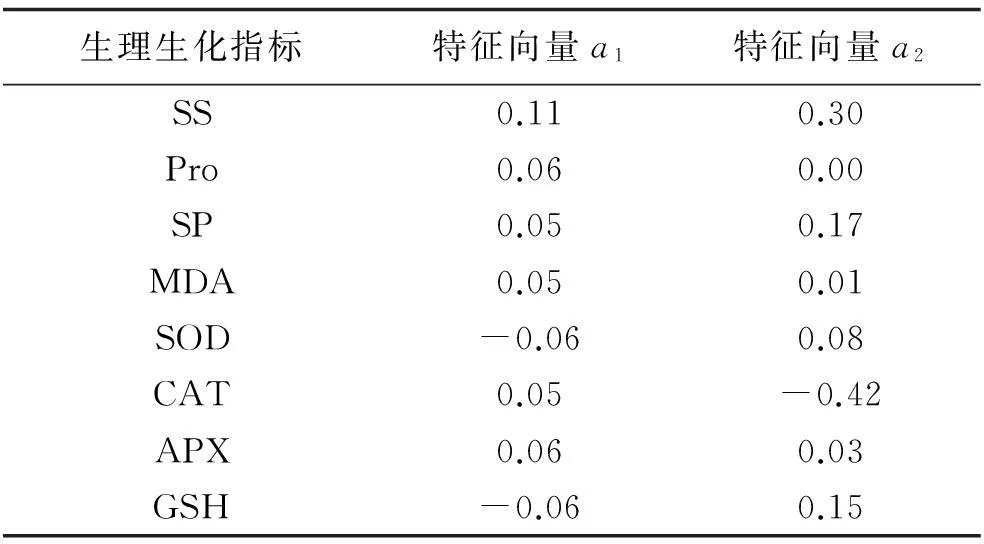
表1 叶部抗寒性生理生化指标的特征向量
由表1可得出,苗期紫花苜蓿品系和对照叶部抗寒性生理指标提取为2个主因子。因此,第一主成分的表达式为:
F1=0.11ZSS+0.06ZPro+0.05ZSP+0.05ZMDA-0.06ZSOD+0.05ZCAT+0.06ZAPX-0.06ZGSH
式中:GSH、Pro、APX、SOD和MDA指标的系数较大,即这5个指标起主要作用。第二主成分的表达式为:
F2=0.30ZSS-0.004ZFP +0.17ZSP +0.01ZMDA+0.08ZSOD -0.42ZCAT+0.03APX+0.15GPX
式中:CAT,SS和SP指标的系数较大,这3个指标起主要作用。
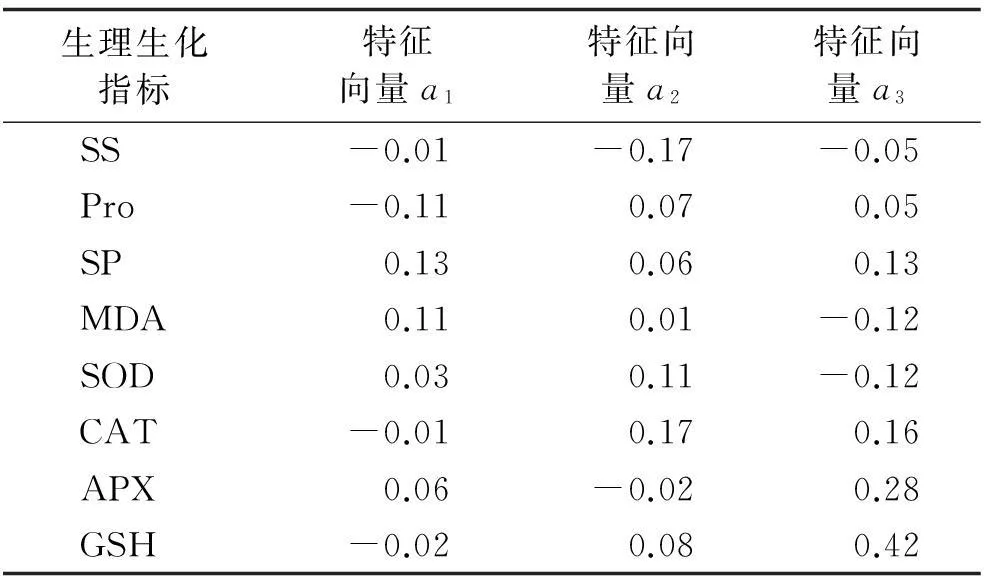
表2 茎部抗寒性生理生化指标的特征向量
由表2可得出,苗期紫花苜蓿品系和对照茎部抗寒性生理生化指标提取为3个主因子。因此,第一主成分的表达式为:
F1=-0.01ZSS-0.11ZFP+0.13ZSP+0.11ZMDA+0.03ZSOD-0.01ZCAT+0.06ZAPX-0.02ZGPX
式中:SP,MDA和Pro指标的系数较大,这3个指标起主要作用。第二主成分的表达式为:
F2=-0.17ZSS+0.07ZFP +0.06ZSP +0.01ZMDA +0.11ZSOD +0.17ZCAT-0.02APX+0.08GPX
式中:CAT,SS和SOD指标的系数较大,这3个指标起主要作用。第三主成分的表达式为:
F3=-0.05ZSS+0.05ZFP+0.13ZSP-0.12ZMDA-0.12ZSOD+0.16ZCAT+0.28 ZAPX+0.42ZGPX
式中:APX和GSH指标的系数较大,即这2个指标起主要作用。
3讨论与结论
(1)当植物受低温胁迫时,植物组织的胞内糖含量会呈现增加的趋势[5,6]。游离脯氨酸作为细胞质的渗透调节物质在植物对抗低温胁迫时起到平衡细胞代谢的作用,以保持细胞内环境的相对稳定[7,8]。在寒冷条件下,细胞渗透调节的关键是细胞内溶物质的主动积累,积累有机酸、糖类、蛋白等大分子物质,使低温条件下细胞维持一定的膨压,减少细胞水分的流失,避免因结冰引起的伤害[9]。MDA为脂质过氧化产物,其与植物所受逆境胁迫程度有关,植物受害越重,MDA积累量越多[10]。SOD是存在于植物细胞中最重要的清除活性氧的酶之一,对保护膜系统的稳定性有重要作用,其活性水平的高低与植物耐性有关[11]。SOD在苜蓿抗寒锻炼过程中起着重要的保持作用,当苜蓿获得抗寒能力后,SOD活性逐渐下降[12],表明在温度下降初期,紫花苜蓿的抗寒机制即启动,CAT的活性增强,有助于对过氧化物的清除,降低膜脂的伤害,提高机体的抗寒性。但随着温度的继续下降,CAT的活性也随之下降,表明紫花苜蓿的抗寒性有一定的低温极限,温度越低,伤害越重[13,14]。APX是植物体内的重要酶系,在抗坏血酸-谷胱甘肽(APX-Glu)循环中,APX是其中的关键酶,它对于保护叶绿体和其它细胞组分免受H2O2及其所产生的羟基自由基的破坏是必不可少的[15,16]。还原型谷胱甘肽(GSH)是一种水溶性抗氧化物质,是OH 的清除剂,还原型谷胱甘肽还可将一些自由基直接还原,以阻断膜脂过氧化的链式反应[17,18]。
(2)试验中随着处理温度的降低,3个紫花苜蓿材料和对照材料西伯利亚杂花苜蓿叶部及茎部的可溶性糖和游离脯氨酸含量均得到了积累与转化。可溶性糖能提高细胞液的浓度,增加细胞持水组织中的非结冰水,从而降低细胞质的冰点,还可缓冲细胞质过度脱水,保护细胞质胶体不至于遇冷凝固[19,20]。在寒冷胁迫下所有植物组织中的可溶性糖含量都会升高,这是一个普遍现象[21,22]。游离脯氨酸是水溶性最大的氨基酸。在发生低温、干旱、盐渍等非生物胁迫时,大部分植物均会积累大量的脯氨酸,来保持细胞持水和生物大分子结构的稳定性,适应逆境[23-25]。在低温胁迫下,苜蓿体内活性氧自由基的积累超出一定限度时,就会引起膜质过氧化,其产物MDA会大量积累[26]。试验中,随着低温胁迫程度的加强,4个紫花苜蓿材料MDA含量均有上升趋势,但抗寒3号含量最低且上升较少。有效的保护酶系统(SOD、CAT、APX等)存在于植物体内,在H2O2氧化还原反应中发挥决定性作用。研究表明,豌豆幼苗在低温胁迫下SOD、POD活性表现为先升后降[27],这与试验中3个紫花苜蓿和对照材料幼苗保护酶在低温胁迫下的动态变化一致。
(3)紫花苜蓿苗期SS、Pro、SP、MDA、SOD、CAT、APX、GSH等8个生理指标中,叶部GPX、FP、APX、SOD、MDA含量或活性敏感性最强,可以作为紫花苜蓿苗期叶部抗寒性评价的首选敏感指标,CAT、SS、SP含量或活性敏感性次之,为紫花苜蓿苗期叶部抗寒性评价的较敏感指标。
紫花苜蓿苗期茎部SP、MDA、FP含量为最敏感性指标,可以作为紫花苜蓿苗期茎部抗寒性评价的选择标准,CAT、SS、SOD含量或活性为较敏感指标,可以作紫花苜蓿苗期茎部抗寒性评价的参考指标,APX、GPX活性为不敏感指标。
(4)经过对西伯利亚杂花苜蓿及3个紫花苜蓿抗寒品系的SS、Pro、SP、MDA、SOD、CAT、APX、GSH等8个生理指标的综合分析,并对各供试材料进行综合评价,计算其综合得分[28],判断3个紫花苜蓿品系的抗寒性强弱顺序为:抗寒2号>抗寒3号>抗寒1号,且均强于对照西伯利亚杂花苜蓿。
参考文献:
[1]韩清芳,贾志宽.紫花苜蓿种质资源评价与筛选[M].杨凌:西北农林科技大学出版社,2004:1-5.
[2]陶雅,玉柱,孙启忠,等.紫花苜蓿的抗寒生理适应性研究[J].草业科学,2009(9):151-155.
[3]贺佳圆.9个野生早熟禾种质材料抗寒性研究[D].兰州:甘肃农业大学,2012.
[4]吴俊.SPSS从零开始学[M].北京:清华大学出版社,2014:261-272.
[5]王运涛,于林清,萨仁.苜蓿抗寒性研究进展[J].草原与草坪,2012(3):91-96.
[6]崔国文.紫花苜蓿田间越冬期抗寒生理研究[J].草地学报,2009(2):145-150.
[7]陶雅,孙启忠,李峰,等.氨基酸与苜蓿抗寒性[C]∥中国草学会饲料生产委员会第15次饲草生产学术研讨会论文集,2009.
[8]冯昌军,罗新义,沙伟,等.低温胁迫对苜蓿品种幼苗SOD、POD活性和脯氨酸含量的影响[J].草业科学,2005,22(6):29-32.
[9]Haagenson D M,Cunningham S W,Joern B C.Autumn defoliation effects onalfalfa winter Survival.Root physiology,and gene expression[J].Corp Science,2003,43:1340-1347
[10]由继红,杨文杰,李淑云.不同品种紫花苜蓿抗寒性的研究[J].东北师大学报(自然科学版),1995,(2):102-105.
[11]沈贤辉,刘刚.植物抗寒生理研究进展[J].长江大学学报(自科版),2014,17:40-42.
[12]魏臻武,王德贤,贺连昌.超氧化物歧化酶在苜蓿抗寒锻炼过程中的作用[J].草业科学,2006(7):15-18.
[13]邱乾栋,吕晓贞,臧德奎,等.植物抗寒生理研究进展[J].山东农业科学,2009(8):53-57.
[14]李勇超,卫秀英,白利杰,等.低温胁迫对小麦品种过氧化物酶的影响[J].湖北农业科学,2009(5):1067-1069.
[15]段明.低温胁迫下番茄类囊体膜抗坏血酸过氧化物酶基因的表达和功能研究[D].泰安:山东农业大学,2012.
[16]黎可华,李志东,陆尚智.9种草坪草抗寒性评价[J].草原与草坪,2012(1):68-71.
[17]麦维军,王颖,梁承邺,等.谷胱甘肽在植物抗逆中的作用[J].广西植物,2005,25(6):570-575.
[18]张建旗,赵峰,巴永娣,等.4种水生植物抗寒性比较[J].草原与草坪,2013(4):63-65,70.
[19]潘瑞炽.植物生理学[M].北京:高等教育出版社,2001:279-288.
[20]孟繁静,刘道宏,苏业瑜.植物生理生化(第4版)[M].北京:中国农业出版社,1995:366-369.
[21]Hanson A A.Alfalfa and alfalfa improvement [M].Madison.Wisconsin:American Society of Agronomy,1988:260-284.
[22]代会平,杨知建,胡勇.狗牙根抗寒性研究进展[J].草业科学,2007,24(11):87-91.
[23]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[24]Stewart C R,Larher F.Accumulation of amino acids and related compounds in relation to environmental stress[J].Biochemistry of Plants,1980(5):609-635.
[25]赵瑞雪,朱慧森,程钰宏,等.植物脯氨酸及其合成酶系研究进展[J].草业科学,2008,25(2):90-97.
[26]杜永吉,于磊,孙吉雄,等.结缕草3个品种抗寒性的综合评价[J].草业学报,2008,17(3):6-16.
[27]彭永康,郝泗城,王振英.低温处理对豌豆幼苗生长和POD、SOD、COD、ATPase同工酶的关系[J].华北农学报,1994,9(2):76-80
[28]李国栋,胡建军,周冀衡,等.基于主成分和聚类分析的烤烟化学品质综合评价[J].烟草科技,2008(12):5-9,13.
Screening of sensitive physiological and biochemical indexes for cold resistance of alfalfa in seedling stage
BI Yi-xian,LU Xue-si,MA Zhou-wen,LIAO Bin-tai,GUO Zhi-qiang,SHI Shang-li
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
Abstract:By measuring physiological and biochemical indexes of leaves and stems of Medicago varia and 3 cold resistant strains of alfalfa in seedling stage,the response of physiological and biochemical indexes to low temperature was studied and the screening of sensitive physiological and biochemical indices in seedling was conducted. The results showed that GPX,FP,APX,SOD and MDA were the most sensitive indicators,CAT,SS and SP were the more sensitive indicators for alfalfa leaves;SP,MDA and FP were the most sensitive indicators,CAT,SS and SOD were the more sensitive indicators for stems,APX and GPX were not the sensitive indicators for alfalfa leaves and stems. By using comprehensive evaluation,the cold-resistance order of alfalfa was K2> K3>K1> Ru.
Key words:alfalfa;seedling stage;cold-resistance sensibility;physiological and biochemical index
中图分类号:S 54,Q 945.6
文献标识码:A
文章编号:1009-5500(2016)01-0035-08
作者简介:秘一先(1993-),女,河北晋州人。
基金项目:农业部“牧草种质资源保护”项目(NB2130135)资助
收稿日期:2015-06-19; 修回日期:2015-09-28
E-mail:beiyixian2011@yeah.net
师尚礼为通讯作者。

