复合菌肥与化肥配施对高寒地区土壤微生物数量和土壤酶活性的影响
陈娟丽,师尚礼,祁 娟
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业
可持续发展研究中心,甘肃 兰州 730070)
复合菌肥与化肥配施对高寒地区土壤微生物数量和土壤酶活性的影响
陈娟丽,师尚礼,祁娟
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业
可持续发展研究中心,甘肃 兰州730070)
摘要:以种植第3年的金皇后紫花苜蓿为材料,以不施肥为对照,研究了固氮菌肥、磷肥、混合菌肥及磷肥与混合菌肥不同比例配施对高寒区土壤微生物数量和土壤酶活性的影响。结果表明:不同比例配施处理后,0~10、10~20 cm土层中土壤微生物(细菌、放线菌、真菌)总数、脲酶、蔗糖酶、蛋白酶活性均增加。土壤3大类微生物数量均表现为细菌>放线菌>真菌。0~10 cm土层中的微生物数量均高于10~20 cm土层中的数量。不同比例的磷肥与混合菌肥配施后的细菌、放线菌数量高于单施磷肥或混合菌肥后的数量,配施后各土层的细菌数量与对照和单施磷肥或混合菌肥后的数量之间有着显著差异。施加50%磷肥+混合菌肥后细菌、真菌数量最多。0~10 cm土层中的脲酶、蔗糖酶、碱性磷酸酶和蛋白酶高于10~20 cm土层中的酶活力,但10~20 cm土层中的过氧化氢酶活力高于0~10 cm土层中的酶活力。不同比例的磷肥与混合菌肥配施后的脲酶活力高于单施磷肥或混合菌肥后的酶活力。相关性研究表明,施肥后各土层土壤微生物与土壤酶之间存在不同程度的相关性。
关键词:紫花苜蓿;微生物菌肥;土壤微生物;土壤酶
王格尔塘镇位于甘肃省甘南州夏河县,属于半农半牧区。由于气候干旱加之土壤贫瘠,饲草料严重缺乏[1]。最受家畜喜食且被称为“牧草之王”的苜蓿,虽有好的适口性和高的营养价值,但因受到环境条件的限制,未能满足家畜的需求[2]。为获得优质高产的苜蓿,施肥成了重要的手段和方法。随着对化学肥料的日益依赖,出现土地板结、土壤养分比例失调和质量下降等问题[3]。因此,寻找能替代或部分替代化肥的新肥源(尤其是生物菌肥)倍受关注[4],生物菌肥能增加土壤肥力,并能改善植物环境[5]。经过长期的试验探究发现,单施生物菌肥不能满足植物生长的需要,特别是在土壤贫瘠的地方,其增产效果有限,若与其他肥料配施,效果显著[6,7]。有关微生物肥料,目前,在农作物如玉米、水稻和燕麦等及苹果、草莓等蔬菜水果产量方面研究较多[8-11],但有关菌种互作对紫花苜蓿品质影响研究尚不多见[12]。
降水量、温度、施肥等很多因素均会对微生物产生一定的影响。土壤微生物的种类、数量及其分布对土壤的变化具有高度敏感性,因此,被用作土壤生物活性最敏感的指标之一。某种特定的土壤酶的活性不能用于土壤肥力的总体评价内容,但结合其他因素(如土壤微生物),可反映土壤的肥力状况[13]。
在甘南州夏河县王格尔塘镇以种植第3年的金皇后紫花苜蓿为试验材料,通过不同比例的化肥与混合菌肥配施后,进行土壤微生物和土壤酶分析,寻找化肥与混合菌肥之间的最优配施方式,为高寒区合理使用肥料、培育优质牧草提供科学依据。
1材料和方法
1.1研究区概况
试验在甘南州夏河王格尔塘镇进行,海拔2 500 m,平均气温4℃,最高气温28.9℃,最低气温-24.6℃。属寒冷湿润类型,高原大陆性气候特点比较明显,年降水量516 mm,全年无霜期56 d,年日照2 296 h≥0℃活动积温2 300℃,≥10℃的积温215~1 636℃,年日照数2 500 h,年降水量450 mm,绝对无霜期40 d,年均蒸发量1 200~1 350 mm,土壤为石灰性草甸土。
1.2试验设计
2011年6月底种植金皇后紫花苜蓿,播种量为22.5 kg/hm2,苜蓿返青前施肥,小区面积4 m×6 m,磷酸二铵(150 kg/hm2)、农家肥为底肥。试验的肥料种类有固氮菌肥、磷肥和混合菌肥,设7个处理:(1)不施肥(CK);(2)固氮菌肥(22.5 kg/hm2)(N);(3)磷肥(1 200 kg/hm2)(P);(4)混合菌肥(22.5 kg/hm2)(M);(5)75%磷肥(900 kg/hm2)+混合菌肥(22.5 kg/hm2)(75%P+M);(6)50%磷肥(600 kg/hm2)+混合菌肥(22.5 kg/hm2)(50%P+M);(7)25%磷肥(300 kg/ hm2)+混合菌肥(22.5 kg/hm2)(25%P+M)。混合菌肥采用微生物促生菌(溶磷菌+固氮菌),供试菌肥由甘肃农业大学草业学院微生物实验室提供,菌株经液体扩大培养,泥炭吸附后菌肥含活性菌≥2×108 cfu/g,用一定量的土拌匀利于田间撒施均匀。所有肥料混合均匀、开沟条施于行间,深度是3~5 cm。试验为完全随机区组设计,重复3次。
1.3土壤样品的采集
2013年6月,土层(0~10 cm)和(10~20 cm)用土钻法采集土样。把采集的土样分成两部分装入无菌袋中,一部分鲜土带回实验室放入4 ℃冰箱进行微生物培养;另一部分土样自然风干后过筛,用于土壤酶活性测定。
1.4指标测定
土壤微生物采用稀释平板计数法,细菌用牛肉膏蛋白胨培养基测定,真菌用马丁氏培养基测定,放线菌用改良高氏1号培养基测定[14,15]。过氧化氢酶用高锰酸钾滴定测定,脲酶用苯酚钠—次氯酸钠显色法测定,磷酸酶用磷酸苯二钠比色法测定,蔗糖酶用3,5-二硝基水杨酸比色法测定,蛋白酶用茚三酮比色法测定[16,17]。所有指标测定均重复3次。
1.5数据统计分析
Microsoft Excel处理数据并制图,SPSS软件进行方差分析、多重比较。
2结果与分析
2.1不同施肥处理对土壤微生物数量的影响
无论土壤中是否施肥,土壤中3大类微生物数量均表现为细菌数量最多,放线菌次之,真菌最少。0~10 cm土层中细菌数量、微生物总数明显多于10~20 cm土层中的数量。土壤微生物中细菌所占份额最大,为59%~84%,放线菌所占比例为16%~41%,真菌数量在微生物总数中的比例在0.1%以下,所以,土壤微生物总数中真菌数量可近似忽略(表1)。
施肥使土壤中细菌数量明显增多。单施P,M和N后,细菌数量差异不显著。P与M配施时,在施加等量M的基础上,配施50%P后,细菌数量最多。P与M配施后细菌数量高于单施P或M后的数量。在0~10 cm土层,各种施肥处理与对照CK(不施肥)差异显著(P<0.05)。施加50%P+M后,细菌数量最多,是对照的3.44倍,与对照或其他施肥处理后的数量之间存在显著差异。在10~20 cm土层,施肥后细菌数量增加了34.7%~259.0%。
施肥后,土壤中放线菌数量增加。施加25%P+M后,土壤中放线菌数量最多。与对照相比,施加P或M,放线菌数量差异不显著。P与M配施后放线菌数量显著多于单施P或M后的数量。在0~10 cm土层,施肥后土壤中的放线菌增加了6.45%~66.2%。在10~20 cm的土层中,施肥后放线菌数量增加了24.7%~200.0%。施加25%P+M,土壤中的放线菌数量是对照的3.57倍,与对照和单施P,M或N后的放线菌数量有着显著差异。
施肥对土壤中真菌数量影响较大,不同土层真菌数量变化不同。施肥后土壤中真菌数量均增加。在0~10 cm土层,施加50%P+M后,土壤中的真菌数量最多,是对照的3倍,与对照和单施P后的数量有着显著差异。施加P、M和25%P+M后,与对照相比,土壤中真菌数量差异不显著。施加75%P+M和50%P+M后的真菌数量多于单施P或M后的数量。在10~20 cm的土层,单施N后,土壤中的真菌数量最多,是对照的3.57倍,与对照和其他施肥处理后的真菌数量差异显著。与对照相比,施加P,M或P与M配施后,土壤中真菌数量差异不显著,但高于单施P或M后的数量。
对施肥后的土壤细菌、放线菌、真菌的数量进行测定,进而累加得到土壤微生物总数(细菌、放线菌、真菌数量之和)。施肥后微生物总数均增加,不同比例的P与M配施后,微生物总数显著多于单施P或M后的数量。施加50%P+M后,土壤中微生物总数量值最多。在0~10 cm土层中,微生物总数从高到低依次为施加50%P+M(15.21×105)>25%P+M(13.78×105)>75%P+M(12.04×105)>N(7.67×105)>M(7.02×105)>P(6.65×105)>CK(5.10×105)。施加50%P+M后,土壤中微生物总数是对照的2.98倍。在10~20cm土层中,微生物总数自高到低依次为施加50%P+M(12.86×105)>25%P+M(11.06×105)>75%P+M(9.78×105)>M(5.85×105)>N(5.75×105)>P(5.74×105)>CK(3.81×105)。施加50%P+M后,土壤中微生物总数量值最大,是对照的3.38倍。
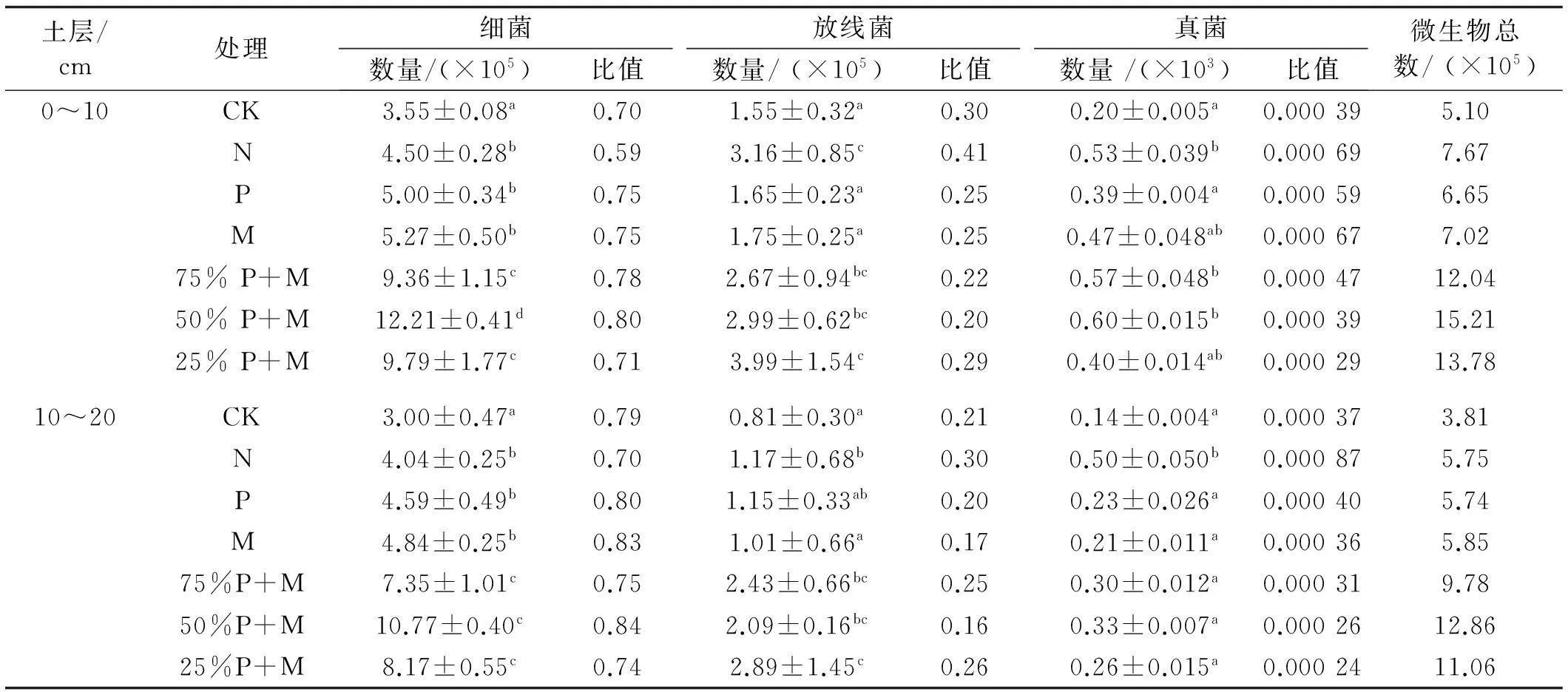
表1 不同施肥处理下土壤微生物数量
注:同列不同小写字母表示不同施肥处理差异显著(P<0.05)
2.2不同施肥处理对土壤酶活性的影响
2.2.1不同施肥处理对土壤过氧化氢酶活性的影响生物呼吸和有机物的氧分解均会产生过氧化氢,无论对于土壤还是生物,它都会产生毒害作用。但土壤存在过氧化氢酶,可通过酶促反应将过氧化氢分解,生成水和氧气,以此来减轻或彻底解除过氧化氢对生物或土壤的毒害作用。图1表明,10~20 cm土层中过氧化氢酶活力高于0~10 cm土层中的酶活力。在0~10 cm土层中,施肥后过氧化氢酶活力均高于对照,但没有显著差异。施加N后,过氧化氢酶活力最高,为0.915 mL/g。单施N,P或M后的过氧化氢酶活力高于P与M配施后的酶活力。在10~20 cm土层中,施肥并未使土壤中过氧化氢酶活力均增加。施加P后,过氧化氢酶活性最高为0.918 mL/g。各施肥处理后的过氧化氢酶活力及与对照间的酶活力差异不显著(图1)。
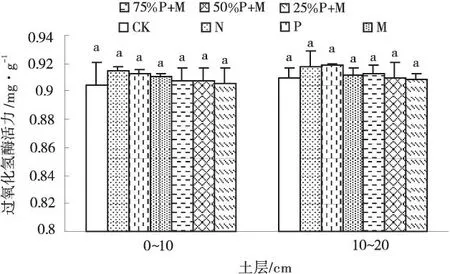
图1 不同施肥处理下土壤过氧化氢酶活性Fig.1 Effect of soil hydrogen peroxidase activity under different treatments
2.2.2不同施肥处理对土壤脲酶活性的影响土壤中施加的尿素只能在土壤脲酶的作用下分解生成水、二氧化碳和氨,氨是植物氮源的来源之一。由此,土壤脲酶的活性和土壤的供氮能力有着密切的关系。不同施肥处理后脲酶活力增加,0~10 cm土层中脲酶活力高于10~20 cm土层中的酶活力。P与M配施后的脲酶活力高于单施P或M时的酶活力,施加50%P+M后的脲酶活力低于施加25%P+M和75%P+M后的酶活力(图2)。在0~10 cm土层中,施加25%P+M后,土壤脲酶活力最高,为0.722 mg/g,比对照高出16.75%,且与对照有着显著差异。施加N和75%P+M后,土壤中脲酶活力增加,与对照之间差异显著。施加P,M和50%P+M后,土壤中脲酶活力略有增加,但与对照的差异不显著。在10~20 cm土层中,施肥后脲酶活力有所增加,各处理间差异不显著。
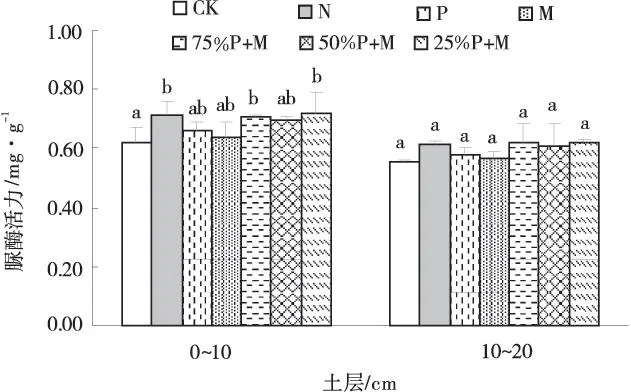
图2 不同施肥处理下土壤脲酶活性Fig.2 Effect of soil urease activity under different treatments
2.2.3不同施肥处理对土壤磷酸酶活性的影响磷酸酶是对有机磷的催化作用具有专一性特点的蛋白质,可以加快有机磷的脱磷速度,从而提高了土壤中磷元素的有效性。土壤中的磷酸酶包括酸性磷酸酶、中性磷酸酶和碱性磷酸酶。有研究报道,在测定土壤磷酸酶的生物活性时,可将3种磷酸酶中活性比例最大的一种酶算作是磷酸酶活性,其余2种磷酸酶活性可忽略。试验地土壤为碱性,因此,测定土壤中的磷酸酶时只测定了碱性磷酸酶活性。0~10 cm土层的磷酸酶活力高于10~20 cm土层。施加P后土壤中的磷酸酶活力最高,在0~10 cm土层中为0.965 mg/g。施加N(0.859 mg/g)和M(0.851 mg/g)后的磷酸酶活力低于对照,但与对照之间没有显著差异。P与M配施后,磷酸酶活力高于对照和单施M,但低于单施P时的酶活力。单施N或M与单施P或75%P+M有显著差异(P<0.05)。不同比例的P和M配施时,在施加等量M的基础上,随着配施P的量逐渐减少,土壤中的碱性磷酸酶活力降低(图3)。

图3 不同施肥处理下土壤磷酸酶活性Fig.3 Effect of soil phosphatase activity under different treatments
2.2.4不同施肥处理对土壤蔗糖酶活性的影响蔗糖酶可将土壤中大分子量的糖分解,进而生成易被植物或微生物吸收利用的果糖和葡萄糖。它的活性可以反映有机物质积累和转化的规律,而且与环境中CO2气体的排放有着密切关系,是促进土壤碳素循环的重要环节部分。与对照相比,不同的施肥处理后,土壤中蔗糖酶活力增加,但增加程度较小,0~10 cm土层中蔗糖酶活力高于10~20 cm土层(图4)。在0~10 cm土层中,施肥后,蔗糖酶活力增加,但各处理之间没有显著差异。施加M后,土壤中的蔗糖酶活力最高为35.78 mg/g。不同比例的P与M配施后的蔗糖酶活力高于单施P后的酶活力(34.98 mg/g),但低于单施M时的酶活力(35.78 mg/g)。在10~20 cm土层中,施加25%P+M后的蔗糖酶活力最高为35.38 mg/g,与对照有着显著差异。不同比例的P与M配施后的蔗糖酶活力高于单施磷肥时的酶活力。施加75%P+M或25%P+M后的蔗糖酶活力与对照差异显著(P<0.05),但这2种处理后的土壤蔗糖酶活力之间没有显著差异。
2.2.5不同施肥处理对土壤蛋白酶活性的影响蛋白酶可以将肽类和蛋白质等分解成氨基酸,参与到生物的氮素代谢过程中,是促进土壤氮循环的重要因素。不同的施肥处理后,土壤中蛋白酶活力增加。单施N后,土壤蛋白酶活力最高,且与其他处理后的酶活力有着显著差异。不同比例的P和M配施时,施加50%P+M时蛋白酶活力较高。0~10 cm土层中蛋白酶活力高于10~20 cm土层(图5)。在0~10 cm土层中,蛋白酶活力增加明显,施加N后,土壤中的蛋白酶活力为17.70 mg/g,增加量为103%,与对照和其他施肥处理有着显著差异。不同比例的P与M配施后的蛋白酶活力低于单施P和M后的酶活力。在10~20 cm土层,所有施肥处理的土壤蛋白酶活力增加,增加量为14.2%~65.5%。P与M配施后的蛋白酶活力高于单施P后的酶活力,但低于单施M时的酶活力。
2.6土壤微生物与土壤酶之间的相关性研究土壤微生物的变化必然会影响土壤酶的变化,二者之间存在着相关性[18]。对土壤微生物与土壤酶之间的相关性研究表明(表2),0~10 cm土层,细菌与放线菌,脲酶与细菌、真菌,蛋白酶与过氧化氢酶之间均显著正相关。在10~20 cm土层,细菌与放线菌、脲酶与蔗糖酶之间均极显著正相关,脲酶与细菌之间显著正相关。总之,不同施肥处理后各土层土壤微生物与土壤酶之间存在不同程度的相关性。
试验发现,土壤微生物和土壤酶之间有着密切的关系。施肥使得土壤微生物数量发生变化,进而间接的对土壤酶产生影响。

表2 土壤微生物与土壤酶之间的相关性分析
注:*表示P<0.05;**表示P<0.01;X1为细菌;X2为放线菌;X3为真菌;X4为过氧化氢酶;X5为脲酶;X6为磷酸酶;X7为蔗糖酶;X8为蛋白酶
3讨论与结论
许多研究报道[19-21],土壤理、化性质的差异会引起土壤微生物的种类及数量、土壤酶等的变化。试验发现,施肥后同一土层或不同土层,土壤中的3大类微生物(细菌、放线菌、真菌)数量和土壤酶活性存在较大差异。土壤中3大类微生物数量均表现为:细菌数量最多,放线菌次之,真菌最少,这与姚拓等[22]研究的天祝高寒草地中微生物数量的结果相一致。0~10 cm土层中微生物总数明显多于10~20 cm土层,此结果与刘恩科等[23]研究一致。施肥后,土壤中细菌、真菌、放线菌数量和微生物总数均增加,说明施肥是影响土壤微生物种类和数量的一种重要管理措施。P与M配施后,土壤中细菌、放线菌数量和土壤微生物总数高于单施磷肥或混合菌肥后的数量,说明P与M配施改善了土壤微生物的环境,更有利于土壤微生物的生长发育和繁殖,从而数量增加。不同比例的P与M配施时,在施加等量M的基础上,配施中等量的磷肥(50%P)时,细菌、真菌数量高于单施P和M后的数量。说明中等量的P与M配施后更利于增加土壤中的细菌数量。施加较低量的磷肥(25%P)时,放线菌数量高于单施P和M后的数量,说明较低量的P与M配施后更利于土壤中放线菌的生长。
土壤酶参与到土壤中的各种生物化学反应,对土壤中植物养分的转化起着重要作用。已有不少研究发现,不同的施肥和耕作等管理措施对土壤酶有明显的影响,试验分析了施肥对土壤酶活性的影响。施肥对土壤过氧化氢酶活性影响较小,而且在各处理之间酶的活性没有显著差异,说明影响过氧化氢酶活力的主要因素并不是施肥,诸如试验地的气候、土壤质地、施肥种类和施肥量等的不同而造成的。漆良华等[24]、郑诗樟等[25]研究表明,土壤微生物类群、土壤酶活性呈现出随土层加深而减少的趋势。研究发现,除过氧化氢酶外,其他土壤酶和土壤微生物均符合此规律。
参考文献:
[1]祁娟,师尚礼,姚拓,等.复合菌肥与化肥配施对寒旱区苜蓿生长特性及土壤养分的影响[J].草原与草坪,2013,33(4):48-53.
[2]师尚礼,龙瑞军,吴劲锋.我国苜蓿种子生产存在的问题及其对策[J].草原与草坪,2002(3):20-23.
[3]考恩,瑞金特吉斯.未来农业[M].北京:中国农业科技出版社.1995,5-6.
[4]赵秉强,张福所,廖宗文,等.我国新型肥料发展战略研究[J].植物营养与肥料学报,2004,10(5):536-545
[5]葛均青,于贤昌,王竹红.微生物肥料效应及其应用展望[J].中国生态农业学报,2003,11(3):87-88.
[6]梁运江,许广波.生物菌肥对水稻营养特性和土壤养分可持续性的影响[J].延边大学农学学报,2000,22(2):91-95.
[7]鲁杰,刘宝忠,周传远.生物有机菌肥对水稻产量及稻米品质的影响[J].中国农学通报,2009,25(6):146-150.
[8]Ahmet Esitken,Yildiz,Ercisli,etal.Effects of plant
growth promoting bacteria(PGPB) on yield,growth and nutrient contents of organically grown strawberry[J].Scientia Horticulture,2010,124:62-66.
[9]张垄,姚拓,张德罡.高寒地区联合固氮菌肥对青稞的促生效应研究[J].植物营养与肥料学报,2010,16(3):708-713.
[10]Walid Fediala,Lidia Sas Paszt.The role of biofertilization in improving apple productivity-a review[J].Advances in microbiology,2015,5(1):21-27.
[11]Souza,Beneduzi,Ambrosini.The effect of plant growth-promoting rhizobacteriaon the growth of rice[J].Plant and Soil,2013,5(1):585-603.
[12]韩光,张磊,邱勤.复合型PGPR和苜蓿对新垦地土壤培肥效果研究[J].土壤学报,2011,48(2):405-411.
[13]陈恩凤,周礼恺,邱凤琼,等.土壤肥力实质研究[J].土壤学报,1985,22(2):113-119.
[14]许光辉,郑洪元.土壤微生物分析方法手册[M].北京:农业出版社,1986.
[15]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[16]关松荫.土壤酶及其研究法[M].农业出版社,1986:1-339.
[17]沃尔克.土壤微生物学[M].北京:科学出版社,1981:73-103.
[18]张昱,程智慧,徐强,等.玉米-蒜苗套作系统中土壤微生物和土壤酶状况分析[J].土壤通报,2007,38(6):1136-1140.
[19]许景伟,王卫东.不同类型黑松混交林土壤微生物、土壤酶及其与土壤养分关系研究[J].北京林业大学学报,2000,22(1):52-55.
[20]姚拓,杨俊秀.森林枯落层及土壤微生物生态研究[J].西北林学院学报,1997,12(4):97-103.
[21]肖育贵,胡震宇.不同林型土壤微生物种群数量及养分变化分析[J].四川林业科技,1997,18(4):33-35.
[22]姚拓,龙瑞军.天祝高寒草地不同扰动生境土壤三大类微生物数量动态研究[J].草业学报,2006,15(4)93-99.
[23]刘恩科,赵秉强.长期施肥对土壤微生物量及土壤酶活性的影响[J].植物生态学报,2008,32(1):176-182.
[24]漆良华,张旭东,彭镇华.湘西北小流域植被恢复区土壤酶活性及养分相关性[J].东北林业大学学报,2011,39(3):83-88.
[25]郑诗樟,肖青亮,吴蔚东,等.丘陵红壤不同人工林型土壤微生物类群、酶活性与土壤理化性状关系的研究[J].中国生态农业学报,2008,16(1):57-61.
Effect of combined application of phosphate and microbial fertilizer on soil microbial quantity and soil enzyme activity in alpine region
CHEN Juan-li,SHI Shang-li,QI Juan
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
Abstract:The alfalfa (Medicago sativa cv. Gold queen) was used to study the effects of phosphate fertilizer and microbial fertilizer on soil microbial quantity and soil enzyme activity in alpine region. Results showed that the soil microorganisms number (bacteria,fungi,actinomycete),urease and invertase,protease activity were increased after fertilization treatments in different soil layers (0 to 10 cm,10 to 20 cm). The number of bacteria was more than actinomycetes,and which was followed by fungi. The number of microorganisms in 0 to10 cm soil layer was higher than that in 10 to 20 cm. The number of bacteria and actinomyces in treatment of phosphorus + mixed microbial fertilizer were higher than those in treatment of single phosphorus fertilizer and mixed microbial fertilizer. After applying 50% phosphorus and mixed microbial fertilizer,the number of bacteria and fungi were the largest. Urease,invertase and alkaline phosphatase and protease in 0 to 10 cm soil layer were higher than those in 10 to 20 cm. However,the hydrogen peroxide enzyme activity in 10 to 20 cm soil layer was higher than that in 0 to 10 cm. Urease activity in treatment of phosphorus + mixed microbial fertilizer was higher than other treatments. The microorganisms correlated to soil enzymes after fertilization.
Key words:alfalfa,microbial fertilizer,soil microorganism,soil enzyme
中图分类号:S 146
文献标识码:A
文章编号:1009-5500(2016)01-0007-07
作者简介:陈娟丽(1988-),女,甘肃定西人,在读硕士。
基金项目:公益性行业(农业)科研专项(201003023),现代农业产业技术体系建设专项资金(CARS-35)资助
收稿日期:2015-04-17; 修回日期:2015-04-29
E-mail:juanlic@163.com
师尚礼为通讯作者。

