基于生物条形码信号放大的电化学方法检测
张瑶++蒙丽君++官菊芳++晋晓勇
摘要:通过抗原抗体的特异性识别作用以及生物条形码的信号放大作用,构建了一种新的电化学免疫传感器,用以检测人免疫球蛋白(hIgG)。将抗体Ab1修饰到金电极上,加入抗原(hIgG),经过抗原抗体的免疫反应再将已制备好的纳米金标记抗体Ab2和生物条形码(Ab2-AuNPs-B)修饰到该免疫传感器上,通过观察电化学阻抗的变化来监控免疫传感器的构建过程。利用生物条形码的信号放大作用,通过循环伏安法和差示脉冲伏安法对hIgG的含量进行定量检测,其检出限达到0.4×10-5 mg/L。
关键词:生物条形码;信号放大技术;生物传感器;hIgG;纳米金
中图分类号: Q511文献标志码: A文章编号:1002-1302(2016)02-0308-04
收稿日期:2015-02-26
基金项目:国家自然科学基金(编号:21067010、21365016)。
作者简介:张瑶(1989—),女,硕士研究生,主要从事生化分析及生物传感器的研究。E-mail:zdjcyylx@163.com。
通信作者:晋晓勇,博士,副教授,主要从事生化分析及生物传感器的研究。Email:xiaoyongjin @126.com。蛋白质是生命的物质基础,它对人体的健康有着极其重要的作用[1-4]。人免疫球蛋白G(hIgG)是血清中含量最高的一种免疫蛋白,是机体再次免疫应答后形成抗体的主要组分,在机体防御机制中发挥着重要的作用,在临床上作为多种疾病诊断及疗效评价的重要指标[5-7],因此对其进行定性、定量检测显得尤为重要。传统的免疫分析法检测hIgG由于存在操作步骤较为繁琐、仪器设备昂贵等缺点,因此在实际应用中受到了一定的限制,难以较大范围推广。
传统检测hIgG的方法主要有质谱法[8]、荧光分析法[9-10]、电化学分析法[11-13]等。其中,电化学方法由于具有较高的灵敏度、极低的检测限逐渐受到广泛关注。生物条形码因其较高的选择性和生物特异性也日益受到人们广泛重视[14-15]。早期的生物条形码主要用于DNA的检测[16-17],而在蛋白质分子的检测及应用方面还鲜有报道。综合以上背景,本研究将电化学方法与生物条形码相结合,以hIgG为模型蛋白,对其进行定量定性分析。
1材料与方法
1.1仪器和材料
电化学工作站(EC550,湖北武汉高仕睿联科技有限公司),UV-265紫外仪(日本岛津),三电极体系:金盘电极(直径2.0 mm),饱和甘汞电极(SCE),Pt电极,KQ-2200B超声清洗器(江苏昆山超声仪器厂)。
本试验所用磷酸盐缓冲溶液(PBS)均为:Na2HPO4(天津市化学试剂六厂)和NaH2PO4(山东莱阳市双双化工有限公司)的混合溶液,Na2CO3(陕西西安化学试剂厂),氯金酸、叠氮化钠(阿拉丁试剂公司)等均为分析纯,试验用水均为超纯水。
兔抗人IgG抗体(Ab1)、hIgG、羊抗人IgG抗体(Ab2)购于北京博奥森生物技术有限公司。条形码序列B:5′-SH-TAGTAAGTAA-FC-3′ 合成于上海生工生物工程技术服务有限公司。
1.2纳米金(AuNPs)的制备
将100 mL 的氯金酸(0.01%)加入到250 mL的圆底烧瓶中加热,搅拌至沸腾后向其中加入4.0 mL的柠檬酸三钠(1%),继续加热10 min [18],制成的纳米金于4 ℃下保存,用于制备金标抗体。
1.3AuNPs与Ab2及条形码序列(B)的结合(Ab2-AuNPs-B)
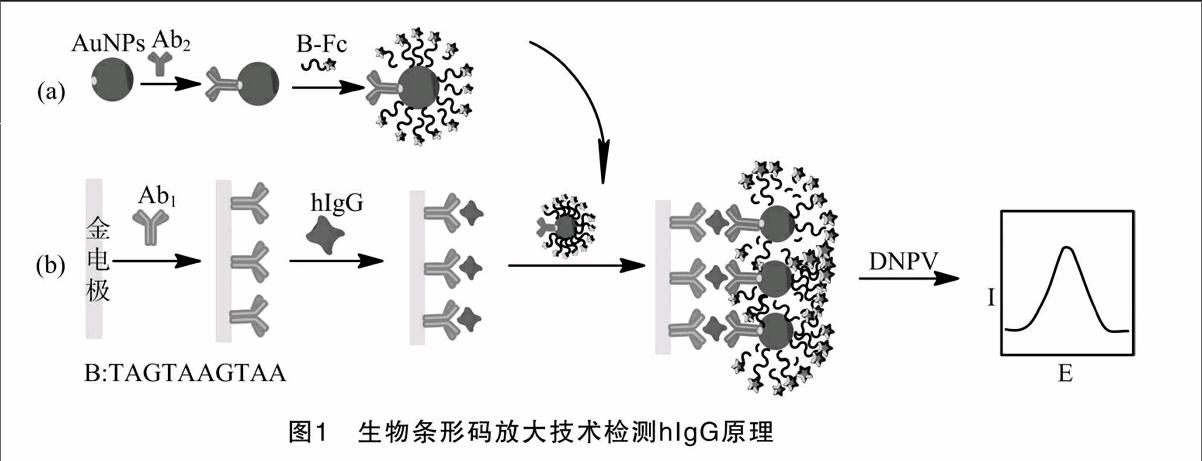
试验原理如图1-a所示,具体试验步骤如下:用Na2CO3调节纳米金pH值至9.0,加入100 μL Ab2(250 mg/L)振荡混匀,室温静置3 h,除去上清液中游离抗体,将离心后聚合物分散于0.05 mol/L含有0.05%叠氮化钠的PBS(pH值7.0)中。后将100 μL B(10 μmol/L)加入已制备好的Ab2-AuNPs中振荡均匀,室温静置1 h。离心,除去上清液中未结合的B。将已制备好的Ab2-AuNPs-B分离到0.05 mol/L含有 0.05% 叠氮化钠的PBS(pH值7.0)中,于4 ℃保存备用。
1.4电极修饰及免疫传感器的构建
将金电极(直径2.0 mm)用0.3 μm的Al2O3粉末打磨洗净,再用0.05 μm的Al2O3粉末将金电极打磨至光滑镜面。超纯水分2次超声清洗5 min,并将金电极浸入新制的Piranha溶液[98% H2SO4 ∶H2O2(体积比)=7 ∶3]约15 min。依次用超纯水、95%乙醇超声约3 min。将电极置于0.5 mol/L H2SO4 溶液中,在0~1.5 V电位范围内扫循环伏安曲线直至峰形稳定。最后依次用超纯水、95%乙醇、丙酮超声3 min,氮气吹干表面,作为工作电极备用。滴加10 μL Ab1修饰于金电极表面,一定时间后,用PBS(pH值7.0)缓冲液冲洗数次,再滴加BSA(1%)溶液封闭电极30 min,用PBS(pH值7.0)冲洗。
1.5目标物的分析检测
滴加10 μL hIgG,使之与电极上修饰的Ab1特异性结合,一定时间后,用PBS(0.01 mol/L,pH值7.0)缓冲液冲洗数次,除去未结合的hIgG,再滴加10 μL Ab2-AuNPs-B。采用三电极体系,以玻碳电极为工作电极,Pt电极为对电极,饱和甘汞电极为参比电极,采用循环伏安法和差示脉冲伏安法对hIgG进行检测。
2结果与分析
2.1试验原理
基于生物条形码及纳米金信号放大的电化学免疫传感器检测hIgG的构建过程如图1所示。首先将Ab1固定于金电极表面,加入hIgG及Ab2-AuNPs-B,经过抗原抗体的免疫反应,构建免疫传感器。通过纳米金及生物条形码将检测信号放大。最后通过电化学差示脉冲伏安法对条形码上标记的二茂铁进行检测,从而实现对蛋白质的定量检测。
2.2表征B-AuNPs-Ab2
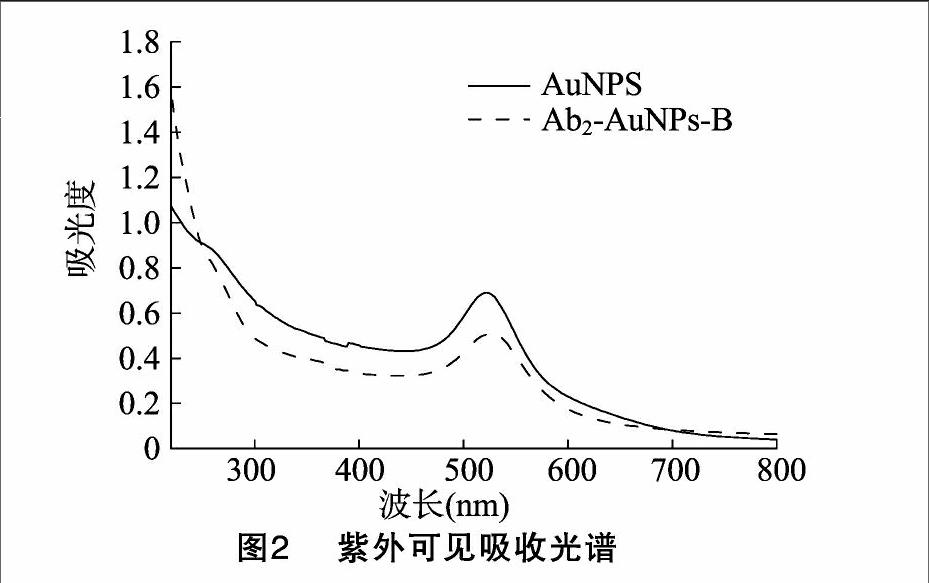
B-AuNPs-Ab2形成以后,AuNPs所处化学环境发生改变。结合基团的紫外吸收光谱中的波长及吸光度会发生变化。因此,本研究采用紫外-可见光谱法来监控 B-AuNPs-Ab2的形成。
B-AuNPs-Ab2的合成方法如“2.3”节所述,通过紫外可见吸收光谱对其组成及化学性质进行表征。如图2所示,AuNPs和B-AuNPs-Ab2的最大吸收波长分别在525 nm和533 nm处。B-AuNPs-Ab2的吸收峰相比AuNPs吸收峰发生红移,主要原因可能是AuNPs上结合了Ab2及B使颗粒尺寸变大,颗粒周围的微环境发生改变。在270 nm处,B-AuNPs-Ab2相对于AuNPs有较强的的吸收峰。说明,Ab2与B已经成功修饰在纳米金上(图2)。
2.2电极表面不同状态的阻抗表征
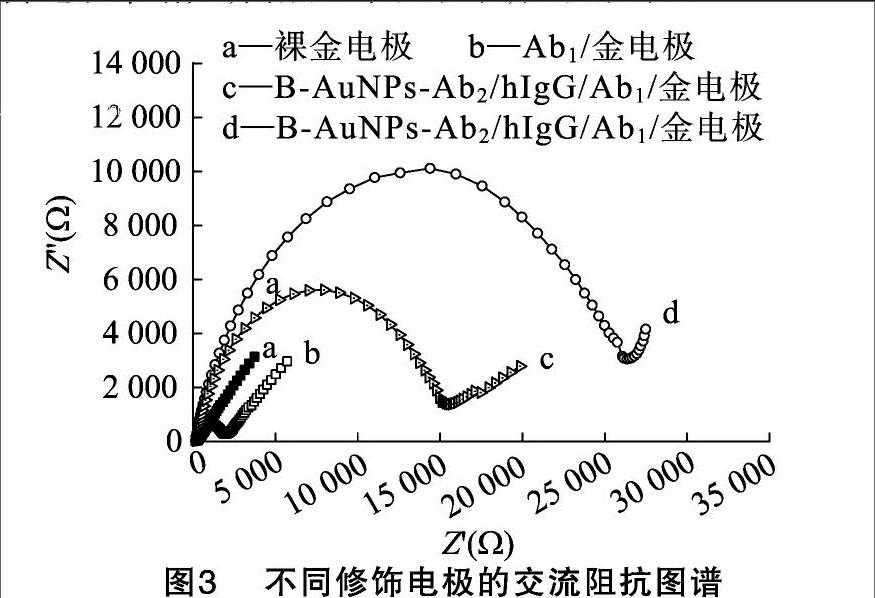
法拉第阻抗图谱是一种测量电极界面性质的有效方法,能用于表征免疫传感器的组装过程,阻抗图谱包括高频的半圆部分(相当于动力学控制的过程)和低频的直线部分(相当于扩散控制的过程),每层的电子传递情况用电阻来表示,可通过计算半圆部分的半径而得到,半圆的直径越大所对应电子传递的阻力越大,因此可以通过监控半圆的直径变化来监控电极的修饰过程[19]。
由图3可见,经过修饰后的金电极(b、c、d)与裸金电极(a)相比,阻抗都有所增加。表明电子传递效率最高,裸金电极阻抗最小。当加入Ab1后(b),阻抗增大。是由于Ab1的存在阻碍了氧化还原探针在电极上的电子传递,使得Ab1修饰的金电极的电阻与裸金电极的电阻相比有所增加。当再加入hIgG后(d),由于抗体分子在电极表面形成了一层阻碍电子传递的屏障,使得电子传递的效率明显降低,从而导致阻抗进一步增大。当继续加入Ab2-AuNPs-B后(c),阻抗值要小于d曲线,这是由于B-AuNPs-Ab2上标记了AuNPs,使电子传递效率增大,高频区半径减小,阻抗减小。
2.3试验条件的优化
本试验考察了免疫分析的结合时间以及包被抗原的浓度。如图4-A所示,较少体积的Ab1不能够确保有足够的抗体进行免疫反应,使得测定的信号值较低;相反,Ab1的用量为0.1 mg/L时,测定信号有显著提高。此外,Ab1与hIgG的结合时间也是影响免疫传感器信号的重要因素。如图4-B 所示,当Ab1结合到电极上的时间为45 min时,免疫传感器的信号值最大。如图4-C所示,电化学响应随着免疫时间的延长而增加,当免疫时间为40 min时,免疫传感器的电化学响应达到最大值,当继续延长反应时间时,响应并未有明显增大。因此分别选择45、40 min为最优时间。
2.4目标物分析检测结果
本试验采用循环伏安法(CV)和差示常规脉冲伏安法(DNPV)优化反应条件,对hIgG进行检测(图5)。图5-A、图5-B是不同修饰电极表面的循环伏安曲线和差示脉冲伏安曲线。由图5可以看出,当Ab2-AuNPs-B结合到hIgG上后,有1对二茂铁的氧化还原峰出现,信号明显增强,说明
纳米金修饰的生物条形码具有很好的信号放大作用。由于差示常规脉冲伏安法所检测的电化学信号强于循环伏安法检测的峰电流信号。因此选用差示常规脉冲伏安法对hIgG峰电流值进行检测,并作标准曲线。随着hIgG浓度的减小,峰电流值随之减小,在一段浓度范围内有很好的线性关系。检测hIgG所得结果:回归方程为I(μA)=2.77 lgCIgG+27.75,相关系数r=0.99,其线性范围为0.003 2~ 31 μg/L,检出限为0.004 μg/L,远低于基于碳纳米管固定抗原的检测方法[20]的检测限2 μg/L与基于金纳米棒标记免疫分析方法[21] 的检测限25 μg/L。可能原因是:首先,由于纳米金粒子具有粒径小、比表面积大、表面反应活性高、催化效率高等优异性[22-23],能有效结合一端修饰有巯基的条形码;其次,每个纳米粒子上都结合了成百上千个生物条形码,采用DNPV法能够有效地捕捉这些条形码另一端标记的二茂铁的信号,使得电化学信号得以放大;最后,采用BSA封闭金电极,可有效降低传感器的非特异吸附,避免了其他相关干扰。
2.5传感器的特异性及重现性
特异性和重现性是考察传感器的重要因素。本研究考察了免疫传感器对干扰蛋白如癌胚抗原、肌红蛋白(Mb)以及BSA的电化学响应。结果表明,当检测物含有1.0 μg/L hIgG及2 μg/L BSA、肌红蛋白、癌胚抗原时,电化学免疫分析方法测定的结果如图6所示。由此可以看出此免疫传感器具有良好的特异性。
将制备的免疫传感器保存于4 ℃下,每隔5 d进行测试。在 5 d 后,电流值仅减小了4.1%。20 d后电流响应值为原来的89.8%。试验结果表明,此传感器具有良好的稳定性。于同一条件下,用5只金电极对同一浓度hIgG(1 ng/mL)做相关分析,检测结果见表1,测定结果的相对标准偏差(RSD)为 6.4%。
3结论
本试验研究了高灵敏的电化学免疫传感器。结合了电化学方法与生物条形码技术,采用夹心型模式对hIgG进行了检测 。 此传感器利用纳米金比表面积和良好的导电性,条形码放大信号的优点,极大地提高了灵敏度 。此免疫传感器检出限低,稳定性好,可望用于其他生化物质的检测。
参考文献:
[1]张学记,鞠熀先,约瑟夫·王. 电化学与生物传感器——原理,设计及其在生物医学中的应用[M]. 张书圣,李雪梅,杨涛,等译.北京:化学工业出版社,2009:425-427.
[2]丁士健,夏其昌. 蛋白质组学的发展与科学仪器现代化[J]. 现代科学仪器,2001(3):12-17.
[3]Man-Seok J,Sang T J. Aglycosylated full-length IgG antibodies:steps toward next-generation immunotherapeutics[J]. Current Opinion in Biotechnology,2014,30(1):128-139.
[4]邹小勇,陈汇勇,李荫. 电化学DNA传感器的研制及其医学应用[J]. 分析测试学报,2005,24(1):123-128.
[5]Dutta G,Kim S,Park S,et al. Washing-Free heterogeneous immunosensor using Proximity-Dependent electron mediation between an enzyme label and an electrode[J]. Analytical Chemistry,2014,86(9):4589-4595.
[6]Zhang J,Topp E M. Protein G,protein a and protein A-Derived peptides inhibit the agitation induced aggregation of IgG[J]. Molecular Pharmaceutics,2012,9(3):622-628.
[7]Wei H,Giddens J,Fan S Q,et al. Chemoenzymatic glycoengineering of intact IgG antibodies for gain of functions[J]. Chem,2012:134.
[8]Dekker L J,Zeneyedpour L,Brouwer E,et al. An antibody-based biomarker discovery method by mass spectrometry sequencing of complementarity determining regions[J]. Analytical and Bioanalytical Chemistry,2011,399(3):1081-1091.
[9]Gu X E,Yan Y,Jiang G Q,et al. Using a silver-enhanced microarray sandwich structure to improve SERS sensitivity for protein detection[J]. Analytical and Bioanalytical Chemistry,2014,406(7):1885-1894.
[10]Byung-Keun O,Jwa-Min N,Seung W L,et al. A fluorophore-based bio-barcode amplification assay for proteins[J]. Small,2006,2(6):103-108.
[11]云雯,王晓英,董平,等. 基于电化学聚合固定抗体的电化学发光免疫分析法检测人免疫球蛋白[J]. 分析化学,2009,37(1):8-12.
[12]Darain F,Gan Kai Ling,Tjin S C. Antibody immobilization on to polystyrene substrate-on-chip immunoassay for horse IgG based on fluorescence[J]. Biomedical Microdevices,2009,11(3):653-661.
[13]李玲,王海燕,孙东艳,等. 基于碳纳米管的脂质体电化学发光免疫传感器检测人免疫球蛋白G[J]. 分析化学,2010,38(9):1329-1332.
[14]Zhang B,Liu B Q,Tang D P,et al. DNA-Based hybridization chain reaction for amplified bioelectronic signal and ultrasensitive detection of proteins[J]. Analytical Chemistry,2012,84(12):5392-5399.
[15]Cao X D,Ye Y K,Liu S Q. Gold nanoparticle-based signal amplification for biosensing[J]. Analytical Biochemistry,2011,417(1):1-16.
[16]Xu Z N,Yin H S,Tian Z B,et al. Electrochemical immunoassays for the detection the activity of DNA methyltransferase by using the rolling circle amplification technique[J]. Microchimica Acta,2014,181(3/4):471-477.
[17]Xiang Y,Qian X Q,Chen Y,et al. A reagentless and disposable electronic genosensor:from multiplexed analysis to molecular logic gates[J]. Chemical Communications,2011,47(7):2080-2082.
[18]Katherine C G,Griffith R,Freeman,et al. Preparation and characterization of Au colloid monolayers[J]. Analytical Chemistry,1995,67(4):735-743.
[19]刘红英,朱俊杰. 金纳米簇信号放大的免疫传感器[J]. 分析化学,2013,41(5):613-658.
[20]李小蓉. 基于碳纳米管固定抗原的电化学免疫传感器法测定IgG抗体[J]. 分析试验室,2013,32(7):121-124.
[21]彭剑淳,王小慧,李媛,等. 人IgG标记金纳米棒并用于抗人IgG抗体的检测[J]. 生物技术通讯,2009,20(5):680-682,702.
[22]Hu C M,Dou W C,Zhao G Y. Enzyme immunosensor based on Gold nanoparticles electroposition and Streptavidin-biotin system for detection of S. pullorum \& S. gallinarum[J]. Electrochimica Acta,2014,117:239-245.
[23]Alvarez S D,Chang P L,Chiang C E,et al. A label-free porous alumina intereferometric immunosensor[J]. ACS Nano,2009,3(10):3301-3307.詹秀环,王子云,苏亚娟. 模拟胃液条件下维生素C对蔬菜亚硝酸盐含量的影响[J]. 江苏农业科学,2016,44(2):312-314.

