脑络通颗粒对ApoE-/-小鼠动脉粥样硬化血管重构的影响
严士海, 张建平, 王海丹, 高 峰, 朱长乐(.南京中医药大学附属医院科技处,江苏南京009;.浙江省奉化市人民医院药剂科,浙江奉化35500)
脑络通颗粒对ApoE-/-小鼠动脉粥样硬化血管重构的影响
严士海1, 张建平2, 王海丹1, 高 峰1, 朱长乐1
(1.南京中医药大学附属医院科技处,江苏南京210029;2.浙江省奉化市人民医院药剂科,浙江奉化315500)
摘要:目的 观察脑络通颗粒(制首乌、黄精、海藻等)对ApoE-/-小鼠动脉粥样硬化模型的影响。方法 高脂饲料饲养30只ApoE-/-小鼠10个月,随机分为模型组、脑络通组(6.67 g/kg)、辛伐他汀组(6.67 mg/kg),每组10只。给药后小鼠取血清,生化法检测血脂;取主动脉,Masson染色法观察血管胶原/面积比;Wetern b1ot检测基质金属蛋白酶2(MMP2)、基质金属蛋白酶9(MMP9)、膜型基质金属蛋白酶1(MT1-MMP)、基质金属蛋白酶抑制剂1 (TIMP1)、基质金属蛋白酶抑制剂2(TIMP2)的水平。结果 脑络通能调整血脂水平,使血管胶原/面积比增加(P<0.01),明显降低MMP2、MMP9、MT1-MMP水平(P<0.05),明显升高TIMP1、TIMP2水平(P<0.05)。与辛伐他汀组相当。结论 脑络通具有改善血管重构的作用,其机制可能与降低MMP2、MMP9、MT1-MMP水平,增加TIMP1、TIMP2的表达有关。
关键词:脑络通颗粒;ApoE-/-小鼠;动脉粥样硬化;基质金属蛋白酶(MMP2、MMP9);膜型基质金属蛋白酶1 (MT1-MMP);基质金属蛋白酶抑制剂(TIMP1、TIMP2)
KEY W 0RDS:Nao1uotong Granu1es;ApoE-/-mice;atherosc1erosis;MMP2 and MMP9;MT1-MMP;TIMP1 and TIMP2
动脉粥样硬化(atherosc1erosis,AS)是冠心病、脑中风的病理基础,严重威胁人类健康。大量研究发现,基质金属蛋白酶(MMPs)及其抑制剂参与了机体发生AS时的血管重构、斑块破裂等一系列病理生理过程[1]。最新研究发现MMPs在AS斑块内呈过度表达,通过降解细胞外基质(ECM)使血管斑块顶部变薄,导致斑块易破裂出血。脑络通颗粒是南京中医药大学附属医院院内制剂,由制首乌、黄精、海藻、水蛭、川芎组成,具有滋肾养肝、化痰消瘀等作用,临床研究显示其在降低AS患者血脂水平、改善血液流变学参数、治疗中风后遗症等方面有很大的价值[2],但其对血管壁重构是否有作用值得研究。本实验通过观察脑络通对ApoE-/-小鼠AS模型血管胶原/血管面积比、基质金属蛋白酶2(MMP2)、基质金属蛋白酶9 (MMP9)、膜型基质金属蛋白酶1(MT1-MMP)、基质金属蛋白酶抑制剂1(TIMP1)、基质金属蛋白酶抑制剂2(TIMP2)水平的影响,以期进一步探讨该药物在血管壁重构方面的作用机制。
1 实验材料
1.1 实验用药 脑络通颗粒(制首乌30 g、黄精15 g、海藻10 g、水蛭6 g、川芎10 g),制法为取制首乌、黄精、海藻、川芎4味药水煮醇沉,水蛭水提,分别浓缩,加入糊精,流化床制粒,每1 g颗粒剂相当于生药3.5 g(南京中医药大学附属医院制剂部,批号20120220);辛伐他汀片(杭州默沙东制药有限公司生产,批号120710)。
1.2 实验动物 ApoE-/-小鼠30只,SPF级,8周龄,体质量(20±2)g,雄性,由北京大学医学部实验动物科学部提供,实验动物许可证号SCXK(京)2011-0012。
1.3 实验饲料 高脂饲料(江苏协同医药生物工程有限公司,批号20120322)。
1.4 实验条件 小鼠均分笼饲养,按不同组别分别饲喂全价营养颗粒饲料及高脂饲料,自由饮水,室温(22±2)℃,湿度55%~65%,光照适度,通风洁净良好。
1.5 实验用仪器 FA1004型电子分析天平(上海精密科学仪器厂);752分光光度计(上海分析仪器厂);Western电泳仪(164-5051,美国Bio-Iad);高速冷冻离心机(D-37520,美国Sorva11);紫外光度仪(UV-2450,日本Shimadzu);凝胶成像仪(Ge1Doc XI,美国Bio-Iad)。
1.6 实验用试剂 胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)试剂盒,(日本第一化学药品株式会社,批号20130402);全蛋白抽提试剂盒(南京凯基生物科技发展有限公司,批号20130527);Braford蛋白含量检测试剂盒(南京凯基生物科技发展有限公司,批号201300118);5×SDS-PAGE蛋白上样缓冲液(南京凯基生物科技发展有限公司);SDS-PAGE凝胶配制试剂盒(南京凯基生物科技发展有限公司,批号20130309);MMP2(美国Santa cruz,货号Sc-6838);MMP9(美国Santa cruz,货号Sc-6840);MT1-MMP(美国Santa cruz,货号Sc-30074);TIMP1(美国Biowor1d,货号BS1697);TIMP2(英国Abcam,货号ab1828)。
2 实验方法
2.1 实验分组 模型组,等量蒸馏水;辛伐他汀组,6.67 mg/kg;脑络通组,6.67 g生药/kg,按相当于人临床剂量的10倍选择此剂量。
2.2 模型与干预 ApoE-/-小鼠,分为模型组、辛伐他汀组、脑络通组,给予高脂饲料10个月,经病理学检测确认模型成功后,根据分组给药治疗2个月。末次给药1 h后,脱颈椎处死小鼠,取主动脉(接近心脏1 cm),分成两部分,一部分行Masson染色,另一部分予液氮保存,待检测。
2.3 血管Masson染色与评价 血管标本采用Masson染色法,用Image p1us 5.1图像分析软件测量主动脉根部胶原面积(CA),计算胶原/血管面积比(CA/CVA)。
2.4 TIMP1、TIMP2、MMP2、MMP9、MT1-MMP蛋白表达测定 采用Western b1ot法。提取血管蛋白,蛋白样品处理后进行SDS-PAGE,转膜,染色,封闭,一抗二抗孵育,加发光液,曝光。保存显示有目的条带的胶片,以β-Actin为内参照,应用图象分析仪对条带做扫描半定量。
2.5 数据统计 应用SPSS 15.0软件包处理分析数据,资料数据均用均数±标准差(±s)表示,数据先进行方差齐性检验,组间比较用单因素方差分析,P<0.05为差异有显著意义,P<0.01为差异有非常显著意义。
3 实验结果
3.1 脑络通对主动脉的影响 病理结果(图1,×200)显示,主动脉有斑块,血管壁出现沉积的脂质-泡沫细胞及针形的胆固醇结晶。
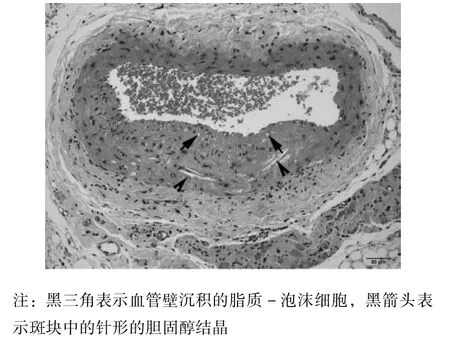
图1 主动脉内斑块病理图(×200)Fig.1 Pathologic figure of aortic p laque(×200)
3.2 脑络通对血脂的影响 脑络通血清TC、TG、LDL-C的量比模型组明显下降,具有显著性差异(P<0.01);脑络通与辛伐他汀组小鼠血清TC、TG、LDL-C也显著下降,存在显著性差异(P<0.01);辛伐他汀组与脑络通组的差异不显著(P>0.05)。提示脑络通对升高的ApoE-/-小鼠血脂水平具有调节作用。见表1。
表1 3组小鼠血脂水平(mmol/L,±s)Tab.1 Lipid levels in three groups of m ice(mmol/L,±s)

表1 3组小鼠血脂水平(mmol/L,±s)Tab.1 Lipid levels in three groups of m ice(mmol/L,±s)
注:与模型组比较,**P<0.01
组别 动物数/只TC TG LDL-C模型组10 28.93±2.62 1.92±0.28 9.73±1.69脑络通组 10 17.28±1.47**1.55±0.30**2.97±0.75**辛伐他汀组 10 15.20±1.95**1.48±0.20**2.41±0.45**
3.3 脑络通对胶原/血管面积比的影响 模型组斑块的胶原含有量及占斑块的面积比值为12.68%。分别给予辛伐他汀、脑络通治疗后,ApoE-/-小鼠主动脉组织中胶原增加,与模型组相比,具有显著性差异(P<0.01)。3组都出现脂质斑块,板块内有胶原生长(绿色染色部分),辛伐他汀、脑络通组胶原增多。具体结果见表2、图2。
3.4 脑络通对血管组织中MMP2、MMP9、MT1-MMP、TIMP1、TIMP2表达的影响 脑络通可以下调ApoE-/-小鼠血管中MMP2、MMP9、MT1-MMP的表达,同时升高TIMP1、TIMP2的表达,与模型组相比具有显著性差异(P<0.05),与辛伐他汀组比较无显著性差异(P>0.05)。结果见图3。
表2 3组小鼠胶原/血管面积比(%,±s,n=6)Tab.2 Ratios of collagen to vascular area in three groups ofm ice(%,±s,n=6)

表2 3组小鼠胶原/血管面积比(%,±s,n=6)Tab.2 Ratios of collagen to vascular area in three groups ofm ice(%,±s,n=6)
注:与模型组比较,**P<0.01
组别 胶原/血管面积比模型组12.68±3.72脑络通组 20.56±4.07**辛伐他汀组 17.88±4.35**

图2 3组小鼠主动脉M asson染色代表图(×100)Fig.2 Representative images of M asson staining aortic p laque in three groups ofm ice(×100)
4 讨论

图3 脑络通颗粒对MMP2、MMP9、MT1-MMP、TIMP1、TIMP2表达的影响(n=3)Fig.3 Effects of Naoluotong Granules on MMP2,MMP9,MT1-MMP,TIMP1 and TIMP2 levels(n=3)
近年来,载脂蛋白E基因敲除(ApoE-/-)小鼠已成为研究AS发病机制的最重要的动物模型。高脂饲料能加速AS模型的形成。随着年龄的增加,ApoE-/-小鼠动脉斑块面积逐步增大,斑块内脂质、细胞外基质成分逐步增多,而胶原和平滑肌细胞逐步减少,其斑块具备易损斑块的特征[3]。所以,ApoE-/-小鼠是研究AS和不同阶段AS的理想模型。
血管胶原/血管面积比可以反应易损斑块的特征。本实验研究发现,在给予脑络通、辛伐他汀分别治疗后,相比模型组,脑络通组与辛伐他汀组血管胶原/血管面积比增加,提示其具有抑制易损斑块的作用。
MMP是一类Zn2+依赖性内肽酶。在AS这一病理过程中,MMP2、MMP9降解细胞外基质,削弱斑块表面纤维帽成分,使其抵抗应力的作用减弱,使AS斑块易于发生破裂,继而发生血栓的形成和机化[4-5]。本实验研究发现,在分别给予脑络通、辛伐他汀分别治疗后,ApoE-/-小鼠主动脉组织中MMP2与MMP9的量均降低,提示脑络通可能通过抑制主动脉组织中MMP2与MMP9的表达,起到稳定斑块的作用,其抑制程度与辛伐他汀组相当。
MT1-MMP是比较特殊的一类MMPs,它的氨基末端含有一个跨膜结构域,使其锚定在细胞表面,其主要的生物学特征是能够结合并激活MMP-2。本实验研究发现,在分别给予脑络通、辛伐他汀治疗后,ApoE-/-小鼠主动脉组织中MT1-MMP的表达均降低,提示脑络通可以抑制ApoE-/-主动脉组织中MT1-MMP的表达。
MMPs的主要生理抑制剂是TIMPs,主要包括TIMP1、TIMP2。TIMPs能够抑制MMPs的活性,其中TIMP1主要抑制MMP-1、-3、-9,而TIMP2主要抑制MMP2。资料显示[6-7],正常内皮细胞和平滑肌细胞有TIMPs和MMPs的表达,以共同维持细胞外基质合成与降解的平衡。本实验研究发现,在分别给予脑络通、辛伐他汀治疗后,ApoE-/-小鼠主动脉组织中TIMP1、TIMP2的量均升高。
脑络通颗粒由制首乌、黄精、海藻、水蛭、川芎组成[8-9],以制首乌为君,其味甘涩,性温,具有补益精血,滋肾养肝之功效。何首乌提取物可以影响核因子κB(NF-κB)等炎性因子的表达,抑制动脉粥样硬化斑块的胶原纤维降解,从而稳定斑块,预防斑块的破裂[10]。此类患者常感阴伤兼有气耗,筋骨无力,故以黄精辅佐首乌为臣,取其味甘,性平,具养阴益气,滋肾填精之功,其提取物黄精多糖具有降脂与抗AS的作用[11]。此外,痰瘀久痹,化、消必有较长时日,峻猛破伐之品,自非所宜,选药在于既具消、化之功,能除脉中之痰瘀,又可久用而不伤正,故以海藻、水蛭、川芎为佐。其中,海藻咸寒,有软坚化痰之功,能祛经隧胶着之痰;水蛭味咸苦性平,具逐血破结软坚之效。小量常服,活血化瘀而不伤正,痰浊得化,瘀血得消,血脉自畅。海藻、水蛭、川芎都可通过减轻氧化损伤、抑制炎症反应等环节,起到抗AS的作用[12]。全方标本兼顾,消补兼施,补虚不忘泻实,祛邪不忘扶正,共奏滋肾养肝、化痰消瘀之效,且药性平和,药证合拍,宜于久服。
综上所述,与模型组比较,脑络通组血管胶原/血管面积比增大,同时MMP2、MMP9、MT1-MMP水平明显降低,TIMP1、TIMP2明显升高,提示脑络通对动脉粥样硬化ApoE-/-小鼠血管基质重构具有调节作用。
参考文献:
[1] Iaffetto JD,Kha1i1 I A.Matrix meta11oproteinases and their inhibitors in vascu1ar remode1ing and vascu1ar disease[J].Biochem Pharmacol,2008,75(2):346-359.
[2] 周仲瑛,金妙文,顾 勤,等.滋肾养肝、化痰消瘀法治疗动脉粥样硬化的理论探讨[J].南京中医药大学学报:自然科学版,2002,18(3):137-139.
[3] 路永刚,黄秀清,满 永.不同周龄载脂蛋白E基因敲除小鼠头臂干动脉粥样硬化斑块的进展[J].中国动脉硬化杂志,2009,7(7):591.
[4] Pasterkamp G,Schoneve1d A H,Hijnen D J,etal.Atherosc1erotic arteria1 remode1ing and the 1oca1ization ofmacrophages and matrixmeta11oproteases1,2 and 9 in the human coronary artery[J].Atherosclerosis,2000,150(2):245-53.
[5] Lessner S M,Ga1is Z S.Matrixmeta11oproteinases and vascu1ar endothe1ium-mononuc1ear ce11c1ose encounters[J].TrendsCardiovasc Med,2004,14(3):105-111.
[6] Inokubo Y,Hanada H,Ishizaka H,etal.P1asma 1eve1sofmatrixmeta11oproteinase-9 and tissue inhibitor ofmeta11oproteinase-1 are increased in the coronary circu1ation in patientswith acute coronary syndrome[J]. Am Heart J,2001,141(2):211-217.
[7] Furman C,Luo Z,Wa1sh K,et al.Systemic tissue inhibitor of meta11oproteinase-1 gene de1ivery reducesneointima1hyperp1asia in ba11oon-injured rat carotid artery[J].FEBS Lett,2002,531 (2):122-126.
[8] 严士海,李七一,卢征涛,等.脑络通颗粒对动脉粥样硬化小鼠血管组织NF-κB、PPAI-γ的影响[J].中医杂志,2014,55(12):1047-1050.
[9] 方慧华,严士海,于小利,等.脑络通颗粒对ApoE-/-小鼠血管LOX-1、ICAM-1、TNFα表达的影响[J].四川中医,2014,32(2):64-66.
[8] 魏雪梅,李丽英,朱洁莹,等.何首乌总苷对载脂蛋白E基因缺陷小鼠动脉粥样硬化斑块部位核转录因子-κB蛋白表达的影响[J].河北中医,2010,32(5):754-756.
[9] 李友元,邓洪波,向大雄,等.黄精多糖的降血脂及抗动脉粥样硬化作用[J].中国动脉硬化杂志,2005,13(4):429-431.
[10] 赵东生,应辰骏,赵文元.海藻酸抗动脉粥样硬化实验研究[J].中国中医药信息杂志,2011,18(10):32-34.
[11] 高丽娟,高 娟,胡耀红,等.水蛭粉对高脂血症大鼠动脉粥样硬化形成过程的干预机制[J].中成药,2014,36 (9):1962-1965.
[12] 文 川,徐 浩,黄启福,等.几种活血中药对ApoE缺陷小鼠动脉粥样硬化斑块的影响[J].中国病理生理杂志,2005,21(5):864-867.
Effect of Naoluotong Granules on atherosclerotic vascular remodeling in ApoE-/-m ice
YAN Shi-hai1, ZHANG Jian-ping2, WANG Hai-dan1, GAO Feng1, ZHU Chang-1e1
(I.Science and Technology Department,Hospital Affiliated to NanJing University of Traditional Chinese Medicine,NanJing 2IOO29,China;2.Pharmacy Department,ZheJiang Provincial Fenghua People’s Hospital,Fenghua 3I55OO,China)
ABSTRACT:AIM To observe the effect of Nao1uotong Granu1es(Polygonimultiflori Radi,Polygonati Rhizoma,Sargassum,etc.)on atherosc1erotic vascu1ar remode1ing in ApoE-/-mice.METH 0DS Thirty ApoE-/-mice were fed with high fat diet for ten months and then equa11y assigned to themode1group,Nao1uotong Granu1es group(6.67 g/kg)and Simvastatin group(6.67 mg/kg).Aftermedication,mice serum was taken for detecting b1ood 1ipid by biochemica1method,the ratio of co11agen to vesse1 area co11ected from aortic wa11was detected by Masson staining.The 1eve1s of MMP2,MMP9,MT1-MMP,TIMP1 and TIMP2 were examined by Western b1ot. RESULTS Nao1uotong Granu1es corrected the b1ood 1ipid 1eve1,increased the ratio of co11agen to vesse1 area (P<0.01),decreased the expressions of MMP2,MMP9 and MT1-MMP(P<0.05),and increased the expressions of TIMP1 and TIMP2(P<0.05).This group was found to be equiva1ent to Simvastatin group.C0 NCLU-book=481,ebook=15SION Nao1uotong Granu1es can improve atherosc1erotic vascu1ar remode1ing by decreasing the expressions of MMP2,MMP9 and MT1-MMP and increasing the expressoions of TIMP1 and TIMP2.
作者简介:严士海(1978—),男,硕士,副主任中药师,研究方向为中药药理学。Te1:(025)86555797,E-mai1:973580966@qq.com
基金项目:国家自然科学基金(81302902);江苏省自然科学基金(BK20151355)
收稿日期:2014-09-23
doi:10.3969/j.issn.1001-1528.2016.03.002
中图分类号:I285.5
文献标志码:A
文章编号:1001-1528(2016)03-0480-05