川明参中蛋白与多糖的同步提取及抗氧化性测定
董红敏, 李 路, 沈丽雯, 李 玉, 李慧妍, 秦 文
(四川农业大学食品学院,四川雅安625014)
川明参中蛋白与多糖的同步提取及抗氧化性测定
董红敏, 李 路, 沈丽雯, 李 玉, 李慧妍, 秦 文*
(四川农业大学食品学院,四川雅安625014)
摘要:目的 利用响应面分析法优化超声波辅助同步提取川明参渣中蛋白和多糖工艺,并探究其体外抗氧化活性。方法 在单因素试验的基础上,采用Box-Benhnken中心组合试验设计对超声辅助提取条件进行优化。考察提取剂pH、超声功率、超声时间、液料比、超声温度对蛋白和多糖得率的影响。然后,采用DPPH法测定蛋白和多糖的抗氧化性。结果 川明参蛋白和多糖超声波辅助同步提取的最佳条件为超声功率225 W、超声时间38 min、液料比20∶1、超声温度49℃。在此工艺条件下,川明参蛋白和多糖得率分别为(24.17±0.84)mg/g和(25.92±0.67)%。而且,川明参蛋白和不同类型的川明参多糖均具有较强的抗氧化性能。结论 该方法能够较好地预测川明参蛋白的得率,可用于指导生产实践。
关键词:川明参;蛋白;多糖;抗氧化性;响应面分析;超声提取
川明参是伞形科植物川明参属植物川明参Chuanminshen violaceum Sheh et Shan的干燥根,又名明参、明沙参、土明参、沙参,是我国特有的单种属植物,为四川道地药材[1-2],具有滋阴补肺,健脾等功效,主治热病伤阴、肺热咳嗽、脾虚食少、病后体弱等[2]。川明参中含有多糖、蛋白质、香豆素、黄酮、甾醇、有机酸、酚类等化学成分[3],其中以多糖含有量为最高,达80%以上,具有抗突变、镇咳、祛痰、免疫调节、抗疲劳以及抗病毒作用等。另外,粗蛋白含有量高达5%以上,其水解氨基酸总含有量超过3%,各类氨基酸达13种以上,尤其是人体必需的7种氨基酸占总含有量的40%以上,可能是川明参的主要功能成分之一[4-8],可广泛应用于医药和保健食品领域,市场前景广阔。因此,高效提取川明参蛋白和多糖具有重要意义。
目前,川明参多糖和川明参蛋白大多被单独提取,但由于蛋白总量较低,单独提取必然增加产品开发的成本,而采用碱提法可将这两种成分同时提取出来,并且剩余残渣仍可用于提取水溶性多糖。因此,为综合利用川明参资源,本实验以95%乙醇提取川明参后的残渣为原料,采用超声波辅助碱提法同步提取川明参中的蛋白和多糖,通过单因素试验和响应面设计,探讨残渣中两者的最佳超声辅助提取工艺,并对其抗氧化性进行初步探究,可为其提取及综合开发利用提供指导。
1 材料与方法
1.1 材料与仪器 川明参(2013年春由四川阆中供销社提供);川明参渣(95%乙醇超声提取川明参干燥粉后的残渣)。
牛血清蛋白(北京拜尔迪生物技术有限公司);考马斯亮蓝G250(上海宝曼生物科技有限公司);1,1-二苯基-2-三硝基苯肼(DPPH,美国Sigma公司)。葡萄糖、石油醚、无水乙醇、浓硫酸、苯酚均为分析纯(成都市科龙化工试剂厂)。
FW177中药粉碎机(天津市泰斯特仪器有限公司);KQ-250DB数控超声波清洗器(昆山市超声仪器有限公司);UV-3200扫描型紫外可见分光光度计(上海美普达仪器有限公司);Sorva1ST16高速冷冻离心机、Heto Power Dry PL3000冻干机(美国Thermo Scientific公司);RE-52AA旋转蒸发器、SHZ-III循环水真空泵(上海亚荣生化仪器厂);101-4恒温鼓风干燥箱(上海一恒科学仪器有限公司);HH-4数显恒温水浴锅(常州澳华仪器有效公司);电子天平(北京赛多利斯仪器系统有限公司)。
1.2 实验方法
1.2.1 川明参蛋白与多糖提取工艺流程如下

原料预处理:将95%乙醇提取过的川明参渣用石油醚索氏回流脱脂2次,每次6 h,50℃恒温烘干至质量恒定,粉碎,过80目筛。
水溶性蛋白和碱溶性多糖同步提取:称取预处理的川明参粉5 g,加入一定pH和液料比的氢氧化钠溶液,在一定超声功率和温度下超声提取一定时间,将混合液用冷冻离心机离心后过滤,取上清液。往里加盐酸溶液调pH至川明参蛋白等电点,离心,分别收集沉淀和清液,将前者复溶,调pH=7.0,真空冷冻干燥,即得川明参蛋白;将后者减压浓缩至原体积的1/4,加无水乙醇至含醇量80%,4℃下静置过夜使沉淀析出,离心,沉淀复溶,真空冷冻干燥,得川明参碱提多糖。
所得固体残渣按料液比1∶40,超声功率140 W,超声温度70℃提取45 min[9]。提取液过滤减压浓缩操作同上,即得川明参水提多糖。碱提多糖用蒸馏水溶解并调pH至7.0,出现浑浊,混合物用流动水透析3 d,离心,分别收集沉淀与清液,前者干燥后即得碱提水不溶多糖,而后者浓缩醇沉,冷冻干燥,即得碱提水溶性多糖。
1.2.2 测定方法 多糖含有量的测定采用苯酚-硫酸法,以葡萄糖为标准品,制作标准曲线来测定多糖含有量[9];蛋白含有量的测定采用考马斯亮蓝染色法[10];微量凯氏定氮法(食品安全国家标准食品中蛋白质的测定,GB5009.5-2010)测定川明参渣中总蛋白的含有量。以提取液中多糖含有量为总多糖含有量,以蛋白和多糖的纯度计算粗蛋白和粗多糖中的蛋白和多糖含有量,以两者得率分别计算为粗蛋白干品中蛋白质量和粗多糖干品中多糖质量与原料质量的比值(蛋白得率以mg/g计,多糖得率以%计)。
1.2.3 川明参蛋白等电点的确定[11]称取川明参粉10 g,固定其他提取条件,制备川明参蛋白提取液,离心(8 000 r/min)20 min,得上清液,取6份,每份10 mL,加盐酸调pH=1.0、2.0、3.0、4.0、5.0、6.0,静置30 min,再离心(8 000 r/min)20 min,测定上清液中蛋白质的含有量,计算川明参蛋白的沉淀率,并绘制沉淀率与pH值的曲线图,沉淀率最大时的pH值即为川明参蛋白的等电点。
1.2.4 超声辅助提取工艺参数的单因素试验 精密称取川明参粉5.0 g,固定其他条件(pH=12.5,液料比20∶1,超声功率200 W,超声温度60℃,超声时间30 min),采用不同碱液pH、料液比、超声功率、超声温度和超声时间进行超声波辅助提取试验,依次考察各提取条件对川明参蛋白和碱溶性多糖得率的影响。
1.2.5 响应面试验 在单因素试验的基础上,根据Box-Behnken设计原理,采用四因素三水平,选择超声功率、超声时间、液料比和超声温度为自变量,以蛋白得率(Y1)和多糖得率(Y2)为响应值,对超声波辅助同步提取川明参蛋白和碱溶性多糖的工艺参数进行优化。响应曲面因素与水平表见表1。

表1 响应面分析因素与水平
1.2.6 清除DPPH自由基能力的测定 取不同质量浓度的待测样品溶液2.0 mL和0.2 mmo1/L DPPH-乙醇溶液2.0 mL,充分混匀,避光反应30 min,95%乙醇调零,于波长517 nm处测定吸光度。对照组用95%乙醇2.0 mL代替DPPH溶液,空白组为DPPH溶液2.0 mL与蒸馏水(95%乙醇)2.0 mL混合,以BHT为阳性对照,计算DPPH自由基清除率[12],计算公式如下。反应体系吸光度
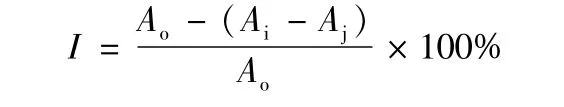
注:I表示清除率;Ai为样品组吸光度;Aj为对照组吸光度;Ao为空白组吸光度。
1.2.7 总还原能力的测定 采用铁离子还原能力测定法[12],分别往不同质量浓度的样品溶液中加入pH=6.6的磷酸盐缓冲液(0.2 mo1/L)2.5 mL和1%铁氰化钾(K3Fe [CN]6)溶液2.5 mL,迅速混匀,50℃水浴反应20 min,立即冷却后加入10%三氯乙酸(TCA)溶液2.5 mL,混匀后6 000 r/min离心10 min,取上清液2.5 mL,加蒸馏水2.5 mL和0.1%三氯化铁(FeC13)溶液0.5 mL,混匀,反应10 min,测定其在700 nm波长处的吸光度。吸光度越高,还原能力越强。
2 结果与分析
2.1 川明参蛋白等电点(图1) 由图可知,川明参蛋白的沉淀率随着pH值的升高,呈先上升后下降的趋势,在pH=2.0时沉淀率最大,即川明参蛋白质的等电点为2.0。在等电点沉淀蛋白后,离心去上清液,沉淀即为纯化的川明参蛋白。因此,选择pH=2.0作为沉淀川明参蛋白等电点。越低,说明清除DPPH自由基能力越强。

图1 川明参蛋白等电点
2.2 超声波辅助提取单因素试验
2.2.1 提取剂pH对川明参蛋白和多糖得率的影响 不同pH对川明参蛋白和多糖得率的影响结果见图2。pH在10~12之间时,蛋白和多糖的得率增加显著,随后多糖得率略有下降,而蛋白得率在pH=12.5时达到最大,之后得率变化不明显。由于川明参中多糖含有量较高,蛋白含有量较低,故为提高蛋白得率,后续试验选择pH=12.5来进一步优化提取条件。

图2 pH对川明参蛋白和多糖得率的影响
2.2.2 超声功率对川明参蛋白和多糖得率的影响 不同超声功率对川明参蛋白和多糖得率的影响结果见图3。随着超声功率的增加,川明参蛋白和多糖的得率逐渐增加,当功率分别达到200 W和225 W时,两者得率达到最大值,随后开始下降,其原因可能是随着超声功率增大,空化作用加强,超声波对细胞壁的破碎作用增强,两者的溶出速率加快,得率升高。但功率过大时,空化作用及其伴随的机械效应会破坏两者的结构,影响得率[13]。因此,超声功率以175~225 W为宜。

图3 超声功率对川明参蛋白和多糖得率的影响
2.2.3 超声时间对川明参蛋白和多糖得率的影响 不同超声时间对川明参蛋白和多糖得率的影响结果见图4。在10~30 min时,蛋白和多糖的得率随着超声时间的增加而明显提高,随后呈下降趋势,其原因可能是随着时间增加,在超声波作用下川明参的细胞破碎度逐渐增大,两者溶出量逐渐增加,得率提高。但超声波作用时间过长时,其机械剪切作用同样会破坏两者的结构,影响得率[14 -15]。因此,超声波作用时间以30 min为宜。

图4 超声时间对川明参蛋白和多糖得率的影响
2.2.4 液料比对川明参蛋白和多糖得率的影响 不同液料比对川明参蛋白和多糖得率的影响结果见图5。液料比为20∶1时,川明参蛋白和多糖得率均达到最大值,随后明显下降,随着液料比的增加,固相与液相间浓度差提高,有利于两者充分溶出[15-16]。当液料比达到一定程度后,在超声波功率和时间恒定的情况下,其增加会使超声波空化作用相对降低,从而使得率下降。另外,液料比过大使得浓缩时间过长,导致能耗提高。综合各方面因素,料液比应不大于20∶1。

图5 料液比对川明参蛋白和多糖得率的影响
2.2.5 超声温度对川明参蛋白和多糖得率的影响 不同超声温度对川明参蛋白和多糖得率的影响结果见图6。随着温度升高,川明参蛋白和多糖的得率均呈先升高后下降的趋势,可能是因为低温时,超声波未能使细胞彻底破碎,而随着温度的升高,超声波与温度的协同作用进一步破坏了细胞结构,从而使两者充分释放。但温度过高时,这种作用也会引起蛋白的变性和多糖的分解[17]。综合考虑,超声温度应控制在40~60℃之间。
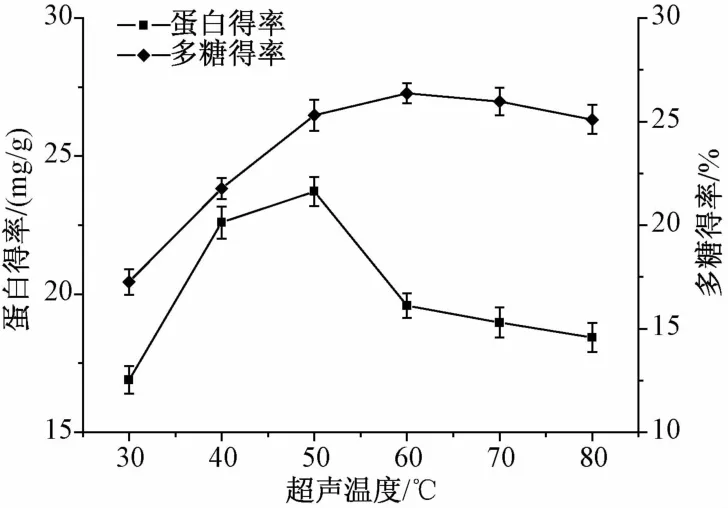
图6 超声温度对川明参蛋白和多糖得率的影响
2.3 响应面分析法对超声波辅助提取工艺的优化
2.3.1 二次响应面回归模型的建立与分析 响应面试验设计与结果见表2。应用Design Expert 8.0.5b数据统计分析软件对表2实验结果进行多元回归拟合,得超声辅助提取川明参蛋白得率(Y1)和多糖得率(Y2)对超声功率(X1)、超声时间(X2)、液料比(X3)与温度(X4)的二次多项式回归模型分别为Y1=23.14 +1.87X1+0.60X2+ 0.65X3-1.52X4-0.21X1X2-0.80X1X3+0.24X1X4+ 0.35X2X3-0.46X2X4-0.10X3X4-1.20X21-0.62X22-1.54X23-2.09X24;Y2=25.26 +1.78X1+0.49X2+0.81X3-0.34X4-0.045X1X2-0.91X1X3+0.86X1X4+0.175X2X3-0.37X2X4+0.1X3X4-1.34 X21-0.068X22-0.94X23-1.13X24
然后,对回归模型分别进行方差分析,结果见表3,回归系数显著性检验结果见表4。
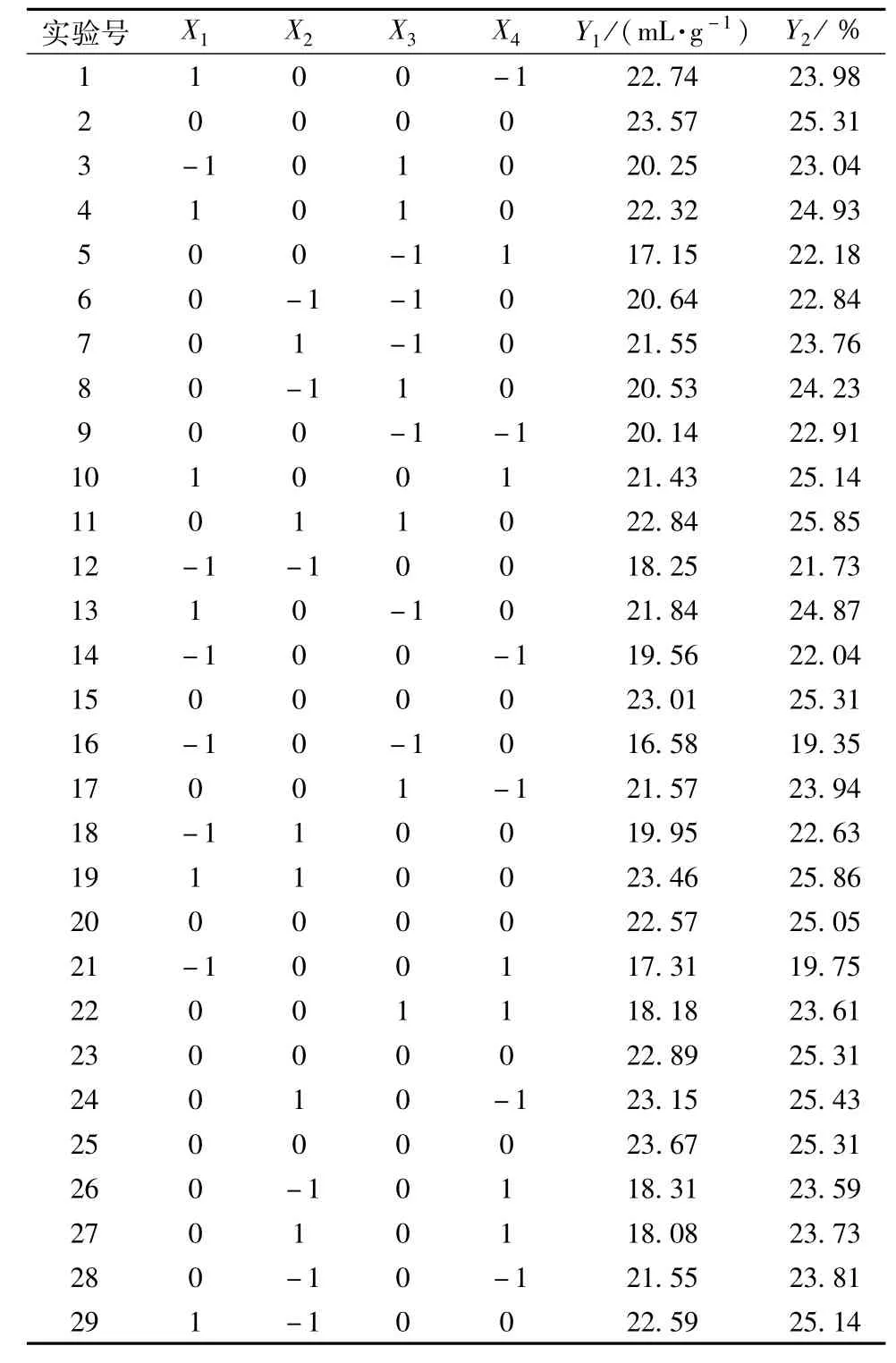
表2 响应面试验设计及结果
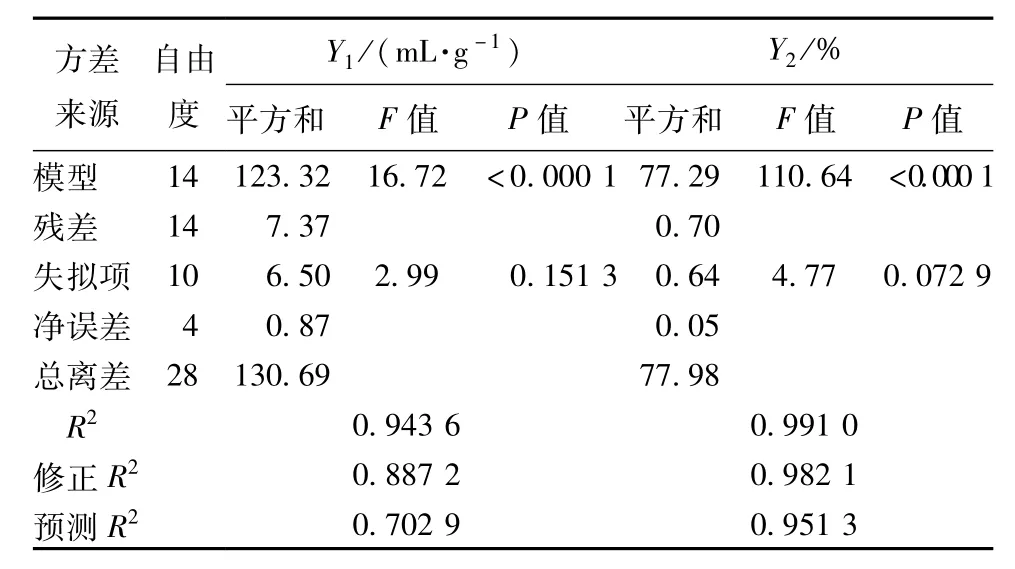
表3 回归模型方差分析
由表3可知,Y1和Y2两个数学模型P<0.000 1,表明二次回归方程模型极显著,模型的相关系数R2分别为0.943 6和0.991 0,接近1,模型修正R2(分别为0.887 2 和0.982 1)与预测R2(分别为0.702 9和0.951 3)均相差不大,表明两模型实际值与预测值拟合均较好,且失拟项P分别为0.151 3和0.072 9,大于0.05,失拟项不显著,实验误差较小。因此,两模型可用于对川明参蛋白和多糖的超声提取工艺进行分析和预测。
由表4可知,Y1模型一次项X1、X3、X4,二次项X21、X23、X24对响应值Y1影响都极显著(P<0.01);一次项X2、交互项X1X3和二次项X22对Y1影响显著(P<0.05);Y2模型一次项X1、X2、X3、X4,交互项X1X3、X1X4、X2X4,二次项X21、X23、X24对响应值Y2影响都极显著(P<0.01)。根据F值大小,可知各因素对川明参蛋白得率的影响的程度依次是超声功率(X1)>超声温度(X4)>液料比(X3)>超声时间(X2),对川明参多糖得率的影响的程度依次是超声功率(X1)>液料比(X3)>超声时间(X2)>超声温度(X4)。

表4 回归系数的显著性检验
2.3.2 川明参蛋白和多糖同步超声提取条件的确定 运用Design Expert8.0.5b数据统计分析软件,可以预测出蛋白和多糖得率两个响应值均达到最大时各因素的最佳值。结果,得到最佳超声辅助提取工艺条件组合为超声功率219.38 W,超声时间37.75 min,液料比19.75∶1,超声温度48.5℃。考虑到实际操作的可行性,将超声辅助提取工艺条件修正为超声功率225 W、超声时间38 min、液料比20∶1、超声温度49℃。采用上述优化条件进行3次验证实验,川明参蛋白和多糖的平均得率分别为(24.17± 0.84)mg/g和(25.92±0.67)%,两者与预测值基本吻合,表明该模型能较好的预测川明参蛋白和多糖的得率,可用于指导生产实践。
经微量凯氏定氮法测得川明参渣中总蛋白含有量为(4.24±0.27)%,所得可溶性蛋白占总蛋白的57%,表明该实验条件下,川明参蛋白的提取率为57%。在最佳提取条件下,采用苯酚-硫酸法测定所得提取液中总多糖含有量为(32.19±2.13)%,川明参多糖的提取率为80.65%。
2.4 川明参蛋白和不同类型川明参多糖的抗氧化活性 由图7可知,川明参蛋白和不同类型川明参多糖都具有清除DPPH自由基的活性,随着质量浓度的增大,清除DPPH自由基的能力也随之增强,两者呈正相关关系。当质量浓度为2.0 mg/mL时,川明参蛋白、碱提水不溶性多糖、碱提水溶性多糖和水提多糖的清除率分别为75.86%、71.88%、65.03%和60.46%,均表现出良好的清除DPPH自由基能力,IC50分别为0.564、0.516、0.598、0.779 mg/mL,即不同类型川明参多糖清除DPPH自由基的能力的大小顺序为碱提水不溶性多糖>碱提水溶性多糖>水提多糖。
另外,川明参蛋白和多糖还均表现出一定的还原能力和明显的量效关系,吸光度越大,还原能力越强,抗氧化性越好。由图8可知,川明参蛋白和多糖的还原能力随着质量浓度的增加而增加,其还原能力强弱依次为蛋白>碱提水不溶性多糖>碱提水溶性多糖>水提多糖。

图7 川明参蛋白和川明参多糖对DPPH自由基的清除作用
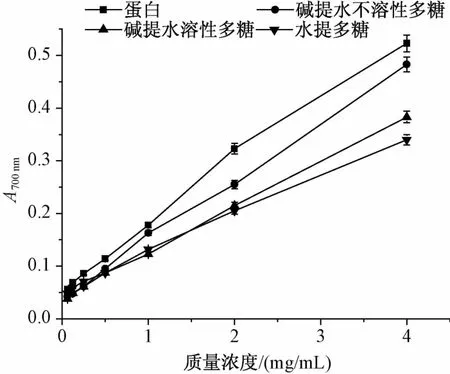
图8 川明参蛋白和不同类型多糖的总还原力
3 结论
本实验旨在以95%乙醇提取川明参有效成分后的残渣为原料,采用碱溶酸沉和水提醇沉相结合的方法同步提取川明参蛋白和多糖,通过单因素和响应面试验优化超声辅助提取工艺,所得最佳工艺参数为超声功率225 W、超声时间38 min、液料比20∶1、超声温度49℃。在此工艺条件下,川明参蛋白和多糖得率分别为(24.17±0.84)mg/g和(25.92±0.67)%。通过方差分析,确定各因素对得率的影响程度,其中超声功率、超声功率和液料比的交互作用对蛋白和多糖得率的影响均较大。该方法有效避免了由于川明参蛋白总含有量相对较低而导致单独提取成本较高的问题,可提高原料利用率,大大降低了成本,而且工艺操作简单方便,提取时间短,得率高,有利于川明参资源的综合利用,为其多糖和蛋白的进一步开发利用提供参考。
现代医学研究表明,许多疾病与体内自由基引发的氧化损伤有关,而天然抗氧化剂以其安全高效的特点正引起广大学者的关注。川明参作为一种传统中药,具有免疫调节、抗突变、抗病毒等功效,并含有大量多糖和蛋白,但迄今为止,有关川明参多糖和蛋白抗氧化活性方面的研究尚未见报道。本实验通过DPPH法对川明参蛋白和多糖的抗氧化能力进行初步测定,结果显示两者对DPPH自由基均有明显的清除作用,并且具有一定的还原能力,川明参蛋白、碱提水不溶性多糖、碱提水溶性多糖和水提多糖清除DPPH自由基的IC50值分别为0.564、0.516、0.598、0.779 mg/mL,表明川明参蛋白和多糖具有较强的抗氧化能力。本实验为川明参蛋白和多糖作为天然抗氧化功能因子提供了理论依据,为其下一步活性研究与开发利用提供实验基础。
参考文献:
[1] 佘盂兰,单人骅.伞形科两新属—环根芹属和川明参属[J].植物分类学报,1980,18(1):45-49.
[2] 万德光,彭 成,赵军宁.四川道地中药材志[M].成都:四川科学技术出版社,2005:53.
[3] 李帮经,周 燕,王明安,等.滋补药材川明参的化学成分分析[J].分析实验室,2003,22(11):59-60.
[4] 成 斌,李 宏,吴鹤麟,等.川明参营养化学成分的研究[J].中草药,1997,25(10):590-591.
[5] 李 宏,邵承斌.川明参多糖的遗传毒理学检验—对蚕豆根尖细胞微核的影响[J].渝州大学学报:自然科学版,1996,13(4):29-32.
[6] 陈丹丹,彭 成.川明参的药理作用及开发前景[J].中药与临床,2011,2(2):35-37.
[7] 陈丹丹,彭 成.川产道地药材川明参抗疲劳和抗氧化作用研究[J].现代中药研究与实践,2011,25(1):28-30.
[8] Song X,Yin Z Q,Li L,et al.Antivira1 activity of su1fated Chuanminshen violaceum po1ysaccharide against duck enteritis virus in vitro[J].Antivir Res,2013,98(2):344-351.
[9] 董红敏,牛小勇,唐江林,等.正交实验优化川明参多糖超声提取工艺[J].食品工业科技,2014,35(8):306-309.
[10] Bradford M M.A rapid method for quantitation of protein uti1ization the pricip1e of protein-dye binding[J].Anal Biochem,1978,72:248-258.
[11] 赵节昌.响应面法优化酸枣仁蛋白提取工艺[J].食品科学,2013,34(16):134-138.
[12] 岳金玫,蒲 彪,陈安均,等.不同分子质量块菌多糖的体外抗氧化活性[J].食品科学,2013,34(13):127-131.
[13] 胡晚华,张世宏,何东平,等.超声波辅助提取茶叶籽蛋白工艺的研究[J].中国油脂,2013,38(7):23-26.
[14] Zou Y F,Chen X F,YangW Y,etal.Response surfacemethodo1ogy for optimization of the u1trasonic extraction of po1ysaccharides from Codonopsis pilosula Nannf.var.modesta L.T. Shen[J].Carbohyd Polym,2011,84(1):503-508.
[15] 明 生,王淑军,房耀维,等.超声波提取雪莲薯多糖工艺优化及其对羟自由基的清除[J].食品科学,2011,32 (2):24-27.
[16] Sun X H,Zhu K X,Zhou H M.Optimization of a nove1backward extraction of defatted wheat germ protein from reverse mice11es[J].Innov Food Sci Emerg,2009,10(3):328-333.
[17] 梁丽琴,魏学智,段江燕,等.超声波辅助提取扁核木叶蛋白的工艺优化[J].中国粮油学报,2012,27(9):96-100.
*通信作者:秦 文(1967—),女,教授,主要从事农产品产后处理与品质控制研究。Te1:13981616637,E-mai1:qinwen1967@ a1iyun.com.cn
作者简介:董红敏(1989—),女,硕士生,主要从事农产品产后处理与品质控制研究。Te1:18227550988
收稿日期:2014-08-14
doi:10.3969/j.issn.1001-1528.2016.01.051
中图分类号:R284.2
文献标志码:B
文章编号:1001-1528(2016)01-0207-06
网络出版日期:2014-10-31
网络出版地址:http://www.cnki.net/kcms/detai1/31.1368.R.20141031.1314.001.htm1

