水黄皮胶囊剂的制备工艺和质量标准
肖成燕, 朱 毅, 董 志*
(1.重庆医科大学药理教研室,重庆400016;2.海南省药品检验所,海南海口570216)
水黄皮胶囊剂的制备工艺和质量标准
肖成燕1, 朱 毅2, 董 志1*
(1.重庆医科大学药理教研室,重庆400016;2.海南省药品检验所,海南海口570216)
摘要:目的 建立水黄皮胶囊的制备工艺及其质量标准。方法 以休止角、吸湿率、临界相对湿度、堆密度为考察指标,确定水黄皮胶囊的处方组成;TLC法对胶囊中的水黄皮进行定性鉴别;紫外分光光度和HPLC法分别测定总黄酮和水黄皮次素的含有量。结果 最佳处方为10%微粉硅胶,临界相对湿度为63.9%,选用0号胶囊即可满足胶囊剂装填要求。TLC鉴别斑点清晰,无干扰。每粒胶囊剂含总黄酮不低于162.42 mg/g,水黄皮次素不低于39.56 mg/g。结论 该工艺路线合理可行,质量控制方法专属性强、重复性好,可用于控制水黄皮胶囊的质量。
关键词:水黄皮胶囊;制备工艺;总黄酮;水黄皮次素;TLC;HPLC;紫外分光光度
水黄皮Pongamia pinnata(L.)Merr.(异名Pongamia glabra)为豆科水黄皮属的半红树植物[1],具有抗菌、抗炎镇痛、抗溃疡、抗氧化、降血糖以及降血脂等作用。现代研究表明,水黄皮主要含黄酮、三萜、生物碱、脂肪酸及类固醇,其主要活性成分为黄酮类化合物[2-4],尤其在治疗胃溃疡中,水黄皮次素具有独特的效果[5]。本实验在前期对水黄皮有效部位总黄酮提取、分离、纯化研究[6-7]的基础上,以休止角、吸湿率、临界相对湿度、堆密度为考察指标,进一步对其胶囊剂的制备进行研究,并采用TLC进行定性鉴别,紫外UV和HPLC进行含有量测定,建立合理可行的质量标准,为其工业生产提供理论依据。
1 仪器与试药
XFB-200高速中药粉碎机(吉首市中诚制药机械厂);标准筛(上虞市申克试验仪器厂);手工胶囊填充板(长沙市雨花区中诚制药机械厂);BPH9200A高温鼓风干燥箱(上海蓝豹试验设备有限公司);AE240电子天平(梅特勒-托利多仪器上海有限公司);SK8200HP超声波清洗器(上海科导超声仪器有限公司);EVOLUTION 300紫外可见分光光度计(美国赛默飞世尔科技公司);LC-2010AHT高效液相色谱仪(日本岛津公司)。
药用乳糖、糊精、预胶化淀粉、微晶纤维素、微粉硅胶(安徽山河药用辅料股份有限公司);0号空心胶囊(浙江绿健胶囊有限公司)。水黄皮次素对照品(美国Chroma-Dex公司);水黄皮总黄酮粉(总黄酮含有量56.39%,水黄皮次素含有量13.74%,自制,水黄皮茎醇经D101大孔树脂纯化后浓缩,减压干燥,即得)。乙腈为色谱纯;水为超纯水;其他试剂均为分析纯。
2 方法与结果
2.1 辅料的选择 预试验表明,水黄皮总黄酮原粉的流动性差、吸湿性强,故选用乳糖、糊精、预胶化淀粉、微粉硅胶和微晶纤维素作为辅料,按表1配方混合药粉,过筛,考察流动性和吸湿性,以确定辅料种类。

表1 辅料与水黄皮总黄酮原粉的配方组成
2.1.1 休止角的测定[8]采用固定漏斗法,将3只漏斗串联,使最底端距水平坐标纸1 cm,将药粉沿漏斗壁倒入最上层的漏斗,直到药粉圆锥尖端接触到漏斗口为止,结果见表2。

表2 不同辅料的休止角及吸湿率
2.1.2 吸湿率的测定[9]将底部盛有NaC1饱和溶液的玻璃干燥器于实验前1天,放入25℃恒温培养箱中。精密称取各配方,平铺于已恒重的扁形称量瓶中,厚度约2 mm,瓶盖打开,置于玻璃干燥器中,间隔一段时间称量,结果见表2。
由表可知,水黄皮总黄酮原粉中加入辅料后,其流动性和吸湿性都有所改善。其中,以微粉硅胶为辅料时,其休止角可达到30°左右,而且在75%湿度环境中放置6 h后,仍呈粉末状。因此,选择微粉硅胶为辅料制备胶囊剂。2.2 辅料用量的筛选 为了确定微粉硅胶的最佳用量,按表3配方混合药粉,考察不同配方的流动性和吸湿性,结果见表3。

表3 不同比例微粉硅胶的休止角及吸湿率
由表可知,随着微粉硅胶比例的增加,其流动性和吸湿性逐渐得到改善。当置于75%湿度环境中6 h后,微粉硅胶为5.0%的配方表面有少量黏结,其他配方均为粉末。根据休止角和吸湿率测定结果的综合分析,选择微粉硅胶的最佳比例为10%。
2.3 临界相对湿度的测定[10]将混合药粉干燥至恒重后,平铺于已恒重的称量瓶底部,厚度约2 mm,再置于不同相对湿度的玻璃干燥器中,7 d后称量。结果,相对湿度分别为0.59%、2.23%、3.78%、6.82%、15.41%、24.17%、29.65%。以吸湿率为纵坐标,相对湿度为横坐标,应用SPSS软件作图,测得其临界相对湿度为63.9%,见图1。
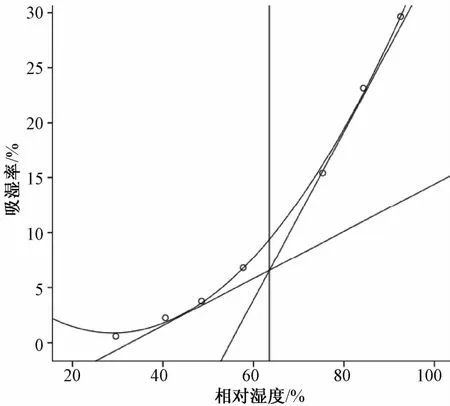
图1 不同相对湿度下的吸湿率
2.4 选择胶囊的型号 先称定量筒质量,将适量混合药粉置于其中,再称定其质量。上下振动,至体积不变时读出体积,计算3次,测得堆密度分别为0.618 5、0.616 1、0.610 8 g/mL,平均值为0.615 1 g/mL,RSD=0.39%。根据药效学实验研究结果,水黄皮总黄酮的有效剂量为(标准体质量60 kg)[11]150×0.162 =24.3 mg/kg,日服剂量每人约1.5 g。另外,每粒胶囊可装0.4 g,每日服用4粒,其所占体积约0.65 mL,与0号胶囊0.67 mL接近,故选用0号胶囊填充。
2.5 工艺验证[12]按照上述处方及工艺条件,对3批样品以外观、崩解时限、水分、含有量为工艺的评价指标进行验证,结果见表4。由表可知,各项指标均符合《中国药典》2010年版附录项下对胶囊剂的质量要求,表明该工艺可行,生产出的产品符合要求。
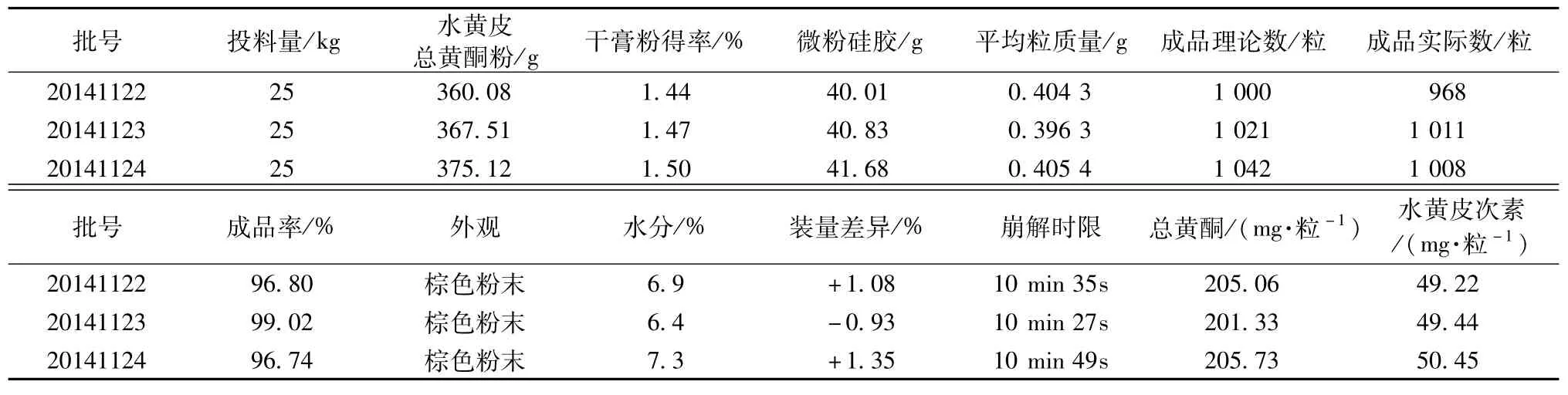
表4 水黄皮总黄酮胶囊工艺验证结果
2.6 薄层鉴别 取本品内容物0.5 g,置于具塞三角瓶中,加甲醇100 mL,超声(250 W、100 Hz)30 min,过滤,水浴蒸干,加水10 mL溶解,石油醚∶乙酸乙酯(92∶8)萃取3次,每次10 mL,挥干脂质部分,移取1 m L,用甲醇溶解,作为供试品溶液。另取水黄皮对照药材2.0 g,同法制成对照药材溶液。再取水黄皮次素对照品1.0 mg,加甲醇10 mL溶解,作为对照品溶液。上述3种溶液各取2~5 μL,分别点于同一硅胶G薄层板上,以环己烷-丙酮(7.5∶2.5)为展开剂展开,于紫外灯(365 nm)下观察,结果见图2。由图可知,在与对照药材和对照品色谱相应的位置上,呈现出相同颜色的斑点。
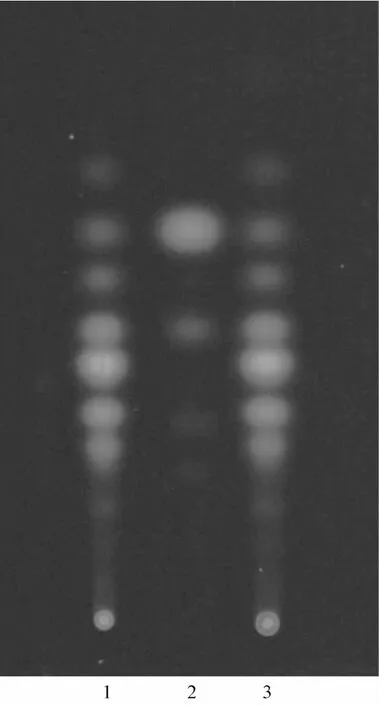
1.供试品 2.对照品 3.对照药材图2 水黄皮胶囊的TLC色谱图
2.7 总黄酮含有量的测定
2.7.1 对照品溶液的制备 精密称取真空干燥24 h的水黄皮次素对照品3.61 mg,置于50 mL量瓶中,甲醇溶解,定容至刻度,超声(250 W、100 Hz)30 min,放冷,甲醇补足至刻度,摇匀,即得质量浓度为72.2 μg/m L的水黄皮次素对照品溶液。
2.7.2 供试品溶液的制备 精密称取本品内容物30 mg,置于100 mL量瓶中,甲醇定容至刻度,超声(250 W、100 Hz)30 min,放冷,甲醇补足至刻度,摇匀,滤过,取滤液1 m L,置于25 m L量瓶中,甲醇定容,即得。
2.7.3 线性关系考察 精密吸取对照品溶液0.3、0.5、0.7、0.9、1.0 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,258 nm波长下测定。以吸收度为纵坐标(Y),水黄皮次素质量浓度为横坐标(X),得回归方程Y= 0.101 4X+0.012 5,r=0.999 8,表明在2.16~7.22 μg/mL范围内,线性关系良好。
2.7.4 精密度试验 精密移取对照品溶液0.9 mL,置于10 mL量瓶中,加甲醇稀释至刻度,258 nm波长下测定其吸收度,重复6次。结果,RSD为0.29%,说明仪器精密度良好。2.7.5 稳定性试验 取供试品溶液适量,每隔3 h测定1次,连续5次。结果,RSD为0.41%,说明该样品在15 h内稳定。
2.7.6 重复性试验 精密称取本品内容物30 mg,共6份,按“2.7.2”项下方法制备供试品溶液,重复6次。结果,RSD为0.65%,表明该方法重复性良好。
2.7.7 加样回收试验 精密称取含有量已知的内容物50 mg,共9份,分成3组,分别按80%、100%、120%的比例精密加入水黄皮次素对照品,按“2.7.2”项下方法制备供试品溶液,进行测定。结果,加样回收率为99.48%,RSD为1.11%。
2.7.8 总黄酮含有量的测定[13]按“2.7.2”项下方法制备3份供试品溶液,计算水黄皮胶囊中总黄酮的平均含有量为507.57 mg/g。根据生产实际,按平均含有量的80%计算,即不得低于406.06 mg/g。若每粒胶囊剂按0.4 g计算,则每粒含总黄酮应不低于162.42 mg。
2.8 水黄皮次素的含有量测定
2.8.1 对照品溶液的制备 按“2.7.1”项下方法制备。
2.8.2 供试品溶液的制备 精密称取内容物30 mg,置于500 m L量瓶中,甲醇定容至刻度,超声(250 W、100 Hz)30 min,放冷,甲醇补足至刻度,摇匀,滤过,即得。
2.8.3 色谱条件[14]大连依力特Hypersi1-C18ODS2色谱柱(4.6 mm×250 mm,5 μm);流动相为0.1%甲酸溶液(三乙胺调pH=3.0)-乙腈(60∶40);体积流量0.8mL/min;柱温35℃;检测波长258 nm;进样量20 μL,结果见图3。

图3 水黄皮胶囊中水黄皮次素的HPLC色谱图
2.8.4 线性关系考察 精密移取水黄皮素对照品储备液1.0、3.0、5.0、7.0、9.0、10 mL,置于10 m L量瓶中,甲醇定容至刻度,摇匀,在“2.8.3”项色谱条件下测定。以峰面积为纵坐标(Y),水黄皮次素质量浓度为横坐标(X)进行线性回归,得到回归方程Y= 149 292X+22 032,r=0.999 9。在7.22~72.2 μg/m L范围内,线性关系良好。
2.8.5 精密度试验 精密吸取水黄皮次素对照品溶液9 mL,置于10 mL量瓶中,甲醇稀释至刻度,测定其峰面积,重复6次。结果,RSD为0.15%,说明仪器精密度良好。
2.8.6 稳定性试验 取同一批号水黄皮胶囊内容物适量,按“2.8.2”项下方法制备供试品溶液,每隔3 h进样1次,共5次,记录峰面积。结果,RSD为1.69%,说明该样品在15 h内稳定,满足测定要求。
2.8.7 重复性试验 取同一批号水黄皮胶囊内容物适量,平行6份,按“2.8.2”项下方法制备供试品溶液。结果,RSD为1.78%,表明该方法重复性良好。
2.8.8 加样回收试验 精密称取含有量已知的水黄皮胶囊内容物15 mg,共9份,分成3组,分别按照80%、100%、120%比例准确加入水黄皮次素对照品,按“2.8.2”项下方法制备供试品溶液,测定含有量。结果,回收率为99.08%,RSD为2.50%。
2.8.9 水黄皮次素含有量的测定 按“2.8.2”项下方法制备3份供试品溶液,在“2.8.3”项色谱条件下测定,计算水黄皮胶囊中水黄皮次素的平均含有量为123.65 mg/g。根据生产实际,按平均含有量的80%计算,即不得低于98.92 mg/g。若每粒胶囊剂按0.4 g计算,则每粒含水黄皮次素应不低于39.56 mg。
3 讨论
目前水黄皮单味药材及其制剂并未收载于《中国药典》中,结合其现有的化学成分和药理研究,本实验对其提取、浓缩、干燥工艺进行了考察,用70%乙醇回流提取3次,减压浓缩至相对密度为1.25~1.30(60℃)的稠膏,然后用50~60℃的程序升温减压干燥,得到表面成蜂窝状、疏松、易粉碎的干膏粉。然后,考察了水黄皮总黄酮原粉的吸湿性和流动性,以休止角、吸湿率、临界相对湿度、堆密度为筛选指标,选用以10%微粉硅胶为最佳辅料的成型工艺。在该工艺下,药粉直接填充胶囊,减少了制粒过程中原料的损失,而且操作简单、稳定、可靠,可满足实际生产过程中胶囊制剂的要求。
基于水黄皮质量标准[15]研究的基础上,本实验采用薄层色谱对胶囊中水黄皮药材进行定性鉴别,发现用石油醚:乙酸乙酯(92∶8)萃取后得到的色谱图不仅较前期依次用石油醚、乙酸乙酯萃取后更清晰,斑点更分明,而且重现性更好。研究表明,水黄皮的主要活性物质为黄酮类成分,因此采用UV和HPLC法分别控制水黄皮胶囊中总黄酮和水黄皮次素的含有量,结果显示,这两种方法准确、可靠、重现性好,可有效控制水黄皮胶囊剂的质量,为水黄皮及其制剂的深入研究提供参考。
参考文献:
[1] 林 鹏.中国红树林研究进展[J].厦门大学学报:自然科学版,2001,40(2):592-603.
[2] 黄欣碧,龙盛京.半红树植物水黄皮的化学成分和药理作用研究进展[J].中草药,2004,35(9):1073-1076.
[3] Yadav P P,Ahmad G,Maurya R.Furanof1avonoids from Pongamia pinnata fruits[J].Phytochemistry,2004,65(4):439-443.
[4] Yin H,Zhang S,Wu J.Preny1ated f1avonoids from Pongamia pinnata[J].Z Naturforsch B,2005,60(3):356-358.
[5] Vismaya L,Srikanta M B,Rajashekhar S,et al.Gastroprotective properties of karanjin from Karanja(Pongamia pinnata)seeds;Ro1e as antioxidant and H+-K+-ATPase inhibitor[J]. Evid-based Compl Alt,2011,2011:e747246.
[6] 赵映淑,朱 毅,董 志,等.水黄皮根总黄酮提取工艺的研究[J].中成药,2011,33(4):722-724.
[7] 赵映淑,董 志,朱 毅,等.大孔吸附树脂纯化水黄皮根总黄酮的工艺研究[J].时珍国医国药,2011,22(1):154-156.
[8] 闫 舒,仰榴青,赵 婷,等.五味子多糖胶囊的制备工艺研究[J].中成药,2010,32(9):1617-1619.
[9] 危华玲,黄 廷,卢文胜.复方野葛根胶囊剂的成型工艺研究[J].时珍国医国药,2008,19(8):1886-1888.
[10] 蒋珍藕,陆国寿,高 微,等.木姜叶柯总黄酮胶囊的成型工艺[J].中国实验方剂学杂志,2011,17(15):52-54.
[11] 陈 奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:1169.
[12] 冷晓红,陈海燕,王英华.甘草黄酮胶囊成型工艺的研究[J].西北药学杂志,2012,27(2):144-147.
[13] 刘惠军,杨 骏,吴丽红,等.血通胶囊的质量控制研究[J].中成药,2008,30(5):776-778.
[14] 赵映淑,朱 毅,陈国彪.RP-HPLC法测定水黄皮药材中水黄皮素的含量[J].药物分析杂志,2010,30(12):2287-2289.
[15] 赵映淑.水黄皮质量标准及其提取物安全性评价研究[D].重庆:重庆医科大学,2010.
*通信作者:董 志(1960—),男,教授,博士生导师,从事神经药理方面研究。Te1:(023)68486678,E-mai1:zhidong073@hotmai1.com
作者简介:肖成燕(1989—),女,硕士,从事热带天然药物的药理毒理研究。Te1:(0898)66832932,E-mai1:1063007138@qq.com
基金项目:海南省中药现代化专项项目(2011ZY020)
收稿日期:2014-09-09
doi:10.3969/j.issn.1001-1528.2016.01.049
中图分类号:R944
文献标志码:B
文章编号:1001-1528(2016)01-0200-04

