高乌头炮制前后高乌甲素含量测定及小鼠急性毒性实验
李 芸, 胡昌江, 徐 婷, 王志旺, 熊 瑞
(1.成都中医药大学,四川成都611137;2.甘肃中医药大学,甘肃兰州730000)
高乌头炮制前后高乌甲素含量测定及小鼠急性毒性实验
李 芸1,2, 胡昌江1*, 徐 婷2, 王志旺2, 熊 瑞1
(1.成都中医药大学,四川成都611137;2.甘肃中医药大学,甘肃兰州730000)
摘要:目的 比较高乌头生品及炮制品的高乌甲素含有量及急性毒性大小,为探讨高乌头炮制机理提供依据。方法 采用测定半数致死量的方法对高乌头生品及炮制品的急性毒性进行研究。采用高效液相色谱法,测定高乌头生品及炮制品中高乌甲素的含有量。结果 高乌头生品的LD50为1.424 g/kg;高乌头炮制品的LD50为2.625 g/kg。生品的毒性大于炮制品,高乌甲素的质量分数分别为1.170%、0.562%,炮制后含有量降低了一半。结论 高乌头炮制后毒性显著降低,表明用甘草汁炮制能够降低高乌头的毒性,且毒性与高乌甲素密切相关,进一步证实高乌甲素就是高乌头的毒性成分之一。
关键词:高乌头;炮制;高乌甲素;急性毒性
高乌头是毛莨科乌头属植物高乌头(Aconitum sinomontanum Nakai)的干燥根,别名麻布七、穿心莲,曲芍,九连环等,是甘肃、四川、陕西太白地区、湖北神农架地区及云南、贵州等地珍稀名贵的“七药”之一[1-2],性味苦辛、温,有毒,具有祛风除湿、理气止痛、活血散结的功效,临床用于治风寒腰痛,痧气腹痛,胃痛,心悸,跌打劳伤,瘰疬,疮疖等[3-5],现收载于《甘肃省中药材标准》(2009年版)[6]。高乌甲素是高乌头主要的C18-双去甲二萜类生物碱,为高乌头的毒性成分之一[7-8],也是有效成分之一,临床上常用其氢溴酸盐,具有抗炎、解热、镇痛、局麻、抗血小板聚集、抗肿瘤、抗心律失常、抗风湿、抗癫痫、抗氧化、抗细菌、免疫调节、杀虫等活性[9-11]。由于高乌头有毒,临床应用受限,需要炮制以解毒,本课题组前期对高乌头的炮制工艺进行了优选(加入10%甘草汁蒸制5 h),分别测定了生品和炮制品中高乌甲素的量,同时对2种样品进行了小鼠急性毒性试验,为高乌头的急性毒性评价提供依据。
1 材料与方法
1.1 受试物
1.1.1 生品 高乌头(甘肃省天祝藏族自治县农贸市场),经甘肃中医学院杨抚德教授鉴定为麻布七,高乌头(Aconitum sinomontanum Nakai)的根。将原药材净制,润法软化,然后切制成约5 mm的碎段,自然干燥,筛去碎屑,制成高乌头生品饮片。
1.1.2 炮制品(甘草制) 取高乌头生品饮片适量,用10%甘草汁(甘草∶水为1∶3)润透后,置立式压力蒸汽灭菌器内,在127℃,0.15 MPa条件下蒸制5 h,取出,晾干,筛去碎屑,制成高乌头炮制品。
1.2 主要试剂与器材 氢溴酸高乌甲素对照品(甘肃神龙药业股份有限公司,批号20001001,纯度97.50%)。甲醇、乙腈为色谱纯;其它试剂均为分析纯。Waters-2695型高效液相仪、2998二极管阵列检测器(PAD);BT 125D电子天平(赛多利斯科学仪器北京有限公司);LDZX-30FA立式压力蒸汽灭菌器(上海中安医疗器械厂);12号灌胃针。
1.3 实验动物及环境 SPF级昆明种小鼠(18~22 g),雌雄各半,均由甘肃中医学院实验动物中心提供,实验动物生产许可证号SCXK(甘)2011-0001,实验设施合格证SYXK(甘)2011-0001。实验室温度20~24℃,相对湿度40%~70%。
1.4 试验方法
1.4.1 高乌甲素含有量测定 对照品溶液的制备:精密称取氢溴酸高乌甲素对照品7.5 mg,置25 m L量瓶中,加甲醇溶解并定容至刻度,摇匀,即得。
样品溶液的制备:取高乌头(过50目筛)约0.5 g,精密称定,置三角瓶中,加甲醇15 mL,超声15 min,滤过,滤渣再加10 mL甲醇,超声15 min,滤液合并于25 mL量瓶中,用甲醇定容至刻度,滤过,取续滤液,经0.45 μm微孔滤膜滤过,作为供试品溶液。
标准曲线的绘制:精密吸取对照品溶液0.5、1、5、10、15、20、25 μL,注入液相色谱仪,测定峰面积,以峰面积(Y)对进样量(X)进行线性回归,氢溴酸高乌甲素在0.15~7.5 μg范围内线性关系良好,回归方程Y=237 512 X-53 646,r=0.999 9。
色谱条件:色谱柱(ZORBAX SB-C18,4.6 mm× 250 mm,5 μm);甲醇-0.05 mo1/LNaH2PO4溶液(45∶55)为流动相;体积流量为1.0 mL/min;进样体积10 μL;检测波长252 nm;柱温为30℃。
1.4.2 小鼠经口毒性试验 采用半数致死量法。将高乌头生品饮片粉碎,过100目筛两次,称取适量样品,加蒸馏水配制成一定质量浓度的混悬液,备用(以下称为高乌头生品)。同法制备高乌头炮制品混悬液(以下称为高乌头炮制品)。
根据预试验结果,设计高乌头生品和炮制品的染毒剂量。每种受试物设5个剂量,其中高乌头生品为3.200、2.272、1.613、1.145、0.813 g/kg体质量;高乌头炮制品为4.000、2.960、2.190、1.621、1.200 g/kg体质量。
选用18~22 g的SPF级昆明种小鼠,雌雄各8只,于灌胃前禁食16 h。各受试物按相应剂量一次性灌胃给药40 mL/kg体质量,对照组给以等容积的蒸馏水。严密观察并记录给药后4 h内动物的反应情况,并连续观察14 d内动物的异常反应及死亡情况。同时,将死亡动物及时进行解剖,肉眼观察各主要脏器有无明显病理改变,未死亡动物于14 d后处死,进行尸检,观察主要脏器有无病理改变。
1.5 数据统计方法 数据统计采用B1iss法,应用SPSS 17.0统计软件进行统计学分析,计算LD50及95%可信限。
2 结果
2.1 高乌甲素含有量测定结果 高乌头生品、炮制品中高乌甲素的质量分数分别为1.170%、0.562%。炮制后,其含有量约为生品的1/2。
2.2 小鼠急性经口毒性试验 在高乌头生品及炮制品染毒动物中,部分动物3~5 min后相继出现活动减少,心跳加速,呼吸困难,全身颤抖相继出现异常兴奋,呼吸抑制,逐渐发展到张口呼吸,阵发性奔跑后出现阵挛惊脉,四肢抽动,角弓反张,嘴巴、四肢及脚部颜色发青等中毒症状,严重惊厥而死亡或断续出现多次惊厥后,部分死亡。给药后10 min左右,陆续有动物死亡,极个别动物第2天死亡,对死亡动物及时进行解剖,其胃及小肠内含有与受试样品性状相同的物质,无明显的胃肠胀气、充血及水肿等,其心、肝、脾、肺、肾、脑、胸腺等重要脏器也未见明显异常;在给药后活动减少,蜷缩于笼内的存活小鼠于给药40~45 min后,中毒症状逐渐减弱缓解,次日外观和活动均恢复正常。给药第14天,处死存活动物,肉眼观察各组织,其肠道及心、肝、脾、肺、肾、脑、胸腺等重要脏器未见明显异常。
高乌头生品及炮制品对小鼠急性毒性实验的结果见表1、表2,LD50及95%可信限见表3。

表1 高乌头生品急性毒性试验结果
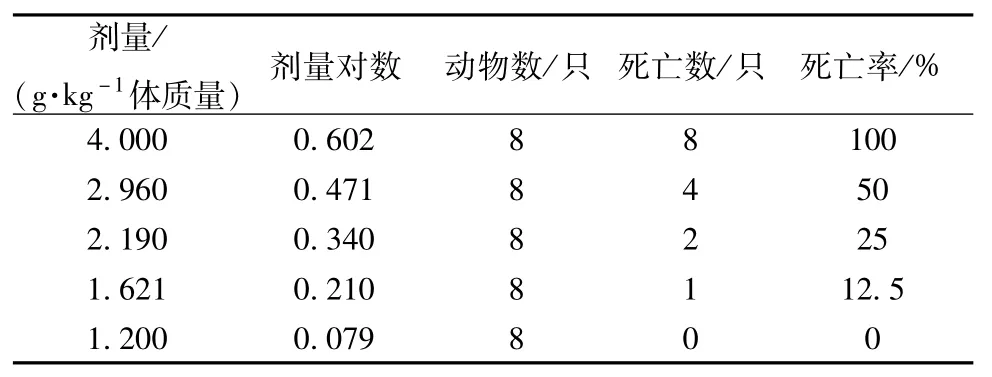
表2 高乌头炮制品急性毒性试验结果

表3 高乌头生品及炮制品的LD50及95%可信限(g/kg)
从表1~3可以看出,高乌头炮制品的LD50约为生品的2倍左右,表明高乌头炮制品的毒性小于生品,也说明高乌头炮制后毒性显著降低。
3 讨论
我国自古就认为高乌头“辛热有毒”,在临床使用中,相继有报道可引起严重的不良反应[12-13],使其临床应用受限,须炮制以解毒,才能保证临床安全有效。降低毒性的方法很多,使用辅料解毒是中药炮制的一个显著特点,也是毒性中药解毒的重要手段。甘草的解毒作用早在《神农本草经》中就有记载,历代炮制毒性中药如乌头、半夏等都用甘草解毒。《景岳全书》也记载:“甘草,味至甘,得中和之性,有调补之功,故毒药得之解其毒,刚药得之和其性……”。甘草的解毒作用与甘草酸的水解产物葡萄糖醛酸有关,后者与毒物结构中的羟基或羧基发生羟醛缩合而解毒。高乌头主要含有二萜生物碱,结构中含有大量的羟基,容易发生羟醛缩合反应而解毒。
辅料去毒常与加热的方法相结合,去毒效果更好。本研究借鉴了其它毒性中药的炮制方法和特点,采用辅料甘草和蒸制相结合的解毒方法。实验结果显示,该法确能降低高乌头的毒性。加热温度与时间如何影响去毒效果,需要深入研究炮制过程中活性成分的转化规律,进一步揭示炮制减毒机理,是亟待解决的问题,有待进一步研究。
将毒性成分转化为毒性较小或无毒物质是较理想的炮制方法。高乌甲素为单酯型二萜生物碱,结构中含有酯键和多个乙酰基,加热处理均易水解,可能是发生水解反应生成N-去乙酰高乌甲素、刺乌宁等多个毒性较低的水解产物[10],也可能与甘草酸形成了稳定的络合物[14],致其含量降低,结构也发生了转化,毒性随之降低。关于高乌头炮制后高乌甲素的结构具体发生了如何变化,有望在后续工作中开展。
毒性中药的炮制要兼顾“减毒”和“存效”两个方面,不可偏废,否则可能造成效失毒存,或毒去效失。高乌头炮制后毒性降低了,能够保证临床用药的安全,那么炮制后镇痛作用等药效是否还存在,是个关键问题,有待药理实验进一步证明。
致谢:2013届药物制剂专业本科毕业生李康、马贝红同学在实验中的帮助和大力支持。
参考文献:
[1] 赵建邦,杨 静.甘肃“七药”类功效和主治整理研究[J].中药材,2003,26(3):165-168.
[2] 郭增军,卜筱茜,王军宪.陕西“七药”植物资源及研究概要[J].中国民族民间医药杂志,2006(79):79-81.
[3] 杨仓良.毒药本草[M].北京:中国中医药出版社,1993:473.
[4] 江苏新医学院.中药大辞典:下册[M].上海:上海科学技术出版社,2001:2225-2226.
[5] 国家中医药管理局《中华本草》编委会.中华本草:第七卷[M].上海:上海科学技术出版社,1999:1746-1747.
[6] 甘肃省食品药品监督管理局.甘肃省中药材标准[S],2009:117-118.
[7] 陈丽娟,唐希灿,王美瑛.刺乌头碱的毒性和致畸作用研究[J].上海实验动物科学,1989,9(1):5-7.
[8] 遵义医学院新药组,贵州省中医研究所药化组.贵州穿心莲总生物硷“平喘”作用及急性毒性的初步实验观察[J].遵义医学院学报,1973(2):45-51.
[9] 魏华波,张宝华,谭 兵,等.氢溴酸高乌甲素的药理作用及临床应用研究进展[J].重庆医学,2014,43(20):2660-2662.
[10] 谢海辉,韦璧瑜.高乌头的化学成分及其药理作用研究进展[J].天然产物研究与开发,2010,22(8):232-235,154.
[11] 任媛媛,王 鹏,詹 妮.二萜生物碱生物活性和毒性的研究概况[J].中国实验方剂学杂志,2010,16(11):210-213.
[12] 魏华波,范艾玲,秦争平.注射用氢溴酸高乌甲素致耳毒性不良反应2例[J].中国医院药学杂志,2012,32(17):1413-1414.
[13] 林鹏锋,张亚坤.氢溴酸高乌甲素粉针剂静脉滴注致过敏反应1例[J].中国药业,2013,22(22):53.
[14] Po1yakov N E,Khan V K,Taraban M B,et al.Comp1exation of 1appaconitine with g1ycyrrhizic acid:stabi1ity and reactivity studies[J].JPhys Chem B,2005,109(51):24526-24530.
*通信作者:胡昌江(1952—),男,教授,博士生导师,主要从事中药炮制学的教学和科研工作。E-mai1:hhccjj@hotmai1.com
作者简介:李 芸(1973—),女,博士生,主要从事中药炮制学的教学和科研工作。E-mai1:1iyunherb@163.com
基金项目:甘肃省自然科学基金项目(1107RJZA242);甘肃中医学院中青年基金项目(ZQ2011-8)
收稿日期:2014-12-02
doi:10.3969/j.issn.1001-1528.2016.01.042
中图分类号:R283.1
文献标志码:B
文章编号:1001-1528(2016)01-0179-03
网络出版日期:2015-02-27
网络出版地址:http://www.cnki.net/kcms/detai1/31.1368.R.20150227.1050.001.htm1

